INTRODUCTION
L’identification des gènes responsables de maladies héréditaires a ouvert la porte dès les années 1970 aux essais de thérapie génique qui consiste non plus à administrer le facteur biologique manquant quand cela était possible, comme dans le cas du diabète de type 1 et de l’hémophilie, mais plutôt à réparer un gène défectueux chez un patient atteint. Pour réaliser cela, on construit un gène « médicament » avec une séquence normale qui sera sous la dépendance d’une séquence de régulation (promoteur, autres séquences régulatrices, etc.). Cette séquence d’ADN, ou transgène, est ensuite prise en charge par un vecteur qui va la délivrer au sein des noyaux des cellules d’intérêt. Cette technique maîtrisée dans les années 1980 a permis la concrétisation des premiers essais cliniques chez l’homme principalement dans les syndromes d’immunodéficience congénitaux ou héréditaires. Ainsi en 1995, une fillette de trois ans atteinte d’un déficit immunitaire combiné sévère par déficit en adénosine désaminase (DICS par déficit en ADA), affection entraînant un effondrement total des défenses immunitaires, fut traitée de manière stable pendant quelques années grâce à l’injection de cellules souches et de lymphocytes génétiquement modifiés (1). Dans la foulée, un autre essai clinique par thérapie génique conduit par des équipes françaises et anglaises, permit de traiter des “bébés bulles” atteints d’immunodéficience combiné sévère lié à l’X (SCID-X1) (2, 3).
Ces premiers essais cliniques, réalisés en 2000, furent un succès et rétablirent une immunité chez quasiment tous les sujets traités. Cependant l’insertion du gène dans le génome des cellules souches sanguines, bien que rendant leur immunité aux bébés, peut également déclencher certains effets secondaires graves comme des leucémies. Ainsi sur les neufs patients traités, quatre développèrent une leucémie dont un en mourut (4) remettant en question les techniques utilisées et suspendant plusieurs essais de thérapie génique en cours dans le monde entier.
À partir de ce moment-là, les recherches en thérapie génique se portèrent vers d’autres vecteurs afin de mieux contrôler le lieu d’insertion du transgène permettant non seulement de traiter des pathologies héréditaires monogéniques mais aussi de s’orienter vers le traitement d’autres affections dans lesquelles il est possible d’imaginer qu’un gène sain est capable de suppléer un gène « défectueux », de compenser la version manquante ou de donner à la cellule cible de nouvelles propriétés. Cette dernière méthode est souvent employée dans le traitement du cancer, où l’on ajoute des gènes toxiques (ou gène suicide) aux cellules cancéreuses en vue de les éliminer. Ainsi, à l’heure actuelle, près de 2000 essais cliniques de thérapie génique sont en cours dont 65 % des essais se focalisent sur le traitement du cancer, 10% dans le domaine cardiovasculaires et 10% seulement dans les maladies monogéniques comme l’amaurose congénitale de Leber, l’hémophilie et la bêta-thalassémie. Seuls deux produits de thérapie génique disponibles sur le marché actuellement ont déjà surmonté tous les obstacles du développement clinique à savoir la « Gendicine » commercialisée en Chine depuis 2004 et le « Glybera » en Europe. Le premier est indiqué dans le traitement de carcinomes de la tête et du cou, le deuxième en cas de déficit familial en lipoprotéine lipase.
LES PRINCIPALES STRATÉGIES DE THÉRAPIE GÉNIQUE
Corriger un gène défectueux implique d’abord de connaître le gène et le rôle de la protéine qu’il encode. Ensuite, l’isolation de ce gène non muté à partir de cellules saines en le munissant de séquences indispensables à sa régulation permettra d’insérer la « construction génique » dans un vecteur, généralement un virus désactivé. L’étape ultérieure est d’injecter les vecteurs modifiés « ex vivo » ou « in vivo » chez le malade espérant conférer une modification thérapeutique durable [Figure 1].
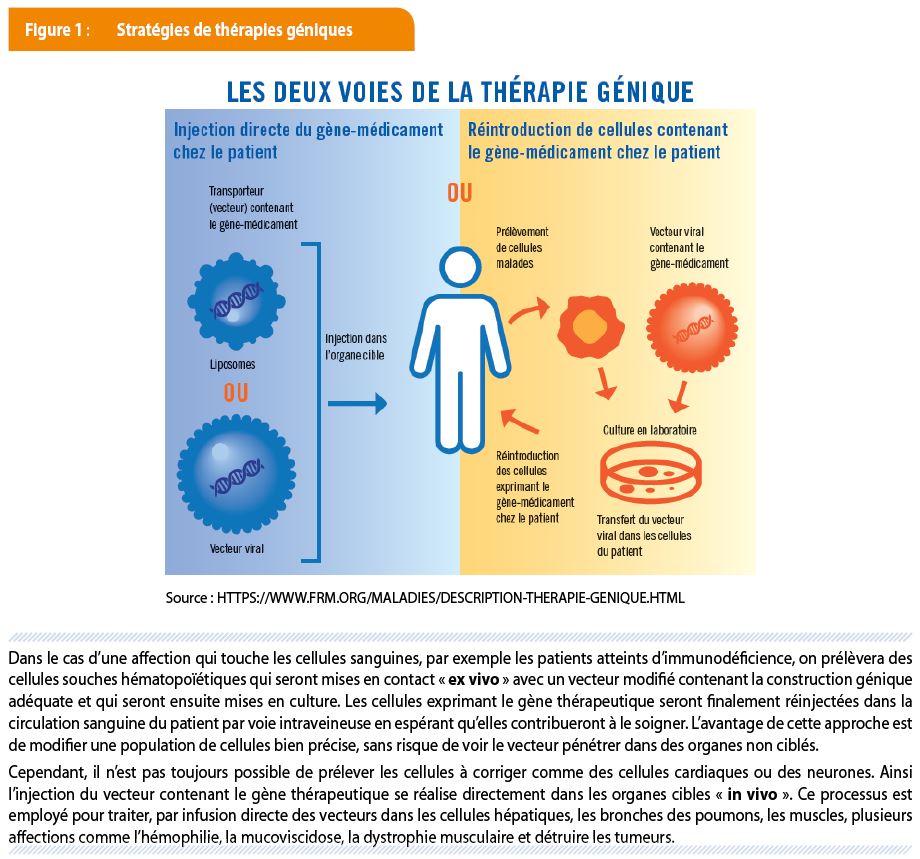
LES BONS VECTEURS POUR TRANSPORTER LES GÈNES
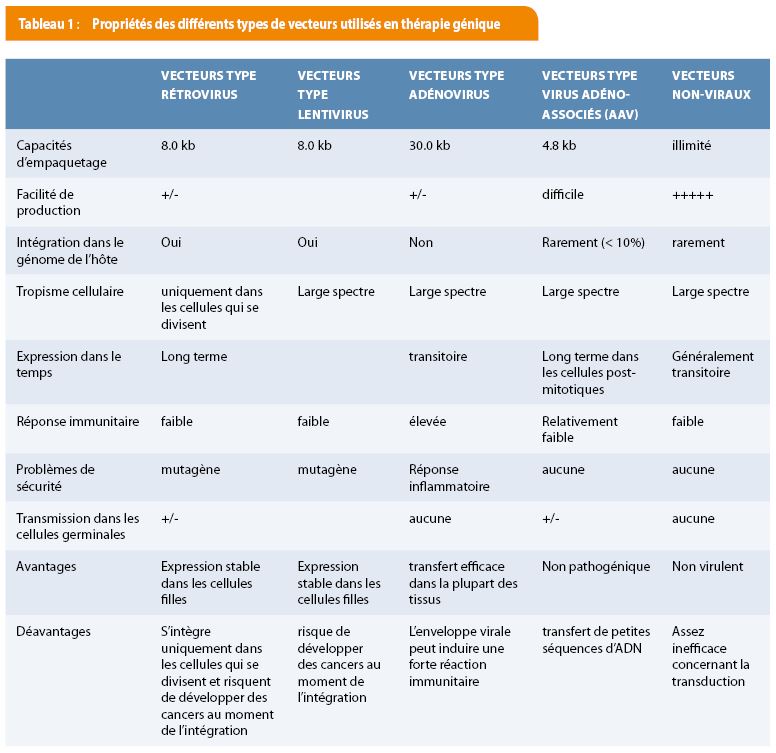
L’étape cruciale de la thérapie génique est de faire pénétrer le transgène dans l’organisme du patient. Pour cela le vecteur doit promouvoir l’interaction spécifique avec la cellule cible (ciblage cellulaire), assurer la pénétration intra cytoplasmique, transporter le gène recombiné jusqu’au noyau et assurer le maintien stable de l’expression du gène thérapeutique. Il existe actuellement différents types de vecteurs : les vecteurs viraux, les plus efficaces actuellement mais qui peuvent déclencher des réponses immunitaires ou provoquer des cancers en s’insérant dans certaines séquences du génome, et les vecteurs non viraux qui ont été conçus pour répondre aux problèmes de sécurité, pour leur facilité de fabrication et pour assurer le transport de grandes quantités d’ADN [Tableau 1].
Les vecteurs viraux
Les débuts de la thérapie génique ont été marqués par des accidents liés à l’utilisation de vecteurs viraux qui se sont introduits dans des organes non cibles, ou qui ont provoqué l’intégration du gène modifié dans des séquences dites «pro-oncogènes» de l’ADN du patient, déclenchant des cancers et décès. Suite à ces accidents, les scientifiques ont développé des vecteurs viraux « domestiqués » plus sûrs et plus efficaces de sorte à réduire le risque d’insertion aléatoire dans le génome de l’hôte. Les autres propriétés que les vecteurs doivent acquérir pour une utilisation optimale en médecine sont qu’ils doivent être produits en grande quantité, induire une faible réaction immune et pouvoir intégrer des grands fragments d’ADN. Ces vecteurs sont impliqués dans 75% des essais cliniques de thérapie génique. Trois familles se discernent à savoir les rétrovirus intégratifs avec une stabilité à long terme, les adénovirus non intégratifs et les virus associés aux adénovirus.
1. Les vecteurs viraux intégratifs. La plupart des essais cliniques ont été réalisés avec des vecteurs type rétrovirus dérivés du virus de la leucémie murine. Ils permettent l’intégration et la transmission du gène thérapeutique aux cellules filles en cas de divisions cellulaires sans dilution de l’information génétique dans le temps. Ces vecteurs sont idéaux en cas de thérapie utilisant des cellules souches, ainsi que dans les approches où l’effet recherché doit être permanent. Suite à la survenue de leucémies lors des essais menés sur les « enfants bulles » dans les années 2000, ils sont de plus en plus délaissés et ne sont impliqués, à l’heure actuelle, que dans moins de 20 % des essais cliniques. Pour pallier le risque d’insertion aléatoire, certains essais cliniques particulièrement en vogue utilisent des vecteurs de type lentiviral dérivés du virus VIH, totalement sécurisés, qui semblent avoir un profil d’intégration génomique plus sûr que celui des rétrovirus. Ce type de vecteur est également capable de pénétrer et de modifier génétiquement des cellules qui ne se divisent pas, ouvrant ainsi des possibilités de manipuler des neurones ou des cellules hépatiques.
2. Les adénovirus, virus à double brin, sont des vecteurs non intégratifs très utilisés dans le passé et restent actuellement des vecteurs de choix en immunothérapie contre le cancer. Ils peuvent transporter de plus grandes séquences d’ADN que les virus intégratifs, même si la taille maximale des transgènes transportés reste parfois inférieure à celle de gènes humains. Ce type de vecteur présente plusieurs avantages : il pénètre bien dans les cellules qui ne sont pas en division comme celles du foie, des muscles et les neurones, n’est pas très nocif et il est associé à un niveau élevé d’expression du gène thérapeutique. Cependant, comme le transgène n’est pas intégré dans l’ADN de la cellule hôte, son expression est transitoire impliquant une répétition régulière du traitement dans les maladies telles que la mucoviscidose. Un autre point négatif est le développement de réactions immunitaires dirigées à l’encontre des vecteurs adénoviraux de la part de l’organisme hôte qui peuvent compromettre l’utilisation ultérieure de ces mêmes vecteurs chez un patient lors du renouvellement de la thérapie génique.
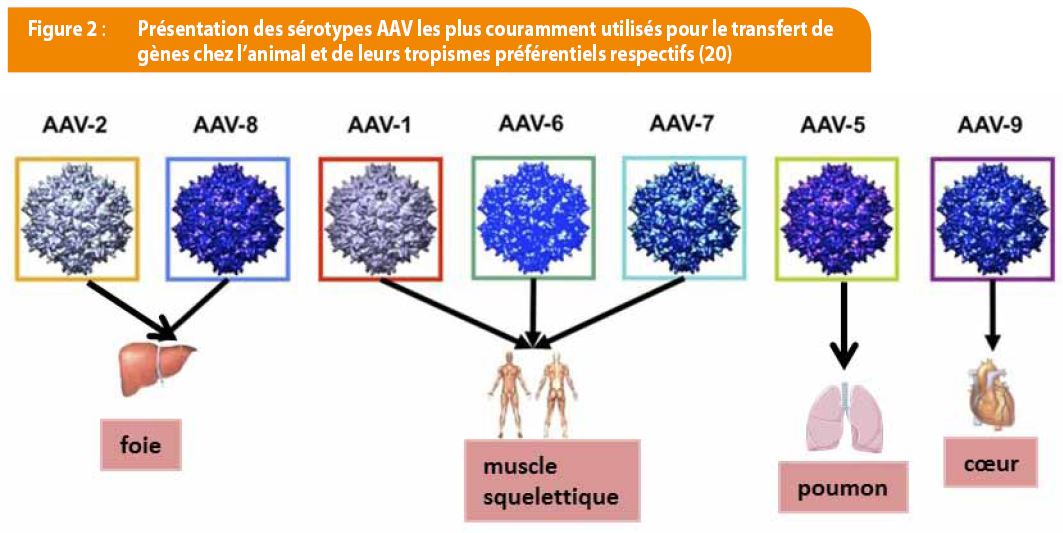
3. Les vecteurs dérivés de virus adéno-associés (ou AAV). Les virus associés aux adénovirus sont des virus à ADN simple brin appartenant à la famille des parvovirus, non pathogènes et très répandus chez l’homme. Ils sont intéressants car peu inflammatoires, plus sécuritaires et peuvent infecter les cellules en dehors des phases de mitoses. Une particularité des AAV est que, selon le sérotype du virus, le tropisme de la capside peut varier considérablement [figure 2]. Le « AAV8 » par exemple a un tropisme pour les tissus hépatiques et en fait un bon candidat notamment dans le traitement de l’hémophilie A et B. Malheureusement, ils ne permettent le transfert que de petites séquences génétiques (<4.8 kb) contrairement aux rétrovirus et aux adénovirus qui peuvent transférer plus de 7 kb.
4. Parmi les autres vecteurs viraux, nous retrouvons le virus de l’herpès simplex (VHS), les poxvirus (actuellement en développement clinique), de virus animaux apparentés au VIH, le virus de la grippe, …..
Les vecteurs non-viraux
D’autres vecteurs ont été imaginés afin de contourner la problématique des virus et d’utiliser directement la molécule d’ADN « nue » ou intégrée dans un plasmide ainsi que de l’ARN. Contrairement aux virus, ces vecteurs non-viraux sont plus faciles à produire, à manipuler et à stocker. Ce sont principalement des liposomes. Ceux-ci permettent de compacter les milliers de paires de bases d’une molécule d’ADN (chargées négativement) et de donner une charge positive à l’ensemble (vecteur + ADN) qui peut interagir avec les charges négatives des membranes des cellules. Ils ne sont pas virulents puisque ce sont des particules inertes. Cependant, ils restent très inefficaces au transfert d’une information génique puisqu’une fois injectés par voie intraveineuse, les vecteurs s’agrègent en particules de grande taille mécaniquement retenues et rejetés principalement par le poumon et le foie. De plus, il faut au moins 100.000 molécules d’ADN par cellule cible pour qu’une seule séquence parvienne à pénétrer dans le noyau qui pourrait poser des problèmes de toxicité.
DES ESSAIS PROMETTEURS DANS PLUSIEURS MALADIES MONOGÉNIQUES
Actuellement, plusieurs essais cliniques pour traiter des maladies monogéniques par thérapie génique sont largement encourageants. Il s’agit de la continuité des travaux sur les déficits immunitaires, des maladies hématologiques comme l’hémophilie et la bêta-thalassémie, des pathologies de la rétine comme l’amaurose de Leber et des maladies neurodégénératives comme l’adrénoleucodystrophie.
L’hémophilie
L’hémophilie B est une maladie intéressante pour la thérapie génique car le gène F9 est de petite taille, une faible synthèse de facteur 9 (FIX) aurait un impact très significatif sur le phénotype hémorragique chez les patients souffrant d’hémophilie B sévère et la réponse au traitement peut être facilement mesurée. Ainsi dès 1996, les premiers essais cliniques utilisèrent un vecteur de type rétrovirus pour transduire des fibroblastes suivis d’une ré-implantation transdermique des cellules modifiées. Bien que ces essais ont démontré leur sécurité, l’expression du FIX était non seulement faible mais surtout transitoire. Par la suite, de nouvelles technologies ont été progressivement mises en place utilisant des AVV du fait de leur non-pathogénicité et de leur non-insertion chromosomique. Cependant, l’expression transitoire du FIX et une élimination précoce des cellules transfectées par réponse immune aux protéines de la capside du virus ont obligé les chercheurs à modifier la séquence codante du gène et la séquence virale par génie génétique pour obtenir de meilleurs résultats. Ceci permit à l’équipe dirigée par le Professeur Amit Nathwani à Londres, en 2010, d’obtenir des résultats très encourageants. Ce premier essai, utilisant le vecteur AAV8, a permis d’évaluer la sécurité et de déterminer la dose minimale requise d’injection du vecteur pour élever le taux d’activité biologique plasmatique du FIX de moins de 1% jusqu’à plus de 3% chez des patients hémophiles B sévères adultes sans précédents d’inhibiteurs, non contaminés par le VHC ou le VIH et en absence de tout dysfonctionnement hépatique. Il est important de noter que des tests préalables ont exclu la moitié des volontaires pour participer à l’étude principalement du fait du développement d’anticorps contre le vecteur AAV8 utilisé. En résumé, chez les six patients atteints d’hémophilie B sévère traités à la dose élevée de vecteurs recombinés par injection intraveineuse, aucune toxicité aiguë ou chronique n’a été observée. Une élévation transitoire des enzymes hépatiques a été rapidement contrôlée à l’aide de prednisolone. Tous les patients ont pu atteindre un taux de FIX entre 2% et 5% et ainsi diminuer la fréquence ou se passer d’injections prophylactiques de FIX exogène. Aucun autre effet indésirable notable a été signalé (5, 6). Ces résultats très encourageants doivent toutefois être encore confirmés par des suivis à long terme incluant un plus grand nombre de sujets. Actuellement, la firme Spark Therapeutics poursuit cet essai clinique de phase I/II avec un vecteur génétiquement modifié contenant le gène du FIX précédé d’un promoteur spécifique reconnu par les cellules du foie. Des quatre sujets traités à une dose modeste, tous ont atteint des niveaux cliniquement très importants de FIX allant de 20 à 40 %. Ces taux ont été maintenus pendant plusieurs mois. Les futurs développements et sa commercialisation seront pris en charge par la société pharmaceutique Pfizer.
Pour la thérapie génique de l’hémophilie A, les scientifiques se heurtent à plusieurs contraintes comme celle de la capacité limite d’empaquetage de l’ADN des vecteurs AAV (les séquences véhiculées ne peuvent excéder 4,5 kb alors que la séquence codante du facteur 8 (FVIII) humain est supérieure de 7.0kb), de la faible expression naturelle du FVIII et du relativement grand pourcentage de patients atteints qui ne répondent pas aux critères de sélection (absence d’inhibiteur, d’hépatite et infection au VIH et d’une réponse immunitaire aux AAV). Pour répondre à ces limitations, des chercheurs ont dès lors développé une approche alternative qui utiliserait non seulement des lentivirus ayant une capacité d’empaquetage supérieur à celle des vecteurs AAV et qui permettrait une expression durable du FVIII compte tenu de la propriété qu’ont ces vecteurs à s’intégrer dans l’ADN du chromosome hôte mais aussi une modification par génie génétique de la molécule « wild type » du FVIII (7). Des données provisoires totalement inattendues ont cependant été annoncées lors du dernier congrès de la Fédération mondiale de l’hémophilie en juillet 2016 à Orlando par l’entreprise BioMarin Pharmaceutical (http://www.biomarin.com/) sur son essai de phase I/II de thérapie génique sous le nom BMN 270. L’essai lancé en septembre 2015 doit évaluer l’innocuité et l’efficacité du traitement (injection unique à dose élevée par voie intraveineuse) chez des sujets atteints d’hémophilie A sévère à partir de virus AAV5 modifiés. Les premiers résultats sont très encourageants. En effet en date du début juillet 2016, le suivi après traitement variait de 12 à 28 semaines. Parmi les sept patients, un présentait un niveau de FVIII de 10 % et 6 autres supérieur à 50%. De plus, les quatre patients ayant été suivis le plus longtemps avaient des taux moyens de FVIII supérieur à 146% de la normale à leur visite de la 20ième semaine, Deux patients présentaient des valeurs au-dessus de 200% sans effet secondaire ni nécessité d’une intervention médicale. Un traitement aux stéroïdes, administré à tous les patients à dose élevée pour lutter contre le rejet, a bien été toléré. Dans cet essai, aucun autre effet indésirable notable n’a été signalé. Il est important aussi de noter que 10 à 20% de la population présente des anticorps contre le vecteur AAV5 et ne pourrait être traité par cette thérapie génique. Une autre étude qui a montré son efficacité chez le chien, utiliserait des plaquettes infectées par un lentivirus modifié exprimant le FVIII. En réalisant une telle opération, le FVIII serait tout de suite disponible pour épauler les plaquettes et pourrait rapidement bloquer une hémorragie (8).
La bêta-thalassémie
En 2007, un essai clinique de phase I/II débuta sur un jeune patient atteint d’une forme grave de bêta-thalassémie. Celle-ci consista à détruire dans un premier temps les cellules souches hématopoïétiques présentes dans sa moelle osseuse par une forte chimiothérapie pour ensuite réinjecter ses propres cellules souches hématopoïétiques CD34 corrigées ex vivo grâce à un lentivirus pour qu’elles expriment un transgène bêta-globine. Quelque trois ans plus tard, plus de 10% des cellules souches de la moelle contenaient le gène correcteur permettant au patient de se passer de transfusions. Cependant, le séquençage de l’ADN montra, dans la moitié des cellules modifiées, le vecteur viral s’était inséré, sans dommage apparent, dans le gène qui code la protéine HMGA2, connue pour participer à la régulation de la prolifération et de la différenciation cellulaires suggérant que la sécurité de l’intervention n’est pas complètement assurée (9).
l’adrénoleucodystrophie (ALD)
Cette maladie démyélinisante du système nerveux central dont l’évolution est fatale a également fait l’objet d’un essai clinique de thérapie génique sur quatre enfants atteints d’adrénoleucodystrophie liée au chromosome X. La stratégie utilisée consista à prélever des cellules souches mésenchymateuses de la moelle osseuse, à les corriger génétiquement ex vivo à l’aide d’un lentivirus contenant le gène ABCD1, puis à les réinjecter dans la circulation sanguine. Le traitement a permis de stopper l’évolution de la maladie chez ces enfants qui mènent aujourd’hui une vie pratiquement normale (10). Cet essai a ouvert la voie au développement de cette stratégie pour de nombreuses autres maladies comme la leucodystrophie métachromatique (11) ou la maladie de Sanfilippo dont les résultats sont attendus dans le courant de l’année 2017.
l’amaurose congénitale de Leber
L’œil est un organe favorable à la thérapie génique car son espace clos et facilement accessible permet d’injecter aisément un gène correcteur in vivo sous la rétine. En 2008, un traitement par transfert intraoculaire du gène RPE65 à l’aide de vecteurs AAV a permis à quatre enfants sur huit souffrant d’amaurose congénitale de Leber de type 2 d’améliorer leur vue. Depuis, sur les douze patients, âgés de 8 à 44 ans, traités de cette façon, les résultats montrèrent que dans tous les cas, la vue s’est améliorée de manière significative et que cette méthode donnait de biens meilleurs résultats chez le jeune patient (12-14).
LA THÉRAPIE GÉNIQUE DANS LES CANCERS
Dans le domaine du cancer, la thérapie génique est une piste très sérieuse. Certains résultats sont très encourageants et s’orientent principalement sur deux voies. La première stimulerait les réactions de défense normales du patient, la seconde induirait l’apoptose des cellules tumorale par un « gène suicide ».
Dans la première voie, une équipe américaine a montré l’efficacité de cellules T modifiées dans les leucémies aiguës lymphoblastiques de type B. La stratégie employée consiste à extraire des lymphocytes T des patients et à les modifier génétiquement « ex vivo » à l’aide d’un vecteur lentiviral de type HIV-1 car il s’intègre naturellement dans les lymphocytes T. Ces cellules modifiées génétiquement vont exprimer des récepteurs d’antigène chimériques (CAR) capables de se lier au récepteur CD19 présent uniquement à la surface des lymphocytes B. Une fois injectées dans le sang des malades, ces cellules modifiées reconnaissent les cellules tumorales et les détruisent (15, 16).
Dans la seconde, un gène « suicide » codant pour des enzymes pouvant convertir la forme inactive d’une drogue (médicament/chimiothérapie) en un produit toxique inhibant la synthèse des acides nucléiques est introduit dans les cellules tumorales. Le principe se résume en deux étapes : la première étant le transfert « in vivo » dans les cellules tumorales d’un gène codant une enzyme normalement absente du patrimoine des cellules visées suivie d’une administration par voie orale du médicament/chimiothérapie en question. Le système le plus expérimenté est celui de la transfection dans les cellules tumorales, via un adénovirus modifié, du gène codant pour thymidine kinase du virus Herpes simplex de type 1 (HSV-TK). Une fois que le gène du virus de l’Herpes est introduit dans les cellules tumorales, il se met à fabriquer la TK qui rendra sensible la cellule au médicament antiviral normalement inoffensif, le Ganclyclovir. On administre ensuite le Gancyclovir (GCV), qui après avoir subi une phosphorylation par la thymidine kinase virale s’incorpore dans l’ADN en élongation (le GCV-Tri-Phosphate est un analogue nucléosidique de la guanosine) et induira l’apoptose des cellules transfectées qui celles-ci infecteront à leur tour les cellules tumorales voisines. Plusieurs essais dans le monde sont en cours, en particulier dans le traitement du glioblastome (17).
LA RÉVOLUTION CRISPR-Cas9
Face, aux résultats parfois décevants de la thérapie génique, la technique prometteuse du CRISPR-Cas9, encore en cours d’essais, tient toutes ses promesses. Exposée pour la première fois en 2012 dans un article de la revue américaine « Science », elle consiste non plus à introduire un gène normal comme dans la thérapie génique mais plutôt à corriger le gène altéré au sein des cellules malades (18). Ceci est possible grâce à une technique de chirurgie du gène coupant sa partie mutée et le remplaçant par une copie fonctionnelle. Mis au jour en 1987 dans l’ADN de la bactérie Escherichia coli, les CRISPR (Clustered Regularly Interspaced Palindromic Repeats ou «courtes répétitions palindromiques regroupées et régulièrement espacées ») constitueraient un système immunitaire ancestral et héritable développé par les bactéries et archéobactéries contre les phages et plasmides invasifs (19). Associés aux génomes porteurs de CRISPR, des gènes Cas (CRISPR associated protein) ont également été identifiés à proximité des locus CRISPR; ce qui permit aux chercheurs de les identifier comme complexe « CRISPR/Cas ». Lors d’une infection virale, les bactéries et archéobactéries incorporent dans leur génome un morceau de l’ADN viral qui leur tient lieu de vaccin. Ainsi, lors d’une nouvelle infection, les CRISPR collectés serviront de guide à l’endonucléases Cas pour découper en petits morceaux et réduire à néant l’ADN viral.
Ce complexe « CRISPR/Cas » a profondément révolutionner les laboratoires de biologie moléculaire puisqu’avant les CRISPR, l’obtention d’une lignée animale mutante (drosophile/souris) consistait à provoquer des cassures au hasard dans le génome en l’exposant à des rayons X ou à des agents chimiques mutagènes suivi par une recherche de l’individu exposé ayant acquis la mutation visée. Il fallait environ deux mois pour obtenir une lignée mutante stable chez la mouche et un an chez la souris. À l’heure actuelle, ce système est devenu un outil de génie génétique révolutionnaire fonctionnant comme des ciseaux génétiques (il cible une zone spécifique de l’ADN grâce à un ARN guide, la coupe et y insère la séquence que l’on souhaite) et de modifier plus facilement et plus précisément les séquences d’ADN en un mois seulement (Figure 3). Pour modifier un gène de façon ciblée dans la cellule, il faut d’abord synthétiser une section d’ARN d’au moins 18 bases correspondant au brin d’ADN qu’on veut éliminer. Ce brin d’ARN-guide va reconnaître la séquence homologue sur l’ADN et s’y placer. L’enzyme Cas9 se charge alors de couper la chaîne ADN complémentaire à ce brin ARN. Le trou laissé par le passage du CRISPR-Cas9 pourra alors être réparé par la machinerie enzymatique de réparation de l’ADN en introduisant n’importe quel nouveau fragment d’ADN.

Cette technique n’en est encore qu’à ses débuts, mais elle va révolutionner tant l’être humain que l’environnement révolutionnant non seulement la recherche fondamentale biomédicale mais aussi le traitement des maladies.
CONCLUSION
La thérapie génique est une technique lourde, nécessitant des précautions rigoureuses consistant par exemple en l’aménagement des locaux afin d’éviter toute contamination éventuelle. Mais au-delà de cette lourdeur, force est de constater, alors que cette technique fonctionne relativement bien dans le modèle animal, qu’elle est assez inefficace chez l’homme où elle n’a que très rarement et brièvement amélioré l’état clinique des patients. Seules quelques stratégies peuvent être considérées comme des réussites ou au moins des avancées thérapeutiques. Le potentiel CRISPR, peu coûteux, facile d’utilisation et rapide, nommé « découverte capitale de l’année 2015 » présente un intérêt énorme pour lutter contre certains cancers ou maladies liés à la mutation d’un gène bien particulier. Cependant, les problèmes éthiques et de sécurité prédominent encore concernant les applications humaines. En effet, des améliorations techniques considérables sont encore nécessaires avant d’envisager des essais cliniques ainsi qu’une réflexion attentive de la Déontologie, de la Bioéthique, du Droit et de la Médecine pour éviter toute dérive éthique.
CORRESPONDANCE
Pr Cédric hermans
Dr Nathalie Lannoy
Cliniques universitaires Saint-Luc
Service d’Hématologie
Centre d’hémophilie
av. Hippocrate 10, B-1200 Bruxelles
RÉFÉRENCES
1. Blaese RM, Culver KW , Miller AD, Carter CS, Fleisher T, Clerici M, et al. T lymphocyte-directed gene therapy for ADA- SCID: initial trial results after 4 years. Science 1995; 270:475-480. Ouvrir dans PubMed
2. Buckley RH, Schiff SE, Schiff RI, Markert L, Williams LW , Roberts JL, et al. Hematopoietic stem-cell transplantation for the treatment of severe combined immunodeficiency. N Engl J Med 1999; 340(7):508- 16. Ouvrir dans PubMed
3. Antoine C, Müller S, Cant A, Cavazzana-Calvo M, Veys P, Vossen J, et al.; European Group for Blood and Marrow Transplantation; European Society for Immunodeficiency. Long-term survival and transplantation of haemopoietic stem cells for immunodeficiencies: report of the European experience 1968-99. Lancet 2003; 361(9357):553-60. Ouvrir dans PubMed
4. Hacein-Bey-Abina S, Hauer J, Lim A, Picard C, Wang GP, Berry CC, et al.. Efficacy of gene therapy for Xlinked severe combined immunodeficiency. N Engl J Med 2010; 363(4):355-64. doi: 10.1056/NEJMoa1000164. Ouvrir dans PubMed
5. Nathwani AC, Tuddenham EG, Rangarajan S, et al. Adenovirus-associated virus vector–mediated gene transfer in hemophilia B. N Engl J Med 2011; 365:2357-2365. Ouvrir dans PubMed
6. Nathwani AC, Reiss UM, Tuddenham EG, Rosales C, Chowdary P, McIntosh J, et al. Long-term safety and efficacy of factor IX gene therapy in hemophilia B. N Engl J Med 2014 ; 371:1994-2004. doi: 10.1056/ NEJMoa1407309. Ouvrir dans PubMed
7. Johnston JM, Denning G, Doering CB, Spencer HT. Generation of an optimized lentiviral vector encoding a high-expression factor VII transgene for gene therapy of hemophilia A. Gene Ther 2013; 20:607-615. doi: 10.1038/gt.2012.76. Ouvrir dans PubMed
8. Du LM, Nurden P, Nurden AT , Nichols TC, Bellinger DA, Jensen ES, et al. Platelet-targeted gene therapy with human factor VII establishes haemostasis in dogs with haemophilia A. Nat Commun 2013; 4:2773. doi: 10.1038/ncomms3773. Ouvrir dans PubMed
9. Cavazzana-Calvo M, Payen E, Negre O, Wang G, Hehir K, Fusil F, et al. Transfusion independence and HMGA2 activation after gene therapy of human β-thalassaemia. Nature 2010; 467:318-322. doi: 10.1038/nature09328. Ouvrir dans PubMed
10. Cartier N, Hacein-Bey-Abina S, Bartholomae CC, Veres G, Schmidt M, Kutschera I, et al. Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy. Science 2009 ; 326:818-23. doi: 10.1126/science.1171242. Ouvrir dans PubMed
11. Biffi A, Montini E, Lorioli L, Cesani M, Fumagalli F, Plati T, et al. Lentiviral hematopoietic stem cell gene therapy benefits metachromatic leukodystrophy. Science 2013 Aug 23; 341(6148):1233158. doi: 10.1126/science.1233158. Ouvrir dans PubMed
12. Maguire AM , Simonelli F, Pierce EA, Pugh EN Jr, Mingozzi F, Bennicelli J, et al. Safety and efficacy of gene transfer for Leber’s congenital amaurosis. N Engl J Med 2008; 358:2240-2248. doi: 10.1056/ NEJMoa0802315. Ouvrir dans PubMed
13. Maguire AM , High KA , Auricchio A, Wright JF, Pierce EA, Testa F, et al. Age-dependent effects of RPE65 gene therapy for Leber’s congenital amaurosis: a phase 1 dose-escalation trial. Lancet 2009 Nov 7;374(9701):1597-605. doi: 10.1016/S0140- 6736(09)61836-5. Erratum in: Lancet. 2010 Jan 2;375. Ouvrir dans PubMed
14. Jacobson SG, Cideciyan AV, Ratnakaram R, Heon E, Schwartz SB, Roman AJ, et al. Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol 2012; 130:9-24. doi: 10.1001/ archophthalmol.2011.298. Ouvrir dans PubMed
15. Davila ML, Riviere I, Wang X, Bartido S, Park J, Curran K, et al. Efficacy and Toxicity Management of 19-28z CAR T Cell Therapy in B Cell Acute Lymphoblastic Leukemia. Sci Transl Med 2014; 6:224ra25. doi: 10.1126/scitranslmed.3008226. Ouvrir dans PubMed
16. Fesnak AD, June CH, Levine BL. Engineered T cells: the promise and challenges of cancer immunotherapy. Nat Rev Cancer 2016 Aug 23;16(9):566-81. doi: 10.1038/nrc.2016.97. Ouvrir dans PubMed
17. Touati W, Tran T, Seguin J, Diry M, Flinois JP, Baillou C, et al. A suicide gene therapy combining the improvement of cyclophosphamide tumor cytotoxicity and the development of an anti-tumor immune response. Curr Gene Ther 2014; 14:236-246. Ouvrir dans PubMed
18. Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNAguided DNA endonuclease in adaptive bacterial immunity. Science 2012; 337:816-821. doi: 10.1126/ science.1225829. Epub 2012 Jun 28. Ouvrir dans PubMed
19. Ishino Y, Shinagawa H, Makino K, Amemura M, Nakata A. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. J Bacteriol 1987; 169:5429-5433. Ouvrir dans PubMed
20. Saint Louis D., Verma I.M. An alternative approach to somatic cell gene therapy. Proc Natl Acad Sci USA 1988; 85: 3150-4. Ouvrir dans PubMed