Introduction
L’infarctus aigu du myocarde est une des causes de mortalité les plus importantes dans le monde, représentant plus de 3 millions de décès par an (1). Cependant, les cas pédiatriques sont peu fréquents et les cas néonataux le sont encore moins. En effet, seule une centaine de cas est rapportée dans la littérature (2,3). Les étiologies ainsi que la présentation clinique diffèrent en de nombreux points de la population adulte. La présentation chez le nouveau-né est atypique et parfois sournoise telle qu’un souffle cardiaque ou une fatigue lors de l’alimentation, mais peut être aussi parfois sévère telle qu’un choc cardiogénique. Bien que plusieurs causes soient établies comme la thrombose coronaire, les malformations coronariennes, les lésions obstructives du cœur gauche, l’asphyxie sévère ou encore la myocardite virale, la grande majorité des infarctus néonataux restent idiopathiques (3,4). S’agissant d’une pathologie extrêmement rare, il n’existe pas de recommandations internationales claires concernant la prise en charge et le traitement en période néonatale.
Vignette clinique
Nous rapportons le cas d’un nouveau-né né par voie vaginale de manière spontanée à 39 semaines et 6 jours. La grossesse était issue d’un long parcours de procréation médicalement assistée, les échographies étaient normales, les sérologies étaient protectrices (immunisation pour la rubéole, négatives pour HIV, syphilis, CMV et hépatite B) et il n’y avait pas de diabète de grossesse, ni d’infection virale maternelle récente. Il est à noter cependant que la mère est infirmière dans un service d’urgences pédiatriques. Le cardiotocogramme démontrait des décélérations tardives pendant les poussées lors de la phase d’expulsion. Le liquide amniotique était méconial en fin de travail.
L’équipe de néonatologie est appelée en urgence après la naissance pour une mauvaise adaptation à la vie extra-utérine. À leur arrivée à 5 min de vie, le nouveau-né demeure flasque, aréactif, cyanosé et sans fréquence cardiaque audible ni visible au monitoring cardio-respiratoire. Les manœuvres de réanimation sont initiées selon les recommandations internationales : le nouveau-né est rapidement intubé, des compressions thoraciques sont effectuées et un cathéter ombilical veineux est installé. Après un cycle de ventilation-compression, une première fréquence cardiaque est observée à 74 battements par minutes (bpm) à 10 minutes de vie avec des complexes QRS larges évoquant un rythme idioventriculaire ; comme l’enfant reste en état de mort apparente et sans pouls, les compressions thoraciques sont poursuivies et un bolus de sérum physiologique est administré. Le nouveau-né récupère un rythme sinusal à 170 bpm après 3 cycles de ventilation-compression. Un défibrillateur est mis en place et confirme une tachycardie sinusale. Les scores d’Apgar sont évalués à 0/0/1/4/7 à respectivement 1, 5, 10, 15 et 20 minutes de vie. À l’anamnèse obstétricale, nous retenons la présence d’un nœud dans le cordon ombilical et un pH artériel de cordon de 7,13 avec un excès de bases à -9.
Lors de l’évaluation à 1 heure de vie, l’enfant présente une évaluation hémodynamique normale sans support inotrope avec un souffle cardiaque 2/6 audible à tous les foyers et une encéphalopathie modérée (score de Sarnat à 2). Le pH artériel à une heure de vie est de 7,11 avec des bicarbonates calculés à 13 mmol/L, un excès de base à -16 et des lactates à 12,5 mmol/L. Au vu de l’histoire clinique, de la réanimation et des résultats sanguins, l’enfant se qualifie pour une hypothermie thérapeutique. L’évolution dans les premières heures de vie est marquée par une discordance entre l’évaluation neurologique qui est plutôt rassurante, l’absence d’atteinte multi-organique qui ne concorde pas avec une asphyxie sévère et la sévérité de l’atteinte cardiaque. L’enfant garde une mauvaise perfusion périphérique avec un temps de recoloration capillaire prolongé, des tensions artérielles dans les limites inférieures de la normale ainsi que des lactates augmentés.
Les équipes médicale et paramédicale sont rapidement marquées par l’aspect inhabituel des ondes T pointues et triangulaires au monitoring cardio-respiratoire. L’avis de l’équipe de cardiologie est sollicité en urgence. L’électrocardiogramme (ECG) montre des ondes de Pardee ou surélévation des segments ST en I, II, avL et de V3 à V6. On note de manière concomitante des ondes Q pathologiques, le tout témoignant d’un infarctus aigu antéro-latéral (Figure 1). L’échographie cardiaque réalisée 2 heures après la naissance montre une hypocontractilité de la paroi latérale et postérieure du ventricule gauche (VG) avec une dysfonction cardiaque systolique du VG sévère (fraction de raccourcissement du VG à 17% en mode-M, fraction d’éjection du VG à 38% selon la méthode Simpson-Biplan) (Figure 2) ainsi qu’une hypertension artérielle pulmonaire (HTAP) isosystémique. Les coronaires droite, inter-ventriculaire antérieure et circonflexe sont bien visualisées dans leur trajet proximal avec un débit antérograde en doppler couleur. Le nouveau-né est mis sous support inotrope avec une perfusion de dobutamine.

Les troponines ultrasensibles ont atteint un pic à 7451 ng/mL à 14 heures de vie (pour une valeur normale de laboratoire à < 30 ng/mL). Vers 48h de vie, la patiente développe des signes de bas débit cardiaque avec des lactates élevés à 8,3 mmol/L (normale 1,4 à 3,4mmol/L) sur une HTAP suprasystémique estimée à 88 mmHg pour une pression artérielle systolique à 60 mmHg.
Notre hypothèse était une diminution de la précharge du VG causée par l’HTAP, alors que celui-ci était déjà en défaillance systolique ainsi qu’une HTAP post-capillaire sur défaillance du VG. Dans ce contexte, de l’oxyde nitrique inhalé (iNO) a été initié ainsi que de la milrinone dans le but de vasodilater le réseau pulmonaire associé à un effet inotrope. Un traitement par prostaglandines a été instauré en vue de maintenir l’ouverture du canal artériel.
Malgré toutes ces prises en charge ainsi que l’optimisation de la sédation et une ventilation agressive, l’HTAP reste majeure et l’enfant présente des signes de mauvaise perfusion. Il est donc décidé de cesser l’hypothermie thérapeutique avant les 72 heures recommandées. Une baisse des vasodilatateurs pulmonaires est aussi réalisée, de manière à permettre au ventricule droit d’assister le ventricule gauche défaillant via le canal artériel. Par la suite, la perfusion systémique s’améliore grandement avec normalisation des lactates, récupération d’une diurèse satisfaisante et amélioration de la saturation. L’évolution est finalement favorable avec une désescalade des traitements ainsi que la mise en place d’un traitement de l’insuffisance cardiaque par diurétiques et inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA). Les prostaglandines sont cessées lorsque le shunt prédominant par le canal artériel devient gauche-droit, dénotant une récupération de la fonction ventriculaire gauche. Trois semaines après sa naissance, les pressions artérielles pulmonaires se sont normalisées. L’ECG de suivi évolue vers une disparition des ondes de Pardee avec des ondes Q dans les dérivations latérales et antérieures (Figure 3). Les valeurs de troponine diminuent nettement mais ne sont pas encore revenues à la normale à 10 jours de vie (Figure 4).
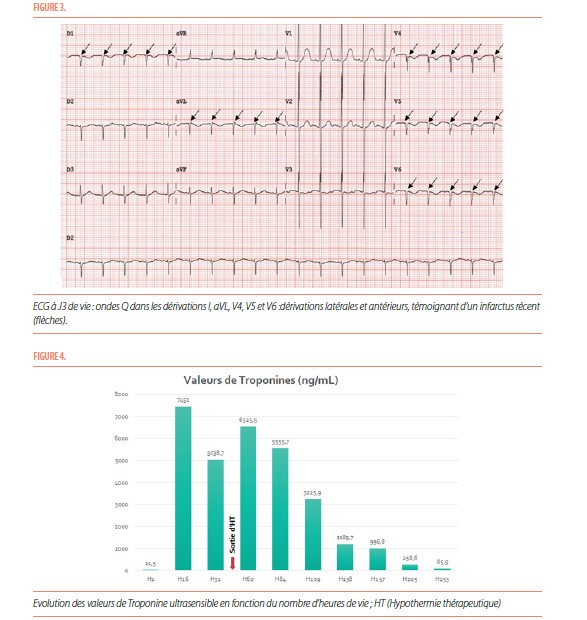
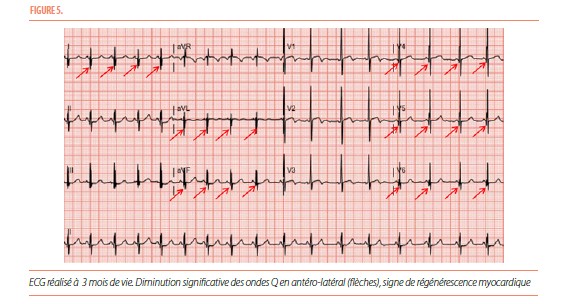
L’échographie à un mois de vie sans support ionotrope cardiaque montre une légère amélioration des indices de fonction quantitative systolique du VG, soit une FR à 21% au mode-M et une FEVG par la méthode Simpson-Biplan à 48%. La fonction cardiaque continue à s’améliorer aux échographies de suivi. L’ECG réalisé à 3 mois de vie (Figure 5) montre une diminution significative des ondes Q dans le territoire antéro-latéral, signe d’une régénérescence myocardique. Ceci n’est pas habituel dans la population adulte mais est décrit chez l’enfant, signant le potentiel de récupération.
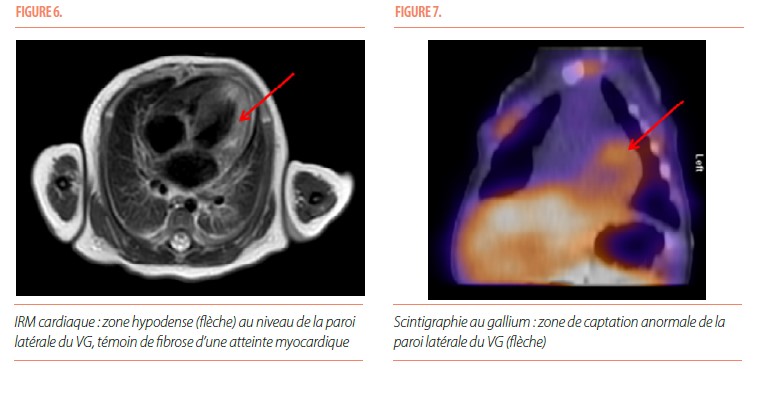
Le bilan étiologique réalisé ne montre pas de trouble de coagulation et ne met pas en évidence de facteurs pro-thrombotique chez l’enfant. L’anamnèse poussée était positive pour une virose de type coxsackie chez la fratrie en fin de grossesse mais la recherche d’entérovirus par Polymerase Chain Reaction (PCR) sanguine et nasopharyngée est négative chez notre patiente. La recherche d’autres virus (herpès, entérovirus et CMV) est également revenue négative. Une imagerie par résonance magnétique (IRM) cardiaque est effectué et montre une dilatation des cavités gauches avec une diminution de la fonction cardiaque, une hypocontractilité de la paroi latérale du VG ainsi qu’une zone hypodense compatible avec de la fibrose au lieu présumé d’infarctus (Figure 6). Les coronaires sont visibles sur une grande partie de leur trajet et semblent normales à l’angioscan, infirmant une atteinte anatomique des coronaires. Une scintigraphie au gallium réalisée au 7ème jour de vie confirme une captation majorée de façon diffuse dans le myocarde (Figure 7).
Le cas rapporté décrit donc la présentation initiale d’un nouveau-né avec infarctus néonatal périnatal. L’étiologie n’est pas complètement établie mais il est possible qu’un virus de type entérovirus ait causé une myocardite virale et donc une prédisposition à l’ischémie. Dans ce cas, la transition extra-utérine accompagnée d’un nœud dans le cordon ombilical aurait précipité l’infarctus, qui aurait eu lieu en période périnatale voire néonatale immédiate, comme l’évoque l’évolution des troponines. L’absence d’autres emboles, notamment au niveau cérébral ainsi que l’évolution favorable sans geste curatif coronarien rend un diagnostic thrombo-embolique moins probable.
Discussion
La présentation néonatale de l’infarctus du myocarde est souvent très différente de l’adulte et a un spectre clinique large, allant de l’auscultation d’un souffle cardiaque au choc cardiogénique en passant par une détresse respiratoire, comme montré par Martinez et al. (3) dans sa revue de cas. De Vetten (5) et Caruso (6) rapportent chacun des nouveau-nés avec des arythmies comme présentation. Plusieurs cas décrits dans la littérature sont associés à des asphyxies sévères avec défaillance multi-organique (6,7). Nous n’avons pas retrouvé dans la littérature de présentation d’infarctus néonatal avec besoin de réanimation intensive à la naissance et description d’une activité électrique sans pouls. L’absence d’atteinte d’autres organes chez notre patiente conforte notre hypothèse d’une atteinte myocardique primaire, plutôt que secondaire à une ischémie néonatale.
La définition d’infarctus rassemble des trouvailles cliniques, électrocardiographique et biologique. Le diagnostic d’infarctus aigu du myocarde est démontré par la présence d’onde de Pardee ou surélévation du segment ST à l’ECG. De plus, la confirmation diagnostique se fait par l’élévation des enzymes cardiaques spécifiques : Troponine I, Troponine T ou CK-MB (3,4). La réalisation d’une échographie cardiaque n’est pas nécessaire au diagnostic mais doit être faite pour l’évaluation la fonction cardiaque et la visualisation des conséquences cliniques. Elle permet également de visualiser l’implantation des coronaires ainsi que la perméabilité de leur trajet proximal.
Certaines étiologies d’infarctus néonatal sont bien décrites, la plus fréquente étant l’atteinte thrombo-embolique des artères coronaires. Elle peut être associée ou non à des anomalies morphologiques de ces artères (2,8,9). Des atteintes myocardiques ischémiques associées à des asphyxies périnatales sont également une des causes fréquemment rapportées d’infarctus néonatal dans leurs formes sévères (6,7). Les cardiopathies complexes avec dysfonctionnement valvulaire, les cardiomyopathies hypertrophiques retrouvées chez les enfants de mères diabétiques ou encore les hernies diaphragmatiques congénitales importantes sont également décrites comme facteurs en cause d’ischémie myocardique voire d’infarctus (4,10). Parmi ces phénomènes, le mécanisme sous-jacent serait une thrombo-embolisation spontanée, secondaire à un cathétérisme ou à une stase sanguine lors de la compression du cordon ombilical en cas d’asphyxie (10). L’association avec une myocardite virale est également rapportée (5,8). Cette association pourrait être une coïncidence étant donné que les infections à entérovirus sont fréquentes mais il semble néanmoins que ces infections sont associées à une artérite, des thromboses localisées ou encore des spasmes des artères coronaires, conduisant à l’ischémie myocardique (9). D’autres causes plus rares comme une vasoconstriction lors de traitement par ocytocine maternelle lors de l’accouchement, l’hématome de cordon, la consommation de drogue dure maternelle ou encore l’embolie après mise en place de cathéter ombilical sont également décrites mais la causalité ne semble pas établie.
L’examen de choix pour exclure une cause thrombo-embolique est l’angio-coronarographie (4). Comme chez l’adulte, cet examen permet une visualisation rapide des vaisseaux coronaires (implantation ou trajet anormal, anévrysme congénital ou autre malformation vasculaire) ainsi qu’une exclusion d’une sténose ou thrombus. Un article récent dans la littérature préconise un accès rapide (soit si possible dans les six heures suivant le diagnostic) au cathétérisme cardiaque dans un but diagnostique mais également thérapeutique (11). Le traitement dans le cas de phénomène thrombo-embolique consiste alors en l’adminstration d’une thrombolyse locale avec du r-tPA (activateur tissulaire du plasminogène recombiné ou de l’urokinase) (4). Cependant, cet examen est difficile d’accès en néonatologie au vu du petit calibre des vaisseaux sanguins, du besoin d’équipes et de matériel spécialisés ainsi que l’injection nécessaire d’une grande quantité de produit de contraste et n’est donc pas facilement réalisable en routine (3). La coronarographie comporte peu d’effets secondaires et devrait être réalisée en cas de questionnement étiologique persistant. Dans le cas de notre patiente, étant donné les résultats de l’échographie-doppler ainsi que du scanner réalisé au 3ème jour de vie mais également de l’évolution clinique, le diagnostic thrombo-embolique ne semblait pas probable et l’enfant n’a pas bénéficié de cathétérisme cardiaque ou coronarographie.
Il est démontré que l’échographie cardiaque n’est pas assez sensible pour visualiser de manière correcte et suffisante les vaisseaux coronaires et donc dans ce cas précis présente une faible sensibilité. Elle permet par contre une évaluation de la fonction cardiaque et des retentissements secondaires à la zone ischémiée ou infarcie (11). L’échographie cardiaque doit également compléter le bilan pour exclure une cardiopathie associée (3).
L’angioscan cardiaque, s’il est de bonne qualité, permet de voir les artères coronaires ainsi que leur trajet. La scintigraphie au gallium est un examen isotopique permettant de mettre en évidence les zones d’inflammation et donc différencier les myocardites des infarctus myocardiques. Une imagerie par résonnance magnétique cardiaque peut également être réalisée dans le but d’évaluer la fonction cardiaque et l’atteinte tissulaire (fibrose…).
Parmi les autres examens à réaliser à visée diagnostique, on retient un bilan hématologique de thrombophilie (bilan de coagulation de base, dosage D-Dimères, dosage des facteurs de coagulation, dosage antithrombine III, dosage et recherche de mutation génétique de protéine C et protéine S, dosage du facteur V Leiden, dosage de l’homocystéine, présence d’anticorps lupiques et antiphospholipides, dosage de prothrombine au minimum) mais également une recherche de virus vu la causalité rapportée avec des myocardites virales (2,3,8). Une analyse par PCR peut être réalisée sur le sang ou sur des sécrétions pharyngées. Le virus retrouvé le plus fréquemment en association avec les infarctus néonataux sont les entérovirus, en particulier le coxsackie de type B (5,12). D’autres examens tels que l’IRM cardiaque ou la scintigraphie aident à confirmer le diagnostic mais ont peu d’intérêt pour la mise en évidence de l’étiologie. Une anamnèse poussée sur la consommation de toxiques (drogues et médicaments) durant la grossesse est souhaitable.
Etant donné la sévérité de la pathologie et son évolution souvent compliquée, la majeure partie du traitement consiste en un support des fonctions vitales et de la fonction cardiaque. Il est clair qu’en cas d’étiologie traitable, le traitement causal doit être instauré. C’est ainsi qu’en cas de phénomène occlusif coronarien, une injection intra-coronarienne de nitroglycérine et/ou d’activateur tissulaire du plasminogène (tPA) peut être effectuée lors de la coronarographie (11). Une thrombolyse par antithrombine ainsi qu’une anticoagulation par héparine peuvent également être réalisées (4,11). Par la suite un traitement par anti-agrégant plaquettaire doit être envisagé (4). La dysfonction cardiaque associée à l’infarctus du myocarde en période néonatale est souvent sévère et un support inotrope est souvent nécessaire; l’agent de choix dans ce cas est la milrinone si la tension artérielle le permet. En cas d’hypotension artérielle, la dobutamine ou encore l’adrénaline sont de bonnes alternatives. Plusieurs études décrivent l’utilisation de diurétiques et d’antiarythmiques avec plus ou moins de succès (5,8). La réouverture du canal artériel par prostaglandines est une modalité thérapeutique unique à la période néonatale, lorsque la défaillance du VG est prédominante, comme chez notre patiente. Il est tentant de traiter les patients après l’évènement aigu par des IECA, comme cela est recommandé chez les patients adultes et pédiatriques en prévention du remodelage ventriculaire (12). Il n’existe cependant pas d’étude ni de recommandation dans ce sens dans la population néonatale. En cas de non-réponse aux différents traitements, une option envisageable est le recours à l’Oxygénation par Membrane Extra-Corporelle ou ECMO. Ferns décrit plusieurs cas avec une récupération quasi complète de la fonction cardiaque après une assistance par ECMO à courte durée chez des nouveau-nés (13). Bien que la mortalité soit élevée et atteigne jusque 50% selon les séries de cas (2,3,5), celle-ci survient principalement lors des premiers jours de vie. Le potentiel de récupération et de survie est par ailleurs très bon dans la population néonatale si l’enfant survit à l’évènement aigu. En effet, des études animales ainsi que des séries de cas avec suivi à long terme ont confirmé le potentiel énorme de réparation des dommages myocardiques et de récupération d’une fonction cardiaque normale (14,15).
Conclusion et recommandations pratiques
L’infarctus en période néonatale est rare, de présentation variée et mène à une mortalité importante durant la première semaine de vie. La reconnaissance rapide du diagnostic ainsi que la réalisation d’examens complémentaires adéquats sont indispensables pour trouver une étiologie. La prise en charge optimale consiste en un traitement causal si possible ainsi qu’un traitement de support comportant des inotropes intra-veineux avec un relais vers un traitement oral d’insuffisance cardiaque.
Affiliations
1 Département de néonatologie, CHU Sainte-Justine, Montréal, Canada
2 Département de néonatologie, CHC Clinique du Montlégia, Liège, Belgique
3 Département de cardiologie, CHU Sainte-Justine, Montréal, Canada
4 Département de pédiatrie, Cliniques universitaires Saint-Luc, Bruxelles, Belgique
Correspondance
Dr. Nancy Laval
CHC Montlégia
Département de Néonatologie
Boulevard Patience et Beaujonc n°2, B-4000 Liège
nancy.laval@gmail.com
Conflits d’intérêts : Les auteurs déclarent n’avoir aucun conflit d’intérêt lors de la rédaction de ce cas clinique.
Références
- Mechanic OJ, Gavin M, Grossman SA. Acute Myocardial Infarction. [Updated 2022 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK459269/
- Celermajer DS, Sholler GF, Howman-Giles R, Celermajer JM, Adolph Basser T, Sholler R et al. Myocardial infarction in childhood: clinical analysis of 17 cases and medium term follow up of survivors [Internet]. 1991. Available from: http://heart.bmj.com/
- Rodríguez Martínez M, Ruiz González E, Parra-Llorca A, Torres MV, Aguar Carrascosa M. Myocardial Infarction in Neonates: A Diagnostic and Therapeutic Challenge. Case Rep Pediatr. 2019 Oct 24; 2019: 7203407.
- Papneja K, Chan AK, Mondal TK, Paes B. Myocardial Infarction in Neonates: A Review of an Entity with Significant Morbidity and Mortality. Pediatr Cardiol. 2017; 38(3): 427–41.
- de Vetten L, Bergman KA, Elzenga NJ, van Melle JP, Timmer A, Bartelds B. Neonatal myocardial infarction or myocarditis? Pediatr Cardiol. 2011; 32(4): 492–7.
- Caruso E, di Pino A, Poli D, Manuri L, Guccione P. Erythrocytosis and severe asphyxia: Two different causes of neonatal myocardial infarction. Cardiol Young. 2014; 24(1): 178–81
- Dattilo G, Tulino V, Tulino D, Lamari A, Falanga G, Marte F et al. Perinatal asphyxia and cardiac abnormalities. Int J Cardiol. 2011; 147(2).
- Farooqi KM, Sutton N, Weinstein S, Menegus M, Spindola-Franco H, Pass RH. Neonatal myocardial infarction: case report and review of the literature. Congenit Heart Dis. 2012 Nov-Dec; 7(6): E97-102.
- Takeuchi M, Suzuki T, Nakayama M, Kenmochi M, Kitajima H. Neonatal myocardial infarction due to thrombotic occlusion. J Matern Fetal Neonatal Med. 2006 Feb; 19(2): 121-3.
- Murugan SJ, Gnanapragasam J, Vettukattil J. Acute myocardial infarction in the neonatal period. Cardiol Young. 2002; 12: 411–3.
- El-Sabrout H, Ganta S, Guyon P, Ratnayaka K, Vaughn G, Perry J et al. Neonatal Myocardial Infarction: A Proposed Algorithm for Coronary Arterial Thrombus Management. Circ Cardiovasc Interv. 2022 May;15(5):e011664.
- Kirk R, Dipchand AI, Rosenthal DN, Addonizio L, Burch M, Chrisant M et al. The International Society for Heart and Lung Transplantation Guidelines for the management of pediatric heart failure: Executive summary. [Corrected]. J Heart Lung Transplant. 2014 Sep; 33(9): 888-909.
- Ferns S, Khan M, Firmin R, Peek G, Bu’Lock F. Neonatal myocardial infarction and the role of extracorporeal membrane oxygenation. Arch Dis Child Fetal Neonatal Ed. 2009; 94(1).
- Haubner BJ, Schneider J, Schweigmann U, Schuetz T, Dichtl W, Velik-Salchner C et al. Functional Recovery of a Human Neonatal Heart after Severe Myocardial Infarction. Circ Res. 2016;118(2):216–21.
- Blom JN, Lu X, Arnold P, Feng Q. Myocardial Infarction in Neonatal Mice, A Model of Cardiac Regeneration. J Vis Exp. 2016 May 24; (111): 54100.