Chimiothérapie hyperthermique intrapéritoneale (CHIP) dans les cancers avancés de l’ovaire
Mathieu Luyckx, Jean-Francois Baurain, Filomena Mazzeo, Jean-Luc Squifflet
Introduction et rationnel
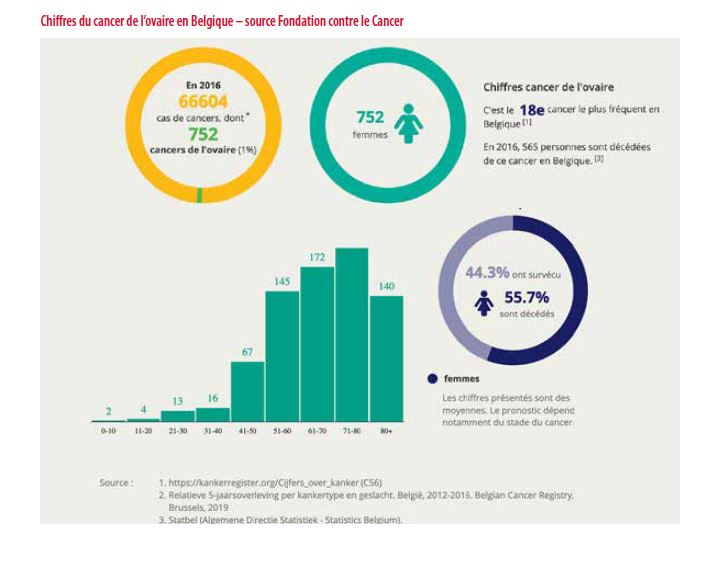
Le cancer de l’ovaire est un cancer rare, touchant en Belgique quelque 752 femmes par an (source Fondation contre le Cancer). Cependant il reste un cancer au pronostic sombre avec seulement 45% de survie à 5 ans.
Cela s’explique par quelques éléments particuliers liés à ce cancer et à son organe d’origine : l’ovaire n’ayant pas de capsule pour pouvoir jouer son rôle de « libérateur mensuel de cellules reproductrices », entendez l’ovulation, lorsque des cellules tumorales se développent à sa surface (cancers épithéliaux de l’ovaire, 80 % des cancers de l’ovaire) elles tombent directement dans le cul-de-sac de Douglas et sont emportées par le flux péritonéal pour se déposer progressivement partout dans l’abdomen sous forme de carcinomatose péritonéale. C’est à ce stade que la patiente deviendra symptomatique suite à la perturbation du flux péritonéal par cette dite carcinomatose qui entraînera l’apparition d’ascite. Son traitement consiste en une chirurgie de « cytoréduction complète » emportant tous les nodules visibles sur le péritoine et les différents organes abdominaux, combinée à une chimiothérapie à base de Carboplatine et Paclitaxel. La séquence de traitement dépend du stade et/ou de la quantité de maladie péritonéale présente au départ ; soit la chirurgie est faisable avec possibilité de résidu nul en fin d’intervention et elle est réalisée, suivie de 6 cycles de chimiothérapie, soit la maladie péritonéale est trop importante risquant de ne pas pouvoir obtenir un résidu nul en fin d’intervention, alors la chimiothérapie est donnée en tout ou en partie, avant la chirurgie pour la rendre faisable.
Malheureusement, malgré une amélioration des traitements chirurgicaux et la grande efficacité du doublet de chimiothérapie, beaucoup de patientes récidivent et dans 80% des cas, dans le péritoine. Plusieurs stratégies ont donc été développées pour essayer d’améliorer le pronostic de ces patientes.
La CHIP ou Chimiothérapie Hyperthermique Intra-Péritonéale consiste en fin de chirurgie de cytoréduction pour un cancer de l’ovaire, entre autres, à introduire directement dans l’abdomen une solution chauffée entre 40 et 43°C contenant un agent cytostatique. Il existe deux techniques : à ventre ouvert (Colysée) ou à ventre fermé, qui donne globalement des résultats similaires (1).
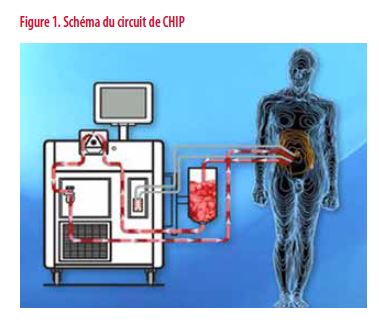
En fin de procédure, l’abdomen est « vidé » de son liquide contenant la chimio et des drains de gros calibre sont laissés en place pour permettre une évacuation complète. Il existe un rationnel évident pour utiliser cette technique dans le cancer de l’ovaire : étant une maladie principalement péritonéale, il paraît logique de détruire la maladie microscopique résiduelle par une chimiothérapie intra-péritonéale (IP).
Initialement la chimiothérapie adjuvante (après la chirurgie) a été administrée en IP pour essayer d’augmenter l’efficacité des traitements de chimiothérapie dans les cancers avancés de l’ovaire avec des résultats encourageants et maintenus au long terme (2) ; cependant, l’administration IP était difficile techniquement avec beaucoup de problèmes avec le cathéter d’administration, les adhérences post opératoires, etc …par la suite, une revue Cochrane de 2016 a revu les résultats des différentes études réalisées avec la chimothérapie IP en adjuvant, ne montrant plus de bénéfice (3). L’IP n’ayant jamais vraiment décollé pour ces lourdes difficultés techniques est dès lors tombé en désuétude.
L’administration peropératoire avec une hyperthermie serait peut-être alors la solution, l’hyperthermie, en tant que telle, ayant un effet cytotoxique et influence la pénétrance de la drogue dans les tissus (4). C’est d’ailleurs une technique validée et utilisée depuis de nombreuses années pour les maladies péritonéales de type pseudomyxome péritonéal et les mésothéliomes (5). Dans les cancers de l’ovaire, maladie péritonéale par excellence, beaucoup d’équipes ont essayé et publié de petites séries très hétérogènes en termes de produits utilisés, de temps d’exposition, de température, de technique…avec des résultats hétérogènes et également une toxicité importante du Cisplatine sur les reins (0-7% d’insuffisance rénale terminale).
Un essai prospectif a été publié mais dont la méthodologie est tellement contestable qu’il est actuellement clairement reconnu que les résultats ne sont pas à considérés comme relevants (6).
Publication du premier essai prospectif randomisé de qualité en 2018
Dans le NEJM paraît en 2018 l’essai de van Dreil et al.(7) qui va, pour la première fois, fournir des données prospectives randomisées de qualité avec un protocole clair pour la CHIP.
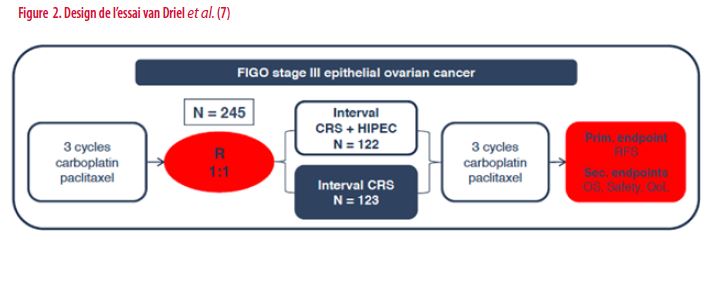
Il s’agit d’un essai multicentrique mené en Hollande et en Belgique, randomisant 245 patientes entre 2007 et 2016 atteintes d’un cancer de l’ovaire au stade IIIc et ayant reçu 3 cycles de chimiothérapie néoadjuvante pour maladie non résécable au départ. Ci-dessous le design de l’étude.
Les groupes sont bien balancés, sans différence significative entre les caractéristiques des patientes dans les deux bras. Le protocole de CHIP utilise le Cisplatine à la dose de 100mg/m2, avec hyperthermie à 40°C pendant 1h30 (avec 30 minutes de temps de chauffe pour atteindre les 40°C) et administration concomitante d’un néphroprotectant par voie intra-veineuse, le Thiosulfate de Sodium, avec bolus initial et administration dans les 6 heures suivantes.
Les résultats montrent un bénéfice tant en survie sans maladie (Disease free survival (DFS)) qu’en survie globale (Overall survival (OS)) de la CHIP par rapport au traitement standard.
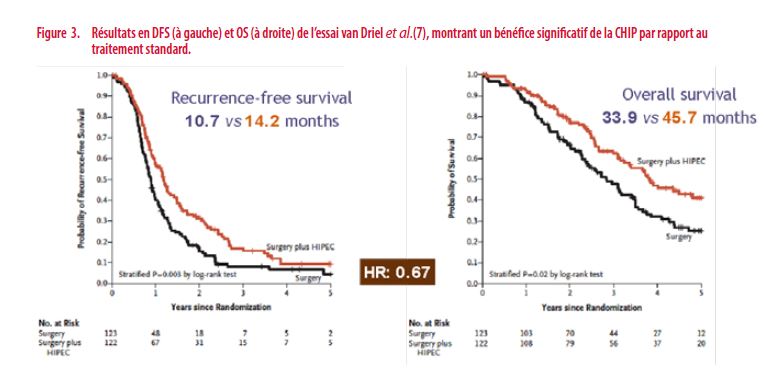
De plus, il n’est pas démontré dans cet essai de morbidité surajoutée, en dehors d’un nombre plus important de stomies de protection dans le groupe CHIP. Les conclusions des auteurs sont que la CHIP apporte un bénéfice en termes de DFS et d’OS pour les patientes atteintes d’un cancer de l’ovaire initialement non résécable, opérées après 3 cures de chimiothérapie, sans entraîner une morbidité additionnelle significative, ni d’altération significative de la qualité de vie des patientes. La toxicité rénale de grade 3 ou plus est inférieure à 1%.
Suite à la sortie de cet article, de nombreuses critiques ont émané de la communauté onco-gynécologique, parmi lesquelles :
- critères de sélection des patientes pour être envoyées en chimiothérapie néoadjuvante pas clairs ;
- recrutement long et certains centres ont un recrutement très/trop bas amenant au questionnement par rapport à l’expertise du centre/des chirurgiens dans la prise en charge des cancers de l’ovaire ;
- randomisation sensée être faite en peropératoire, mais pour 25% des patientes, randomisation avant le début de la chirurgie, avec potentiel biais sur la chirurgie pratiquée ;
- pas de différence significative en termes de morbidité mais les chiffres absolus de complications dans le groupe CHIP sont nettement supérieurs.
Parallèlement, en carcinomatose pour cancer colorectal, qui avait initialement montré un bénéfice de la CHIP par rapport à la chirurgie seule, présentation des résultats de l’essai PRODIGE 7, qui randomise CHIP vs. chirurgie seule dans le cadre de cancers colorectaux en carcinomatose, qui ne montre aucune différence significative entre les deux groupes.
Enfin vu la petite taille de l’essai de van Driel et al., le consensus de recommandations de l’ESMO-ESGO pour la prise en charge des cancers de l’ovaire ne recommande pas la CHIP lors de la chirurgie des cancers de l’ovaire en dehors d’essais cliniques (8).
Deux essais prospectifs sont en cours, OVHIPEC-2 par l’équipe de van Driel (Netherlands Cancer Institute) qui inclut et randomise entre CHIP vs. simple chirurgie les patientes opérées sans chimiothérapie néoadjuvante (chirurgie « première ») et l’essai CHIPPI par le Centre Oscar Lambret à Lille (PI F Narducci), qui randomise CHIP versus standard quel que soit le timing de la chirurgie (Première, post 3 cures de Chimiothérapie ou de « clôture »).
Conclusion
La CHIP reste une technique intéressante en théorie pour les maladies oncologiques à localisation péritonéale et, pour la première fois, dans les cancers de l’ovaire, il a été démontré prospectivement un bénéfice en DFS et OS. Cependant l’étude étant de petite taille et présentant certains biais potentiels, les sociétés scientifiques européennes ne la recommandent pas en routine clinique mais encouragent son utilisation uniquement dans le cadre d’étude clinique.
Aux Cliniques universitaires Saint-Luc, depuis Septembre 2019 est ouvert l'essai CHIPI, en collaboration avec le centre Oscar Lambret de Lille (PI : Prof F NARDUCCI), évaluant l’utilisation de la CHIP lors de la prise en charge des cancers avancés de l’ovaire, tant en chirurgie première (avant toute chimio) que lors d’une chirurgie d’intervalle ou de clôture (au milieu ou à la fin d’un traitement de chimiothérapie néoadjuvante).
Place de la lymphadénectomie dans le cancer de l’ovaire
Mathieu Luyckx, Jean-Luc Squifflet
Introduction
Le cancer de l’ovaire a pour voie de dissémination principale le péritoine mais également, une dissémination lymphatique, comme la majorité des tumeurs solides. En effet, on retrouve dans des études rétrospectives des taux d’atteinte ganglionnaire allant de 44-53% tous stade FIGO (Fédération Internationale de Gynécologie Obstétrique) confondus (stadification propre à la pathologie gynécologique, des stades I à IV) (9). Lors de la chirurgie de cytoréduction pour le cancer de l’ovaire, le but est d’atteindre la résection de toutes les lésions macroscopiquement visibles dans le péritoine et vu les taux importants d’atteinte ganglionnaire, il paraissait logique de réaliser une exérèse des ganglions. Beaucoup d’études rétrospectives ont montré une amélioration du pronostic de la maladie chez les patientes qui avaient bénéficié d’une lymphadénectomie complète (10,11,12). Une seule étude prospective n’avait pas montré de bénéfice à la lymphadénectomie mais elle comparait des lymphadénectomies complètes à des chirurgies de « débarras » des grosses adénopathies chez des patientes qui avaient encore des résidus tumoraux centimétriques, facteur majeur de pronostic de la maladie (13).
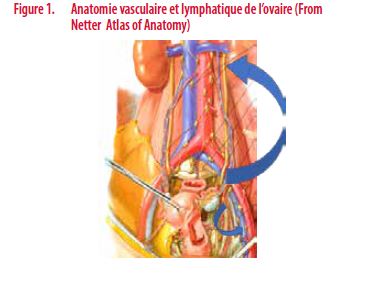
L’anatomie et particulièrement l’embryogénèse des ovaires (développement des gonades dans l’abdomen qui descendent ensuite dans le pelvis) induit que le drainage lymphatique se fait soit vers le pelvis via les vaisseaux utéro-ovariens, soit vers la région lombo-aortique via les vaisseaux ovariens, naissant de l’aorte se jetant dans la veine cave inférieure et veine rénale gauche (Figure 1). Il est donc nécessaire pour faire un curage complet des zones de drainage des ovaires, de réaliser un curage pelvien et lombo aortique complet (jusqu’aux vaisseaux rénaux), emportant un nombre important de ganglions (40-90 ganglions en moyenne – expérience CUSL), pouvant entraîner des complications (lymphocèle et lymphœdème des membres inférieurs entre autres) ayant au final un impact parfois important sur la qualité de vie de ces patientes, rarement évalué dans les études anciennes.
Sur le peu d’évidence scientifique à notre disposition, beaucoup d’équipes continuaient à pratiquer les lymphadénectomies systématiques en cas de chirurgie péritonéale complète lors de la chirurgie des cancers avancés de l’ovaire.
L’étude LION (Lymphadenectomy In Ovarian Neoplasm) : l’évidence surprenante
Dans ce contexte d’indication floue des lymphadénectomies dans les cancers avancés de l’ovaire, l’équipe allemande de Essen (Ph Harter, A Dubois, et al.), équipe reconnue internationalement pour la qualité et la radicalité de sa chirurgie en oncologie pelvienne, a monté un essai randomisé incluant les patientes suivantes : patientes atteintes d’un cancer avancé de l’ovaire (stade II-IV selon FIGO), n’ayant pas d’adénopathie visible au bilan pré- opératoire, bénéficiant d’une chirurgie de cytoréduction complète (CC0, pas de résidus visibles en fin de chirurgie) première (avant tout traitement de chimiothérapie) ET n’ayant pas d’adénopathie mise en évidence lors de la chirurgie (exploration des aires ganglionnaires indispensable !!). Elles étaient alors randomisées en per-opératoire, pour s’assurer de remplir ces critères stricts pour que la population soit la plus homogène possible, entre lymphadénectomie complète versus pas de geste ganglionnaire.
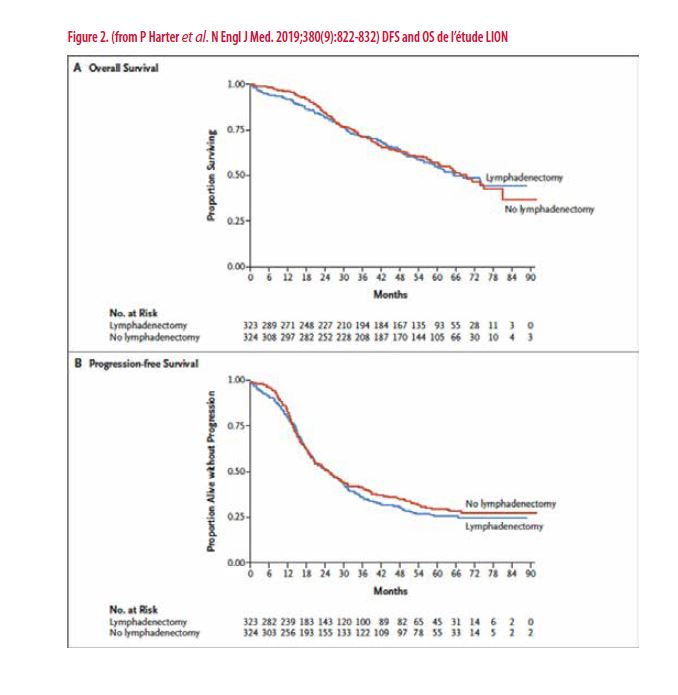
Les résultats sont parus dans le NEJM en Février 2019 (14). Ils ont screené 1895 patientes, dont 650 (34,3%) ont rempli tous les critères jusqu’en per-opératoire ; 3 furent exclues permettant d’avoir 647 patientes randomisées ; 323 dans le groupe lymphadénectomie et 324 dans le groupe sans lymphadénectomie. Vu la randomisation per-opératoire, les groupes sont bien balancés en termes de caractéristiques cliniques, de type de maladie, d’extension chirurgicale.
L’analyse de survie et de survie sans maladie ne montre aucune différence entre les deux groupes, mais un allongement du temps opératoire, une augmentation des saignements et de complications post-opératoires allant jusqu’au décès dans le groupe lymphadénectomie,
Les auteurs concluent donc logiquement qu’il n’y a plus de place pour une lymphadénectomie systématique chez les patientes atteintes d’un cancer de l’ovaire pour autant qu’il n’y ait pas d’adénopathies mises en évidence au bilan pré- et per-opératoire.
Conclusion
Vu la qualité, tant statistique de l’étude que des chirurgies pratiquées (nombre moyen de ganglions prélevés : 57 – taux de chirurgie complète 99%), ces résultats sont indiscutables et sonnent le glas de la lymphadénectomie systématique dans le cancer avancé de l’ovaire. Il reste cependant important de signaler qu’elle garde une place dans les cancers apparemment débutants (stade I), afin de ne pas méconnaître une adénopathie positive qui ferait alors passer la maladie d’un stade I à un stade III, ayant bien entendu un impact majeur sur le traitement adjuvant, et également en cas de maladie ganglionnaire détectée en pré- ou per-opératoire afin de ne pas laisser en place une maladie résiduelle évidente, tout à fait à l’opposé de la philosophie qui prime dans la chirurgie du cancer de l’ovaire, à savoir, l’absence de résidu tumoral visible. Il reste important de noter également qu’une exploration complète des aires ganglionnaires per-opératoire est indispensable pour ne pas méconnaître d’adénopathie ; cette exploration est plus qu’un simple palpé trans-péritonéal mais nécessite l’ouverture de tous les plans pour atteindre dans de bonnes conditions les aires ganglionnaires pelviennes ET Lombo-aortiques.
Inhibiteur PARP en première ligne des cancers avancés de l’ovaire
Violette Warzée, Mathieu Luyckx
Introduction
Les mutations dans les gènes codant pour des éléments clés du mécanisme recombinaison homologue (mécanisme de réparation de l’ADN) jouent un rôle important dans la carcinogenèse du cancer de l’ovaire mais sont également une cible d’intérêt pour les oncologues. Dans le cancer de l’ovaire, une mutation du gène BRCA 1/2 est identifiée dans 20 % des cas (15). Il est désormais admis que d’autres mutations mènent également à une déficience dans le mécanisme de réparation de l’ADN par recombinaison homologue. On les retrouve notamment dans 50 % des tumeurs ovariennes séreuses de haut grade (16).
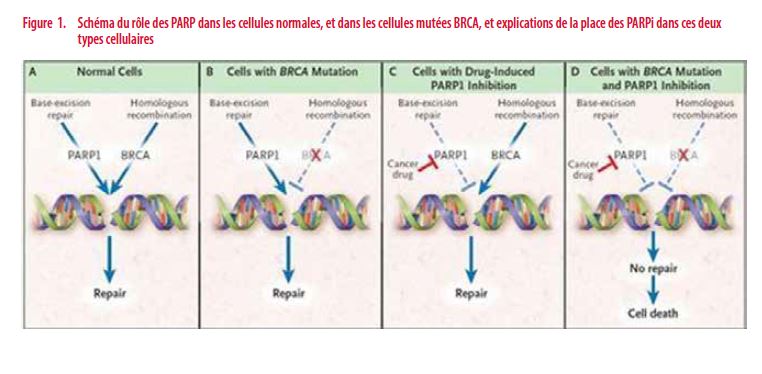
L’intégrité de l’ADN est soumise en permanence à de nombreux challenges. En effet, lors de la multiplication cellulaire ou en cas d’exposition à des agents chimiques, environnementaux… l’ADN peut subir des cassures simples ou doubles brins. Une cellule doit être capable de réparer les dommages créés au sein de son noyau pour assurer sa survie. Pour y parvenir, elle fait le plus souvent appel à des mécanismes tels que l’excision de nucléotides/de bases en cas de cassures d’un seul brin, ou encore aux recombinaisons homologues/non homologues lorsque les deux brins sont endommagés. Parmi eux, les recombinaisons homologues constituent le principal et plus fidèle moyen de réparation de l’ADN (17). En comparaison, le mécanisme de recombinaison non homologue est pourvoyeur de beaucoup plus d’erreurs, ce qui génère instabilité génomique souvent létale pour la cellule.
Lorsqu’un brin d’ADN est endommagé, c’est le plus souvent le mécanisme d’excision de nucléotides dans lequel sont impliquées les protéines polyadenosine diphosphate–ribose polymerase (PARP) qui permet la restauration de la séquence. Si la réparation est empêchée par des inhibant les PARP, la cassure simple brin évolue vers une cassure double brin qui sera corrigée par le mécanisme de recombinaison homologue dont les acteurs les plus connus sont BRCA 1 et 2. Dans une cellule normale, les inhibiteurs de PARP (PARPi) sont peu délétères car un dommage à l’ADN sera pris en charge par le mécanisme de recombinaison homologue, même en cas de mutation germinale du gène BRCA. Dans une cellule tumorale BRCA mutée, dont les deux allèles BRCA sont non fonctionnels, l’inhibition des PARP mène à la mort cellulaire car la cellule ne sera plus capable de réparer son ADN en maintenant son intégrité (18).
Initialement traités à visée curative, dans les cancers de l’ovaire de stade avancé, une récidive est objectivée dans 75 % dans cas dans les 3 ans (15). La découverte de ces mutations ouvre la voie vers de potentielles cibles et permettrait d’élargir les indications des PARPi.
Deux études de phase 1 et 2 menées chez des patientes porteuses de mutations germinales BRCA1/2 avaient ouvert la voie, révélant l’activité anti-tumorale des PARPi dans le cancer de l’ovaire (16). En 2012, l’étude de phase 2 STUDY19 a démontré l’intérêt d’un PARPi en cas de récidive d’un carcinome ovarien séreux de haut grade sensible à la chimiothérapie à base de platine. La médiane de survie sans progression (mSSP) à 4,8 mois dans le groupe contrôle se voyait presque doublée (8,4 mois) dans le groupe traité par Olaparib (hazard ratio, 0.37; 95% CI, 0.26 to 0.51; P<0.001) (16).
Les PARPi en Phase III
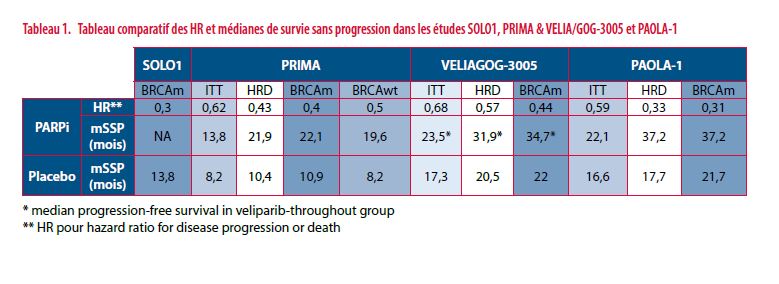
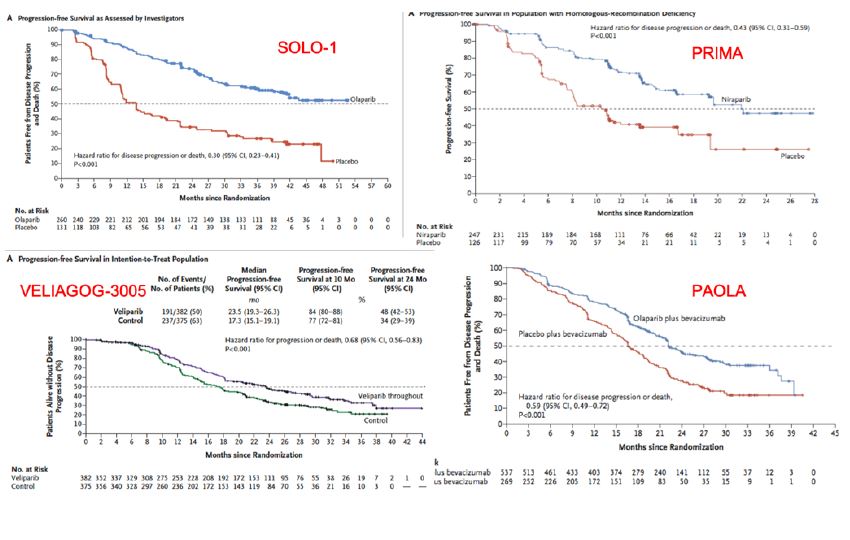
En décembre 2018, l’étude de phase 3 SOLO-1, a permis d’étendre l’indication de ces thérapies ciblées aux cancers ovariens de stade avancés (19). Moore et al. ont évalué dans une étude randomisée, en double aveugle et sous contrôle placebo l’efficacité d’un traitement d’entretien par Olaparib chez des patientes porteuses d’une mutation BRCA 1/2 atteintes d’un cancer de l’ovaire avancé (FIGO III - IV). Une diminution du risque de progression de la tumeur ou de décès de 70 % avait été observée dans le bras recevant l’olaparib (hazard ratio for disease progression or death, 0.30; 95% confidence interval [CI], 0.23 to 0.41; P<0.001). Au moment de l’interprétation des résultats la mSSP n’était pas atteinte dans le groupe Olaparib et atteignait 13,8 mois dans le groupe placebo.
En décembre 2019, les résultats de trois études de phase 3 randomisées et multicentriques publiées dans le NEJM confortent ceux obtenus dans SOLO-1.
Dans l’étude PRIMA(20), González-Martín et al. ont évalué l’intérêt du Niraparib comme traitement d’entretien (vs. placebo) dans la population globale et chez les patientes dont la tumeur présente un phénotype BRCA (certaines mutées BRCA et d’autre ayant des anomalies dans les mécanisme de recombinaison homologue) et enfin des patiente sans trouble de réparation de l’ADN retrouvés dans leur tumeurs. Dans la population globale, la mSSP atteint 13,8 mois chez les patientes traitées par niraparib (vs. 8,2 mois dans le groupe placebo) (hazard ratio, 0.62; 95% CI, 0.50 to 0.76; P<0.001). En cas de tumeurs déficientes en recombinaison homologue, la mSSP atteint 21,9 mois en cas de traitement par niraparib (vs. 10,4 mois dans le groupe placebo) (hazard ratio for disease progression or death, 0.43; 95% confidence interval [CI], 0.31 to 0.59; P<0.001). Cependant, même chez les patientes n’ayant pas d’anomalies retrouvée de la réparation de l’ADN dans leur tumeur, le Niraparib avait un effet significativement positif sur la DFS, ce qui est intéressant mais incomplètement compris.
L’étude VELIA-GOG3005 (15) menée par Coleman et al. confirme à nouveau qu’un traitement par PARPi, ici veliparib, en traitement d’entretien apporte un bénéfice en terme de survie sans progression de la maladie dans les cancers de l’ovaire à un stade avancé. L’objectif était d’évaluer l’intérêt potentiel d’un schéma concomitant Chimiothérapie/veliparib + veliparib en entretien. On évalue une diminution du risque de progression de la tumeur ou de décès de 32 % (HR = 0,68 ; IC95 : 0,56-0,83 ; p < 0,01) dans la population globale, de 43 % (HR = 0,57 ; IC95 : 0,43-0,76 ; p < 0,001) en cas de déficit de RH et de 56 % (HR = 0,44 ; IC95 : 0,28-0,68 ; p < 0,001) en cas de tumeurs BRCA mutées. Par ailleurs, les résultats n’ont pas prouvé de bénéfice significatif à un traitement concomitant par chimiothérapie et veliparib, non suivi par un traitement de maintenance en comparaison à un traitement de chimiothérapie seule. Ceci suggère que le bénéfice du veliparib est lié à son utilisation en tant que traitement de maintenance et nous pousse à nous interroger sur le réel bénéfice de l’instauration d’un PARPi dès l’initiation de la chimiothérapie.
L’étude PAOLA-1(21) avait pour objectif principal l’évaluation d’un traitement d’entretien par un PARPi, l’olaparib, chez les patientes montrant une réponse partielle ou complète à un traitement par chimiothérapie combinée à un anticorps monoclonal anti-VEGF, le bevacizumab (22) dans le cancer ovarien de stade avancé. Les résultats dans la population générale et les sous-groupes étudiés montrent à nouveau une amélioration significative de la survie sans progression. Les mSSP atteignent dans la population générale 22,1 mois (vs. 16,6 mois dans le groupe placebo; HR de progression de la maladie ou décès : 0.59; 95% CI, 0.49 to 0.72; P<0.001), 37,2 mois en cas de tumeurs BRCA mutées (vs. 21,7 mois dans le groupe placebo; HR de progression de la maladie ou décès : 0.31; 95% CI, 0.20 to 0.47) et 37,2 mois en cas de tumeurs présentant un déficit de réparation de l’ADN par RH (vs. 17,7 mois dans le groupe placebo; HR de progression de la maladie ou décès : , 0.33; 95% CI, 0.25 to 0.45) (I. Ray-Coquard, 2019).
Les PARPi ne sont pas dépourvus d’effets secondaires. Les plus souvent rapportés touchent le secteur digestif (nausées) et hématologique (anémie, thrombocytopénie). Le veliparib semble montrer une incidence d’effets secondaires inférieure à celle des autres PARPi. En combinaison à la chimiothérapie, l’incidence d’anémie et de thrombocytopénie est plus importante que dans le traitement par chimiothérapie seule. D’une manière générale, le profil d’effets secondaires était considéré de bas grade, et montrait un impact acceptable sur la qualité de vie des patientes. Cependant, des cas de syndromes myélodysplasiques et de leucémies aiguës ont été rapportés en cas de traitement par Olaparib (1%) et Niraparib. Dans l’étude PAOLA-1, on note également un taux plus élevé d’hypertension, effet secondaire connu du bevacizumab. Par ailleurs, l’association d’un PARPi ne semble pas modifier le profil de toxicité du bevacizumab.
Conclusions
Plusieurs études fiables ont démontré une amélioration significative en terme de survie sans progression du cancer de l’ovaire de stade avancé grâce à l’adjonction d’une thérapie ciblée inhibant le mécanisme PARP en traitement d’entretien. Dans les études SOLO-1, PRIMA, COG-3005 et PAOLA-1, l’analyse des sous-groupes étudiés en fonction du statut mutationnel montre un bénéfice supérieur en cas de tumeur porteuse d’une mutation BRCA par rapport à la population générale, ce qui rappelle l’intérêt de la recherche de mutations chez toute patiente atteinte d’un cancer ovarien. Cependant, il existe une réponse significative dans TOUS les sous-groupes, avec ou sans anomalies des mécanismes de réparation de l’ADN.
Au regard de ces conclusions et des résultats des différentes études évoquées ci-dessus, il semble raisonnable de proposer à toutes les patientes un traitement d’entretien par PARPi, quel que soit le profil mutationnel tumoral, le statut post-traitement associant chirurgie cytoréductive et chimiothérapie, ou encore l’administration d’un traitement par bevacizumab préalable.
Figure 2. DFS de la population ITT (Intention TO treat) des quatre études évaluant les PARPi dans les cancer avancés de l’ovaire
Références
- Halkia E, Tsochrinis A, Vassiliadou DT, et al. Peritoneal carcinomatosis: intraoperative parameters in open (coliseum) versus closed abdomen HIPEC. Int J Surg Oncol. 2015;2015:610597.
- Armstrong DK, Bundy B, Wenzel L, et al. Intraperitoneal cisplatin and paclitaxel in ovarian cancer. N Engl J Med. 2006;354(1):34-43.
- Jaaback K, Johnson N, Lawrie TA. Intraperitoneal chemotherapy for the initial management of primary epithelial ovarian cancer. Cochrane Database Syst Rev. 2016(1):CD005340.
- Strohbehn JW, Trembly BS, Douple EB. Blood flow effects on the temperature distributions from an invasive microwave antenna array used in cancer therapy. IEEE Trans Biomed Eng. 1982;29(9):649-661.
- Chua TC, Moran BJ, Sugarbaker PH, et al. Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. J Clin Oncol. 2012;30(20):2449-2456.
- Spiliotis J, Halkia E, Lianos E, et al. Cytoreductive surgery and HIPEC in recurrent epithelial ovarian cancer: a prospective randomized phase III study. Ann Surg Oncol. 2015;22(5):1570-1575.
- van Driel WJ, Koole SN, Sonke GS. Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer. N Engl J Med. 2018;378(14):1363-1364.
- Colombo N, Sessa C, Bois AD, et al. ESMO-ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages, borderline tumours and recurrent disease. Int J Gynecol Cancer. 2019.
- Harter P, Gnauert K, Hils R, et al. Pattern and clinical predictors of lymph node metastases in epithelial ovarian cancer. Int J Gynecol Cancer. 2007;17(6):1238-1244.
- du Bois A, Reuss A, Harter P, et al. Potential role of lymphadenectomy in advanced ovarian cancer: a combined exploratory analysis of three prospectively randomized phase III multicenter trials. J Clin Oncol. 2010;28(10):1733-1739.
- Scarabelli C, Gallo A, Visentin MC, et al. Systematic pelvic and para-aortic lymphadenectomy in advanced ovarian cancer patients with no residual intraperitoneal disease. Int J Gynecol Cancer. 1997;7(1):18-26.
- Chan JK, Urban R, Hu JM, et al. The potential therapeutic role of lymph node resection in epithelial ovarian cancer: a study of 13918 patients. Br J Cancer. 2007;96(12):1817-1822.
- Panici PB, Maggioni A, Hacker N, et al. Systematic aortic and pelvic lymphadenectomy versus resection of bulky nodes only in optimally debulked advanced ovarian cancer: a randomized clinical trial. J Natl Cancer Inst. 2005;97(8):560-566.
- Harter P, Sehouli J, Lorusso D, et al. A Randomized Trial of Lymphadenectomy in Patients with Advanced Ovarian Neoplasms. N Engl J Med. 2019;380(9):822-832.
- Coleman RL, Fleming GF, Brady MF, et al. Veliparib with First-Line Chemotherapy and as Maintenance Therapy in Ovarian Cancer. N Engl J Med. 2019;381(25):2403-2415.
- Ledermann J, Harter P, Gourley C, et al. Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer. N Engl J Med. 2012;366(15):1382-1392.
- Farmer H, McCabe N, Lord CJ, et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature. 2005;434(7035):917-921.
- Mateo J, Lord CJ, Serra V, et al. A decade of clinical development of PARP inhibitors in perspective. Ann Oncol. 2019;30(9):1437-1447.
- Moore K, Colombo N, Scambia G, et al. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2018;379(26):2495-2505.
- Gonzalez-Martin A, Pothuri B, Vergote I, et al. Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2019;381(25):2391-2402.
- Ray-Coquard I, Pautier P, Pignata S, et al. Olaparib plus Bevacizumab as First-Line Maintenance in Ovarian Cancer. N Engl J Med. 2019;381(25):2416-2428.
- Wang TS, Lei W, Cui W, et al. A meta-analysis of bevacizumab combined with chemotherapy in the treatment of ovarian cancer. Indian J Cancer. 2014;51 Suppl 3:e95-98.
Affiliations
- Service de gynécologie et Andrologie, Cliniques universitaires Saint-Luc, Bruxelles
- TIL’S group, Institut de Duve, UCLouvain Bruxelles
- Service d’oncologie médicale, Cliniques universitaires Saint-Luc, Bruxelles
- Board Onco-Gynécologie pelvienne, Institut Roi Abert II, Cliniques universitaires Saint-Luc, Bruxelles
Correspondance
Dr Mathieu Luyckx
Cliniques universitaires Saint-Luc
Service de gynécologie et Andrologie
Avenue Hippocrate 10
B-1200 Bruxelles