Introduction
Poser rapidement le diagnostic de COVID-19 - récemment renommé COVID- avec le plus d’exactitude possible est la pierre angulaire du contrôle de la pandémie. Parmi les tests diagnostiques qui nous permettent de confirmer le COVID, la réaction de transcription inverse suivie d’une réaction de polymérisation en chaîne quantitative en temps réel (RT-qPCR), et le test de diagnostic rapide basé sur la détection de l’antigène spécifique du SARS-CoV-2 sont deux méthodes utilisées dans la phase précoce des manifestations infectieuses. Les tests de détection des anticorps sériques (ELISA et test de flux latéral) sont utilisés dans la phase ultérieure et après la guérison. En l’absence de « test de référence » parfait, les sensibilités et spécificités respectives citées dans les différentes études doivent être considérées avec prudence et ne seront donc que brièvement commentées.
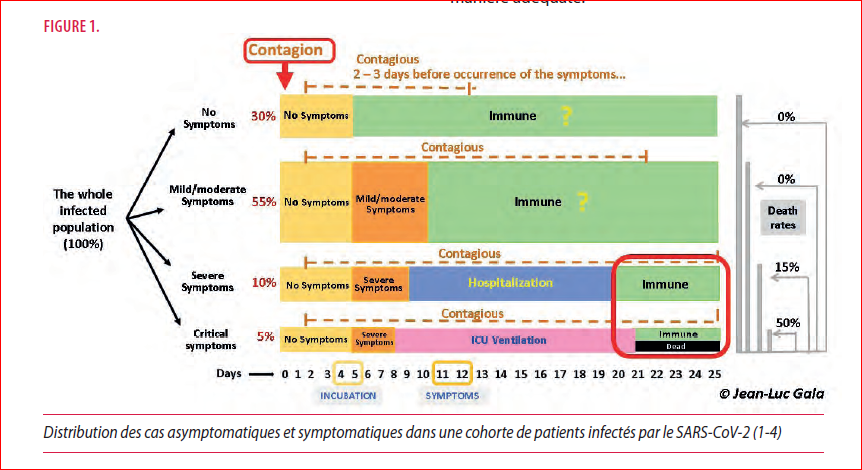
Néanmoins, il n’existe actuellement aucun «test de référence» parfait pour le diagnostic du COVID auquel les outils de diagnostic puissent être comparés. Les sensibilités et spécificités rapportées dans les différentes études, dont certaines sont grevées de nombreux biais : un recrutement insuffisant, l’absence de revue par les pairs (peer-review) et la nature commerciale de certaines communications, non confirmées par des études indépendantes. Dans l’attente d’études à large échelle menées de manière contradictoire, il faut donc considérer ces résultats avec une très grande prudence. En outre, les valeurs de diagnostic prédictives positives et négatives dépendent fortement de la prévalence du virus, du stade de l’épidémie dans le pays ou la région où les tests sont effectués, et celui de la maladie chez un individu. Le moment où les tests sont effectués chez un individu par rapport à l’apparition des symptômes est un facteur essentiel à prendre en compte lors de la comparaison des outils de diagnostic (Figure 1). En effet, les charges virales dans les voies respiratoires supérieures sont les plus élevées la veille et les premiers jours de l’apparition des symptômes, tandis que la tomodensitométrie thoracique et la sérologie semblent avoir des performances accrues plus tard dans la maladie. Il est essentiel de connaître les avantages et les limites de chaque outil, afin d’utiliser les tests et d’interpréter les résultats de manière adéquate.
LA RT-qPCR
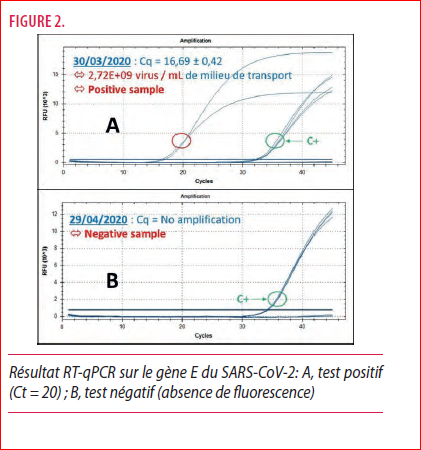
En plus de la présentation clinique, des marqueurs biologiques et de l’imagerie qui contribuent également au diagnostic du COVID, la confirmation de cette maladie virale est faite par l’identification de l’ARN du SARS-CoV-2 dans des échantillons biologiques. Dans ce contexte de diagnostic précoce impératif mais très difficile, la détection du génome viral (ARN) dans les voies aériennes supérieures (i.e. le nasopharynx ou l’oropharynx) est l’un des piliers du diagnostic de l’infection provoquée par SARS-CoV-2. Elle se fait concrètement en analysant la présence du virus au sein d’un écouvillon nasopharyngé prélevé chez un patient suspect. Au laboratoire, nous utilisons le «protocole de Berlin» qui a été développé et mis à disposition dans le monde entier à la mi-janvier 2020 par le professeur Christian Drosten, directeur de l’Institut de virologie de l’hôpital de la Charité à Berlin. Ce test cible le gène E et RdRp du SARS-CoV-2 (Figure 2).
La RT-qPCR permet de quantifier la charge virale dans un échantillon et de mesurer l’évolution au cours du temps (Figure 3).

L’analyse par RT-qPCR vient toutefois en complément d’autre investigations (cliniques, biologiques, et radiologiques). Bien que la spécificité de la RT-qPCR pour le diagnostic de la COVID soit élevée, sa sensibilité dépend largement du type d’échantillon, du moment du prélèvement, de la technique d’échantillonnage et de la qualité du test et de l’équipe de test. Ce résultat doit donc être interprété à la lumière de l’ensemble des résultats : trop précoce ou trop tardif, il peut ne pas être informatif parce que le patient est dans la phase présymptomatique dans le premier cas, ou déjà en voie de guérison dans le second cas, avec dans ces deux cas une « charge virale indétectable ». Celle-ci est notoirement plus élevée la veille et les premiers jours de l’apparition des symptômes.
Il faut également rappeler qu’un test parfait, spécifique et sensible à 100%, n’existe tout simplement pas, et que le prélèvement lui-même peut être source de résultat négatif, par exemple en raison d’un prélèvement non conforme, car effectué à l’entrée des fosses nasales et non pas en site profond (au contact de la muqueuse du nasopharynx) tel que recommandé. Le rendement de cette analyse dépend donc de facteurs multiples incluant le stade de l’infection, l’expérience du médecin qui pratique l’écouvillonnage nasopharyngé mais aussi la qualité de la méthode PCR utilisée.
Si l’écouvillon nasal est le prélèvement habituel et le meilleur pour confirmer la présence du CoV-2 du SARS dans un «cas suspect», il est utile de rappeler que certains patients le supportent mal. Il requiert donc une certaine compétence de la part du médecin qui prélève l’échantillon. A cet égard, et sur la base de notre propre expérience avec la collecte ce type d’échantillons nasopharyngés, nous pensons qu’un échantillonnage inapproprié peut, en partie, expliquer des résultats qualifiés de «PCR faux négatif» (jusqu’à ~30% dans certaines séries).
Notons aussi que, lorsque l’écouvillon nasopharyngé est difficile à obtenir, un échantillon oropharyngé est une alternative valable, celui-ci étant d’ailleurs la méthode de choix adoptée dans d’autres pays. A l’heure actuelle, on ne dispose de données comparatives de qualité suffisante permettant de comparer la sensibilité des deux méthodes et de juger si l’une est préférable à l’autre. Chez les patients hospitalisés, les échantillons des voies respiratoires inférieures (par exemple, les échantillons de lavage bronchoalvéolaire (BAL), les aspirations endotrachéales, et les expectorations peuvent également être analysées par RT-qPCR. Les échantillons des voies respiratoires inférieures sont toutefois réservés à certains cas d’hospitalisation ou de soins intensifs.
Pour mémoire, la RT-qPCR a également été utilisée sur d’autres types d’échantillons, notamment des échantillons de sang ou de matières fécales, mais ceux-ci ne sont jamais utilisés pour le bilan diagnostique.
Mentionnons enfin, que la plateforme nationale de test va entamer une étude comparant les résultats de l’analyse d’échantillons de salive et d’écouvillons nasopharyngés.
Comment prélever correctement un écouvillon nasopharyngé ?
Ces recommandations sont celles détaillées par Sciensano https://COVID-19.sciensano.be/sites/default/files/COVID19/COVID19_proced... et le New England Journal of Medicine (https://www.nejm.org/doi/full/10.1056/NEJMvcm2010260). Tout d’abord, il faut suivre les mesures de prévention de contamination lorsque des échantillons sont prélevés sur un cas suspect. L’examinateur doit porter des gants, un masque respiratoire FFP2/N95, une blouse et des lunettes de protection ou une visière protectrice. Le patient doit être coopératif, il doit être assis dans une position détendue et confortable pendant le prélèvement de l’échantillon; demandez au patient de se moucher d’abord, et de placer la tête légèrement en arrière (Figure 4): soutenez-la avec la main non dominante, ou appuyez-la contre le mur afin minimiser les mouvements subis incontrôlés pendant la prise d’échantillon, et tenez-vous debout légèrement en décalé par rapport au patient pour éviter le risque de contamination en cas de toux ou d’éternuement soudain. Informez le patient de la gêne potentielle pendant le prélèvement de l’échantillon.

Dans la mesure du possible, les échantillons doivent d’abord être prélevés dans les trois jours suivant l’apparition des symptômes chez les patients répondant à la définition de cas ; seuls des écouvillons stériles en coton, en polyester ou en nylon (écouvillons floqués) avec tige en plastique souple doivent être utilisés (ne pas perdre de vue que les matériaux constituant des écouvillons non-conformes peuvent inactiver les particules virales ou inhiber les tests PCR). Tenez l’écouvillon comme un stylo entre le pouce, l’index et le majeur. Commencez par insérer l’écouvillon horizontalement dans la narine gauche ou droite, faites-le avancer avec précaution tout en maintenant une trajectoire proche à la fois de la cloison et du plancher nasal, parallèle au palais ; ne dirigez pas l’écouvillon vers le haut mais maintenez le à l’horizontal et poussez le doucement ; une résistance est ressentie lorsque l’écouvillon atteint le nasopharynx postérieur (pour un adulte, cela correspond à 5-6 cm), laissez l’écouvillon pendant quelques secondes tout en frottant doucement la paroi dans un mouvement en faisant tourner l’écouvillon sur son axe, retirez l’écouvillon lentement et doucement; insérez immédiatement l’écouvillon dans le tube de prélèvement d’échantillons qui contient 2 à 3 ml de milieu de transport universel (UTM) viral et briser la tige à hauteur de la marque indiqués sur la tige; si pour une raison quelconque, un écouvillon nasal ne peut être prélevé, un écouvillon oropharyngé peut également être prélevé par la bouche, sans toucher la langue, les dents. Une fois encore, informez le patient que le frottis peut être inconfortable pendant un court instant et peut déclencher un réflexe nauséeux.
Les échantillons collectés peuvent être mis au réfrigérateur à 4°C pendant un maximum de 3 jours et être traités par le laboratoire dans ce laps de temps trois jours. L’idéal est toutefois d’analyser l’échantillon aussi tôt que possible après le prélèvement.
Tests immunologiques ou tests sérologiques
Des tests immunologiques permettent de mesurer des anticorps (IgM et IgG circulants) de patients atteints de COVID. On distingue les tests dit tests ELISA et les tests immunochromatographiques. Ces derniers incluent les tests rapides de détection d’anticorps et les tests rapides de détection d’antigène.
La question qui se pose est celle de l’utilisation de ces tests comme outil épidémiologique. La réponse à cette question dépend de leur fiabilité en termes de spécificité (éviter les faux positifs) et de sensibilité (éviter les faux négatifs). A ce jour, de très nombreux tests sont proposés, dont de nombreux tests chinois, avec des spécificités et des sensibilités variables mais globalement élevées. La variabilité des résultats dépend de la fenêtre immunitaire. Elle doit être adéquate, ni trop tôt ni trop tard, afin de générer un résultat qui soit interprétable.
L’ELISA (Enzyme-Linked Immunosorbent Assay, littéralement « dosage d’immunoabsorption par d’enzyme liée »)
C’est une technique immuno-enzymatique de détection qui se fait en laboratoire et qui permet de visualiser une réaction antigène-anticorps grâce à une réaction colorée produite par l’action sur un substrat d’une enzyme préalablement fixée à l’anticorps. L’utilisation d’anticorps monoclonaux rend la détection spécifique et la réalisation d’une gamme en parallèle (droite de référence réalisée en diluant de manière sériée avec un contrôle positif) permet de quantifier les anticorps du patient présents dans le sang. Plusieurs tests sont commercialisés dont anti-SARS-CoV-2 ELISA IgG, Euroimmun, Germany, EDI New Coronavirus COVID-19 IgG ELISA, Epitope Diagnostics (EDI), USA, et recomWell SARS-CoV-2 IgG ELISA, Mikrogen, Germany (6). Une réaction enzymatique rend toutefois cette technique dépendante de la température, du pH et de l’éclairement. Concrètement, l’ELISA nécessite la réalisation de différentes étapes successives : antigène spécifique du virus SARS-CoV-2 (la protéine N contenue dans la nucléocapside virale ou le récepteur de liaison du virus dit RBD (Receptor Binding Domain) est fixé pendant une nuit dans le fond d’un puit d’une plaque 96 puits (« coating ») ; les anticorps présents dans l’échantillon de plasma du patient vont se fixer spécifiquement sur l’antigène. Un anticorps de détection va ensuite fixer les anticorps humains à doser. Ces anticorps de détection sont couplés à une enzyme qui en présence de son substrat le transforme en produit de réaction détectable et mesurable grâce à l’apparition d’une coloration L’intensité de celle-ci est proportionnelle à la quantité d’enzyme présent et donc à la concentration d’anticorps recherché (Figure 5).

Certaines de ces étapes (dont le coating) prennent plusieurs heures. Le test ELISA ne peut être effectué sur une goutte de sang. Ce n’est donc pas un test rapide et il ne peut être réalisé au lit du malade !
Les tests rapides immunochromatographiques sur bandelette de nitrocellulose (aussi appelés communément « Lateral Flow Assay » ou « LFA »)
Par opposition au test ELISA, ce sont des tests rapides qui permettent d›établir un diagnostic en quelques minutes (<15 minutes). Une réaction chimique, enzymatique ou immunologique fait apparaître une coloration particulière permettant d’interpréter immédiatement le résultat. En Belgique, nous disposons du test fabriqué par la firme Zentech dont la spécificité est de 100% et la sensibilité ~98.8% (Figure 6). Ce test détecte la présence d’anticorps humains anti-SARS-CoV-2 dans les échantillons de serum. La validation sur le plasma et la goutte de sang est en cours d’évaluation.

Les tests rapides de détection des antigènes du virus SARS-CoV-2
Ce test « COVID-19 Ag Respi-Strip diagnostic assay » est un test immunochromatographique développé par la firme belge Coris Bioconcept pour la détection rapide de l’antigène CoV-2 du SRAS sur un échantillon nasopharyngé (7-9). Il a été mis au point pour identifier les patients COVID-19 positifs. A ce titre c’est test de screening rapide, qui constitue une alternative à la RT-qPCR, et permet de prendre rapidement des décisions cliniques et de quarantaine. Ce test a une sensibilité de <60% et une spécificité de 99.5%. Il est positif chez les patients présentant une charge virale élevée (correspondant à un Ct de < 25). Sa faible sensibilité constitue donc un handicap majeur pour une utilisation visant à détecter tous les cas COVID-suspects.
Évolution des anticorps sériques
La plupart des virus à ARN avec un tropisme respiratoire confèrent de fait une bonne immunité protectrice sur le long terme. Les SARS-CoV-2 stimule une réponse immunitaire. Dans la phase précoce de la maladie, les anticorps IgM commencent à apparaître, de manière inconstante, dans les 5 à 7 premiers jours suivant l’apparition des symptômes avec un temps moyen de séroconversion de 10 à 11 jours. Ils sont habituellement bien détectables après 15 jours, avec un taux de séroconversion proche de 100%, mais ils diminuent ensuite assez rapidement pour disparaître après 6 à 7 semaines (notons qu’au 15ème jour post-infection, le taux de positivité de la RT-qPCR est de moins de 50%). Les IgG sont généralement détectables plus tardivement, habituellement bien détectables 15 jours après le début de l’infection, et leur taux s’accroît progressivement jusqu’à la 5ème ou 6ème semaine après début des symptômes (10-14).
Les données sur la séroconversion dans les cas asymptomatiques et modérément symptomatiques sont forcément peu nombreuses car ce type de patients ne fait que très rarement l’objet de tests sérologiques. Lorsqu’ils sont présents, les IgM et/ou IgG sont être un marqueur fiable d’infection silencieuse ou à bas bruit dans cette cohorte peu ou pas symptomatique. Toutefois, le titre en anticorps est très variable d’un patient à l’autre. Les patients d’âge moyen ou très âgés ont des taux plasmatiques significativement plus élevés que les patients jeunes. A l’inverse, le taux d’anticorps est généralement élevé chez les patients ayant présenté un COVID sévère mais leur caractère neutralisant n’est pas fréquemment évalué.
Puissance et persistance de la réaction immunitaire
Chez certains de ces patients, aucun anticorps n’est détecté, justifiant l’hypothèse que l’immunité anti-SARS-CoV-2 sera de courte durée, et que cette faiblesse apparente de la réponse immunitaire sera associée à un risque réel de réinfections (15), mais c’est sans compter sur le rôle probable de l’immunité mucosale et cellulaire dans la réponse globale anti-SARS-CoV-2 de l’organisme (Figure 7). A titre de comparaison, les anticorps anti-SARS-CoV, cousin proche du SARS-CoV-2, persistaient pendant au moins 1 à 2 ans puis diminuaient rapidement.

Il est intéressant de noter qu’aucune réactivité croisée n’est rapportée entre les anticorps anti-SARS-CoV-2 et les autres types de coronavirus responsables de rhumes banals. Il est également important de noter qu’en raison d’un recul insuffisant, la durée persistance des anticorps après le COVID est actuellement inconnue. Aucune corrélation n’a pu être établie entre les taux d’anticorps et la clairance virale.
Néanmoins, plusieurs questions-clé persistent et nécessitent un recul de longue durée - actuellement insuffisant- par rapport la date des premiers symptômes et la mise en place d’études de population permettant d’apporter une réponse robuste aux nombreuses interrogations dont celles qui suivent :
- Les tests sérologiques sont-ils suffisamment fiables ou interprétables pour en faire un outil épidémiologique d’estimation de l’immunité collective?
Les anticorps sont-ils neutralisants et quel est le délai d’apparition de ces anticorps ?
- Quelle est la corrélation entre les niveaux d’anticorps et la protection contre la réinfection ?
- Quelle est la puissance de cette protection contre une réinfection par le SARS-CoV-2 et sa persistance (en jours, semaines, mois) ?
- Pourquoi certains patients guéris du COVID n’ont-ils pas d’anticorps détectables? Sont-ils à risque de réinfection et si oui dans quel délai?
- Quel est le rôle de l’immunité mucosale (IgA) et de l’immunité cellulaire (cellules NK et lymphocytes T CD-8+ (16) ?
- La réponse humorale prend-elle le relais lorsque l’immunité cellulaire est déficiente ?
Conclusion
Quoiqu’il en soit, les tests sérologiques constituent un précieux indicateur de la prévalence du SARS-CoV-2 et de l’immunité collective dans une population. Ils permettront de définir la cinétique des anticorps et les performances diagnostiques des tests sérologiques, une donnée essentielle qui fait actuellement défaut en raison du caractère émergent du SARS-coV-2. A ce jour les données préliminaires avancent un chiffre de 6 à 10% de la population en contact avec ce virus, mais c’est sans compter sur la sortie du déconfinement et une circulation plus large du virus dans toutes les couches de la population et sur l’inconnue de la qualité de la réponse immunitaire humorale chez les jeunes, les asymptomatiques, et les pauci-symptomatiques. Il faudra également tenir compte du choix des kits diagnostiques et de leur fiabilité, tout autant que les conditions dans lesquelles les dosages ont été effectués. La convergence des résultats des études à tous les stades de la maladie, y compris asymptomatique, présymptomatique et symptomatique, est le prérequis pour une bonne compréhension de l’apport individuel de la sérologie dans le dépistage du COVID.
Affiliations
1. Centre des technologies moléculaires appliquées, Institut de recherche clinique et expérimentale, Université catholique de Louvain, Bruxelles, Belgique.
2. Département des laboratoires de défense, ACOS Ops&Trg, Forces armées belges, Martelarenstraat, 181, 1800 Peutie, Belgique
Correspondance
Pr. Jean-Luc Gala, MD, PhD
Dir Centre for Applied Molecular Technologies (CTMA)£
Université catholique de Louvain (UCLouvain) & Defence Laboratory Department (DLD)
BE-Armed Forces At: UCLouvain-CTMA Building CLAUDE BERNARD1st floor
Av Hippocrate, 54/PO BOX B1.54.01
B-1200 Brussels
jean-luc.gala@uclouvain.be
Références
- Li R. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV2). Science. 2020. Mar 16. pii: eabb3221. doi:10.1126/science.abb3221.
- Liu Y, et al. Viral dynamics in mild and severe cases of COVID-19. Lancet Infectious Diseases. 2020. µ
- Lauer S. A, et al. The incubation period of coronavirus disease 2019 (COVID-19) from publicly reported confirmed cases: estimation and application. Ann Intern Med. 2020; 172(9), 577-582. µ
- Flaxman S., et al. Report 13: Estimating the number of infections and the impact of non-pharmaceutical interventions on COVID-19 in 11 European countries. 2020.
- Jones TC, et al. An analysis of SARS-CoV-2 viral load by patient age. German Research network Zoonotic Infectious Diseases website. 2020.
- Krüttgen A, et al. Comparison of four new commercial serologic assays for determination of SARS-CoV-2 IgG. J Clin Virol. 2020; 104394.
- Scohy A., et al. Low performance of rapid antigen detection test as frontline testing for COVID-19 diagnosis. J Clin Virol. 2020; 104455.
- Mertens, P., et al. Development and Potential Usefulness of the COVID-19 Ag Respi-Strip Diagnostic Assay in a Pandemic Context. Frontiers in Medicine. 2020; 7: 225.
- Vandenberg O. Development and potential usefulness of the COVID-19 Ag Respi-Strip diagnostic assay in a pandemic context. medRxiv. 2020.
- Guo L et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis.2020; Mar 21, doi: 10.1093/cid/ciaa310.
- Zhao J. et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020; Mar 28, doi: 10.1093/cid/ciaa344.
- NM O, Muller et al. SARS-CoV-2 specific antibody responses in COVID-19 patients. 2020.
- Wilson ME. Serologic Tests for SARS-CoV-2: First Steps on a Long Road. New Engl J Med Watch. 2020; Mar 31.
- Okba NM., et al. SARS-CoV-2 specific antibody responses in COVID-19 patients. medRxiv. 2020.
- Wu F, et al. MedRxiv. https://doi.org/10.1101/2020.03.30.20047365
- Zheng M, et al. Cell Mol Immunol 2020. Mar 19. doi: 10.1038/s41423-020-0402-2.