Introduction
Depuis la dernière mise à jour des recommandations en prévention cardiovasculaire en 2021 par la Société Européenne de Cardiologie (European Society of Cardiology/ESC) et la Société Européenne d’Athérosclérose (European Atherosclerosis Society/EAS), de nouveaux outils d’évaluation du risque et de nouveaux médicaments hypolipémiants sont disponibles. Il nous semblait important de présenter ces nouveautés qui permettent une meilleure identification des patients à plus haut risque ainsi que de positionner ces médicaments qui faciliteront l’atteinte des cibles thérapeutiques. Nous proposons un algorithme adapté sur base de ces nouveautés et tenant compte de l’expérience sur le terrain en Belgique.
Les nouveaux outils dont nous parlerons sont accessibles sur différentes plateformes électroniques dont les liens sont disponibles via les QR codes affichés à la figure 1. Avant de parler de ces nouveautés, nous rappellerons quelques éléments principaux des recommandations de 2021 (1), dont vous retrouverez les détails dans une précédente publication de ce journal (2, 3).

Quelques rappels
Dans la prise en charge de la prévention cardiovasculaire, la première étape est de préciser la catégorie de risque à laquelle appartient le patient (Figure 2). Depuis 2021, trois catégories de risques ont été définies (risque très haut, haut et faible à modéré). Les patients ayant une histoire de maladies cardiovasculaires (infarctus du myocarde, accident vasculaire cérébral (AVC), maladie artérielle périphérique) ou ayant des lésions athéromateuses significatives et non équivoques en imagerie sont classées dans la catégorie des patients à très haut risque. Ils feront l’objet d’un paragraphe complet plus loin. Concernant les patients diabétiques, des recommandations sur leur prise en charge cardiovasculaire ont été publiées en 2023 et seront également développées en détails dans une autre section. Les patients avec une insuffisance rénale chronique sont classés en fonction de la sévérité de l’atteinte rénale évaluée selon leur degré de déficit de la filtration glomérulaire associé à la présence plus ou moins importante d’une albuminurie évaluée par le ratio albuminurie/créatininurie (ACR) (Figure 2). Le patient avec une hypercholestérolémie familiale (HF) est toujours classé d’emblée à haut risque, et devient à trés haut risque s’il présente au moins un facteur de risque additionnel (hypertension, adiposité, diabète ou tabagisme). Le diagnostic d’HF est basé sur les critères DLCN (Dutch Lipid Clinic Network) lorsqu’il s’agit d’un premier diagnostic dans une famille. Chez les membres de la famille d’un patient chez qui a déjà été diagnostiqué cette maladie génétique, on peut utiliser une table de vraisemblance où les seuils de cholestérol LDL (LDL-C) sont moins stricts que dans le DLCN puisque la probabilité a priori est plus élevée. Cette table a été publiée dans le Louvain médical ou est accessible sur le site du BSA (4). De nouveaux outils intégrant l’intelligence artificielle permettront dans le futur de faciliter encore ce diagnostic.
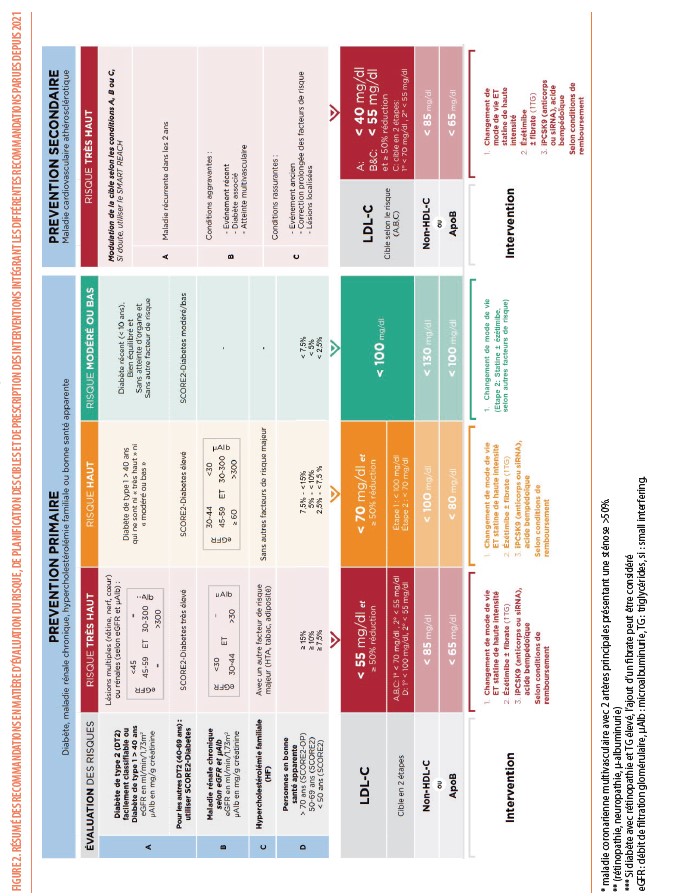
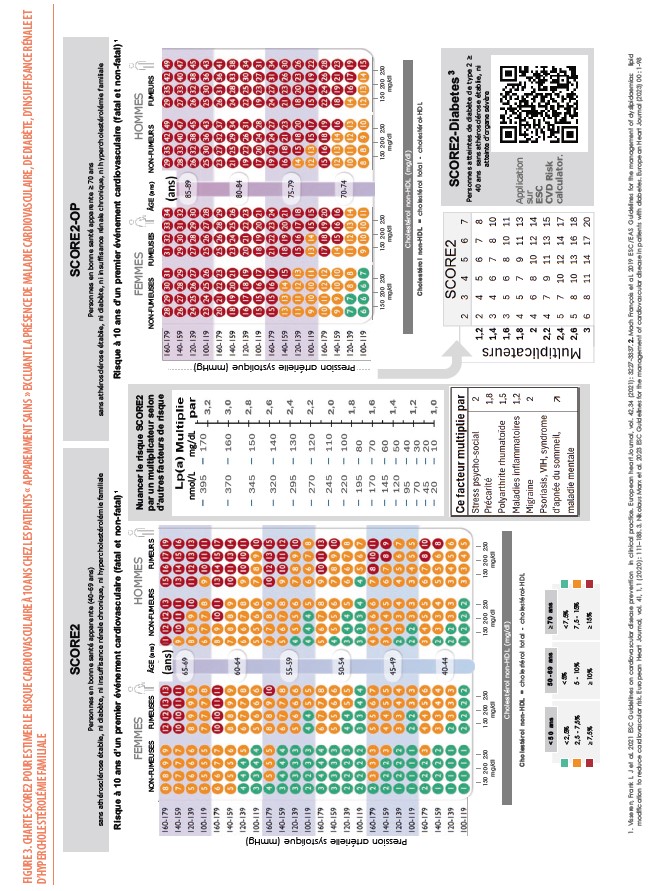
Chez les patients « apparemment sains » qui n’ont pas de maladie cardiovasculaire (MCV), pas de diabète, pas d’insuffisance rénale, pas d’HF, on estime le risque cardiovasculaire à 10 ans à partir de la charte SCORE2 (Figure 3) calibrée pour les pays à faible risque dont la Belgique fait partie (5). Dans deux précédents articles, nous avons développé l’intérêt de cette nouvelle charte et en quoi elle différait de la charte « SCORE belge » précédemment utilisée depuis 2010 (6, 7) : le risque cardiovasculaire est exprimé en « morbi-mortalité » plutôt qu’en mortalité ; le facteur lipidique de risque est le « cholestérol non-HDL » (calculé selon : cholestérol total - cholestérol HDL) plutôt que le taux de cholestérol total ; les seuils de risque pour catégoriser les patients en risque « très élevé », « élevé » ou « faible à modéré » varient selon l’âge. Alors que les seuils de risque élevé ou très élevé sont les mêmes que précédemment pour les individus entre 40 et 69 ans (soit entre 5% et 9% ou > 10%), ils sont abaissés (entre 2,5% et 7,5% ou > 7,5%) pour les patients plus jeunes (< 40 ans) pour identifier ceux qui seront susceptibles de développer des accidents cardiovasculaires dès la cinquantaine, et relevés (entre 7,5% et 15% ou > 15%) chez les patients plus âgés (plus de 70 ans) afin de s’aligner sur le risque le plus bas à ces catégories d’âge. Grâce au « SCORE2-OP » (« SCORE2 for Old Person »), il est possible maintenant d’estimer le risque cardiovasculaire chez des individus de plus de 70 ans et jusqu’à 90 ans.
Pour rappel, le taux de « cholestérol non-HDL » est la fraction de cholestérol portée par toutes les lipoprotéines athérogènes liées à l’apolipoprotéine B (VLDL, LDL, lipoprotéine(a) et les particules intermédiaires : IDL et chylomicrons remnants), à l’exclusion de la fraction portée par les particules HDL (non athérogénique). Ainsi le « cholestérol non-HDL » mesure l’intégralité du cholestérol athérogène circulant dans le sang.
Dans les directives ESC de 2021, il est également recommandé de tenir compte d’autres facteurs qui permettent de nuancer la valeur du SCORE2 par l’application de multiplicateurs (précisés dans la figure 3). Ceci peut contribuer à reclasser le patient vers une catégorie de risque plus élevée : stress psychosocial, précarité sociale, maladie migraineuse, maladie inflammatoire intestinale, syndrome d’apnée du sommeil, stéatose hépatique… L’utilisation du score calcique coronaire (CAC) ou, alternativement, de la présence d’une plaque à l’échographie carotidienne, permet de reclassifier le risque de patients se situant à la frontière entre 2 catégories de risque à la hausse en cas de valeur élevée du CAC (> la valeur médiane pour l’âge) ou de plaques carotidiennes ou à la baisse dans le cas contraire. D’autres tests tels que l’échocardiographie cardiaque, l’électrocardiogramme d’effort, le complexe intima-média, le scanner coronaire (hors score calcique coronaire), l’index bras-cheville ou la rigidité artérielle ne sont pas recommandés pour l’évaluation du risque en l’absence de bénéfice démontré. Un autre paramètre lipidique, la lipoprotéine(a) [Lp(a)] influence aussi ce risque global et sera développé plus loin.
Un nouveau score chez les patients souffrant d’un diabète de type 2
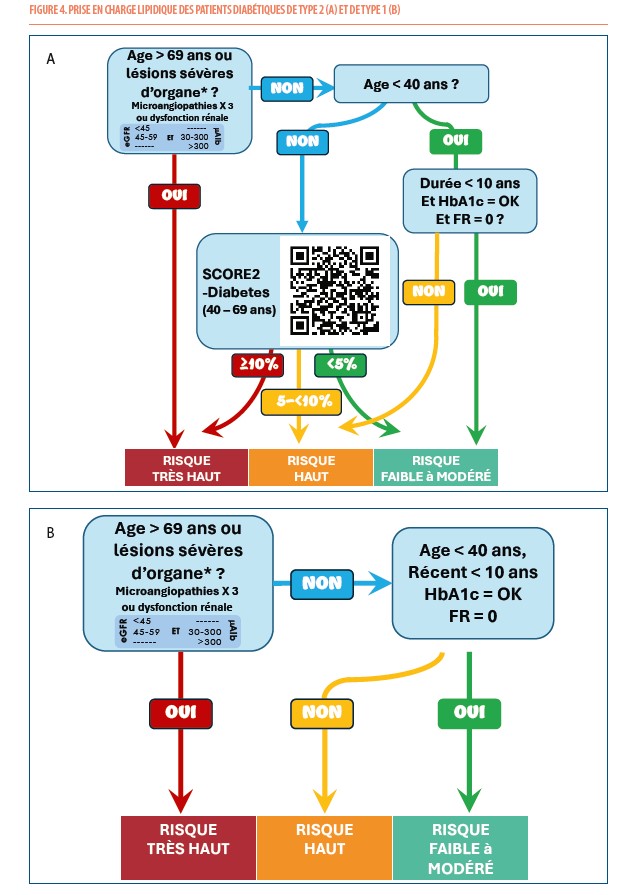
Afin de mieux individualiser les stratégies de traitement chez les patients diabétiques de type 2, un nouveau score de risque de MCV a été introduit en 2023 : le SCORE2-Diabetes (8). Ce score n’est destiné qu’aux patients atteints de diabète de type 2, âgés entre 40 et 69 ans, sans MCV et sans lésions d’organes cibles sévères. Comme le SCORE2 de la population générale, il indique le risque à 10 ans d’événements cardiovasculaires mortels et non mortels prenant en compte les facteurs de risque conventionnels (sexe, âge, tabagisme, pression artérielle systolique et cholestérol non HDL dérivé des taux de cholestérol total et HDL) mais aussi d’informations plus spécifiques au diabète (âge au moment du diagnostic de diabète, HbA1c et estimation de la filtration glomérulaire). Vu sa complexité, cette estimation du SCORE2-Diabetes n’est pas réalisable au moyen d’un abaque comme le SCORE2 mais peut être calculé à partir d’une application accessible sur le site de l’ESC (QR code disponible).

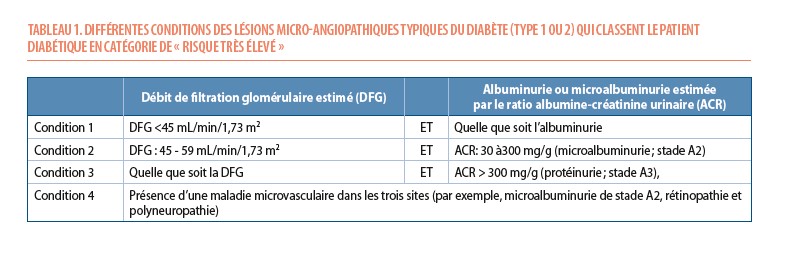
Ce SCORE-diabetes permet de reclasser un certain nombre de patients précédemment classés à « risque élevé » vers le « risque très élevé ». La classification précédente excluait en effet de la catégorie « risque très élevé », tout patient qui ne présentait pas de lésions microangiopathiques (ou « lésions d’organes cibles ») sévères ou multiples compliquant le diabète (néphropathie, rétinopathie, neuropathie) (Tableau 1). Pourtant, il y a indubitablement des patients qui, malgré l’absence de complications sévères typiques du diabète, présentent des facteurs de risques en nombre ou en sévérité telles qu’ils doivent être pris en charge comme des patients à risque très élevé. Le SCORE2-diabetes permet de corriger ce défaut.
La figure 4 résume la prise en charge lipidique chez les patients diabétiques de type 2. On identifiera d’abord les conditions clairement et facilement classifiables (1° et 2°). Ensuite, si ces conditions sont exclues, on calculera le SCORE2-diabetes (Figure 1 et Figure 4).
1° La présence d’une MCV ou de lésions microangiopathiques (ou « lésions d’organes cibles ») sévères ou multiples compliquant le diabète, telles que résumées dans le tableau 1 (reprises aussi dans l’algorithme de la figure 2 sous la forme d’une petite table à l’intérieur de la case du « très haut risque »). Si le patient présente une de ces caractéristiques, il est d’emblée considéré comme à « risque très élevé ». De même les patients diabétiques de plus de 69 ans, doivent être considérés à risque très élevé.
2° Si le patient est jeune (moins de 40 ans) n’a pas de MCV, ni de lésions sévères d’organes, ni d’autre facteur de risque (ni tabagisme, ni adiposité, ni hypertension), on peut estimer que son risque est dans la catégorie la plus basse, soit « un risque modéré à bas ». Ce risque sera d’autant plus bas que le diabète est récent, bien équilibré et que le patient a un mode de vie très satisfaisant (activité physique, alimentation équilibrée, pas de stress, …).
3° Pour les autres patients âgés de plus de 40 ans, sans MCV ou lésion microangiopathique sévère, il est recommandé d’estimer le risque de MCV à 10 ans à l’aide de l’algorithme SCORE2-Diabetes.
D’une telle classification, il pourrait sembler qu’il reste quelques patients encore non classés. On pense aux patients qui ont moins de 40 ans et présentent des facteurs de risques ou ont un diabète difficile à équilibrer ou qui durent depuis plus de 10 ans. Ces situations sont sans doute assez rares. Toutefois si c’était le cas, on pourrait considérer que ces patients sont à risque élevé (mais pas très élevé étant donné leur jeune âge). Toutefois, ils méritent certainement de voir leur taux de cholestérol LDL abaissé au moins en dessous de 70 mg/dL. Les patients diabétiques de plus de 70 ans seront, au contraire, d’emblée considérés à risque très élevé.
Quid des patients souffrant d’un diabète de type 1
Pour les diabétiques de type 1, l’estimation du risque se fait actuellement encore sans recours à un SCORE spécifique. Chez les patients porteurs de lésion(s) micro-angiopathique(s) ou de plus de 69 ans (Tableau 1), le risque est d’emblée très élevé. Chez les patients jeunes sans facteur de risque, sans lésion d’organe et sans MCV, le risque est faible à modéré. Les patients diabétiques de type 1 de plus de 40 ans qui présentent des facteurs de risques tels qu’hypertension, adiposité ou tabagisme seront considérés à risque élevé (Figure 4).
Quelques nuances en prévention secondaire
Dans notre algorithme, il nous semblait important de séparer prévention primaire et secondaire, surtout dans la mesure où les conditions de remboursement de certains médicaments tels que les traitements ciblant le PCSK9 requièrent un historique de MCV. Même si ces patients souffrant de MCV doivent faire l’objet d’une attention toute particulière, cela ne doit pas faire oublier que certains patients en prévention primaire peuvent avoir aussi un risque trés élevé et nécessiter donc tout autant d’attention.
Tous les patients qui ont souffert d’un ou plusieurs événements cardiovasculaires (infarctus du myocarde/ syndrome coronarien aigu, revascularisation artérielle coronaire ou périphérique, AVC/AIT, anévrysme aortique et maladie artérielle périphérique) ou les patients démontrant clairement par imagerie des lésions artérielles reconnues comme prédictives d’événements cliniques (présence d’une maladie coronarienne multi-vaisseaux avec sténose de plus de 50% dans deux artères épicardiques majeures en coronarographie ou scanner coronaire ou sténose carotidienne de plus de 50%) sont considérés à risque très élevé. Mais certains ont un risque plus élevé que d’autres et nécessiteront un traitement plus intensif. En Belgique, les traitements additionnels ciblant le PCSK9 (inclisiran et évolocumab, mais pas l’alirocumab) sont remboursés chez les patients souffrant de MCV et ne sont donc plus limités aux patients présentant une HF. Chez ces patients, les recommandations sont de réduire le LDL-C de 50% et à un taux inférieur à 55 mg/dL. Chez les patients qui ont récidivé une MCV dans les 2 ans suivant un premier événement, elles recommandent même de réduire de façon plus drastique en dessous de 40 mg/dL. À l’opposé, des patients dont le dernier événement cardiovasculaire remonte à de très nombreuses années, chez qui la plupart des facteurs de risques sont très bien maîtrisés depuis longtemps, ne nécessitent vraisemblablement pas un traitement aussi intensif (surtout s’ils ont un âge avancé) et la balance risque/bénéfice de l’intensification du traitement doit être évaluée au cas par cas (principe du STEP1/STEP2 proposé par les guidelines).
L’importance de mesurer au moins une fois la lipoprotéine(a) (Lp(a))
La lipoprotéine(a) est une lipoprotéine plasmatique, de structure voisine des particules LDL, à la différence que l’apolipoprotéine B du LDL est associée par une liaison disulfure avec une glycoprotéine appelée apolipoprotéine(a) (9). La lipoprotéine (a) est donc, comme la particule LDL, une lipoprotéine riche en cholestérol. Toutefois, à la diffèrence de celui-ci, elle présente une très grande hétérogénéité en termes de contenu protéique vu la grande variabilité de la taille de l’apolipoprotéine(a). Cette apolipoprotéine(a) est constituée d’un domaine de protéase inactif similaire au plasminogène et de domaines appelés « Kringles » qui sont composés de sous-unités typiques dont la structure tertiaire rappelle la forme des « bretzels » danois (ou « kringles » en anglais). Parmi ces sous-unités, le kringle 4 de sous-type 2 (parmi les 10 sous-types de ce kringle) a la particularité de varier en nombre d’un individu à l’autre (entre 2 et > de 40). Ce polymorphisme en taille détermine le poids moléculaire qui peut varier entre 300 et 800 kiloDalton mais aussi la concentration de la lipoprotéine(a) chez un individu : moins il y a de kringles 4 de sous-type 2, plus le poids moléculaire est petit, plus ces isoformes d’apo(a) de petite taille peuvent être produites en plus grand nombre par le foie, plus le taux de Lp(a) est élevé dans le sang (Figure 5).
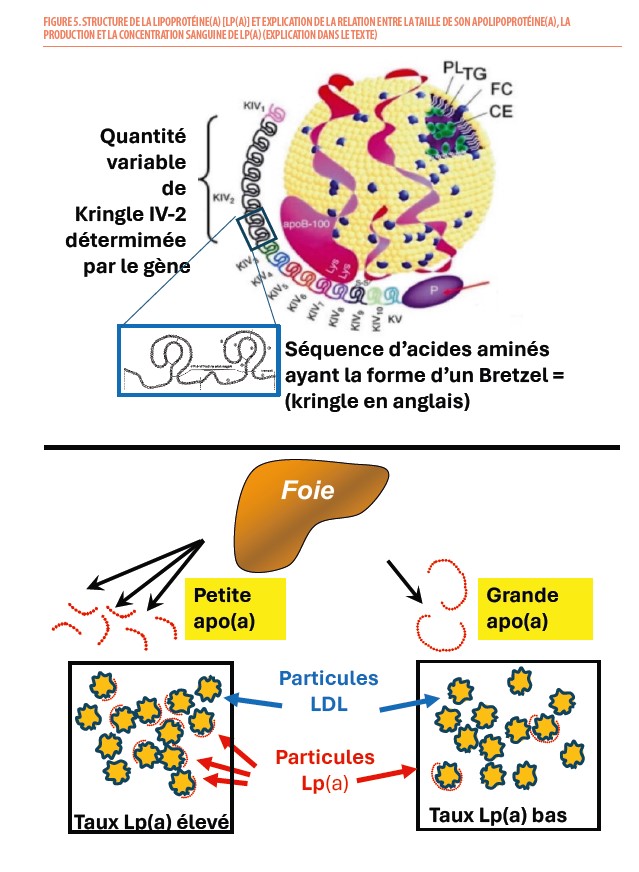
Le taux plasmatique de Lp(a) varie ainsi de manière extrême dans la population : entre 0,1 mg/dL et plus de 200 mg/dL (soit un rapport de plus de 1000 fois). Comme il est principalement déterminé par ce polymorphisme génétique, le taux reste relativement stable tout au long de la vie sans influence majeure d’interventions diététiques ou médicamenteuses (à de rares exceptions près). Quelques maladies qui altèrent le métabolisme protéique hépatique peuvent toutefois modifier ce taux : il diminue légèrement en cas de traitement (ou de production excessive) d’œstrogènes ou d’androgènes et peut augmenter à la ménopause, durant une grossesse, en cas hypothyroïdie et des traitements par hormones de croissance.
Un taux élevé de Lp(a) est un facteur causal important de MCV, mais aussi de sténose de la valve aortique par calcification précoce.
Chez qui faut-il doser la lipoprotéine(a)
Selon les recommandations de la société européenne d’athérosclérose, le dosage de la lipoprotéine(a) devrait être réalisé chez tout individu au moins une fois dans sa vie (9). Il doit particulièrement être envisagé chez des patients atteints de MCV prématurées ou récurrentes malgré une prévention optimale, chez ceux atteints de sténose valvulaire aortique et chez les individus qui ont des antécédents familiaux de MCV prématurées ou présentant une HF.
Une fois qu’est découvert un taux élevé de Lp(a) chez une personne, il est important de réaliser un dépistage au niveau familial (« cascade screening ») en dosant la Lp(a) chez les apparentés au premier degré (ses enfants, ses frères et sœurs, etc).
Que faire lorsqu’on découvre un taux élevé de lipoprotéine(a) ?
Les recommandations 2019 de la Société Européenne de Cardiologie et de la Société Européenne d’Athérosclérose (9) suggèrent qu’un taux très élevé de Lp(a) > 180 mg/dL (> 430 nmol/L) pourrait conférer un risque de MCV athérosclérotique au cours de la vie équivalent au risque associé à l’HF hétérozygote (10). Pour les taux inférieurs à 180 mg/dL (< 430 nmol/L), on peut nuancer le risque évalué par SCORE2 (ou SCORE2-OP ou SCORE2-diabetes) à partir de multiplicateurs qui augmentent de 1 à 3,2 (Figure 2 et Figure 6) selon que le taux de Lp(a) varie de 30 à 170 mg/dl (70 à 400 nmol/L). Ainsi, la découverte d’un taux élevé chez un individu signifie qu’il présente un risque cardiovasculaire plus élevé qu’initialement estimé sur base des facteurs classiques de risque ou, par la seule présence d’une maladie identifiable (diabète, HF ou insuffisance rénale).
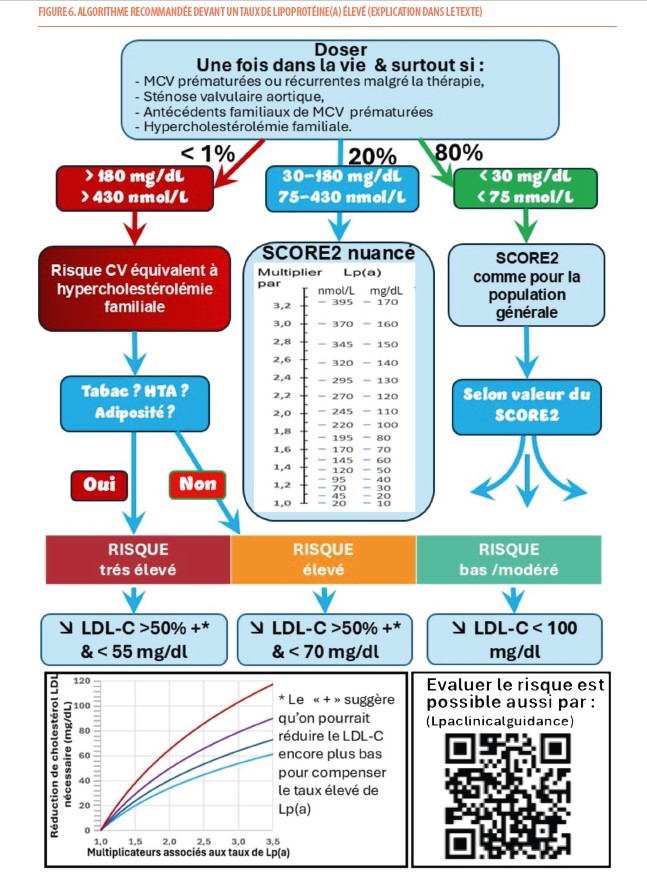
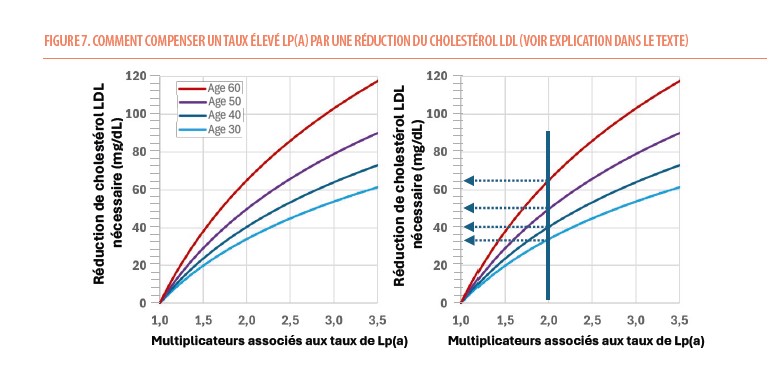
Comme on ne dispose pas encore actuellement de traitements spécifiques pour réduire la production d’apolipoprotéine(a), la stratégie face à un taux de Lp(a) élevé est de contrôler au mieux tous les facteurs de risques et d’essayer de réduire encore plus bas le taux de LDL-C. À partir d’études épidémiologiques d’observation (on ne dispose pas d’études d’intervention actuellement), on a pu modéliser l’amplitude de réduction de LDL-C nécessaire pour neutraliser l’effet d’un taux élevé de Lp(a) en fonction de l’âge du début du traitement (Figure 7) (9). Par exemple un homme de 50 ans chez qui est découvert un taux de Lp(a) de 110 mg/dL (donc un risque augmenté de 2 fois) devrait bénéficier d’une réduction supplémentaire de son LDL-C de 50 mg/dL pour neutraliser l’effet de cette élévation de taux de Lp(a). Pour compenser le même taux de Lp(a), il sera nécessaire de réduire le LDL-C de manière plus intense si cette réduction est démarrée plus tard (ex : 64 mg/dL si on commence la réduction à 60 ans) ou moins intense si démarrée plus tôt (ex : 32 mg/dl à 30 ans) (Figure 6).
Des médicaments (11, 12, 13) capables de réduire la production hépatique d’apoliprotéine(a), et donc de réduire (de presque 100% !) le taux de Lp(a), font actuellement l’objet d’études de phase 3 pour évaluer leur efficacité à réduire le risque cardiovasculaire ainsi que leur sécurité. On peut espérer avoir les premiers résultats de ces études prometteuses pour 2027.
Atteindre les cibles lipidiques en une étape ou deux étapes ?
Dans chaque catégorie de risque, les cibles thérapeutiques sont établies sur un principe très simple : plus le risque est élevé et plus la cible est stricte (Figure 2). Ainsi, chez les patients à risque élevé et très élevé, les objectifs sont d’atteindre une réduction de LDL-C d’au moins 50% et un taux final (cible) de LDL-C de < 70 mg/dl (si risque élevé) ou de < 55 mg/dL (si risque très élevé). Ces cibles très basses sont justifiées par le fait qu’une diminution du LDL-C en dessous de 70 mg/dL permet de bloquer la progression des plaques d’athérome, voire de produire une régression de celles-ci quand on atteint des valeurs plus basses (3).
Pour les patients à risque très élevé en prévention secondaire, l’approche en 2 étapes consiste à rapidement atteindre au moins un taux de LDL-C < 70 mg/dl. La deuxième étape serait d’atteindre la cible de LDL-C < 55 mg/dL. Si celle-ci n’a pas été atteinte à la première étape, l’intensification du traitement sera discutée avec le patient sur base de ses préférences et d’une information éclairée sur sa MCV et ses conséquences en tenant compte d’autres paramètres tels que sa fragilité et la présence d’autres comorbidités.
Ainsi par exemple, un patient de 55 ans, ayant présenté récemment un évènement coronarien, présentant de multiples facteurs de risque difficiles à corriger dans un laps de temps raisonnable (par exemple une obésité avec insulinorésistance, une hypertension sévère ou un taux de lipoprotéine(a) élevée) sera un candidat à une réduction rapide du LDL-C < 55 mg/dL. Par contre, un patient de 75 ans, dont les facteurs de risque ont été bien contrôlés, qui a une bonne hygiène de vie et n’a plus fait de problème cardiovasculaire depuis plus de 10 ans, pourrait ne pas obligatoirement nécessiter une réduction si profonde de son taux de LDL-C.
Pour les patients à risque élevé ou très élevé en prévention primaire, ces deux étapes pourraient se faire aussi de façon plus progressive. Une première étape, moins stricte et moins exigeante qu’en prévention secondaire, consisterait à atteindre un taux de LDL-C <100 mg/dL (Figure 2). Cette recommandation est de classe IIa pour les patients âgés de < 70 ans mais n’est que de classe IIb pour ceux de 70 ans et plus. Ceci doit être suivi d’une deuxième étape, qui selon le profil du patient (fragilité, comorbidités, bénéfices attendus et selon les préférences du patient) propose les cibles de LDL-C < 55 mg/dL chez les patients à risque très élevé et < 70 mg/dL chez les patients à risque élevé.
Ces cibles plus strictes de LDL-C < 70 mg/dL ou < 55 mg/dL seront plus particulièrement justifiées chez les patients plus jeunes (âge < 70 ans), qui présentent d’autres facteurs de risque supplémentaires accentuant encore le risque estimé par le SCORE2. À l’inverse, elles seront moins justifiées chez les patients de plus de 70 ans qui présentent une comorbidité importante avec une espérance de vie raccourcie. Il existe bien sûr des zones grises où le bon sens est de mise pour estimer le bénéfice attendu versus les inconvénients possibles pour le patient d’une telle intensification de son traitement médicamenteux (y compris le coût à la société quand il s’agit de molécules coûteuses, par exemple). Dans tous les cas, une discussion ouverte avec le patient est importante pour échanger des informations sur les bénéfices et risques, mieux identifier ses préférences (Il y a souvent des a priori concernant la prise de trop de médicaments ou le risque d’effets secondaires).
Chez les patients souffrant d’un diabète, d’une HF ou d’une insuffisance rénale sévère, ces deux étapes existent également mais avec une recommandation forte (classe I) d’atteindre la cible thérapeutique la plus basse possible dans un délai relativement court.
Triglycérides, cholestérol HDL et cholestérol non HDL
Dans les recommandations il n’y a pas de cible pour les taux de triglycérides et les taux de cholestérol HDL. En cas d’un taux élevé de triglycérides, il y a tout de même plusieurs lignes de conduite pour prévenir certaines complications associées à l’hypertriglycéridémie.
La première est de réduire le risque de pancréatite, ce qui requiert une réduction du taux de triglycérides en dessous de 800 mg/dL. Cela sera obtenu essentiellement par une diminution des excès en sucre, féculents, graisses saturées, et alcool, associée à une augmentation de l’activité physique et une perte de poids. Des médicaments tels que les fibrates ou les oméga 3 peuvent aider bien que leurs effets ne soient pas extrêmement importants.
La seconde est de réduire le risque cardiovasculaire si celui-ci est estimé « élevé » ou « très élevé » sur base de l’algorithme de la figure 2. Dans ce cas, l’objectif n’est pas de réduire le taux de triglycérides en dessous d’une certaine cible mais d’atteindre un taux (ou plutôt le calcul) du cholestérol non HDL suffisamment bas : moins de 100 mg/dL en cas de risque élevé et moins de 85 mg/dL en cas de risque très élevé. Ces cibles sont faciles à déduire de celles du LDL-C puisqu’il suffit de leur ajouter 30 mg/dL ; 30 étant la limite « normale » de 150 mg/dL du taux de triglycérides divisé par 5 selon la formule de Friedewald, pour en déduire la fraction « VLDL », « intermédiaire (IDL) » et/ou « remnants » (chylomicron remnants) du cholestérol. La réduction du cholestérol non HDL s’obtiendra par une alimentation équilibrée (même recommandations que pour le risque de pancréatite) et la prescription en premier choix d’une statine associée aux autres molécules possibles dont l’ézétimibe et d’autres médicaments hypocholestérolémiants selon les possibilités. Chez les patients hypertriglycéridémiques dont le taux de triglycérides est supérieur à 400 mg/dL, comme le calcul du taux de LDL-C n’est plus possible (la formule de Friedewald n’est plus applicable), on peut utiliser soit un dosage direct du LDL-C (demande spécifique au laboratoire et remboursé en cas de traitement) soit le taux d’ApoB ou de cholestérol non-HDL comme cible primaire au lieu du taux de LDL-C.
Enfin les autres risques associés à la présence d’une hypertriglycéridémie sont aussi les risques de diabète, de stéatose et fibrose hépatique, ainsi que diverses autres complications associées au syndrome métabolique ou à l’obésité (souvent présente) : syndrome d’apnée du sommeil, insuffisance cardiaque à fraction d’éjection préservée, lithiase vésiculaire, etc.
Des médicaments anciens et nouveaux
Dans toutes les situations, il est préconisé d’essayer d’améliorer au mieux l’équilibre diététique et l’hygiène de vie (arrêt du tabagisme, augmentation de l’activité physique). En ce qui concerne les traitements médicamenteux, ceux-ci sont réservés en priorité (Recommandations de niveau I-A) aux groupes de patients à risque élevé et très élevé tandis qu’ils ne sont encouragés (Recommandations de niveau IIa-A) dans les situations de risque modéré qu’en présence d’autres facteurs de risques qui nuancent le calcul du risque (présence d’une athérosclérose subclinique inattendue pour l’âge, taux élevé de lipoprotéine(a), …). Les lignes de conduites concernant les médicaments sont reprises dans la figure 2. La plupart des médicaments prescrits aujourd’hui (statines, ézétimibe, acide bempédoïque et anticorps monoclonaux anti-PCSK9) ont tous fait l’objet d’études d’intervention démontrant leur efficacité à réduire la survenue d’évènements cardiovasculaires.
Les statines et l’ézétimibe
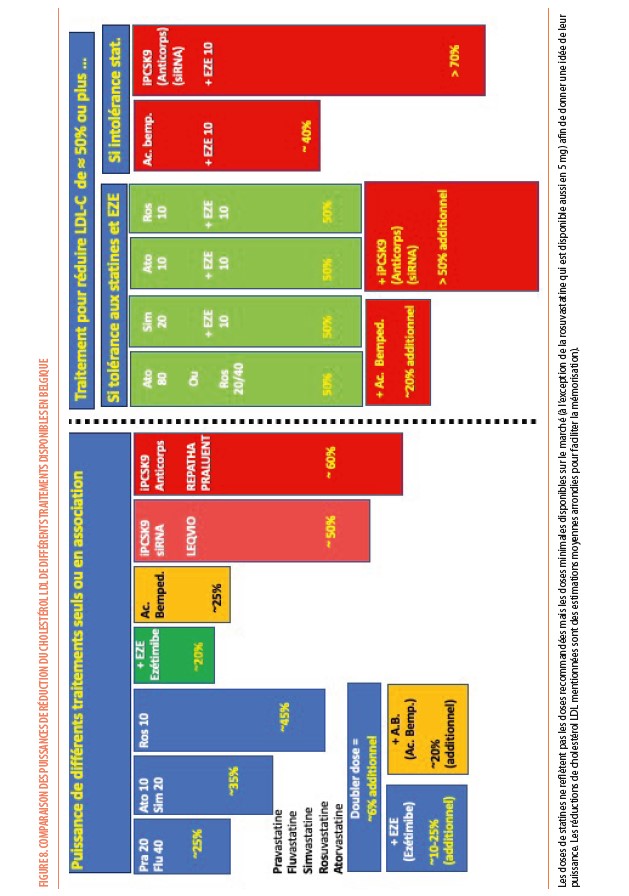
Les statines inhibent l’HMGCoA réductase, l’enzyme clef de la synthèse de cholestérol. Elles existent depuis 1986 et ont été les plus étudiées quant à leur bénéfice cardiovasculaire tant en prévention primaire que secondaire sur toutes les strates de la population (évidences établies sur base d’une trentaine d’études, incluant en tout 196,592 patients). Aux plus hautes doses, les statines les plus puissantes (atorvastatine et rosuvastatine) sont capables de réduire le taux de LDL-C de 50% ou plus (Figure 8). L’ézétimibe, qui inhibe l’absorption de cholestérol au niveau de la barrière en brosse de l’intestin grêle, permet une réduction additionnelle jusqu’à 25% du LDL-C quand il est associé à des statines. Cette addition d’ézétimibe à une statine s’accompagne aussi d’un bénéfice cardiovasculaire significatif.
Les statines sont grevées d’un pourcentage non négligeable d’intolérance caractérisée par des myalgies principalement. La fréquence de ces myalgies est estimée à 2 à 3% dans les études d’intervention mais à plus de 20% dans les études d’observation. Selon une dernière étude (14), la plupart (>90%) de ces plaintes musculaires n’était pas due à la statine. Bien qu’un effet nocebo ne soit pas exclu, c’est malheureusement un problème qui limite fréquemment la prescription de ces médicaments chez un certain nombre de patients en consultation, et donc qui limite notre capacité de réduire suffisamment le LDL-C chez des patients qui en ont besoin en raison de leur risque cardiovasculaire élevé où très élevé. Des stratégies sont proposées dans les recommandations pour pouvoir réintroduire un traitement. Chez ces patients dits « intolérants aux statines » : il faut tenter de réintroduire une statine (si possible différente), en commençant avec des doses très faibles, par exemple un demi comprimé ou un comprimé du plus faible dosage d’atorvastatine ou rosuvastatine (compte-tenu de leur longue demi-vie), 2 à 3 fois par semaine, puis en augmentant progressivement la fréquence puis la dose et/ou en combinant avec de l’ézétimibe. Des études indiquent qu’en menant une telle stratégie progressive de reprise douce, on peut arriver dans 75% des cas à une reprise complète de la dose nécessaire et utile (15). Il reste toutefois une part de patients chez qui cela sera impossible, et chez qui on devrait alors se contenter d’ézétimibe (si bien toléré) mais souvent encore insuffisant en puissance que pour atteindre les cibles thérapeutiques. Notre chance en Belgique est de pouvoir disposer du remboursement d’autres médicaments (ci-dessous) qui en addition de l’ézétimibe vont permettre d’obtenir tout de même les cibles souhaitées chez une proportion de nos patients.
Un conseil important ! A l’exception de la simvastatine et la pravastatine dont la demi-vie est courte (moins de 5 heures), les autres statines (atorvastatine et rosuvastatine) ayant une demi-vie très longue (entre 15 et 20 heures), peuvent être données aussi bien le matin que le soir, tenant compte que la prise de médicaments le soir est souvent propice à un manque d’adhérence ! Une autre statine, la pitavastatine, sera probablement commercialisée prochainement en Belgique. Elle présente une demi-vie intermédiaire (6 h) et une puissance proche des statines puissantes (donnée de 1 mg à 16 mg par jour, elle réduit le LDL-C de 33% to 55%).
Et les fibrates ou les oméga-3 ?
Les fibrates qui étaient jadis utilisés en première ligne ne sont actuellement plus recommandés. La seule exception est leur intérêt chez les patients diabétiques de type 2 qui ont des taux de triglycérides élevés et un taux de cholestérol HDL bas, et qui, malgré les autres traitements de première ligne (statines et ézétimibe), n’atteignent pas encore la cible du cholestérol non HDL. C’est en effet dans ces seules conditions que ces molécules ont pu démontrer un bénéfice cardiovasculaire (dans les études, on observe aussi une réduction du risque d’amputation et d’aggravation d’une rétinopathie diabétique) (16).
Les oméga-3 ne sont plus recommandés en prévention cardiovasculaire. D’une part, le bénéfice cardiovasculaire n’a pas pu être démontré chez les patients qui étaient déjà traités de façon optimale notamment par une statine. D’autre part le risque de fibrillation auriculaire augmente de manière dose-dépendante avec la supplémentation d’oméga 3. On conseille toujours par contre la consommation de poissons gras au moins une fois par semaine. Il existe toutefois une variété d’oméga-3 de forme icosapent ethyl (éthyle de l’acide eicosapentaénoïque « EPA » pure), qui à dose très élevée (4 gr) a démontré une réduction du risque cardiovasculaire chez des patients hypertriglycéridémiques (150 à 500 mg/dL) en prévention secondaire (17). Cette réduction n’est pas causée par une amélioration du profil lipidique (l’EPA 4 gr réduit le taux de triglycérides d’environ 20%) mais par d’autres effets encore mal précisés. Cette molécule sous le nom de Vazkepa® n’est toutefois pas encore commercialisée en Belgique. A contrario une autre étude avec des oméga-3 mixtes (EPA et DHA) aux mêmes doses et dans la même population n’a pas montré de bénéfice.
L’acide bempédoïque
L’acide bempédoïque est un inhibiteur de la synthèse du cholestérol agissant sur la même voie métabolique que les statines mais sur une enzyme (l’ATP-Citrate lyase) en amont de l’HMGCoA réductase sur laquelle agit les statines. La prise orale de 180 mg d’acide bempédoïque par jour réduit le LDL-C de 25% chez les patients qui ne reçoivent pas de statine (car intolérants ou contre-indiquée), et de 17% chez les patients déjà sous statine (18) (Figure 8). Dans l’étude CLEAR-Outcomes (19) réalisée chez 13970 patients de 65 ans d’âge moyen, (48% femmes, 46% diabétiques, LDL-C de base : 139 mg/dL) intolérants aux statines (23% recevaient une statine à très faible dose et 12% de l’ézétimibe) et présentant un risque élevé (30% en prévention primaire) ou ayant déjà présenté une MCV (70% en prévention secondaire), 180 mg d’acide bempédoïque a réduit de 21% (29 mg/dL) le taux de LDL-C et de 13% le critère primaire d’évaluation (risque de MACE-4 : IM non fatal, AVC non fatal, revascularisation coronarienne ou décès d’origine cardiovasculaire) comparé au placebo. Le traitement était bien toléré (pas de signal d’intolérance musculaire) et n’entrainait qu’une élévation modérée de l’incidence d’hyperuricémie (10,9% dans le groupe traitement contre 5,6% dans le groupe placebo), de goutte (3,1% contre 2,1%) et de lithiase biliaire (2,2% contre 1,2%). On n’observait pas d’apparition de nouveaux cas de diabètes ni d’augmentation du taux d’HbA1c ou de glucose, comme on peut le voir avec les statines. Dans une sous-analyse prenant en compte les récidives d’évènements cardiovasculaires (20), l’efficacité de l’acide bempédoïque s’est confirmée au-delà du premier évènement, avec une diminution globale de 20% des évènements (inauguraux et ultérieurs). Ce type d’analyse sur l’ensemble des événements (et pas seulement sur le premier) reflète mieux la pratique clinique. Une autre sous-analyse de cette étude (21) a montré également une diminution importante du risque cardiovasculaire en prévention primaire, avec aussi une diminution significative de la mortalité cardiovasculaire et, même de la mortalité toutes causes confondues (ce qui n’était pas significatif dans l’étude au complet).
En Belgique, ce traitement est remboursé chez tout patient à risque élevé ou très élevé et n’atteignant par leur cible (LDL-C < 70 mg/dL ou 55 mg/dL) et ce malgré un traitement à dose maximale tolérée de statine (de haute intensité comme atorvastatine 40 et 80 mg ou rosuvastatine 20 et 40 mg) associé à l’ézétimibe. Il doit donc être prescrit en association avec un traitement par une statine et l’ézétimibe sauf en cas de contre-indication ou intolérance à l’une et/ou l’autre de ces molécules.
Les anticorps monoclonaux anti-PCSK9 : alirocumab et evolocumab
Depuis 2015, nous disposons aussi des anticorps monoclonaux contre le PCSK9 qui empêchent la liaison de la protéine PCSK9 aux récepteurs des particules de LDL, prévenant ainsi leur dégradation lysosomale et donc contribuant à faciliter l’élimination hépatique des particules de LDL. Des injections réalisées toutes les 2 semaines (alirocumab ou Praluent® 75 ou 150 mg ou evolocumab ou Repatha® 140 mg) ou tous les mois (alirocumab ou Praluent® 300 mg) permettent dans les études une réduction du LDL-C de 46 à 73% chez des patients traités par une statine (± ézétimibe) (Figure 8). Un bénéfice cardiovasculaire a été démontré pour cette diminution du LDL-C induite par ces traitements (22, 23). Depuis 2022, les conditions de remboursements ont été modifiées : le remboursement de l’evolocumab (Repatha®) est maintenant possible tant pour les patients présentant une hypercholestérolémie familiale, que pour les patients ayant souffert d’une MCV (même en l’absence d’HF), pour autant que ces patients (HF ou MCV sans HF) aient un taux de LDL-C supérieur à 100 mg/dL malgré un traitement maximal toléré par statine (haute intensité si possible) et ézétimibe. Le remboursement de l’alirocumab (Praluent®) reste, pour l’instant, limité aux patients présentant une HF.
L’inclisiran
L’inclisiran (Leqvio®) est un petit ARN interférent dirigé au niveau intracellulaire hépatique contre l’ARN messager du PCSK9. Il est muni d’un ligand (N-acétylgalactosamine) qui permet sa capture préférentielle par le foie (via un récepteur spécifique, l’« asialoglycoprotein receptor »). Une fois capté, l’inclisiran intervient dans la voie de l’interférence ARN (ARNi) des hépatocytes, un mécanisme naturel, dans lequel il se lie au « silencing complex » (RISC) qui une fois activé par cette liaison, hydrolyse les molécules d’ARN messagers, ici, l’ARNm de la protéine PCSK9. L’inclisiran inhibe donc la production du PCSK9 au niveau de la cellule hépatique. Par ce biais, il réduit la destruction lysosomiale des récepteurs des LDL favorisée par le PCSK9 . La clairance hépatique des LDL est donc augmentée, ce qui réduit le taux de LDL-C circulant.
Il se donne par une injection sous-cutanée tous les six mois (après un « boost » initial consistant en une 2e injection après 3 mois de la première) ce qui est une différence par rapport aux anticorps monoclonaux dirigés contre le PSCK9 qui s’injectent de manière plus fréquente.
Dans une analyse groupée de 3 essais cliniques de l’inclisiran (ORION-9, -10 et -11, comprenant en tout 3660 participants) incluant des patients atteints d’HF ou de MCV athérosclérotiques (24), la réduction du LDL-C était de 50,7% au jour 510 (intervalle de confiance à 95% : 53% à 48%) et en moyenne de 50,5% de réduction sur la période de ces études (18 mois). La sécurité était semblable à celle du placebo hormis les effets indésirables liés au site d’injection qui sont plus fréquents dans le bras inclisiran qu’avec le placebo (5,0% contre 0,7%), mais principalement bénins et rapidement résolutifs. Une analyse d’incidence d’évènements cardiovasculaires survenus au cours des 18 mois de ces études (303 MACE, dont 74 infarctus du myocarde mortels et non mortels et 28 AVC mortels et non mortels) montre que l’inclisiran réduit de 26% le composite d’événements cardiovasculaires majeurs. Cette analyse offre déjà un aperçu des avantages CV potentiels de la réduction du LDL-C avec l’inclisiran. La question de savoir si la réduction du LDL-C-avec l’inclisiran réduit le risque d’événements cardiovasculaires ne sera toutefois formellement répondue qu’à la publication (prévue en 2026-27) des études en cours : ORION-4 (NCT03705234) et VICTORION-2 Prevent (NCT05030428).
Comment choisir le traitement le plus approprié
L’arsenal thérapeutique est donc actuellement très large. Le principe est toutefois toujours de commencer par une statine, considérée comme le traitement de première ligne selon les recommandations avec un excellent rapport coût/bénéfice. Idéalement, le médecin doit choisir le type de statine et la dose qui permettra d’atteindre au mieux la cible de LDL-C. Par exemple, si le taux de LDL-C de base est de 140 mg/dL chez un patient à risque élevé pour lequel il faut réduire le LDL-C en-dessous de 70 mg/dL selon les recommandations, la rosuvastatine 20 mg ou de l’atorvastatine 40 mg sera capable de réduire le LDL-C de 50% et d’atteindre cette cible (principe de planification du traitement) (Figure 8).
Par la suite, si, malgré la prescription de la dose maximale tolérée de statine, la cible n’a pas pu être atteinte, le médecin pourra associer à la statine de l’ézétimibe. Étant donné la forte interaction positive entre les 2 molécules qui permet même en présence de petites doses de statines d’obtenir une réduction du LDL-C (jusqu’à 60% !), une attitude de plus en plus fréquente et recommandée consiste à prescrire d’emblée une combinaison fixe d’une statine à petite dose avec de l’ézétimibe. Il existe actuellement de nombreuses formes associant la simvastatine, l’atorvastatine ou la rosuvastatine avec l’ézétimibe qui facilitent l’adhérence thérapeutique.
Si malgré l’association de statine et ézétimibe à dose maximale tolérée, les cibles de LDL-C ne sont toujours pas atteintes, il sera possible d’avoir recours à l’addition d’acide bempédoïque.
Dans certaines conditions (HF ou MCV), pourra également être ajouté un traitement ciblant le PCSK9 (anticorps ou siRNA). Les conditions de remboursement exigent toutefois que le taux de LDL-C reste encore supérieur à 100 mg/dL.
Conclusions
L’objectif de la prévention cardiovasculaire est d’offrir aux patients la garantie que les traitements prescrits limiteront au mieux de nos connaissances le risque de maladies cardiovasculaires. Une attention particulière doit être portée aux groupes de patients à risque élevé et très élevé. Ils incluent des patients en prévention secondaire mais également des patients en prévention primaire, soit présentant une maladie (telles qu’une hypercholestérolémie familiale, un diabète, une insuffisance rénale), soit « apparemment sains » mais présentant un risque élevé d’évènements à moyen terme (10 ans) selon l’estimation du risque selon SCORE2. Chez ces patients, une approche multifactorielle est essentielle : amélioration de l’hygiène de vie, arrêt du tabagisme, promotion d’une activité physique régulière et d’une alimentation équilibrée ainsi que l’instauration d’un traitement de chaque facteur de risque (hypertension, diabète, lipides, …). Dans ce contexte, la réduction du LDL-C s’avère être un des moyens les plus efficaces et les plus universels. Elle sera d’ailleurs d’autant plus efficace que le risque absolu est élevé. L’intérêt d’un traitement médicamenteux est donc surtout important chez les patients à risque élevé ou très élevé. On sait que chaque diminution du LDL-C de 40 mg/dL s’accompagne d’une diminution du risque relatif d’évènements cardiovasculaires de 20% (cette relation a été établie par de nombreuses méta-analyses). D’où l’intérêt de réduire de manière drastique le LDL-C particulièrement chez ces patients.
Avec les nouveaux outils pour estimer le risque cardiovasculaire de nos patients et les nouvelles thérapeutiques actuellement remboursées en Belgique, de plus en plus de patients ont la possibilité d’atteindre leur cible thérapeutique.
S’il fallait faire aussi quelques recommandations à notre commission de remboursement, ce serait de simplifier les documents de remboursement et surtout de garantir la possibilité de le perpétuer, (sans devoir nécessairement remettre à jour le document de remboursement). En effet les recommandations en matière de prévention cardiovasculaire, sont mises à jour régulièrement (tous les 3 à 5 ans, au niveau international par l’ESC) à partir des nouvelles données épidémiologiques et de l’accès à de nouvelles thérapies. Sont ainsi modifiés régulièrement : les critères de catégories de risques et les seuils thérapeutiques de LDL-C dans les catégories de risques élevés et très élevées qui concernent ce traitement.
Références
- Frank L.J. Visseren et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice (Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies. Eur Heart J. 2021; 42: 3227-3337. https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/CVD-Pre...
- Descamps OS, Demeure F, Mertens A, Verhaegen A, Langlois M, Wallemacq C, Rietzschel E au nom du Belgian Atherosclerosis Society/Belgian Lipid Club. Quelques nouveautés dans les recommandations 2021 pour la prise en charge des dyslipidémies en prévention cardiovasculaire. Louvain Med. 2023 ; 142 (3) : 152-162. https://www.louvainmedical.be/fr/article/quelques-nouveautes-dans-les-re...
- Descamps OS, Verhaegen A, Demeure F, Langlois M, Rietzschel E, Mertens A, et al. Evolving concepts on the management of dyslipidaemia. Acta Clin Belg. 2020 Feb;75(1):80-90.
- Descamps OS, Demeure F, Wallemacq C, Mertens A, Verhaegen A, De Sutter J, et al. Diagnostiquer l’hypercholestérolémie familiale chez un patient et les membres de sa famille. Louvain Med. 2021; 140:451-459.
- SCORE2 working group and ESC Cardiovascular risk collaboration. SCORE2 risk prediction algorithms: new models to estimate 10-year risk of cardiovascular disease in Europe. Eur Heart J. 2021;42:2439-2454.
- SCORE2-OP working group and ESC Cardiovascular risk collaboration. SCORE2-OP risk prediction algorithms: estimating incident cardiovascular event risk in older persons in four geographical risk regions. Eur Heart J. 2021;42:2455-2467.
- De Bacquer D, De Backer G. Predictive ability of the SCORE Belgium risk chart for cardiovascular mortality. Int J Cardiol. 2010; 143, 385-390.
- SCORE2-Diabetes Working Group and the ESC Cardiovascular Risk Collaboration. SCORE2-Diabetes: 10-year cardiovascular risk estimation in type 2 diabetes in Europe. Eur Heart J. 2023 Jul 21;44(28):2544-2556. doi: 10.1093/eurheartj/ehad260. PMID: 37247330; PMCID: PMC10361012.
- Kronenberg F, Mora S, Stroes ESG, Ference BA, et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. Eur Heart J. 2022 Oct 14;43(39):3925-3946. doi: 10.1093/eurheartj/ehac361. PMID: 36036785; PMCID: PMC9639807.
- Hedegaard BS, Bork CS, Kaltoft M, et al. J Am Coll Cardiol. 2022 Nov 22;80(21):1998-2010. doi: 10.1016/j.jacc.2022.09.021. PMID: 36396201.
- O’Donoghue ML, Rosenson RS, Gencer B, et al. OCEAN(a)-DOSE Trial Investigators. Small Interfering RNA to Reduce Lipoprotein(a) in Cardiovascular Disease. N Engl J Med. 2022 Nov 17;387(20):1855-1864. doi: 10.1056/NEJMoa2211023. Epub 2022 Nov 6. PMID: 36342163.
- Nissen SE, Linnebjerg H, Shen X, et al. Lepodisiran, an Extended-Duration Short Interfering RNA Targeting Lipoprotein(a): A Randomized Dose-Ascending Clinical Trial. JAMA. 2023 Dec 5;330(21):2075-2083. doi: 10.1001/jama.2023.21835. PMID: 37952254; PMCID: PMC10641766.
- Tsimikas S, Karwatowska-Prokopczuk E, Gouni-Berthold I, et al. APO(a)-LRx Study Investigators. Lipoprotein(a) Reduction in Persons with Cardiovascular Disease. N Engl J Med. 2020 Jan 16;382(3):244-255. doi: 10.1056/NEJMoa1905239. Epub 2020 Jan 1. PMID: 31893580.
- Cholesterol Treatment Trialists’ Collaboration. Effect of statin therapy on muscle symptoms: an individual participant data meta-analysis of large-scale, randomised, double-blind trials. Lancet/ 2022 ; 400 (10355) :832-845.
- Mampuya WM et al. Treatment strategies in patients with statin intolerance: the Cleveland Clinic experience. Am Heart J. 2013; 166: 597-603.
- Descamps OS, Hermans M. Quelles leçons tirer de l’étude ACCORD-Lipid (association statine et fénofibrate) pour les patients diabétiques et dyslipidémiques ? Louvain Med. 2010; 129 (4): 138-146.
- Bhatt DL, Steg PG, Miller M, Brinton EA, et al. REDUCE-IT Investigators. Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia. N Engl J Med. 2019;380:11-22.
- Descamps OS, Demeure F, Mertens A, Verhaegen A, Balligand J-L, Langlois M, et al. On behalf of the Belgian Society of Atherosclerosis/Belgian Lipid Club. Acide bempédoïque: nouvelle option thérapeutique pour améliorer le profil lipidique des patients à risque cardiovasculaire élevé. Louvain Med. 2022:141:153-161.
- Steven E. Nissen et al. Bempedoic Acid and Cardiovascular Outcomes in Statin-Intolerant Patients N Engl J Med. 2023; 388:1353-1364.
- Nicholls SJ, Nelson AJ, Lincoff AM, et al. Impact of Bempedoic Acid on Total Cardiovascular Events: A Prespecified Analysis of the CLEAR Outcomes Randomized Clinical Trial. JAMA Cardiol. Published online January 17, 2024. doi:10.1001/jamacardio.2023.5155
- Nissen SE, Menon V, Nicholls SJ, Brennan D, Laffin L, Ridker P, et al. Bempedoic Acid for Primary Prevention of Cardiovascular Events in Statin-Intolerant Patients. JAMA. 2023 Jul 11;330(2):131-140. doi: 10.1001/jama.2023.9696. PMID: 37354546; PMCID: PMC10336623.
- Schwartz GG, Steg PG, Szarek M, et al. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N Engl J Med 2018;379:2097-107. DOI: 10.1056/NEJMoa180117
- Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017;376:1713-22. DOI: 10.1056/NEJMoa1615664
- Wright RS, Ray KK, Raal FJ, et al. ORION Phase III Investigators. Pooled Patient-Level Analysis of Inclisiran Trials in Patients With Familial Hypercholesterolemia or Atherosclerosis. J Am Coll Cardiol. 2021 Mar 9;77(9):1182-1193. doi: 10.1016/j.jacc.2020.12.058. PMID: 33663735.
Affiliations
1. Département de médecine interne, Centres Hospitaliers Universitaires HELORA, Site La Louvière, Service de Cardiologie, CUSL, Bruxelles & Service de Biochimie Métabolique et Moléculaire, Université de Mons.
2. Service de Cardiologie, CHU UCL Namur site Godinne, 1, avenue Dr G. Thérasse 5530 Yvoir
3. Ann Mertens, Clinical and Experimental Endocrinology, Department of Chronic Diseases, Metabolism and Aging (CHROMETA), KU Leuven, Leuven
4. Ann Verhaegen, Department of Endocrinology, Diabetology and Metabolism, Antwerp University Hospital, Antwerpen
5. Michel Langlois, Department of Laboratory Medicine, Algemeen Ziekenhuis Sint-Jan, Brugge, and national representative of the Royal Belgian Society of Laboratory Medicine
6. Caroline Wallemacq, Department of Diabetes, Nutrition and Metabolic diseases, Centre Hospitalier Universitaire Sart Tilman, Liège
7. Ernst Rietzschel, Department of Cardiology, University Hospital Gent and Gent University, Gent
Correspondance
Pr Dr Olivier S. Descamps
CHU HELORA La Louvière
Rue Ferrer 159
B-7100 Haine Saint-Paul