Introduction
En 2019, de nouvelles recommandations ont été formulées sur le traitement des dyslipidémies pour la prévention des maladies cardiovasculaires athérosclérotiques (MCVA) par un groupe de travail de la Société Européenne de Cardiologie (ESC) et de la Société Européenne d’Athérosclérose (EAS). Ce document assez long (78 pages) est disponible (1) ainsi que sa version de poche (www.escardio.org/guidelines).
La Société Belge d’Athérosclérose a fait une sélection de ce qui est important pour la pratique quotidienne. Les recommandations de classe I sont basées sur des preuves et/ou un consensus sur lesquels tout le monde est d’accord ; les recommandations de classe II sont plus controversées et sont divisées en IIa où les preuves et/ou consensus sont en faveur de l’utilité et l’efficacité alors qu’en classe IIb il y a moins de preuves et/ou de consensus. Le traitement des dyslipidémies pour la prévention des MCVA est basé principalement sur une réduction des taux sanguins des lipoprotéines de basse densité (LDL) qui peut être estimée en mesurant le taux de cholestérol de ces LDL : le taux de cholestérol LDL (LDL-C). Le lien entre LDL et MCVA est maintenant clairement considéré comme causal (2) et les nombreuses études d’intervention randomisées et contrôlées ont démontré qu’une réduction de LDL-C s’accompagne d’une prévention des MCVA avec comme règle de base que chaque réduction additionnelle de 40 mg/dL entraîne une réduction de 20 % des MCVA (3). Afin de mettre ces connaissances en pratique de manière efficace, une approche étape par étape est recommandée pour pondérer l’intensité de l’approche préventive en fonction du risque global de MCVA d’un individu et de son taux de base (non traité) de LDL-C. Nous abordons dans ce document certaines des questions qui peuvent se poser dans la pratique quotidienne.
Qui est éligible à une prévention de MCVA ?
En principe, tout le monde mais, dans la pratique, l’approche individuelle dépendra du risque global de MCVA et du taux de base (non traité) de LDL-C. En évaluant le risque global, la population sera divisée en quatre « catégories » de risque global comme cela est indiqué à la figure 1, risque « très élevé », « élevé », « modéré » et « faible ».
Pour les personnes sans MCVA, diabète, insuffisance rénale ou sans valeur extrême de facteur de risque, il est recommandé d’estimer le risque global cardiovasculaire (CV) grâce au modèle SCORE ; ce dernier est recommandé parce que ce modèle peut être recalibré dans chaque pays en tenant compte des données nationales. Cela a été réalisé pour la Belgique (4) comme il est présenté dans la figure 2. Dans les directives ESC/EAS de 2019, il est également recommandé de tenir compte d’autres facteurs qui ne sont pas inclus dans le modèle (le tableau 1 montre de tels facteurs), mais qui peuvent nuancer l’évaluation du risque CV total. D’autres paramètres lipidiques tels que le cholestérol HDL (HDL-C), les triglycérides (TG) et la Lipoprotéine(a) (Lp(a)) influencent aussi le risque CV total. Il est également recommandé de rechercher la présence d’athérosclérose subclinique chez les personnes à risque modéré à l’aide d’une tomodensitométrie cardiaque (coroscanner ou score calcique) et/ou d’une échographie carotidienne ; ce résultat peut entraîner un reclassement du risque modéré vers faible ou élevé selon les résultats et donc avec des conséquences sur la prévention (Tableau 1).
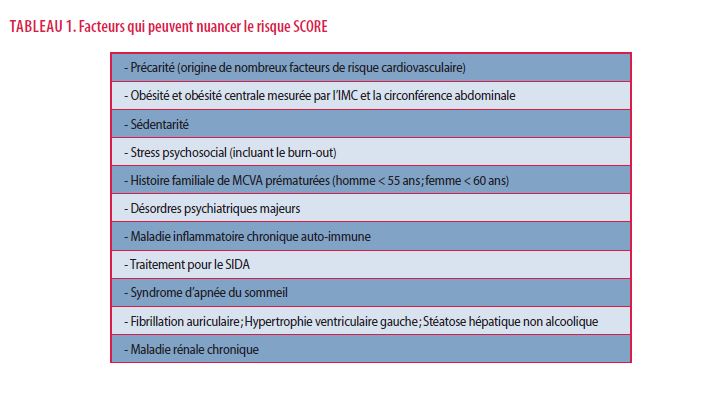
La figure 2 montre comment estimer le risque de MCVA à partir du modèle SCORE pour la Belgique suivant les taux de HDL-C et la présence d’antécédents familiaux de MCVA prématurées (5).
Chez quel patient faut-il maximaliser l’approche préventive ?
Les patients que l’on identifie dans la catégorie à « risque élevé » ou à « risque très élevé » . Ces patients sont identifiables par leur histoire clinique (Figure 1).

Un patient est dit à « risque très élevé » lorsqu’il présente une des situations cliniques suivantes : des antécédents de maladies cardiovasculaires ; une insuffisance rénale sévère (eGFR < 30 mL/min/1.73m²) ; un diabète compliqué d’une atteinte d’au moins un organe-cible ou associé à ≥ 3 facteurs de risque majeurs ou un diabète de type 1 de durée supérieure à 20 ans ; une hypercholestérolémie familiale compliquée de MCVA ou associée à ≥ 1 autre facteur de risque majeur ; le patient chez qui la charte SCORE estime un risque de mortalité cardiovasculaire d’au moins 10 % à 10 ans (Figure 2). Un patient est à « risque élevé » lorsqu’il présente une des situations cliniques suivantes : une insuffisance rénale modérée (eGFR 30-59 ml/min/1.73m²) ; un diabète sans atteinte d’organe-cible, de durée supérieure à 10 ans ou associé à ≥ 1 facteur de risque ; une hypercholestérolémie familiale sans autre facteur de risque ; un facteur de risque isolé mais fortement élevé comme une pression artérielle > 180/110 mmHg, un taux de cholestérol total > 310 mg/dL ou de LDL-C > 190mg/dL ; le patient chez qui la charte de SCORE estime un risque de mortalité cardiovasculaire entre ≥ 5 et <10 % à 10 ans (Figure 2).
Faut-il se désintéresser du patient à risque bas et modéré ?
Non ! Chez ceux-ci, les recommandations nous encouragent à contextualiser et à repérer ainsi les plus critiques, c’est-à-dire ceux qui risquent de se retrouver dans la catégorie à « risque élevé » ou à « risque très élevé » dans un futur proche ou qui pourraient être assimilés à ces catégories par la présence d’autres facteurs de risques (facteurs « modificateurs ») (voir Tableau 1). Chez les jeunes patients à « risque bas » et à « risque modéré », le médecin peut s’aider de la charte par une simple extrapolation à un âge plus élevé. L’illustration de cette extrapolation permettra aux patients de comprendre la nécessité d’adapter leur mode de vie afin de leur éviter d’arriver dans la zone rouge/rouge foncé quand ils seront plus vieux. Les conseils diététiques doivent être appliqués dans toutes les catégories de risque y compris dans les catégories de « risque faible » et de « risque modéré ». C’est un des changements importants dans ces nouvelles recommandations, puisqu’elles veulent donner une place plus prioritaire à l’équilibre diététique, au point d’ailleurs qu’elles ont fixé, pour les patients à « faible risque », la nécessité d’essayer d’atteindre un taux de cholestérol LDL inférieur à 116 mg/dL par une adaptation du régime alimentaire.
Quels objectifs de LDL-C faut-il atteindre en fonction du risque global de MCVA et pourquoi a-t-on abaissé de nouveau les cibles par rapport aux recommandations précédentes ?
Les valeurs cibles pour le LDL-C sont décidées en fonction de la catégorie de risque CV total, comme présentées à la figure 1. Ces valeurs cibles de LDL-C ont récemment été ajustées sur la base d’une synthèse critique de l’évidence scientifique dont on dispose ; la classe de recommandations est présentée à la figure 1 pour chaque catégorie de risque.
Ainsi, les nouvelles recommandations sont caractérisées par un abaissement important des cibles thérapeutiques du LDL-C et la nécessité de réduire d’au moins de 50 % le taux de LDL-C chez les patients à « risque élevé » et « risque très élevé ». Chez ces derniers patients, le principe est « the lowest is the best », c’est-à-dire réduire le LDL-C au maximum de nos possibilités et de la tolérance. Les cibles sont justifiées par le fait que l’on a démontré qu’une diminution du LDL-C en dessous de 70 mg/dL permettait une régression des plaques d’athérome et que chez les patients avec des antécédents cardiovasculaires, c’est cette régression des plaques qui permettait une prévention CV efficace.
Il est vrai que chaque nouvelle directive nous demande de reculer les cibles de LDL-C vers des taux de plus en plus bas. Ceci n’a rien d’étonnant, ni d’inquiétant, ni de commandé par les firmes pharmaceutiques quand on connaît l’historique des études cliniques qui ont enrichi les évidences en prévention par la correction des lipides et aussi l’évolution en puissance de nos moyens thérapeutiques (7). Les cibles des recommandations se sont calquées sur les taux atteints dans ces études. Cette progression dans les études a permis de démontrer qu’il n’existait pas de limite inférieure au-delà de laquelle le bénéfice cardiovasculaire se perdait (« Lowest is best »). Autrement dit, la courbe de bénéfice n’est pas une courbe en « J » comme pour la glycémie ou la tension artérielle mais une droite qui reste linéaire même dans les valeurs les plus basses. Ainsi, chez les patients à haut risque, il est recommandé de viser un LDL-C < 55 mg/dL ET au moins une réduction de 50 % par rapport à la ligne de base. Chez certains de ces patients qui présentent un nouvel événement MCVA endéans les deux ans après le premier événement malgré un traitement avec une statine à la dose maximale tolérée, une cible de LDL-C < 40 mg/dL peut même être envisagée.
Y a-t-il un danger à abaisser le LDL-C à des valeurs très basses ?
Certainement pas ! La réduction de LDL-C, même à des taux extrêmement bas, par les médicaments ne s’accompagne d’aucun effet secondaire particulier et les médicaments hypolipémiants eux-mêmes, indépendamment de leurs effets sur le cholestérol, ont fait largement la preuve de leur innocuité. Il reste que les statines peuvent occasionner des myalgies chez un petit nombre de patients.
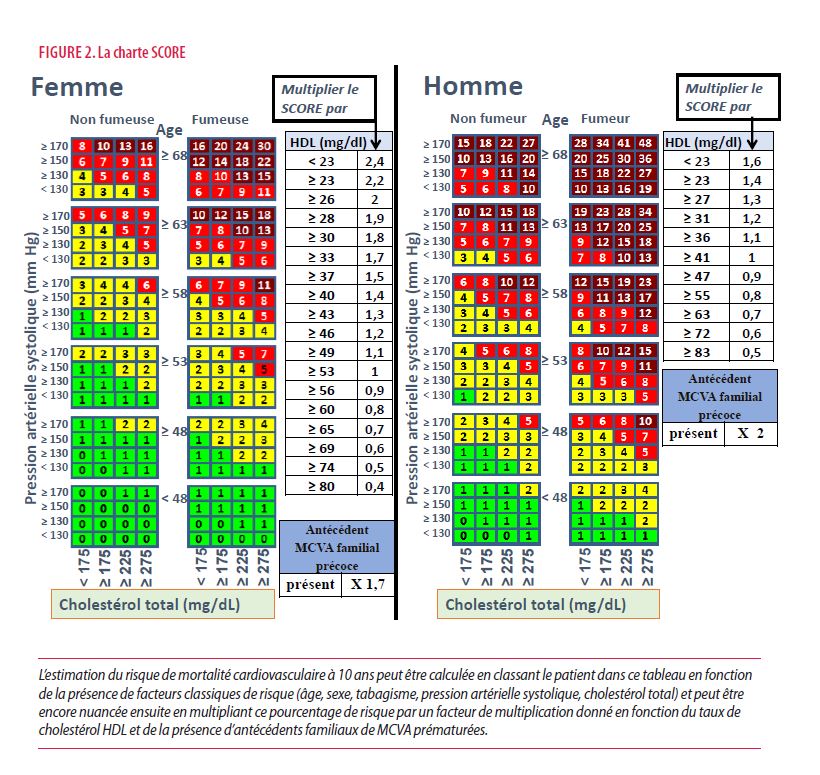
Comment puis-je choisir le médicament le plus approprié pour atteindre la cible LDL-C ?
Le taux cible de LDL-C et la réduction que l’on veut atteindre dépendent de la catégorie de risque à laquelle appartient le patient (voir la figure 1). Selon le taux de base (non traité) du LDL-C et la valeur cible à atteindre, on peut estimer quel pourcentage de réduction de LDL-C sera nécessaire. La réduction LDL-C qui peut être réalisée avec une statine dépend du type de statine et de la dose. En règle générale, l’atorvastatine 40 ou 80 mg/j et la rosuvastatine 20 ou 40 mg/j sont considérées comme des statines « puissantes ». La figure 3 décrit la réduction de LDL-C qui peut être obtenue avec divers types de traitement. Ce schéma indique clairement quel traitement permet de réduire d’au moins 50 % en moyenne le LDL-C, réduction actuellement recommandée chez les patients présentant un risque CV élevé ou très élevé. Il faut se rappeler que ce sont des chiffres moyens et qu’il y a une grande variation inter-individuelle dans la réponse de réduction du LDL-C pour une dose donnée d’une statine donnée. Par exemple, un traitement avec rosuvastatine 20 mg/j apportera, en moyenne, une diminution de LDL-C d’environ 50 %, mais cela peut varier d’une personne à l’autre depuis à peine 10 % jusqu’à des extrêmes de 80 %. Il est donc très important d’évaluer le résultat après quelques semaines avec le patient, à la fois en termes d’efficacité et d’innocuité. Chez les patients qui ont eu un syndrome coronarien aigu, il sera presque toujours nécessaire d’utiliser une statine de haute intensité pour atteindre les valeurs cibles. Il est donc également recommandé de leur prescrire une statine de haute intensité (sauf contre-indication) dès l’hospitalisation (Figure 3).
Recommandations pour le traitement des dyslipidémies chez les personnes de plus de 65 ans
- Chez les patients plus âgés atteints de MCVA, le traitement des dyslipidémies n’est pas différent de celui des patients plus jeunes atteints de MCVA.
- Pour la prévention primaire des MCVA chez les individus âgés de 75 ans ou moins, le traitement par statines est approprié en fonction du risque global de MCVA.
- Il est recommandé de commencer les statines à faible dose chez les patients souffrant d’insuffisance rénale et/ou lors de l’interaction avec d’autres médicaments. Dans ce contexte, il suffira simplement de commencer avec une dose inférieure et, éventuellement, d’augmenter progressivement.
À quoi faut-il penser en cas d’antécédents familiaux précoces de maladies cardiovasculaires et/ou d’un taux très élevé de LDL-C ?
Dans un tel contexte, il faut penser à une hypercholestérolémie familiale mais aussi à la présence dans la famille de taux de Lipoprotéine(a) extrêmement élevés. L’hypercholestérolémie familiale (HF) est un désordre autosomal dominant responsable d’un déficit de métabolisation des particules LDL qui est caractérisée par l’élévation importante des taux de LDL-C et un risque nettement accru et prématuré de MCVA. La prévalence de l’HF est de 1/300 (environ 40.000 Belges). L’hypercholestérolémie familiale (HF) reste sous-diagnostiquée et sous-traitée dans le monde entier. Le diagnostic clinique peut être confirmé en calculant le score du Dutch Lipid Clinic Network (DLCN) qui prend en compte l’existence d’antécédents personnels ou familiaux de MCVA prématurées, la présence d’un arc cornéen avant 45 ans ou de xanthomes et le taux de LDL-C (1). Une fois identifié, un dépistage approfondi « en cascade » dans la famille est la meilleure approche pour identifier et traiter le plus tôt possible (autour de l’âge de 10 ans). Les études épidémiologiques et de randomisation mendélienne soutiennent que Lp(a) est causale dans la survenue de maladie cardiaque ischémique (6). Sa concentration (une seule mesure suffit car le taux ne varie pas en cours de vie) est un facteur permettant de nuancer le risque chez les individus à « risque faible » et « modéré ». Mais il faut retenir aussi que les personnes qui ont un taux extrêmement élevé de Lp(a) (au-dessus de 180 mg/dL ou de 430 nmol/L) peuvent avoir un risque CV équivalent à celui observé chez les patients atteints d’HF. Le taux de Lp(a) est déterminé par la génétique à hauteur de 90 %.
Que faire lorsque le patient se plaint de myalgies ?
C’est un des effets secondaires le plus souvent mentionné (8). Ces myalgies ne doivent pas être négligées mais elles ne doivent pas non plus être surestimées comme cela est parfois le cas dans les médias ou comme le croient les patients. Dans les études randomisées en double aveugle, les statines ne provoquent que peu souvent plus de douleurs musculaires en comparaison avec le placebo. Par contre, dans les études d’observation où les patients savent la nature du produit qu’ils prennent, 10 % à 15 % des patients se plaignent de faiblesses, de gènes ou de crampes musculaires. La figure 4 montre l’algorithme des lignes directrices ESC/EAS 2019 concernant la gestion des douleurs musculaires sous traitement aux statines. Le traitement sera interrompu à court ou à long terme, en fonction de la gravité des plaintes, de la localisation de la douleur, du temps écoulé depuis le début du traitement et du niveau de CK. En fonction de l’évolution ultérieure des plaintes et du taux de CK, un « re-challenge » peut être envisagé avec une faible dose à augmenter progressivement en fonction de la tolérance. En cas d’intolérance complète et de risque CV global important, d’autres médicaments hypolipidémiants doivent être envisagés en monothérapie ou en association. Si l’objectif de LDL-C n’est pas atteint, le risque total de MCVA peut encore être réduit en accordant une attention maximale aux autres facteurs de risque CV (Figure 4).

Que faire lorsque le patient a des taux élevés de triglycérides et/ou un taux bas de cholestérol HDL
Un cholestérol HDL (HDL-C) bas et une augmentation des triglycérides (TG) sont associés à un risque accru de MCVA. Cependant, à ce jour, il n’y a pas suffisamment de preuves qu’une augmentation médicamenteuse du HDL-C ou une réduction par médicaments des TG conduise à moins de MCVA. Les concentrations de HDL-C et TG peuvent donc être utilisées pour estimer le risque total de MCVA mais ne constituent pas un objectif premier de traitement.
Chez les patients avec des TG considérablement augmentés (> 400 mg/dL), le niveau de LDL-C ne peut pas être calculé par la formule de Friedewald. Pour les dyslipidémies à TG élevés et/ou à HDL-C bas, comme on en voit chez les personnes atteintes d’un syndrome métabolique, d’un pré-diabète ou d’un diabète de type II, il est recommandé d’utiliser le Non-HDL-C ou l’ApoB comme cible thérapeutique. Le Non-HDL-C est facile à calculer par soustraction du HDL-C au taux de cholestérol total. Le Non-HDL-C comprend le taux de cholestérol présent dans toutes les lipoprotéines athérogènes : LDL, Lp(a) et les lipoprotéines riches en TG (9). Ça veut dire que lorsque le taux cible de LDL-C serait atteint sans avoir une réduction suffisante de Non-HDL-C, la valeur des lipoprotéines riches en TG reste augmentée. Malgré un taux de LDL-C idéal, le risque total de MCVA ne sera pas suffisamment diminué. La mesure de l'ApoB est plutôt une estimation directe du taux de LDL dans le sang. Cette méthode est plus précise en cas d'hypertriglycéridémie par rapport au calcul de Friedewald (9). La figure 1 montre les valeurs cibles pour le Non-HDL-C et pour l’ApoB dans les différentes catégories de risque CV total.
Bien que les statines restent le premier choix thérapeutique pour la prévention cardiovasculaire chez les patients souffrant d’hypertriglycéridémie et/ou de HDL-C bas, il est primordial de corriger le mode de vie et l’alimentation (éviter les excès en sucres, féculents, graisses saturées et alcool).
Conclusions
Les recommandations insistent sur la correction la plus appropriée des taux de LDL-C et Non-HDL-C selon la catégorie de risque du patient. Elles complètent bien sûr ses conseils en répétant l’importance de la correction de tous les facteurs de risque (approche multifactorielle) surtout, comme pour le taux de LDL-C, une correction qui soit la plus optimale possible chez les patients à risque cardiovasculaire « élevé » ou « très élevé ». Cela passe par un meilleur contrôle de la glycémie et/ou de la tension artérielle chez le patient diabétique et/ou hypertendu, un arrêt du tabagisme chez le fumeur et une alimentation plus équilibrée pour tous. L’avantage d’un facteur causal tel que le LDL-C ou Non-HDL-C est que l’abaissement à des taux très faibles s’accompagne toujours d’un bénéfice et n’entraîne aucun effet indésirable contrairement à d’autres facteurs tels que la tension artérielle, ce qui permet donc de pousser sa réduction au maximum de nos possibilités thérapeutiques pour obtenir le plus grand bénéfice chez nos patients à risque élevé ou très élevé.
Affiliations
1. Department of Internal Medicine, Centres Hospitaliers Jolimont, B-7100 Haine-Saint-Paul and Department of Cardiology, UCLouvain, Cliniques universitaires Saint-Luc, B-1200 Bruxelles, President of the Belgian Atherosclerosis Society
2. Department of Cardiology, AZ Maria Middelares, B-9000 Gent and Ghent University; Chairman of the Belgian Working Group on Cardiovascular Prevention and Rehabilitation
3. Clinical and Experimental Endocrinology, Department of Chronic Diseases, Metabolism and Aging (CHROMETA), KU Leuven, B-3000 Leuven
4. Department of Diabetes, Nutrition and Metabolic diseases, Centre Hospitalier Universitaire Sart Tilman, B-4000 Liège
5. Department of Laboratory Medicine, Algemeen Ziekenhuis Sint-Jan, B-8000 Brugge, and national representative of the Royal Belgian Society of Laboratory Medicine
6. Department of endocrinology, diabetology and metabolism, Antwerp University Hospital, B-2000 Antwerpen
7. Department of Cardiology, University Hospital Gent and Gent University, B-9000 Gent
8. Department of public health and primary care, Ghent University, B-9000 Ghent
Correspondance
Dr. Olivier S. Descamps
Department of Internal Medicine
Centres Hospitaliers Jolimont
Rue Ferrer 159
B-7100 Haine-Saint-Paul
olivier.descamps@jolimont.be
Références
- Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020; 41:111-188.
- Ference BA, Ginsberg HN, Graham I, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017. 21; 38: 2459-2472.
- Cholesterol Treatment Trialists, Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010; 376:1670-1681.
- De Bacquer D, De Backer G. Predictive ability of the SCORE Belgium risk chart for cardiovascular mortality. Int J Cardiol. 2010; 143: 385-90.
- Descamps OS, Cooney MT, De Backer G, Graham I. A simple multiplier to calculate the impact of HDL cholesterol on cardiovascular risk estimation using SCORE. Atherosclerosis. 2012; 222: 564-566.
- Nordestgaard BG, Langsted A. Lipoprotein(a) as a cause of cardiovascular disease: insights from epidemiology, genetics, and biology. J Lipid Res. 2016; 57: 1953-75.
- Descamps OS, Verhaegen A, Demeure F,et al. Evolving concepts on the management of dyslipidaemia. Acta Clin Belg. 2020;75(1):80-90.
- Stroes ES, Thompson PD, Corsini A et al. Statin-associated muscle symptoms impact on statin therapy European Atherosclerosis Society Consensus panel statement on assessment, aetiology and management. Eur Heart J. 2015; 36: 1012-1022.
- Langlois MR, Nordestgaard BG, Langsted A et al. Quantifying atherogenic lipoproteins for lipid-lowering strategies: consensus-based recommendations from EAS and EFLM. Clin Chem Lab Med. 2020; 58: 496-517.
