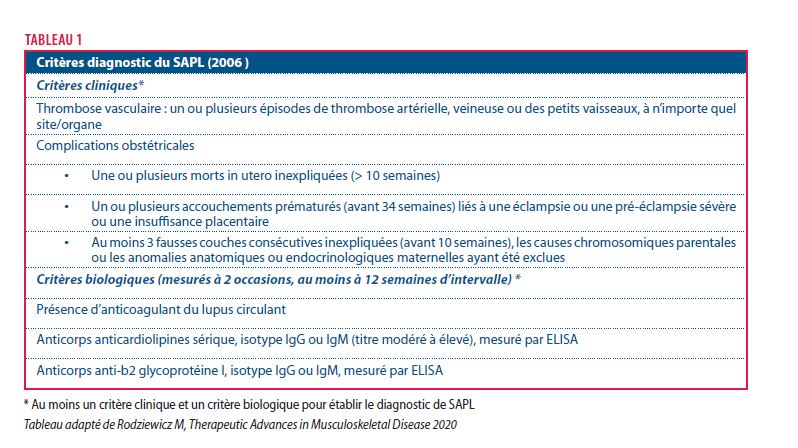
Le syndrome antiphospholipide (SAPL) est une pathologique thrombophilique sévère auto-immune acquise qui se définit par la survenue d’événements thrombotiques veineux, artériels, micro-vasculaires et/ou de complications obstétricales en présence d’anticorps antiphospholipides (APL) (anticoagulant du lupus, anticardiolipines et anti-ß2 glycoprotéine I). Les critères cliniques et biologiques du SAPL sont repris dans la tableau 1. Il est important de souligner que le diagnostic repose sur la présence d’anticorps antiphospholipides détectés à deux reprises et au moins à 12 semaines d’intervalle.
Sans faire partie de la liste des critères diagnostiques, d’autres manifestations peuvent être présentes dans le SAPL comme un livedo, une thrombopénie, une anémie hémolytique, une valvulopathie mitrale (Libman-Sacks), des troubles cognitifs, une néphropathie et des ulcères cutanés. La complication ultime du SAPL est le syndrome antiphospholipides catastrophique qui se manifeste par des thrombi multiples au niveau des petits vaisseaux. Cette entité est grevée d’une mortalité élevée (environ 37 %) et requiert des traitements spécifiques. La prévalence du SAPL est de 50/100.000 avec une incidence de 2.1/100.000 et une prédominance féminine (ratio femme/homme 5:1). La prévalence du SAPL augmente en cas de maladie auto-immunitaire : 30 à 40 % des patients ayant un lupus érythémateux disséminé (SLE) ont des anticorps antiphospholipides et 10 à 20% d’entre eux souffrent d’un SAPL (1).
La physiopathologie des événements thrombotiques dans le SAPL repose sur un mécanisme de double hit associant une prédisposition génétique dépendante ou non du système HLA et un stimulus (infection, inflammation, chirurgie, médicament…). Elle implique différents acteurs de l’hémostase ce qui explique probablement pourquoi les traitements antithrombotiques classiques peuvent ne pas suffire. Le déclenchement du SAPL débute par la fixation de la ß2glycoprotéine I aux phospholipides de l’endothélium, aux plaquettes et aux monocytes, chargés négativement. Ceci entraîne un changement de conformation de la ß2glycoprotéine I et expose les épitopes cryptiques Arg39-Arg43 auquel les anticorps antiphospholipides vont se fixer. En découle une activation des neutrophiles et la formation de NETs (neutrophiles extra-cellular traps), l’activation du facteur tissulaire, une résistance à la protéine C activée et une hypofibrinolyse aboutissant à la formation de caillots et l’activation des plaquettes (2).
La présentation des événements thrombotiques dans le SAPL est particulière. Elle combine des événements thrombotiques artériels et veineux, chez des patients souvent jeunes, sans facteur prédisposant évident, de localisations parfois inhabituelles ou multiples et récurrents malgré le traitement anticoagulant. Le taux de récidive thrombotique est élevé (10 à 65 %) et influencé par les caractéristiques cliniques (thrombose artérielle) et biologiques (simple, double ou triple positif) (3).
Le diagnostic biologique peut s’avérer compliqué notamment pour détecter l’anticoagulant du lupus avec un risque de faux positif lié à des interférences avec le traitement anticoagulant et son caractère parfois transitoire en phase aiguë d’un événement thrombotique. Il est indispensable d’effectuer 2 prélèvements à 12 semaines d’intervalle et de prélever en même temps les 3 anticorps antiphospholipides. À l’inverse, la présence d’un anticoagulant lupus interfère avec les tests phospholipides dépendant ce qui peut compliquer le monitoring des INR chez les patients sous anti-vitaminiques K (AVK) (3).
L’anticoagulation constitue la pierre angulaire thérapeutique du SAPL avec comme traitement standard les AVK au long cours. Ces derniers réduisent la récidive de thrombose veineuse de 80 à 90 % (4). Les AVK au long cours présentent toutefois de nombreux challenges : le monitoring régulier des INR, une fenêtre thérapeutique étroite, l’interférence de l’anticoagulant lupus sur les INR phospholipides-dépendants, un risque hémorragique accru, des interactions médicamenteuses et alimentaires multiples, une possible résistance aux AVK, des difficultés d’adhérence pouvant causer des récidives thrombotiques. Le débat persiste quant à la valeur cible optimale de l’INR et l’ajout éventuel de l’aspirine aux AVK.
Au cours de la dernière décennie, les anticoagulants oraux directs (DOAC) se sont imposés comme le traitement de choix dans la maladie thrombo-embolique veineuse. Leurs avantages sont multiples : administration orale, délai d’action et demi-vie courts, réversibilité rapide, effet thérapeutique prévisible, peu ou pas d’interaction médicamenteuse ou alimentaire, utilisation facile, disponibilité d’agent neutralisant, éducation des patients simple. Leur inconvénient principal est l’élimination rénale.
Le traitement anticoagulant dans le SAPL est complexe avec des recommandations parfois contradictoires proposées par les différentes sociétés scientifiques, liées aux limitations voire aux faiblesses des études évaluant le traitement anticoagulant dans cette indication. De plus, il s’agit d’une maladie rare qui implique une population hétérogène avec un risque thrombotique variable touchant dans 30 à 40 % des cas tant le système artériel que veineux. De nombreuses questions subsistent quant au traitement anticoagulant optimal dans le SAPL. Même si les AVK au long cours constituent le traitement standard, l’INR cible reste débattu. La durée optimale de l’anticoagulation en cas d’événement thrombo-embolique veineux circonstancié associé à des anticorps antiphospholipides est discutée. Quelle est la place des DOACs, lequel privilégier et à quelle dose ? Quelle est la place des antiagrégants plaquettaires ? Quelle approche proposer en cas de thrombose réfractaire ou récidivante ? Quid de la prévention primaire en cas d’anticorps antiphopholipides ?
Intensité d’anticoagulation avec les AVK
Il n’y a actuellement pas de consensus sur la valeur cible de l’INR (2-3 ou >3) dans le SAPL. Deux études rétrospectives et deux RCT n’ont pas montré de différence en termes de récidive thrombotique entre un traitement par AVK à dose standard (INR 2-3) versus à haute intensité (INR >3) (5). La Société Européenne de Rhumatologie (EULAR) recommande un INR entre 2 et 3 (6). Toutefois, malgré une anticoagulation efficace avec un INR cible entre 2 et 3,10 % des patients avec SAPL et 30 % des triple positifs ont fait une récidive thrombotique dans une étude de suivi de 5 ans (7). Enfin, rappelons qu’augmenter l’INR cible expose à un risque de saignement accru.
Traitement des thromboses artérielles dans SAPL
EULAR recommande le recours aux AVK avec INR cible de 2-3, associé ou non à de l’aspirine ou un INR cible >3 (6). Les recommandations varient selon les guidelines qui s’accordent toutefois sur l’importance d’une thérapie individualisée qui tient compte du phénotype thrombotique et met en balance le risque cardiovasculaire et le risque d’hémorragie notamment intracrânienne. En l’absence de risque cardiovasculaire ajouté, la British Society of Haematology (BSH) recommande le recours à un AVK en visant un INR entre 2 et 3 (3). Un contrôle des facteurs de risque cardiovasculaire est bien sûr indispensable. Certains auteurs recommandent le recours aux antiagrégants plaquettaires en cas de contre-indication à l’anticoagulation (risque hémorragique accru) (4). Il est important de souligner le manque d’études prospectives validant le traitement des thromboses artérielles dans le SAPL. Enfin, il convient de rappeler que les DOACs sont pas enregistrés dans le traitement des thromboses artérielles (sauf le Rivaroxaban à faible dose en prévention secondaire des événements cardiovasculaires).
Traitement des événements thrombo-emboliques veineux dans SAPL
Les DOACs se sont imposés comme le traitement de choix dans la maladie thrombo-embolique veineuse dans la population générale. Leur utilisation a été validée par des larges essais randomisés multicentriques (RCT) avec comme bras comparateur la Warfarine (INR cible entre 2 et 3). A noter que les patients avec des anticorps antiphospholipides n’avaient pas été spécifiquement inclus ou exclus de ces études. Par ailleurs, le diagnostic de SAPL est établi dans une proportion de patients traités par DOAC après un premier événement thrombo-embolique. Lors du diagnostic du SAPL se posera la question du maintien du DOAC ou du relais par un AVK.
La place des DOACs dans la prise en charge du SAPL reste à ce jour débattue et limitée compte tenu des résultats défavorables et des nombreuses faiblesses scientifiques des études dont nous disposons. Les principales données sont décrites ci-dessous.
1. Analyses post-hoc des RCT ayant validé les DOACs dans la population générale
Pour le dabigatran : des analyses poolées des SAPL ont été faites à partir des données de RE-COVER/RE-COVER II et RE-MEDEDY (n=70 soit 2,2% de SAPL). L’efficacité et la sécurité étaient similaires entre le groupe Dabigatran et Warfarine chez les patients avec au moins un anticorps antiphospholipide et une maladie thrombo-embolique veineuse (MTEV) (8). Pour l’apixaban, aucune sous- analyse effectuée pour les SAPL dans AMPLIFY. Pour l’edoxaban, seulement 1 cas de SAPL a été rapporté dans ENGAGE-AF (9). Enfin, pour le rivaroxaban, aucune distinction spécifique des SAPL n’a été faite au sein de la population thrombophile (5%) dans EINSTEIN-DVT (9).
2. Études de cas rapportés
Environ 200 cas de remplacement des AVK par des DOACs ont été rapportés dans des SAPL. Malgré les limitations scientifiques de ces publications, il ressort que les récidives sous DOAC surviennent essentiellement en cas de SAPL triple positifs et chez des patients ayant souffert de thromboses artérielles ou micro-vasculaires (9).
3. Études randomisées contrôlées (n=4) évaluant les DOACs dans le SAPL
- L’étude RAPS a comparé le Rivaroxaban 20mg/j versus la Warfarine avec un INR cible 2,5 (2-3) chez 116 patients avec MTEV, sans thrombose artérielle et dont 28% étaient triple positifs. Cette étude avait comme critère d’évaluation primaire la modification sur les tests de génération de thrombine. Elle n’offre toutefois pas la puissance statistique pour les mesurer les résultats cliniques et le suivi était limité à 7 mois. Aucune de récidive thrombotique ou hémorragie n’était à signaler au sein des 2 groupes mais on notait une meilleure qualité de vie dans le groupe Rivaroxaban (10).
- TRAPS est une étude de non-infériorité comparant le Rivaroxaban 20mg/j (ou 15 mg/j en cas d’insuffisance rénale) versus la Warfarine avec un INR cible 2,5 (2-3). Cette étude a été interrompue prématurément, suite à la survenue de 7 (12%) thromboses artérielles dans le bras Rivaroxaban (4 accidents vasculaires cérébraux (AVC), 3 infarctus du myocarde) versus 0 dans le bras Warfarine. Il n’y a pas eu de différence significative en terme d’événement hémorragique et de thromboses veineuses. A noter que l’étude a inclus 120 patients triple positifs avec antécédents thrombotiques et que le bras Rivaroxaban comprenait 19% de participants avec des antécédents thrombotiques artériels (dont 57% récurrents) (11).
- Ordi-Ross a publié en 2019 les résultats d’une étude de non-infériorité comparant le Rivaroxaban20mg/j (ou 15 mg/j en cas d’insuffisance rénale) versus la Warfarine avec un INR cible 2.5 ou >3.0 (en cas de thromboses récurrentes). Cette étude a suivi pendant 3 ans 190 patients avec SAPL dont 60% de triple positifs. Une récidive thrombotique a été rapportée dans 11.6% dans le bras Rivaroxaban (avec 9 AVC) et 6.3% pour les la Warfarine (0 AVC). Les auteurs retiennent comme facteurs de risque de récidives les antécédents de thrombose artérielle, une atteinte des petits vaisseaux, une valvulopathie et un livedo racemosa (12).
- Astro-APS est une étude de phase 2, de non-infériorité évaluant l’efficacité de l’Apixaban versus la Warfarine en prévention secondaire des événements thrombotiques en cas de SAPL. Le protocole a été modifié 2 fois, suite aux résultats de TRAPS (dose d’Apixaban majorée à 5 mg 2x/j et exclusion des patients ayant des antécédents thrombotiques artériels) et 48 patients ont été enrôlés. Les résultats publiés en mars 2022 rapportent la survenue d’un AVC chez 6/23 des patients dans le bras Apixaban versus 0 dans le bras Warfarine (13).
4. Les méta-analyses
- La méta-analyse publiée en 2018 par Dufrost et al., a montré une récurrence annuelle thrombose de 11,7% chez 447 patients avec SAPL sous DOACs ciblant le Facteur Xa (n=303) et le Facteur IIa (n=144). Le risque de thrombose sous DOACs était multiplié par 4 dans le groupe des triple positifs et des thromboses artérielles. Les facteurs de récidive sous anti-Xa étaient les suivants : triple positif, nombre élevé de critères SAPL, thrombose sous AVK, sexe masculin, antécédent de thrombose artérielle ou des petits vaisseaux, traitement prolongé par HBPM. Les facteurs de récidive thrombotiques sous anti-IIa étaient le nombre élevé de critères SAPL et les antécédents de thrombose sous AVK. Il s’agissait de récidives thrombotiques artérielles dans 42% des cas (58% avec antécédent de MTEV et 50% triple positifs) (14).
- La méta-analyse de Sanchez-Redondo confirme une récurrence annuelle thrombose 11% chez 728 SAPL sous DOACs dont 48% triple positif (15).
- Enfin l’étude rétrospective publiée par Sato et al. s’est intéressée aux patients SAPL chez qui un AVK a été remplacé par un DOAC anti-Xa (Edoxaban=12 – Rivaroxaban=5 et Apixaban=1). Elle a montré une période sans événements plus courte sous DOAC (16).
Malgré leurs limitations, les études TRAPS et Ordi-Ros ont conduit l’Agence Européenne du médicament à modifier la notice des DOCAs : « Ils ne sont pas recommandées en prévention secondaire des thromboses artérielles ou veineuses chez les patients avec SAPL, surtout les triple positifs ». Les études incluant les triple positifs et les thromboses artérielles ont en effet montré un risque accru de thromboses sous DOACs avec un risque multiplié par 4 dans ce groupe dans une méta-analyse (14). Par contre, les résultats de RAPS suggèrent que les DOACs pourraient être une bonne alternative aux AVK pour les patients avec un antécédent de MTEV nécessitant une anticoagulation d’intensité standard. De plus, aucune des études incluant des non-triple positifs n’a rapporté d’excès de récidive thrombotique veineuse avec les DOACs (9,17).
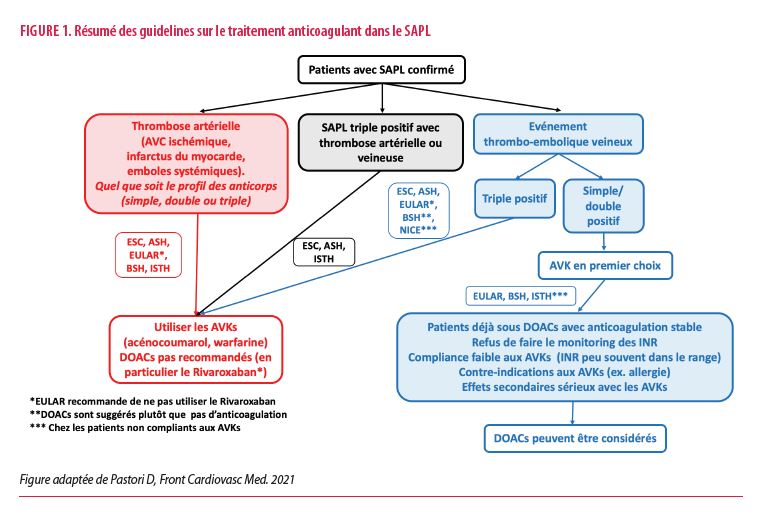
Sur base de l’ensemble des résultats ci-dessus, les sociétés scientifiques ont émis des recommandations parfois discordantes. Elles sont résumées dans la Figure 1 et détaillées ci-dessous (9) :
- ISTH (International Society of Thrombosis and Haemostasis) 2020 : les DOACs ne sont pas une option pour le SAPL mais la poursuite d’un DOAC est possible chez un patient stable, à faible risque de récidive et après accord éclairé.
- EULAR 2019 : les AVK sont le premier choix de traitement (INR 2-3 pour une première MTEV ou >3 pour les récidives de MTEV ou les thromboses artérielles). Les DOACs peuvent être une option en cas de thrombose veineuse simple ou double positif dans certaines circonstances :
- le patient est stable sous DOAC ;
- l’équilibre de l’INR est difficile (temps dans le range <60%) ;
- il existe une contre-indication (allergie) ou un effet secondaire sévère sous AVK ;
- le patient refuse le contrôle des INR.
Par contre EULAR émet une contre-indication aux DOACs (pas de Rivaroxaban) pour les thromboses artérielles et les triples positifs. Le remplacement des AVK vers un DOAC uniquement pour éviter monitoring n’est pas non plus accepté.
- ESC (European Society of Cardiology) et ASH (American Society of Hematology): déconseillent les DOACs dans le SAPL. BSH : les DOACs ne sont, de façon générale, pas une option pour les SAPL. Ceci est formel pour les thromboses artérielles. Pour la MTEV, la BSH recommande le switch d’un DOAC vers un AVK si le patient était traité par DOAC au moment du diagnostic du SAPL. Cependant, la poursuite d’un DOAC est acceptable si le patient refuse de passer à un AVK (surtout pour les non-triple positif).
- Les recommandation émises lors du congrès International du SAPL en 2020 étaient les suivantes: les DOACs sont évités en cas de thrombose artérielle, de valvulopathie ou de maladie petits vaisseaux et de thrombose récurrente sous AVK. Après 1er épisode de thrombose veineuse chez un patient avec SAPL simple ou double positif, il est recommandé de discuter avec le patient de l’informer des risques et des bénéfices de la poursuite du DOAC. En cas de 1er épisode chez un patient triple positif, les experts soutiennent le remplacement du DOAC par un AVK. En cas de refus du patient, un suivi rapproché et une IRM cérébrale (pour exclure un AVC passé inaperçu) sont de mise. En cas de récidive d’événements thrombotiques veineux sous AVK, plusieurs options sont possibles : augmenter le range de l’INR, relais du traitement anticoagulant par une héparine de bas poids moléculaire (HBPM) ou le fondaparinux, ajout d’un antiagrégant plaquettaire. Pour les thromboses artérielles, il est recommandé d’avoir recours à un AVK d’intensité standard ou élevée, en association éventuelle avec l’aspirine et de contrôler les facteurs de risque cardio-vasculaires (1).
Prévention antithrombotique primaire chez les patients avec SAPL
Il n’y a pas de preuve d’un bénéfice d’une anticoagulation en prévention primaire du SAPL3. En ce qui concerne l’utilisation de l’aspirine en prévention primaire, les RCT se limitent à l’étude APLASA qui n’a pas démontré de bénéfice. L’échantillon était toutefois de petite taille. Une méta-analyse a par contre montré une réduction du risque de thrombose sous aspirine avec un impact variable selon les sous-groupes (18).
Le bénéfice de l’aspirine doit cependant être balancé par rapport au risque hémorragique notamment digestif. EULAR propose une stratification du risque thrombotique et discussion au cas par cas pour instaurer de l’aspirine en tenant compte des éléments suivants : le profil des APL (double ou triple positivité, titre élevé APL), la présence d’un lupus erythémateux disséminé, les facteurs de risque cardio-vasculaires classiques et des antécédents obstétricaux (en prévention des événements thrombotiques en dehors de la grossesse) (6).
Prévention des complications obstétricales dans SAPL
Chez les patientes ayant des complications obstétricales associées au SAPL, une prophylaxie antithrombotique mixte (aspirine faible dose + HBPM) est recommandée pendant les grossesses suivantes. Il convient de rappeler les HBPM constituent le traitement anticoagulant de choix pendant la grossesse, que les DOAC sont contre-indiqués pendant la grossesse et l’allaitement et les AVK sont tératogènes entre les semaines 6 et 12 (19). En dehors de la grossesse, en cas de SAPL et antécédents obstétricaux uniquement, EULAR recommande l’aspirine en fonction du profil des anticorps antiphospholipides et éventuellement un traitement anticoagulant en présence de facteurs de risque surajoutés (6).
Messages et conclusions
Le SAPL est une pathologie rare et hétérogène qui rend complexe la validation du régime anticoagulant optimal. L’objectif du traitement est de prévenir la récidive des événements thrombotiques artériels et veineux. Le traitement standard des complications thrombotiques du SAPL repose actuellement sur les AVK. De nombreuses recommandations scientifiques reposent toutefois sur l’avis d’experts et la place des DOACs doit encore être validée par des études prospectives pour déterminer quel groupe pourrait bénéficier des atouts de cette classe d’anticoagulants. Il est également crucial d’identifier les patients à haut risque de récidive candidats à un traitement anticoagulant renforcé.
Dans l’état actuel des connaissances, la règle reste donc bien de privilégier les AVK dans le traitement du SAPL, certainement chez les patients triples positifs et/ou avec des manifestations thromboemboliques artérielles et/ou une endocardite de Liebman-Sacks. Par contre, on pourrait, au cas par cas, envisager un DOAC chez les patients simple ou double positifs n’ayant souffert que d’un seul épisode de thrombose veineuse, en particulier si la surveillance d’un traitement par AVK risque d’être sous-optimale.
Correspondance
Pr. Catherine LAMBERT, MD, PhD
Cliniques universitaires Saint-Luc
Hemostasis and Thrombosis Unit/Division of Adult Hematology
UCLouvain
ORCID:0000-0003-2222-0357
Catherine.lambert@saintluc.uclouvain.be
Références
- Cohen H, et al. 16th International Congress on Antiphospholipid Antibodies Task Force Report on Antiphospholipid Syndrome Treatment Trends. Lupus. 2020;29(12):1571-1593.
- Sayar Z, et al. Thrombotic antiphospholipid syndrome: A practical guide to diagnosis and management. Thromb Res. 2021;198:213-221.
- Arachchillage D, Laffan M. What is the appropriate anticoagulation strategy for thrombotic antiphospholipid syndrome? Br J Haematol. 2020;189(2):216-227.
- Ruiz-Irastorza G et al. A systematic review of secondary thromboprophylaxis in patients with antiphospholipid antibodies. Arthritis Rheum. 2007;57(8):1487-1495.
- Finazzi G, et al. A randomized clinical trial of high-intensity warfarin vs. conventional antithrombotic therapy for the prevention of recurrent thrombosis in patients with the antiphospholipid syndrome (WAPS). J Thromb Haemost. 2005;3(5):848-853.
- Tektonidou M, et al. EULAR recommendations for the management of antiphospholipid syndrome in adults. Ann Rheum Dis. 2019;78(10):1296-1304.
- Pengo V, et al. Clinical course of high-risk patients diagnosed with antiphospholipid syndrome. J Thromb Haemost. 2010;8(2):237-242.
- Goldhaber S, et al. Efficacy of dabigatran versus warfarin in patients with acute venous thromboembolism in the presence of thrombophilia: Findings from RE-COVER®, RE-COVERTM II, and RE-MEDYTM. Vasc Med (United Kingdom). 2016;21(6):506-514.
- Pastori D, et al. Use of Direct Oral Anticoagulants in Patients With Antiphospholipid Syndrome: A Systematic Review and Comparison of the International Guidelines. Front Cardiovasc Med. 2021;8-715878
- Cohen H et al. Rivaroxaban versus warfarin to treat patients with thrombotic antiphospholipid syndrome, with or without systemic lupus erythematosus (RAPS): a randomised, controlled, open-label, phase 2/3, non-inferiority trial. Lancet Haematol. 2016;3(9):e426-e436.
- Pengo V, et al. Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome. Blood. 2018;132(13):1365-1371.
- Ordi-Ros J et al. Rivaroxaban Versus Vitamin K Antagonist in Antiphospholipid Syndrome. Ann Intern Med. 2019;171(10):685-694
- Woller S , et al. Apixaban compared with warfarin to prevent thrombosis in thrombotic antiphospholipid syndrome: a randomized trial. Blood Adv. 2022;6(6):1661-1670.
- Dufrost V. Increased risk of thrombosis in antiphospholipid syndrome patients treated with direct oral anticoagulants. Results from an international patient-level data meta-analysis. Autoimmun Rev. 2018;17(10):1011-1021.
- Sanchez-Redondo J, et al. Recurrent Thrombosis With Direct Oral Anticoagulants in Antiphospholipid Syndrome: A Systematic Literature Review and Meta-analysis. Clin Ther. 2019;41(9):1839-1862.
- Sato T et al. Factor Xa inhibitors for preventing recurrent thrombosis in patients with antiphospholipid syndrome: a longitudinal cohort study. Lupus. 2019;28(13):28(13):1577-1582.
- Dufrost V, et al. Direct oral anticoagulants in antiphospholipid syndrome: Meta-analysis of randomized controlled trials. Autoimmun Rev. 2021;20(1):1-26.
- Arnaud L, et al. Patient-level analysis of five international cohorts further confirms the efficacy of aspirin for the primary prevention of thrombosis in patients with antiphospholipid antibodies. Autoimmun Rev. 2015;14(3):192-200.
- Zuily S, et al. Use of direct oral anticoagulants in patients with thrombotic antiphospholipid syndrome: Guidance from the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. J Thromb Haemost. 2020;18(9):2126-2137