1. INTRODUCTION
En matière de stratégie thérapeutique, les nouvelles recommandations édictées fin août 2016 (à l'occasion du Congrès ESC. Guidelines on the management of Dyslipidaemias) par les sociétés européennes d’athérosclérose (EAS) et de cardiologie (ESC) ont renforcé celles de la précédente version de 2011 (1), tout en poursuivant les principes basés sur la théorie du LDL. Selon cette théorie, toute réduction du cholestérol LDL s’accompagne d’une réduction du risque cardiovasculaire, proportionnellement à l’importance de la réduction du LDL-cholestérol (LDL-C). On visera donc à prescrire avant tout un traitement qui réduit le taux de LDL-cholestérol de manière à atteindre la cible de LDL-C soit une statine combinée ou non à l’ézétimibe. Dans un deuxième temps, on visera à atteindre aussi la cible pour le non HDL cholestérol (non HDL-C). Le problème très en vogue de l’intolérance aux statines sera abordé séparément (2).
Mais avant tout, il est utile de rappeler qu’une approche multifactorielle reste le point le plus important dans la prévention cardiovasculaire. Selon celle-ci, les recommandations diététiques restent indispensables même si leurs effets sur le profil lipidique sont souvent mineurs (peu d’effet sur le LDL-cholestérol, mais souvent plus d’effet sur les triglycérides) comparé aux médicaments. Nous les rappellerons donc d’abord.
Dans tous les cas, il est important d’impliquer le patient dans la prise de décision des moyens pour prendre en charge son risque cardiovasculaire.
2. QUELS MOYENS THÉRAPEUTIQUES ?
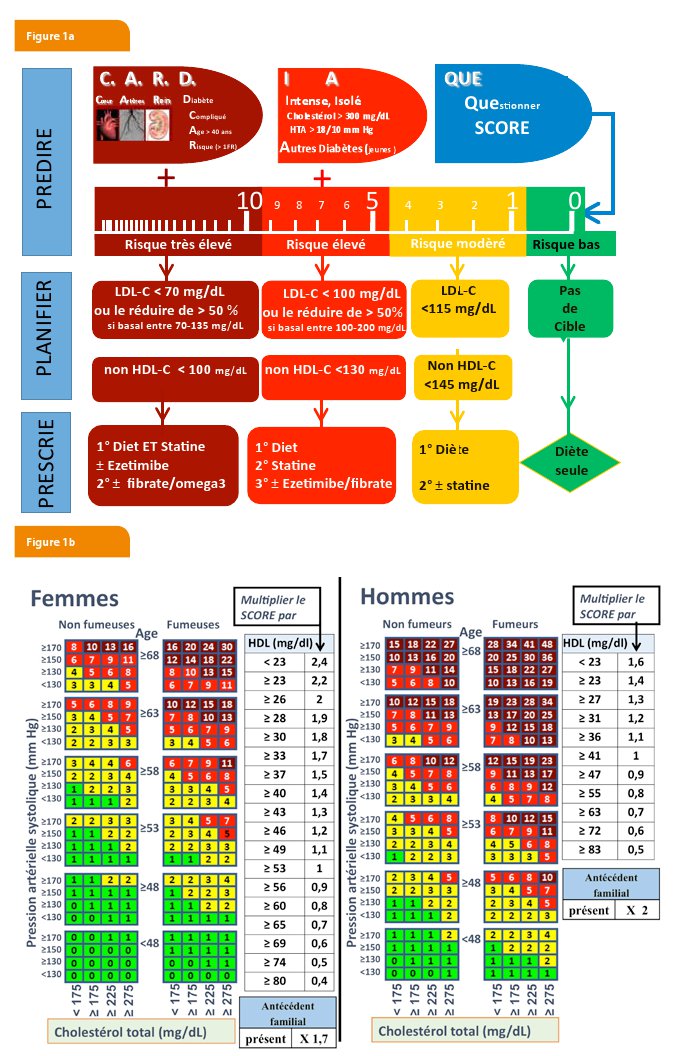
Les recommandations diététiques restent indispensables pour une bonne approche préventive des maladies cardiovasculaires. En cas de non correction du LDL-C (et du Non HDL-C) malgré une alimentation rééquilibrée, elles seront suivies par l’addition d’un médicament chez les patients à risque élevé. Chez les patients à risque très élevé (antécédents cardiovasculaires, diabétique, insuffisant rénaux par exemple), l’addition d’un médicament n’attendra toutefois pas la compliance à une alimentation équilibrée. Ainsi, un traitement médicamenteux devra être instauré dès la survenue d’un évènement cardiovasculaire ou dans les premiers mois après la découverte d’un diabète ou d’une insuffisance rénale. Pour les autres catégories de risque en prévention primaire, on peut mettre le temps à profit pour renforcer les efforts diététiques et évaluer leurs répercussions sur le profil lipidique (Figure 1).
2.1. Des mesures hygièno-diététiques toujours
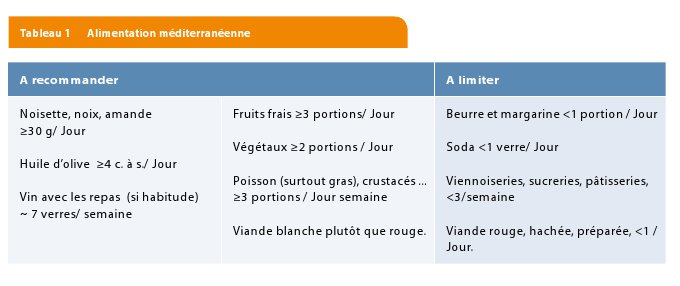
Il ne faut surtout pas négliger l’importance de l’arrêt du tabagisme, d’activité physique (2,5 à 5 heures par semaine ou 30 à 60 minutes par jour, à un niveau modérément vigoureux) et d’un bon équilibre alimentaire : réduire les acides gras saturés, en mettant l’accent sur les produits céréaliers, légumes, fruits et poissons. Même si les effets de ces changements d’habitude semblent négligeables sur le profil lipidique, de nombreuses autres effets qui allait bien au-delà des variations lipidiques mesurables ont été démontrés: effets sur la distribution des lipoprotéines (petites et denses, …), sur l’oxydation, sur la coagulation, l’inflammation et sur la fonction endothéliale (3). De plus, on comprend de plus en plus que de petites modifications de LDL cholestérol (par exemple 15 mg/dL) telles celles engendrées par des petites variations génétiques ou des changements alimentaires prolongés tout au long d’une vie ont des effets bénéfices bien plus grand que ceux engendrés par les médicaments donnés tardivement dans la vie (Figure 2).
2.1.1 Macronutriments
En 2014, une méta-analyse des études randomisées et contrôlées pour les macronutriments semait le doute sur la preuve d’un effet bénéfique significatif cardiovasculaire de la réduction des apports en graisses saturés ou de leur substitution par des graisses mono ou polyinsaturées. Globalement, seule la réduction des graisses dites « trans » démontrait un bénéfice (4). Démontrer un effet dans des études d’intervention diététique n’est pas simple en raison de la nécessité d’importantes tailles de cohorte et durées de suivi, de la difficulté à maintenir l’adhésion des participants au programme alimentaire, des inégalités d'efforts entre groupes soumis à des régimes différents et du fait qu’un changement d’un nutriment introduit aussi le changement d’autres.
Actuellement, les recommandations officielles se basent donc toujours sur la nature des variations lipidiques apportées par les macronutriments et sur les résultats positifs démontrées dans les études d’observations : supprimer les grasses « trans » (industrielles) et substituer les graisses saturées par des graisses polyinsaturées pour réduire la quantité à moins de 10% d’apport calorique par jour. On évitera la substitution par des glucides qui souvent augmente les taux de triglycérides ou par trop des acides gras mono-insaturés qui réduisent le taux de HDL-C. Il n’y a plus de recommandations en ce qui concerne la quantité de cholestérol alimentaire (jaune d’œuf, crustacés …)
Pour les individus avec une dyslipidémie plus sévère, on intensifie ces recommandations selon le(s) parametre(s) altèré(s). Chez les patients avec des taux sévèrement élevé de cholestérol sanguin, on recommande moins de 300 mg/jour de cholestérol ingéré.
2.1.2. Aliments simples
Les fibres solubles surtout d’orge et d’avoine (contenant des béta-glucans, recommandés à au moins 3 g/jour) ou les protéines de Soja (voir aussi plus bas les stanols et stérols considérés aux doses recommandées comme compléments alimentaires) réduisent modestement (<10%) le taux de LDL-C (1). Contrairement à une croyance bien ancrée, la consommation de poissons gras ne modifie pas les taux de LDL-C mais ont des effets bénéfiques sur la prévention cardiovasculaire comme l’a montré encore la méta-analyse de Delgado-Lista (5) chez les personnes ayant un risque cardiovasculaire élevé : réduction du risque d’accident cardiovasculaire (-10%), de mortalité cardiaque (-9%), des accidents coronariens mortels ou non mortels (-18%) et de mortalité totale (tendance de -5%).
2.1.3. Les styles alimentaires
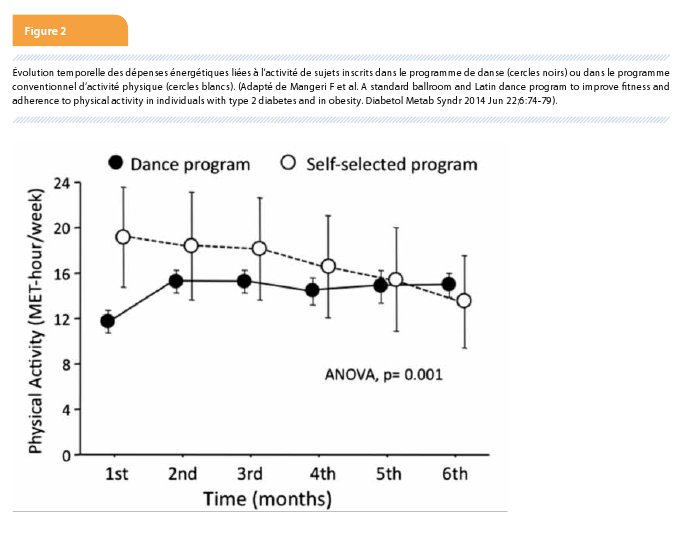
Bien que le régime méditerranéen (Tableau 1) modifie peu le profil lipidique (une petite augmentation des HDL et une légère diminution des triglycérides), ils sont intéressants. Par exemple, l’étude PREDIMED (6) enrôlant 7447 participants à haut risque cardiovasculaire, mais sans maladie cardiovasculaire (dont 2425 étaient diabétiques) a démontré que deux types de régimes méditerranéens (enrichis soit d’un litre d’huile d’olive par semaine, soit de 30 gr de noix ou amandes ou noisettes par jour) résultaient après 4,8 ans de suivi en une réduction de 30 % des évènements cardiovasculaires.
2.2. Les statines toujours en première ligne des traitements médicamenteux
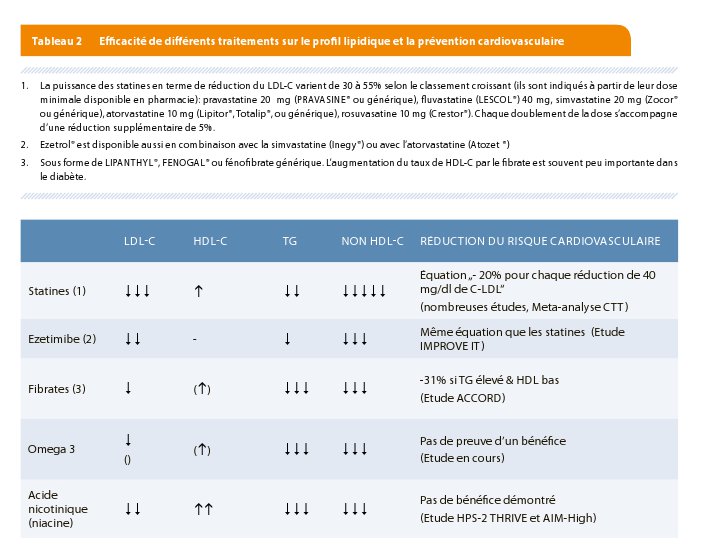
Quand il faut prescrire un médicament, les statines sont le traitement de première ligne quel que soit le profil lipidique. Les statines, en plus de réduire le cholestérol LDL de 30 à 55% réduisent légèrement le taux de triglycérides et augmentent légèrement le taux de HDL-C (Tableau 2) et ont prouvé leur bénéfice en prévention cardiovasculaire.
2.2.1. Effets sur le LDL-C
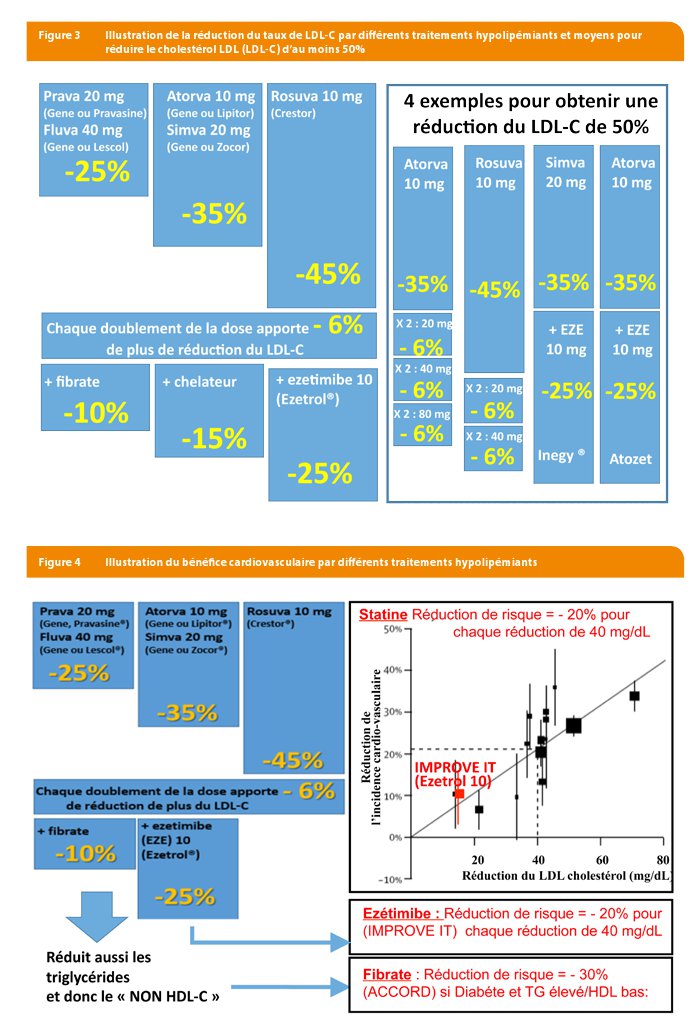
Chaque statine a une puissance différente en terme de réduction du LDL-C (7). En général, les niveaux de puissance de réduction du LDL-C par les différentes statines sont, aux doses minimales prescriptibles, 25% de réduction du LDL-C pour la pravastatine 20 mg (générique, PRAVASINE®, PRAREDUCT ®) ou la fluvastatine 40 mg (LESCOL® 40 mg), 35% pour la Simvastatine 20 mg (générique ou ZOCOR®) et l’atorvastatine 10 mg (LIPITOR®, TOTALIP®, générique) et 45% pour la rosuvastatine 10 mg (CRESTOR®, bientôt générique en 2017). Chaque doublement de la dose de statine permet d’obtenir une réduction additionnelle de 5-6% (Figure 3).
2.2.2. Bénéfice cardiovasculaire
La méta-analyse des études d’intervention avec les statines (« Cholesterol Treatment Trialists ou CTT méta-analyse », 170.000 participants de 26 études d’intervention) démontre que chaque abaissement de 40 mg/dl résulte en une réduction d’environ 20% de l’incidence des événements cardiovasculaires à 4-5 ans (Infarctus du myocarde, mortalité cardiaque, AVC ….). (Figures 2 et 4)
2.2.3. Effets secondaires et surveillance
Les douleurs, sensibilités, crampes et faiblesses musculaires restent un sujet de grande polémique en ce moment bien que très probablement surévalué, de même que l’effet des statines sur la tolérance glucidique. Ils seront détaillés dans une publication de cette revue (2)
Symptômes musculaires
Les effets secondaires les plus gênants et les plus médiatisés associés à la prise de statine sont les plaintes musculaires qui surviennent chez 7 à 29% des patients selon les études d’observation et les registres (8). Les facteurs qui semblent prédisposer sont le sexe féminin, l’origine asiatique, un poids bas, la présence de maladie multisystémique. Ces plaintes rebaptisées « SAMS » (Statin-associated muscle symptom) n’ont rien de spécifique si bien que l’on intègre sous le nom de SAMS, toutes plaintes musculaires (douleur, faiblesse, crampes) avec ou sans taux modérément élevé de CPK (CPK < 10 x normale). Quelques caractères plus typiques sont la symétrie, le caractère précoce (dans les 4-5 semaines), la localisation proximale, touchant de larges groupes musculaires (cuisse, fesse et dos), surtout si la personne est physiquement active. L’apparition de douleurs plusieurs années après le début de la statine peut résulter d’une augmentation de dose, une insuffisance rénale/hépatique ou une interaction médicamenteuse. Elles sont malheureusement la cause principale de non-adhésion et d’arrêt du traitement par statine. La causalité avec la statine reste toutefois incertaine car les études contrôlées et randomisées ne montrent pas de différence versus placebo. Le mécanisme reste aussi mal compris : des altérations de la fonction mitochondriale, de la production d’énergie et de la dégradation des protéines musculaires ont été évoqués. De nombreuses autres causes fréquentes (activité physique, diabète, ...) et d’autres médicaments peuvent aussi causer des plaintes musculaires : anti-inflammatoires (glucocorticoïdes), antipsychotiques (risperidone, haloperidol), immunosuppresseur ou antiviraux (inhibiteurs de la protéase), autres hypolipémiants (gemfibrozil), ou d’autres substances telles qu’alcool, opioïdes et cocaïne.
Les statines ont aussi été associées à des élévations asymptomatiques des CPK (généralement moins que 4 X la normale), plus rarement (<1/10000 par an avec une dose standard de statine comme simvastatine 40 mg), une myosite qui est une vraie inflammation du muscle avec douleurs musculaires et élévations plus importantes de CPK (CPK> 10 x la normale). Ces myosites sont peu dangereuses sauf si l’atteinte musculaire s’étend (CPK> 40 x la normale) et se transforme en rhabdomyolyse avec myoglobinurie et insuffisance rénale, ce qui survient très rarement (1/100000 par an).
Risque de diabète
Des études avec les statines telles que PROVE-IT ou JUPITER avaient montré le développement de nouveaux cas de diabète sous traitement par statines (9). Diverses méta-analyses (l’une d’elle incluant un quart de millions de d’individus traités par statine dans 135 études randomisées) confirment une majoration de 9 % du risque de diabète (9). Ceci se traduit donc par une augmentation d’un cas de diabète par 255 sujets sur quatre ans (1 % par décennie), soit un très faible risque en regard du bénéfice cardiovasculaire. Une autre méta-analyse sur les cinq études comparant régime intensif versus plus classique par statines (32 753 participants) a montré une augmentation de 12 % du risque de diabète sur 2-5 ans de suivi (2 % par décennie) (9). L’augmentation du risque diabétique est corrélée aux doses utilisées et à l’existence de certains facteurs préexistants (intolérance au glucose, obésité, hypertension et existence d’une hypertriglycéridémie à jeun). Le mécanisme sous-jacent à cet effet reste inconnu. In vitro, les statines affectent la fonction des cellules-bêta et diminuent la sensibilité à l’insuline. Plus récemment, une étude génétique de type “ randomisation mendélienne ” suggère une relation entre réduction constitutionnelle d’activité de l’HMG-CoA réductase (la cible des statines) et une légère augmentation du poids (~ 300 grammes) (9). Curieusement, chez les patients avec une hypercholestérolémie familiale ou avec des taux élevés de lipoprotéine(a), on observe une prévalence moindre de diabète et un risque moindre de diabète de novo sous statines (35).
Autres précautions
Les recommandations sur la manière de pourvoir au problème des gênes musculaires liées aux statines sont présentées dans une publication de cette revue (2). Rappelons juste qu'il est utile de doser les CPK avant tout début de traitement mais qu'il n'est plus utile de le faire une fois le traitement démarré sauf en cas de symptômes (Figure 5). En ce qui concerne la surveillance hépatique, les précautions d’usage sont de surveiller les enzymes hépatiques avant le début du traitement et au cours du traitement (1 X par an). Si une augmentation des valeurs des enzymes hépatiques persiste pendant une période prolongée à un niveau 3 fois supérieur aux valeurs normales, une diminution de la dose ou l’arrêt du traitement est recommandé (Figure 5).
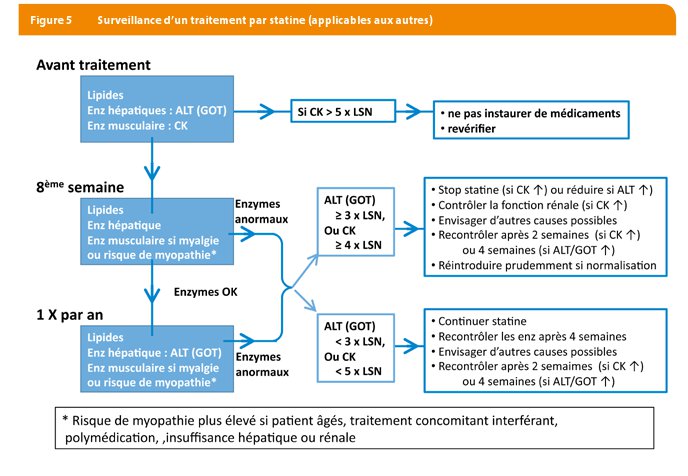
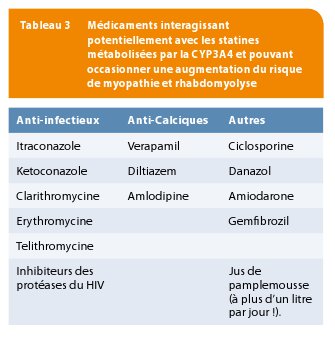
Il faut rester vigilant à propos des interactions médicamenteuses (Tableau 3). Toutes les statines sauf la pravastatine et la rosuvastatine subissent leur métabolisme via les cytochromes (principalement l’isoenzyme CYP3A mais aussi les CYP2C8, CYP2C9, CYP2C19 et CYP2D6). Rappelons aussi que le jus de pamplemousse contient un ou plusieurs composants qui modifient le métabolisme de certaines statines (comme l’atorvastatine) mais seulement à plus d’un litre par jour ! Un verre de 250 ml par jour n’occasionnera aucun problème.
2.3. L’ézétimibe à combiner pour atteindre les cibles
2.3.1. Effets lipidiques
L’addition d’ézétimibe, un inhibiteur de l’absorption intestinale du cholestérol, à une statine permet d’obtenir une réduction additionnelle du LDL cholestérol de 20 à 25% (Tableau 2). Ensemble ils permettent d’obtenir les réductions de plus de 50% du taux de LDL-C comme cela est nécessaire en prévention chez les patients à risque très élevé (Figure 1). Un effet moins connu et pourtant intéressant de l’ézétimibe est son effet stabilisateur sur la variabilité de la réduction du LDL-C, comme cela a été démontré dans une méta-analyse portant sur 24 études (10). Cette propriété permet une meilleure prédiction de l’effet lipidique , et donc en pratique, de mieux ajuster le traitement à la cible poursuivie.
2.3.2. Bénéfice cardiovasculaire
Dans l’étude IMPROVE-IT (18144 patients à très haut risque CV), l’addition d’ézétimibe chez des patients dont le taux de LDL-C était déjà considérablement abaissé (70 mg/dL) par la statine a permis une baisse supplémentaire de 16 mg (soit les 20% d’effet hypocholestérolémiant de l’ézétimibe) et sur les 6 ans de suivi une réduction des évènements CV de 6,4% en analyse « intention-to-treat » (tous patients même ayant abandonné le traitement) et de 7,8% en analyse « on-treatment » (seulement ceux ayant suivi le traitement) : pourcentages cohérents avec la courbe CTT, où une baisse de 16 mg/dl prédit un bénéfice de 8% sur le risque cardiovasculaire (11, 12). L’étude récente HIJ PROSPER présentée à l’ESC en aout 2016 et qui étudiait la combinaison ézétimibe et pitavastatine n’a pas confirmé ces résultats, mais cette étude souffrait d’une puissance statistique moindre (proportion plus faible de patients troponine positif, durée plus courte de 3,9 ans, cohorte plus petite de 1734 patients, au Japon où le risque cardiovasculaire est l’un des plus faibles au monde).
Récemment, une nouvelle combinaison fixe a été commercialisée, l’Atozet® (atorvastatine plus ézétimibe) permettant à la fois une synergie d’activité sur la réduction du LDL cholestérol et des maladies cardiovasculaires en même temps qu’une amélioration de l’adhérence au traitement (réduit le nombre de prises médicamenteuses) (13).
2.3.3. Effets indésirables
La dose recommandée de l’ézétimibe de 10 mg/jour peut être administrée le matin ou le soir sans tenir compte de l’apport alimentaire. Il n’y a cliniquement pas d’effets de l’âge, du sexe ou de la race sur la pharmacocinétique et aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère ou un insuffisance rénale sévère. Aucun effet indésirable majeur n’a été signalé. Les effets indésirables les plus fréquents sont des élévations modérées des enzymes hépatiques et des douleurs musculaires.
2.4. Les fibrates pour corriger le non HDL cholestérol plutôt que les triglycérides
2.4.1. Effets lipidiques
Les fibrates, dont le fénofibrate (Lipanthyl®, Fénogal®, ou générique) (14) n’ont que peu d’effet sur le LDL-cholestérol (-5 à -20%) mais réduisent bien les taux de triglycérides (20-30%) (Tableau 2). Ils peuvent aussi augmenter le taux de HDL-cholestérol (moins d’effet toutefois chez les diabétiques) et réduire les taux circulants des LDL petits et denses.
2.4.2. Bénéfice cardiovasculaire
Les effets cliniques des fibrates ont été illustrés dans cinq études randomisées prospectives : Helsinki Heart Study (HHS), Veterans Affairs Highdensity lipoprotein Intervention Trial (VA-HIT), Bezafibrate Infarction Prevention (BIP) study, Fenofibrate Intervention and Event Lowering in Diabetes (FIELD) and Action to Control Cardiovascular Risk in Diabetes (ACCORD-Lipid) (dans cette dernière, le fibrate était associé à une statine). Bien que la HHS démontra une réduction des évènements cardiovasculaires avec le gemfibrozil, ni l’étude FIELD (chez 9795 patients diabétiques), ni l’étude ACCORD-Lipid (chez 5518 patients diabétiques) n’ont montré de réduction des événements CV. Toutefois, comme le montre une analyse de sous-groupe prédéfinie, combiner du fénofibrate à une statine apportait un bénéfice significatif chez les patients diabétiques qui avaient une « dyslipidémie athérogène » (TG élevé / HDL bas) (15). Dans toute la cohorte, on observait également un bénéfice sur l’évolution des rétinopathies (bénéfice également observé dans l'étude FIELD). Dans l'étude FIELD, un bénéfice sur le risque d'amputation a en outre pu être noté. Les fibrates sont donc un traitement intéressant chez certains patients diabétiques avec un tel profil athérogène.
2.4.3. Effets indésirables
Comme les statines, les fibrates peuvent causer des myalgies et une myotoxicité. Le risque de myosite est 5,5 fois plus élevé qu’avec les statines, surtout en cas d’insuffisance rénale et varie selon le type de fibrate (plus souvent avec le gemfibrozil qui inhibe le métabolisme des statines via la the glucuronidation ; il n’existe pas en Belgique) et la combinaison avec une statine. Les autres effets secondaires des fibrates sont surtout des troubles gastro-intestinaux, des rashs et des céphalées, rarement des pancréatites (0.8% vs. 0.5% avec placebo dans l’étude FIELD) et des embolies pulmonaires (1.1% vs. 0.7% dans l’étude FIELD). Les fibrates augmentent les taux sériques de créatinine et d’homocystéine. L’augmentation des taux de créatinine disparait totalement après arrêt du traitement. L’augmentation de l’homocystéine peut potentiellement réduire légèrement l’effet bénéfique lié à l’amélioration du profil mais aussi peut favoriser des phénomènes thrombotiques. Les fibrates sont déconseillés chez les patients avec insuffisance rénale, une dysfonction hépatique sévère (si modérée, diviser la dose journalière par 2) ou une maladie lithiasique préexistante. Ils gardent par ailleurs leur place en cas d'hypertriglycéridémie sévère, associée ou non à des taux bas d'HDL-c et en cas d'hyperlipidémie mixte lorsque les statines sont contre-indiquées ou mal tolérées.
2.5. Les acides gras omega-3 à fortes doses
Les acides gras omega-3 polyinsaturés forment un groupe d’acides gras, souvent d’origine marine, caractérisés chimiquement par une liaison insaturée située en position 3. Les principaux acides gras du groupe oméga-3 sont l’acide alpha-linolénique ou ω3α (18:3; ALA), l’acide eicosapentaénoïque (20:5; EPA) ou acide timnodonique et l’acide docosahexaénoïque (22:6; DHA) ou acide cervonique. Bien que considérés comme essentiels (les oméga-6 tel que l’acide linoléique étant l’autre type d’acides gras essentiels), les acides EPA et DHA peuvent être synthétisés à partir de l’acide ALA avec un taux de conversion très variable (0,2 % à 21 % pour l’EPA et 0 % à 9 % pour le DHA), en fonction de l’apport d’acide linoléique (LA, oméga-6, qui est en compétition avec l’ALA pour la même désaturase) et de l’apport exogène de EPA + DHA. LA et ALA se retrouvent dans les huiles végétales (tournesol, maïs, pépins de raisin et soja pour le premier ; colza et noix pour le second) tandis que EPA et DHA dans les poissons gras.
2.5.1. Effets lipidiques
Les suppléments d’omega 3 à forte dose réduisent les taux de triglycérides de 25 à 35% (Tableau 2). Toutefois les études d’intervention publiées jusqu’à présent qui ont examiné l’effet sur la prévention cardiovasculaire n’utilisaient que des doses de moins de 1 gramme /jour.
2.5.2. Bénéfice cardiovasculaire
Les premières études de prévention cardiovasculaire réalisées avec les omega-3 à de telles doses (500 à 1000 mg/J) avaient apporté l’espoir que ces suppléments apporteraient un bénéfice sur la santé cardiovasculaire. Toutefois de récentes études n’ont démontré le plus souvent que des résultats négatifs (9). Ainsi par exemple L’étude ORIGIN où des suppléments d’acides gras oméga-3 (OMACOR®) ont été proposés versus placebo chez 12537 patients diabétiques n’a pas montré de bénéfice sur les décès par maladie cardiovasculaire (mais ils ne réduisaient le taux de triglycérides que de 13 mg/dL sans autres effets lipidiques significatifs). Plusieurs méta-analyses (totalisant plus de 70 000 patients en prévention secondaire) a conclu à l’absence d’effet (16). Cette absence de reproductibilité des bénéfices observés plus tôt dans l’étude GISSI (avant 1996) est peut-être liée à la généralisation des prescriptions de statines qui annihilent l’effet bénéfique des oméga-3. Il est aussi possible que des doses plus élevées, capables de réduire de manière plus importante les taux de triglycérides auraient été plus efficaces. Deux essais randomisés et contrôlés contre placebo sont en cours pour étudier les avantages potentiels de l’EPA sur les MCV chez les sujets ayant des taux élevés de TG : REDUCE-IT (avec 8000 sujets, ou Reduction of Cardiovascular Events with EPA-Intervention Trial) et STRENGTH (avec 13000 sujets ou Outcomes Study to Assess STatin Residual Risk Reduction with EpaNova in HiGh CV Risk PatienTs with Hypertriglyceridemia).
Actuellement, donc, l’impact des apports d’oméga-3 sous forme de suppléments reste donc peu concluant. Il n’empêche que l’apport alimentaire par la consommation de poisson est utile (voir plus haut).
2.5.3. Autres effets
Selon la dose, ces acides gras peuvent aussi prévenir la résistance à l’insuline, prolonger les temps de saignement et diminuer l’adhérence plaquettaire. Néanmoins, pris en excès, ces acides gras peuvent aussi provoquer une baisse de l’immunité, une fragilisation des membranes des cellules et des troubles de la coagulation sanguine.
2.6. Les autres médicaments ?
De multiples médicaments associés à une augmentation du HDL-C n’ont pas montré de bénéfice cardiovasculaire (1, 9) : la niacine (ou acide nicotinique) qui augmentait de 20% dans l’étude HPS2-THRIVE, les médicaments de la classe des « trapibs », dont le dernier en date, l’evacetrapib qui augmentait pourtant le HDL-C de 130% dans l’étude ACCELERATE. Ceci a conduit à la notion que le HDL cholestérol, bien que bon marqueur de risque n’est pas réellement un acteur dans le processus d’athérosclérose, et donc pas une cible (17).
Tout médicament qui diminue le LDL-C ne s’accompagne pas non plus d’un bénéfice cardiovasculaire. Ainsi la niacine et les trapibs juste mentionnés réduisaient aussi de manière très significative (20% et plus) le taux de LDL-C. L’effet neutre observé au niveau du bénéfice cardiovasculaire pourrait alors signifier soit qu’une toxicité compense l’effet bénéfique de la chute du LDL-C ou soit que le mécanisme causant la baisse du LDL-C a son importance. En effet, contrairement aux statines et à l’ézétimibe, leur mécanisme de réduction du LDL-C est indépendant du récepteur aux LDL. Ainsi peut-on se demander si l’augmentation de l’expression des récepteurs aux LDL n’est pas essentielle aux bénéfiques en terme de prévention ?
2.7. D’autres solutions dites « naturelles »
Les stérols de plantes (ou phytostérols) ainsi que leurs contreparties saturées, les stanols, ont été reconnus pour abaisser le taux de cholestérol LDL : 14 % réduction du LDL-C à la dose recommandée de 2 g par jour chez les patients au-dessus de 50 ans (moins chez les patients de moins de 50 ans). Cet effet est probablement lié à un déplacement du cholestérol des micelles intestinales par compétition avec le phytostérol avec comme résultat une diminution de l’absorption intestinale du cholestérol alimentaire et biliaire.
Il n’y a pas d’étude d’intervention examinant les effets cardiovasculaires cliniques des stérols ou des stanols végétaux. Comme une maladie génétique très rare (1/1.000.000), la « sitostérolémie familiale » s’accompagne d’une élévation importante des taux sanguins de stérols végétaux et de maladies cardiovasculaires précoces, que la présence des phytostérols ont été détectés dans les plaques d’athérome et que certaines études épidémiologiques ont parfois montrés une association entre taux élevés de stérols végétaux et maladies cardiovasculaires, il a été longtemps discuté si un apport en ces stérols végétaux pourrait contribuer à un bénéfice ou, au contraire, avoir un effet délétère. Un récent consensus a toutefois clarifié le bénéfice potentiel. La consommation d’une quantité de stérols / stanols végétaux supérieure à 3 grammes par jour doit toutefois être évitée.
Les levures de riz rouge et extraits de pleurotes sont traitées séparément dans cette revue (2). Quant à la berberine, une récente méta-analyse (mais seulement six essais disponibles et 452 patients randomisés toujours d’origine asiatique) montre avec une grande hétérogénéité une réduction du taux de TG et LDL-C (1). Ceci reste donc à valider dans des essais cliniques randomisés de meilleure qualité.
Divers autres produits sont proposés en supplémentation et vantés pour être capables de réduire les taux de LDL-C, mais sans réelle preuve. C’est le cas du Policosanol (mélange naturel d’alcool formé de longue chaîne aliphatique, extrait du sucre de canne de riz ou de blé) qui, dans les études sérieuses, n’a pas montré d’effet significatif sur le profil lipidique ou tout autre paramètre de l’inflammation ou la coagulation (1).
3. COMMENT PRESCRIRE EN PRATIQUE ?
Prescrire un traitement est le fruit d’une réflexion autour du risque cardiovasculaire (première et seconde étape : quel risque et quelles cibles) et d’une discussion qui implique le patient (Tableau 4).

3.1. Patients à risque très élevé
Les patients qui ont un diabète, une histoire personnelle cardiovasculaire ou une insuffisance rénale, mais aussi les patients qui cumulent de multiples facteurs de risque au point d’atteindre un risque SCORE supérieur à 10% sont considérés à « risque très élevé » (Figure 6).
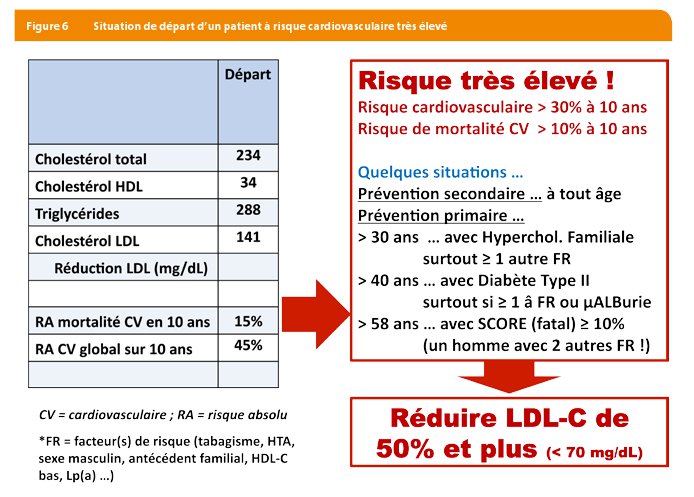
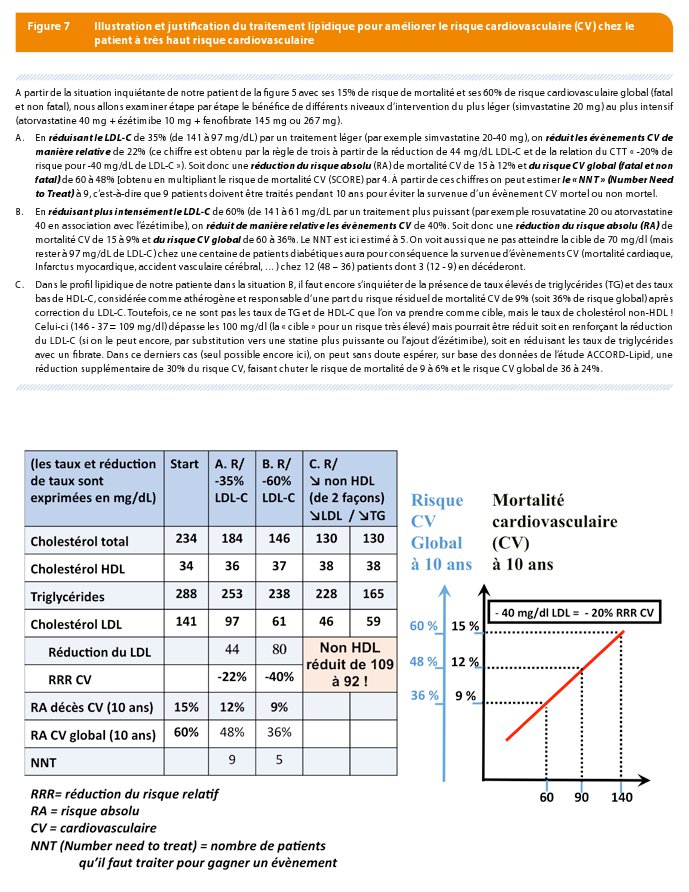
Selon les dernières recommandations 2016, chez les patients à risque très élevé, l’objectif est d’obtenir une réduction d’au moins 50% du LDL-C et, lorsque le LDL-C de départ est de plus de 140 mg/dL d’atteindre moins de 70 mg/dL de LDL-C (Figure 7).
Une telle réduction de LDL-C (> 50%) ne peut s’obtenir qu’avec une haute dose de statine puissante (atorvastatine 40-80 mg ou rosuvastatine 20-40 mg) ou avec une association d’une statine à dose suffisante et d’ézétimibe 10 mg.
3.2. Patients à risque élevé
Selon les dernières recommandations 2016, chez les patients à risque élevé (SCORE entre 5 et 10%, patients avec une hypercholestérolémie familiale), l’objectif est aussi d’obtenir une réduction d’au moins 50% du LDL-C et, lorsque le LDL-C de départ est de plus de 200 mg/dL d’atteindre moins de 100 mg/dL de LDL-C.
Ici aussi, le choix et la dose de la statine et la décision d’associer l’ézétimibe se feront comme pour le risque très élevé.
3.3. Patients à risque modéré
Selon les dernières recommandations 2016, chez les patients à risque modéré, l’objectif est d’atteindre un taux de LDL-C de moins de 125 mg/dL. Notons toutefois qu’en Belgique, les statines n’ont pas reçu l’indication pour ce groupe de patients. Si après discussion avec le patient, il apparait que celui-ci souhaite un traitement, il pourra être prescrit en précisant qu’il ne doit pas être remboursé. Compte tenu du prix actuellement bas des statines (moins de 60 euros par an pour simvastatine 20 mg ou atorvastatine 10 mg), ceci ne représentera pas vraiment un investissement lourd pour un tel patient.
3.4. Patients avec des taux de triglycérides élevés et de HDL-C bas
Le premier réflexe chez ces patients est de rechercher une cause secondaire (souvent présente) (diabète, alimentation riche en glucides à index glycémique élevé telle que sucres raffinés et féculents, en graisses, et en alcool, …) qui, si elle peut être corrigée, permettra une amélioration (voire une normalisation) des taux de triglycérides.
Chez ces patients comme tout autre, le premier objectif est de réduire le taux de LDL-C selon la cible fixée en fonction du risque établi (voir ci-dessous) ! Toutefois, même lorsque le LDL-C sera « corrigé », il persistera parfois sur le profil lipidique un taux élevé de triglycérides (TG) et/ou un taux bas de cholestérol HDL (HDL-C).
Un autre problème est celui des patients dont le taux de triglycérides est trop élevé (> 400 mg/dl) pourque le laboratoire puisse calculer le LDL-C.
Pas de recommandation pour les taux de triglycérides/HDL-C mais le non HDL-C
Les recommandations ne fixent pas de cible pour les taux de triglycérides et de HDL-C en raison des faits suivants : le taux de HDL-C est à peine modifiable par les traitements actuels (les fibrates l’augmentent de 15- 20% soit 4 à 6 mg/dl pour un HDL-C de 30 mg/dl) ; il n’y a pas de preuves d’un rôle causal des HDL dans le processus d’athérosclérose (20) ; les taux de TG varient quotidiennement et donc, la réponse thérapeutique est difficile et même frustrante à apprécier.
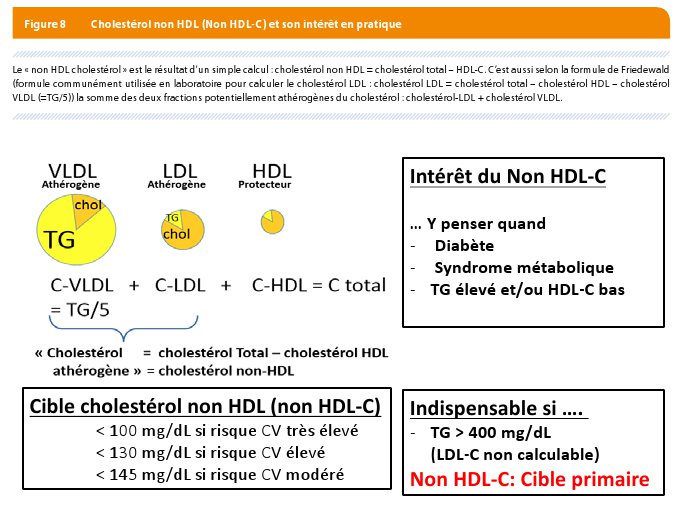
Aussi, les dernières recommandations ont suggéré de s’atteler à corriger un paramètre appelé « cholestérol non HDL « ou Non HDL-C (21) ? Celui-ci est le résultat d’un simple calcul : Cholestérol non HDL = cholestérol total – HDL-C (Figure 8). Ce paramètre résume (selon la formule de Friedewald) la somme des deux fractions potentiellement athérogènes du cholestérol : cholestérol-LDL + cholestérol VLDL ; ce dernier (VLDL-C) étant particulièrement élevé en présence d’un HDL-C bas et de TG élevés notamment dans le diabète.
Chez les patients dont les taux de triglycérides (TG) sont élevés et dont le LDL-C est calculable
Corriger d’abord le taux LDL-C selon la cible recommandée. Après correction de ce taux, on calcule le cholestérol non HDL (Non HDL-C) et on prescrit les traitements utiles pour lui faire atteindre sa cible (Figure 7) : réduire le taux de cholestérol non HDL en dessous de 100 mg/dl chez les patients à risque élevé, en dessous à 130 mg/dL chez les patients à risque élevé et en dessous à 145 mg/dL chez les patients à risque modéré (Figure 8).
L’abaissement du cholestérol non HDL s’obtiendra soit en réduisant plus encore la fraction LDL-C du non HDL-C (par une statine plus forte ou plus fortement dosée, ou par la combinaison avec l’ézétimibe), soit en réduisant la fraction VLDL-C du non HDL-C via une réduction des triglycérides (par le fénofibrate ou les oméga 3). Bien que l’effet bénéfique cardiovasculaire de l’association du fénofibrate à une statine a surtout été montré chez les patients diabétiques, il n’est pas exclu de les associer chez des patients non diabétiques avec (ce qui est souvent le cas) ou non un syndrome métabolique.
Chez les patients chez qui les taux de LDL-C n’est pas calculable
C’est le cas lorsque le taux de TG est supérieur à 400 mg/dL, le taux idéal de non HDL-C devient alors la cible primaire selon les chiffres mentionnés ci-dessous. Ici aussi, l’obtention du taux désirable se fera à l’aide de statine associée au fibrate et à l’ézétimibe.
Chez les patients chez qui les taux de triglycérides sont supérieur à 1000 mg/dL
Dans ce cas, le risque est double : complications cardiovasculaires et pancréatite. L’attitude reste la même que pour les autres patients hypertriglycéridémiques, sinon que l’on commencera par un fibrate seul si le risque cardiovasculaire n’apparait pas trop élevé. Chez ces patients, une origine polygénique associée à d’autres facteurs (alimentation, diabète, …) est le plus probable. Chez un patient récidivant des pancréatites associées à des hypertriglycéridémies sévères depuis le plus jeune âge, on ne négligera pas la possibilité d’une forme homozygote de déficit en lipoprotéine lipase (très rare).
3.5. Limitations Belges
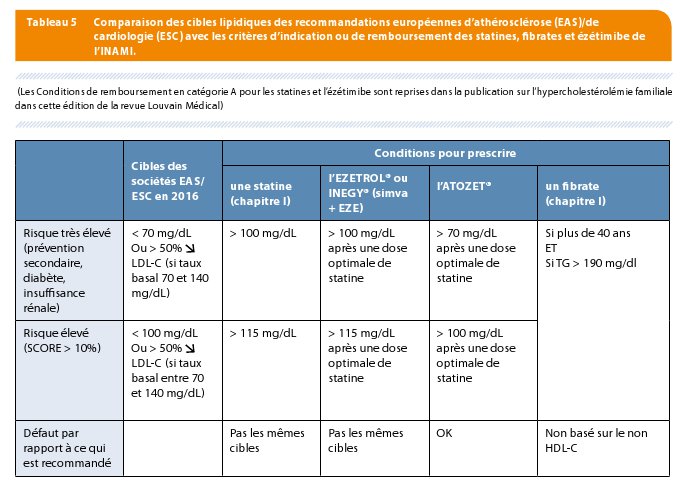
En Belgique, la prescription des statines et fibrates (chapitre I) ainsi que le remboursement de l’ézétimibe chapitre IV) sont conditionnés par les conditions et indications de l’INAMI (même au chapitre I !) qui sont malheureusement en décalage par rapport aux dernières recommandations européennes (Tableau 5): cible de 100 mg/dl en prévention secondaire et diabète et cible de 115 mg/dl en prévention primaire avec risque SCORE > 5%. Une autre contrainte impose le choix de la statine puisqu'est encouragée en priorité, pour la prévention primaire uniquement, la prescription des statines « bon marché », c’est-à-dire la simvastatine, la pravastatine (mais on peut y ajouter l’atorvastatine depuis 2011 auquel s’ajoutera sans doute la rosuvastatine après juin 2017).
Du fait des critères de remboursement, l’addition d’une prescription d’EZETROL® 10 mg (ezetimibe) ou d’INEGY® (combinaison fixe simvastatine et ezetimibe) chez un patient en prévention secondaire qui a un taux de LDL-C, par exemple à 90 mg/dL (donc au-dessus de la cible européenne de 70 mg/dL) n’est pas possible. Seules les conditions de remboursement de la combinaison fixe ATOZET® mis sur le marché depuis janvier 2016 ont été ajustées aux nouvelles recommandations. Ainsi, l’ATOZET® peut être prescrit chez les patients à très haut risque (cardiaque, diabète, insuffisance rénale, SCORE>10%) dont le taux de LDL-C reste au-dessus de 70 mg/dL et chez les patients à haut risque (prévention primaire avec SCORE entre 5 et 10%) dont le taux de LDL-C reste au-dessus de 100 mg/dL (Tableaux 5 et 6). Les conditions de remboursement d'ATOZET® facilitent aussi la possibilité de substituer les autres combinaisons fixes (INEGY®) ou séparées (statine plus EZETROL®) pour lesquelles un remboursement a déjà été obtenu. Ce qui devrait améliorer l’adhérence pour le traitement.

3.6. Arrive-t ’on toujours aux cibles avec nos moyens actuels ?
Comme le montre l’étude EUROASPIRE IV (18), une large proportion des patients à haut risque cardiovasculaire n’atteignent pas la cible de cholestérol LDL (<70 mg/dL) préconisée par les recommandations européennes (19, 20).
Plusieurs raisons peuvent être avancées. La première est que les (mono)thérapies disponibles ne sont pas assez puissantes. La seconde est que l’adhérence n’est pas toujours totale surtout pour des patients à haut risque qui reçoivent de multiples traitements pour corriger leurs autres facteurs de risque (diabète, hypertension, aspirine, …). Les autres raisons de non adhésion sont le problème d’intolérance et les messages confus sur les médias (2). La troisième est que les conditions actuelles de remboursement ne rendent pas faciles l’application d’une intensification du traitement hypolipémiant.
Cette troisième limitation s’est vue toutefois améliorée par l’approbation par l’INAMI du remboursement de la spécialité ATOZET® (une combinaison fixe entre atorvastatine, une des statines les plus puissantes et l’ézétimibe du laboratoire Merck Sharp & Dohme) pour des conditions mieux alignées avec les recommandations (Tableaux 5 et 6). Le futur ira sans doute vers la combinaison avec d’autres thérapies dont les anticorps anti-PCSK9.
4. UN NOUVEAU CANDIDAT : LES ANTICORPS MONOCLONAUX ANTI-PCSK9 ?
Une nouvelle classe thérapeutique ciblant le PCSK9 vient d’être mise sur la marché depuis septembre 2016 dans l’indication des hypercholestérolémies familiales (12, 21). Ce traitement pourrait à l’avenir être utilisé dans d’autres indications.
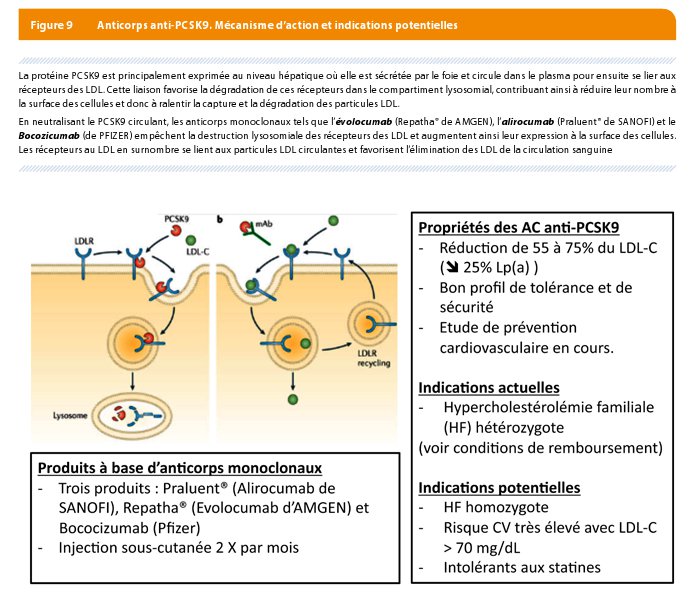
Le principe est né des résultats des études génétiques: à côté des mutations du PCSK-9 dites « gain de fonction », associées à certaines formes d’HF, des mutations destructrices (mutations « perte de fonction ») sont associées à des taux bas de LDL-C et un risque très faible de maladie coronarienne (22). Quelques individus ont même un déficit complet du PCSK9 associés à des taux extrêmement bas de LDL-C (< 20 mg/dL), sans aucun handicap particulier ni problème de santé (23). Le mécanisme par lequel le PCSK9 régulent l’expression du récepteur aux LDL commencent à être de mieux en mieux compris (Figure 8). Ce mécanisme ainsi que les observations ci-dessus suggèrent que l’inhibition du PCSK9 apparait comme une nouvelle stratégie possible et sécure pour abaisser le taux de LDL-C.
Une telle inhibition est actuellement possible grâce à l’injection par voie sous-cutanée (1 – 2 X par mois) d’anticorps monoclonaux entièrement humains et dirigés contre la protéine PCSK9: evolocumab (Amgen), alirocumab (Sanofi) et bococizumab (Pfizer) (Figure 9).
4.1. Effets lipidiques
Dans de vastes programmes d’études, ces traitements permettaient de réduire significativement de 45% à 65 % des taux de LDL-C et ainsi d’atteindre chez une grande majorité de patients les cibles thérapeutiques (< 70 mg/dl en prévention secondaire ou < 100 mg/dl en prévention primaire).
4.2. Bénéfices cardiovasculaires
Deux récentes analyses post-hoc ont montré que l’utilisation des anti-PCSK9 en ajout d’une statine à dose maximale tolérée réduisait significativement (de plus de 50% à un an) l’incidence des événements cardiovasculaires (24, 25). Trois études de suivi à long terme (premiers résultats attendus en 2017) sont en cours actuellement : études FOURIER, ODYSSEY OUTCOMES et SPIRE. En attendant, la firme Amgen vient d’annoncer les résultats positifs pour l’étude Glagov, une étude avec ultrasons intravasculaires dont l’objectif principal était de démontrer une réduction de la plaque. Les résultats complets seront présentés lors de l’AHA en novembre de cette année.
4.3. Effets indésirables
Ces traitements présentent une très bonne tolérance et une sécurité très satisfaisante. Hormis quelques effets locaux au niveau de l’injection (rougeur, chatouillement), il n’y a pas eu de manifestations systémiques majeures ou même mineures gênantes.
4.4. Remboursement et indications
Ces médicaments constituent une belle promesse d’espoir pour des cas bien particuliers de patients à très haut risque CV, qui présentent des taux de LDL-C encore particulièrement élevés malgré les doses optimales des traitements classiques. Elle est d’ores et déjà remboursée dans certaines conditions de l’hypercholestérolémie familiale (Tableau 7). Ce remboursement utilise les critères de diagnostic de l’hypercholestérolémie familiale hétérozygote comme le score du Dutch Lipid Clinical Network clinical criteria for diagnosis of HeFH. Le PRALUENT est remboursé dans cette indication depuis le 1er septembre (tableau 7 et (26)) tandis que la firme Pfizer vient d'annoncer ce 1er novembre qu'elle ne commercialiserait pas le Bocozicumab.

5. CONCLUSIONS
Nous avons parcouru les différentes possibilités thérapeutiques dans le domaine des dyslipidémies et vu que des possibilités futures amélioreraient encore la prise en charge. Reste après cela le grand challenge de l’observance thérapeutique (2). Celle-ci dépend de nombreux facteurs incontrôlables par le médecin mais aussi d’un mode de dialogue que le médecin peut optimaliser.
On peut parfois s’interroger sur l’existence de différence et même de confrontation entre recommandations. Ainsi par exemple les recommandations américaines qui ont aboli l’idée de cible et limité l’arsenal thérapeutique aux seules statines (27). Elles éveillent aussi des questions pertinentes comme celle-ci : ainsi un patient qui a un infarctus et dont le taux de LDL-C est juste en dessous de 70 mg/dL , ne devrait-il pas tout de même recevoir un traitement pour abaisser ce taux ?
L’important est au final que l’attitude choisie pour corriger la dyslipidémie le soit en pleine connaissance et intelligence avec le patient. Il paraît essentiel de lui parler des enjeux qu’implique chaque choix thérapeutique, tant au niveau des bénéfices qu’au niveau des contraintes (surtout dans les poly-médications associées aux prises en charge multifactorielles, comme dans le diabète) et des risques d’effets secondaires. Ce n’est qu’avec cet esprit que les patients auront à cœur de suivre leur traitement correctement.
Correspondance
Dr. Olivier S Descamps
Centres Hospitaliers Jolimont
Département de Médecine Interne
B-7100 Haine Saint-Paul
Tel 064/23 31 67
olivierdescamps@hotmail.com
Cliniques universitaires Saint-Luc
Service de cardiologie
B-1200 Bruxelles
Tel 02/764 2812
Références
1 Catapano AL, Graham I, De Backer G, Wiklund O, Chapman MJ, Drexel H, et al; Authors/Task Force Members; Additional Contributor. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias: The Task Force for the Management of Dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS) Developed with the special contribution of the European Association for Cardiovascular Prevention and Rehabilitation (EACPR). Eur Heart J 2016 Aug 27. pii: ehw272.
ouvrir dans Pubmed
2 Descamps OS. Polémique, intolérance, non adhérence et autres contrariétés autour de la prescription des statines. Louvain Med 2016 ; 135 (9) : 600-612
3 Descamps OS. Quelles évidences pour quelles interventions diététiques en prévention cardiovasculaire ? Louvain Med 2009; 128 (1);3-16.
4 Chowdhury R, Warnakula S, Kunutsor S, Crowe F, et al (Mozaffarian D, Danesh J, Di Angelantonio E). Association of dietary, circulating, and supplement fatty acids with coronary risk: a systematic review and meta-analysis. Ann Intern Med 2014 Mar 18;160(6):398-406.
ouvrir dans Pubmed
5 Delgado-Lista J. et al. Long chain omega-3 fatty acids and cardiovascular disease: a systematic review. Br J Nutr 2012 Jun;107 Suppl 2:S201-13.
ouvrir dans Pubmed
6 Estruch R, Ros E, et al. Primary prevention of cardiovascular disease with a Mediterranean diet. N Engl J Med 2013; 368(14):1279-90.
ouvrir dans Pubmed
7 Descamps OS. Prévention cardiovasculaire. Quelle statine et à quelle dose ? Louvain Med 2011; 130 (3): S23-30.
8 Stroes ES, Thompson PD, Corsini A, Vladutiu GD, Raal FJ, Ray KK, et al; European Atherosclerosis Society Consensus Panel. Statin-associated muscle symptoms: impact on statin therapy—European Atherosclerosis Society Consensus Panel Statementon Assessment, Aetiology and Management. Eur Heart J 2015;36:1012–1022.
ouvrir dans Pubmed
9 Descamps OS. Recommandations dans le traitement des dyslipidémies chez les patients diabétiques : un choix raisonné ? Louvain Med 2016 ; 135 (3) : 107-119.
10 Descamps O, Tomassini JE, Lin J, Polis AB, Shah A, Brudi P, et al. Variability of the LDL-C lowering response to ezetimibe and ezetimibe + statin therapy in hypercholesterolemic patients. Atherosclerosis 2015 Jun; 240(2):482-9.
ouvrir dans Pubmed
11 Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al.; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015;372(25):2387-97.
ouvrir dans Pubmed
12 Descamps OS, De Backer G, Scheen AJ, Balligand J-L, Ducobu J, Radermecker RP, et al.; on behalf of the Belgian Society of Atherosclerosis. Étude « IMPROVE-IT » : bénéfice de l’ajout d’ézétimibe à une statine pour prévenir les maladies cardiovasculaires, commentaire de la Société Belges d’Athérosclérose / Belgian Lipid Club. Louvain Med 2014; 133 (10): 692-701.
13 Descamps OS. ATOZET®, combinaison fixe d’atorvastatine et d’ézétimibe ce que cela va changer «from A to Z. Louvain Med 2016; 135 (1): 1-11.
14 Descamps OS. Mettons en pratique le traitement des dyslipidémies selon les nouvelles recommandations européennes. Louvain Med 2012; 131 (4): 166-176.
15 Descamps OS, Hermans M. Quelles leçons tirer de l’étude ACCORD-Lipid (association statine et fénofibrate) pour les patients diabétiques et dyslipidémiques ? Louvain Med 2010; 129 (4): 138-146.
16 Rizos EC et al. Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis. JAMA 2012 Sep 12; 308(10):1024-33.
ouvrir dans Pubmed
17 Descamps OS & Chenu P. Prise en charge des dyslipidémies en matière de prévention cardiovasculaire. Louvain Med 2016 ; 135 (9) : 571-575
18 Kotseva K, Wood D, De Bacquer D, De Backer G, Rydén L, Jennings C, Gyberg V, Amouyel P, et al; on behalf of the EUROASPIRE Investigators. EUROASPIRE IV: A European Society of Cardiology survey on the lifestyle, risk factor and therapeutic management of coronary patients from 24 European countries. Eur J Prev Cardiol 2016 Apr;23(6):636-48
ouvrir dans pubmed
19 Descamps OS, De Backer G, Annemans L, Muls E, Scheen AJ. Belgian Atherosclerosis Society/ Belgian Lipid Club. Les nouvelles recommandations européennes pour le traitement des dyslipidémies en prévention cardiovasculaire. Louvain Med 2012;131(4): 157-165.
20 Descamps OS. Mettons en pratique le traitement des dyslipidémies selon les nouvelles recommandations européennes. Louvain Med 2012;131(4):1 66-176.
21 Descamps OS. Les inhibiteurs du PCSK9, une nouvelle classe d’hypolipémiant. Louvain Med 2016 ; 135 (5): 291-297.
22 Cohen JC, Boerwinkle E, Mosley TH Jr, Hobbs HH. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006; 354: 1264-72.
ouvrir dans Pubmed
23 Zhao Z, Tuakli-Wosornu Y, Lagace TA, Kinch L, Grishin NV, Horton JD, et al. Molecular characterization of loss-of-function mutations in PCSK9 and identification of a compound heterozygote. Am J Hum Genet 2006;79(3):514-23.
ouvrir dans ¨Pubmed
24 Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J et al. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372: 1500-9.
ouvrir dans Pubmed
25 Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372: 1489-99.
ouvrir dans Pubmed
26 Descamps OS. L’hypercholestérolémie familiale. Louvain Med 2016 ; 135 (9): 613-620
27 Descamps OS, Rietzschel ER, Langlois M, Radermecker R, Scheen AJ, Ducobu J, et al. Qu’apportent les nouvelles recommandations américaines à propos de la prise en charge des dyslipidémies en prévention cardiovasculaire ? Comparaison avec les recommandations européennes et belges. Louvain Med 2014; 133 (1): 26-35.