Introduction
Le cancer du rein ou carcinome rénal (Renal Carcinoma Cell, RCC) est le 6ème cancer le plus fréquent chez l’adulte; il touche plus fréquemment les hommes et son incidence augmente avec l’âge (pic d’incidence entre 60 et 70 ans) (1). Le RCC prend naissance dans le cortex rénal et ne doit pas être confondu avec le carcinome urothélial du rein qui se développe dans l’épithélium urothélial tapissant les cavités pyélocalicielles. Les RCCs se divisent en deux groupes : les RCC à cellules claires (ccRCC), qui représentent 75 à 80% des cas, et les RCC non à cellules claires (nccRCC), un groupe hétérogène qui inclut les RCC papillaires (15%), chromophobes (5%), à translocation TFE3 ou TFEB, déficients en fumarate hydratase, et d’autres sous-types rares mais très agressifs tels que le carcinome des tubes collecteurs (Tumeur de Bellini) et le carcinome médullaire rénal.
Le diagnostic du RCC se fait souvent au stade localisé, permettant un traitement radical à visée curative, tel que la néphrectomie (partielle ou radicale), la radiofréquence ou cryo-ablation dans les tumeurs de petite taille, ainsi que la radiothérapie stéréotaxique (SABR) qui peut être envisagée dans certaines situations. Cependant, en fonction du stade et de l’histologie, 20% à 30% de ces patients développent par la suite des métastases et environ 25% des patients ont un RCC d’emblée métastatique, avec un pourcentage de survie ne dépassant pas les 15% à 5 ans. Cette revue remet en lumière les mécanismes pathogéniques ainsi que les stratégies thérapeutiques dans le ccRCC métastatique.
Pathogenèse du RCC à cellules claires
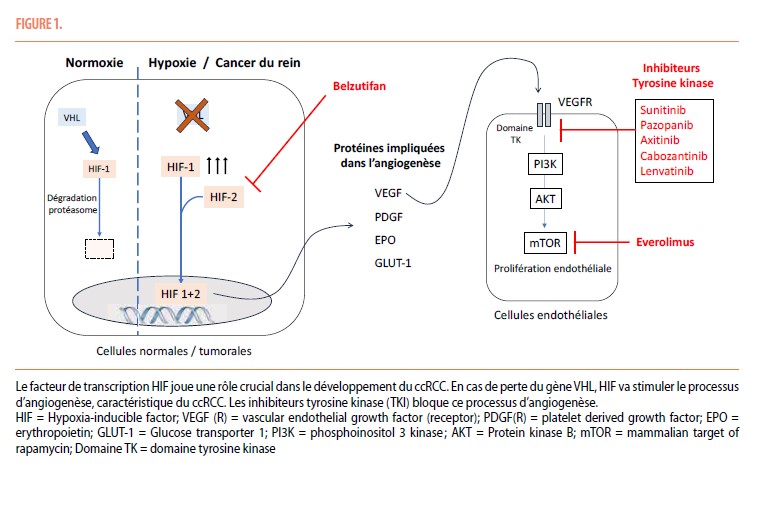
Le ccRCC possède un potentiel métastatique important, les métastases se propageant principalement par voie hématogène et atteignant n’importe quel organe (2). Cette agressivité est en partie associée à une angiogenèse excessive secondaire à la perte du gène Von Hippel Lindau (VHL), encodant la protéine VHL. En normoxie, la protéine VHL induit la dégradation du facteur de transcription Hypoxia-Inducible Factor 1 (HIF-1) par le protéasome. Par contre, en hypoxie, l’inactivation de VHL permet à HIF-1 de s’associer avec la sous-unité HIF-2 ; ce complexe HIF1+2 migre vers le noyau où il active la transcription de nombreux gènes impliqués dans l’angiogenèse, tels que le Vascular Endothelial Growth Factor (VEGF), ainsi que dans la prolifération et la survie cellulaire. La perte du gène VHL, situé sur le chromosome 3p, est aujourd’hui considérée comme un mécanisme « driver » dans le développement du ccRCC. De plus, une expression élevée de HIF et de VEGF est associée à un phénotype plus agressif (stade avancé, grade élevé, nécrose, invasion vasculaire) et à un pronostic défavorable (3).
Le facteur de croissance VEGF en se liant à son récepteur VEGFR présent sur les cellules endothéliales et tumorales stimule, via une activité tyrosine kinase, l’activation de la voie PI3K-AKT-mTOR impliquée dans la prolifération cellulaire (Figure 1). Les premiers inhibiteur tyrosine kinase (TKI) (sunitinib, pazopanib et sorafenib) ciblant VEGFR ont été initialement utilisés en monothérapie dans le ccRCC métastatique; cependant, leur efficacité restait inconstante, avec un taux de réponse objectif (TRO) inférieur à 30% et une survie sans progression (SSP) de moins d’un an. Des TKIs anti-angiogéniques de nouvelle génération (axitinib, cabozantinib et lenvatinib) ont donc été développés, permettant non seulement de cibler le VEGFR mais également d’autres récepteurs tyrosine kinase tels quel c-MET, KIT, RET, AXL … Tous ces molécules orales ont permis d’ouvrir la voie à de nouvelles stratégies thérapeutiques (4).
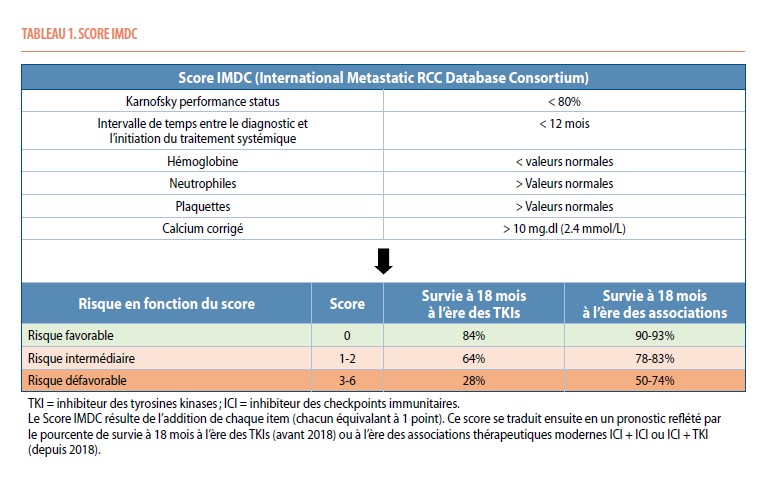
Le score IMDC (International Metastatic Renal Cell Carcinoma Database Consortium) prédit le pronostic des patients traités par TKI. Sur base de six facteurs de risque (FR) clinico-biologiques (statut de performance de Karnofsky <80%, anémie, neutrophilie, thrombocytose, hypercalcémie et intervalle de moins d’un an entre le diagnostic et le traitement systémique), les patients sont classés dans le groupe à risque favorable (0 FR), risque intermédiaire (1-2 FR) et risque défavorable (3-6 FR), avec un pourcentage de survie à 18 mois sous TKI de 84%, 64% et 28% respectivement. Ce score IMDC garde sa valeur pronostic à l’ère de l’immunothérapie (Tableau 1).
Quelle stratégie thérapeutique en première ligne métastatique?
La surveillance active
Certains ccRCC métastatiques présentent une évolution lente de la maladie, justifiant initialement une surveillance active. Cette évolution lente est particulièrement marquée en présence de métastases glandulaires (thyroidiennes, pancréatiques, surrénaliennes) isolées ou associées à d’autres métastases (5). Une étude prospective sur 48 patients atteints de RCC métastatique asymptomatique a montré que la durée médiane de surveillance avant l’initiation d’une traitement atteignait 14.9 mois (allant de 10.6 à 25 mois). Un nombre plus élevé de FR IMDC et de sites métastatiques étaient associé à une durée de surveillance plus courte. Une surveillance active peut donc convenir aux patients de risque IMDC favorable, avec un faible volume tumoral (6). Ceci à l’avantage de retarder l’initiation d’un traitement et donc la survenue d’effets secondaires.
Traitement systémique : vers les associations à base d’immunothérapie
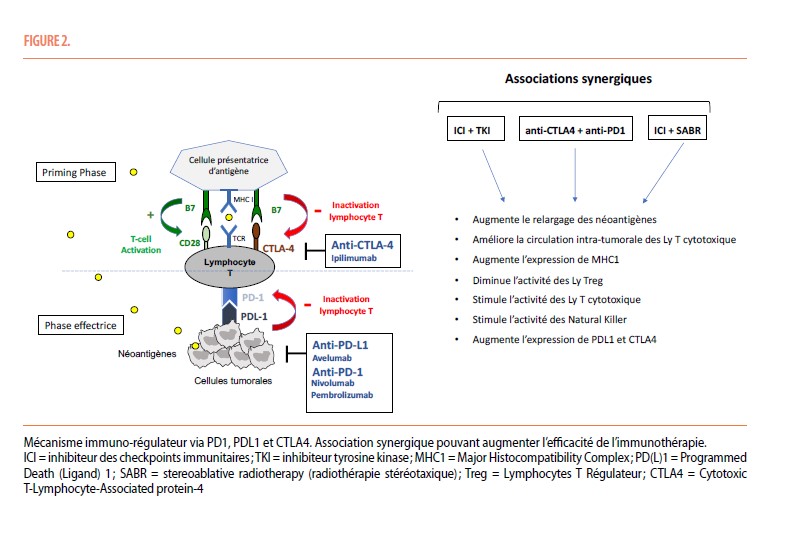
L’immunothérapie permet de réactiver un système immunitaire qui s’est avéré peu efficace pour reconnaitre et détruire des cellules tumorales. Après avoir reconnu via le Complexe Majeur d’Histocompatibilité (CMH -I) les néoantigènes tumoraux libérés par les cellules tumorales, les cellules présentatrices d’antigènes (CPA) vont induire l’activation des lymphocytes T au niveau ganglionnaire (priming phase). Ces lymphocytes T activés vont ensuite être capables d’infiltrer la tumeur et déclencher une réaction immunitaire tumoricide. Les cellules tumorales peuvent échapper à cette reconnaissance immunitaire, notamment en facilitant l’expression de checkpoints immunitaires, présents sur les cellules tumorales (PDL1) et lymphocytaires (CTLA4 et PD1). Ces checkpoints immunitaires induisent un signal inhibant l’activation des lymphocytes T cytotoxiques, permettant alors l’échappement immunitaire. Les inhibiteurs de points de contrôle immunitaire (ICIs) sont des anticorps monoclonaux qui ciblent ces checkpoints immunitaires, perturbant ainsi les signaux inhibiteurs et réactivant le système immunitaire (Figure 2). Le nivolumab et le pembrolizumab ciblent PD1, l’avélumab cible PDL1 et l’ipilimumab cible CTLA4 (7). Le nivolumab a montré une efficacité en monothérapie après échec d’un traitement par TKI avec un TRO de 25% et une survie globale (SG) médiane de 25 mois (8) . Différentes stratégies ont été développées afin d’améliorer l’efficacité des ICIs.
Association de deux inhibiteurs de checkpoints immunitaires
Associer l’ipilimumab et le nivolumab permet, en inhibant deux checkpoints immunitaires différents, d’augmenter de façon synergique la réponse immunitaire (Figure 2).
L’étude clinique de phase III CHECKMATE-214 a comparé l’efficacité de l’association ipilimumab plus nivolumab (I+N) par rapport au sunitinib chez des patients atteints d’un ccRCC métastatique en première ligne (n=1,096). L’objectif primaire de cette étude étaient l’efficacité de I+N dans le groupe de patients à risque IMDC intermédiaire/défavorable. L’association I+N a montré une augmentation par rapport au sunitinib, du TRO (47% dont 9% de réponse complète (RC) vs 27% dont 1% de RC, respectivement), de la SSP médiane (11 .6 vs 8.4 mois, respectivement) et la SG médiane (46.7 vs 26.0 mois, respectivement). Par contre, dans le groupe à risque favorable, l’efficacité de I+N était inférieure au sunitinib en terme de TRO (29% vs 52%, respectivement) et en terme de SSP (12.4 vs 28.9 mois, respectivement). A noter cependant que dans ce groupe favorable, l’I+N était associée à une amélioration non significative de la SG par rapport au sunitinib (médiane de 77.9 vs 66.7 mois, respectivement ; HR 0.82, CI 0.6-1.3) et à un taux de RC complète plus important (13 vs 6%). Comme attendu avec l’immunothérapie, la durée de réponse était supérieure avec I+N par rapport au sunitinib, quelque que soit le groupe IMDC, y compris dans le groupe favorable (9). Pratiquement, l’ipilimumab (1mg/kg IV) est associé au nivolumab (3mg/kg IV) toutes les 3 semaines à raison de 4 cures et est ensuite relayé par du nivolumab toutes les 2 à 4 semaines jusqu’à progression. La durée optimale du traitement n’est pas connue mais un arrêt du nivolumab peut être discuté en cas de toxicité ou en cas de RC soutenue après 12 à 24 mois de traitement.
Association d’un TKI anti-angiogénique et d’un ICI
Le TKI, par son effet cytotoxique, permet un relargage plus important de néoantigènes, stimulant ainsi la réaction immunitaire. De plus, en réduisant la prolifération des vaisseaux tumoraux anarchiques, les TKI facilitent la circulation des lymphocytes en intra-tumoral (4).
Différentes études de phase III ont évalué l’efficacité de combinaison ICI+TKI chez des patients atteints d’un cancer ccRCC en première ligne métastatique. Ces études sont résumées dans le tableau 2. L’étude KEYNOTE-426 a évalué l’association pembrolizumab plus axitinib, l’étude CHECKMATE 9ER l’association nivolumab plus cabozantinib et l’étude CLEAR l’association pembrolizumab plus lenvatinib (10–12). Toutes ces associations étaient comparées au bras contrôle sunitinib et toutes avaient pour objectif primaire l’évaluation de l’efficacité en terme de SSP et/ou SG chez tous les patients (intent-to-treat, ITT = patients avec IMDC favorable ET intermédiaire/défavorable). Ces associations ICI + TKI ont montré une efficacité supérieure au sunitinib dans la population ITT avec un TRO supérieur (55-71% vs 27-39%, respectivement), une SSP majorée (15.7-23.9 vs 8-11 mois, respectivement) et une SG améliorée (47-49 vs 35-40 mois, respectivement). La durée de réponse était également augmentée avec les associations ICI+TKI. Dans ces études, l’ICI est en général administré pour une durée de 2 ans, alors que le TKI est poursuivi jusqu’à progression de la maladie.
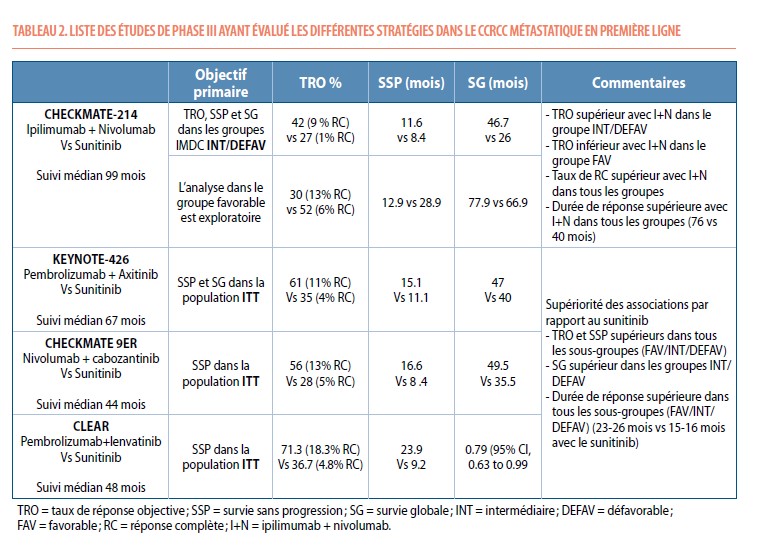
L’analyse des différents sous-groupes dans ces études montre que le TRO était augmenté dans tous les sous-groupes (IMDC favorable ET intermédiaire/défavorable), de même que le taux de RC et la durée de réponse. Par contre, une amélioration significative de la SSP et de la SG n’étaient retrouvées que dans les groupes intermédiaire/défavorable. Ceci pourrait être expliqué par le court follow-up dans cette population qui présente naturellement un meilleur pronostic.
Choisir la meilleure combinaison thérapeutique en fonction du patient
Aucune comparaison directe n’a été réalisée entre ces différentes études, mais plusieurs facteurs semblent favoriser certaines stratégies (Tableau 3 et Figure 3).
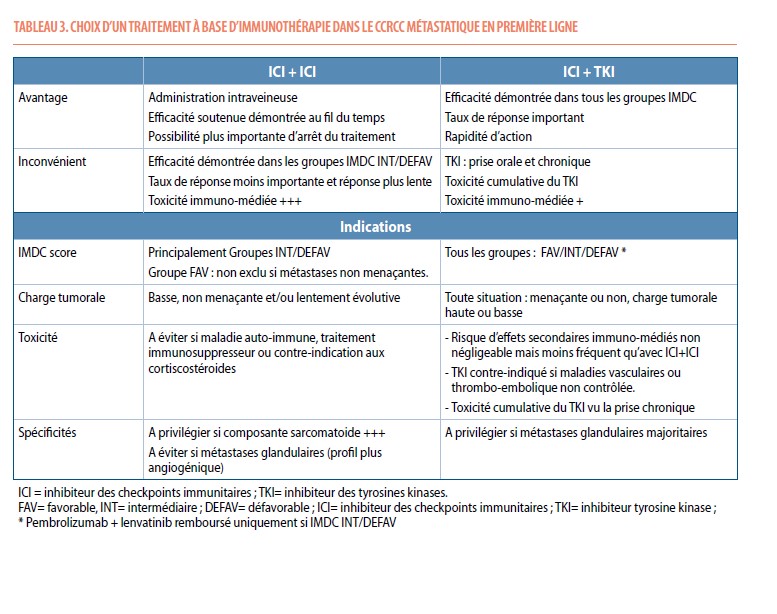
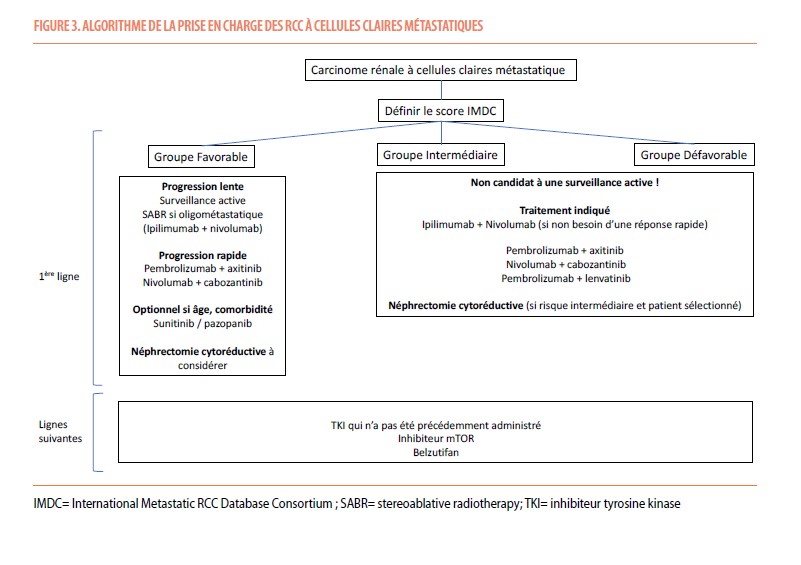
Sur base du design et des résultats des études précitées, les patients avec un risque IMDC Intermédiaire/défavorable peuvent recevoir I+N ou toute association ICI+TKI. Les patients présentant un risque IMDC favorable pourront recevoir une association pembrolizumab + axitinib ou nivolumab + cabozantinib. Cette situation doit être évidemment évaluée au cas par cas : I+N peut parfois être proposée à des patients de risque favorable à condition qu’il n’y ait pas besoin d’une réponse rapide. Le sunitinib seul peut également être proposé aux patients plus âgés de risque favorable, ayant une faible charge tumorale ou ceux ayant certaines comorbidités. L’association ICI+TKI sera privilégiée en cas de besoin d’une réponse rapide et de métastases menaçantes, rapidité de réponse induite par l’action des TKIs.
Les combinaisons ICI+ICI et ICI+TKI ont des profils de toxicité différents. L’I+N entrainera des effets indésirables immuno-médiés plus fréquents et un risque de recours aux corticostéroides plus important par rapport aux combinaisons ICI+TKI. L’I+N sera donc évité chez les patients avec maladie auto-immune, sous thérapie immunosuppressive ou avec des contre-indications aux corticostéroïdes. L’utilisation de TKI, de par l’effet antiangiogénique, est de préférence à éviter chez les patients avec maladies vasculaires non contrôlées (cardiopathie ischémique, accident vasculaire cérébral, maladie thromboembolique récente, hypertension non contrôlée), à risque de perforation ou d’hémorragie.
Le cabozantinib semble présenter une efficacité particulière dans les lésions secondaires osseuses et cérébrales, ce qui en fait un bon choix, en association avec le nivolumab, dans de ce type de métastase. Les métastases glandulaires sont souvent hautement angiogéniques, privilégiant donc soit un TKI monothérapie soit une association ICI+TKI. La composante sarcomatoïde prédit une sensibilité plus importante aux ICIs tout en étant résistants aux TKIs ; dans l’étude CHECKMATE-214 , l’I+N induisait chez les patients avec tumeur présentant une composante sarcomatoide un TRO de 61% dont un taux de RC impressionnant de 19% (9).
La place des traitements ciblés des métastases
La résection chirurgicale des métastases ou la radiothérapie fait partie de l’arsenal thérapeutique. En plus de l’action antalgique de la radiothérapie, la radiothérapie stéréotaxique (Stereoablative radiotherapy,SABR) peut retarder l’initiation d’un traitement systémique lorsque la maladie est oligo-métastatique (≤5 lésions), permettant ainsi un contrôle de la maladie avec une toxicité minimale (13). De plus, la SABR peut également retarder le changement de traitement systémique en cas d’une maladie oligo-progressive, où certaines lésions progressent malgré une thérapie systémique efficace (14). La chirurgie est préférée si une analyse histologique est nécessaire alors que la SABR sera préférée en cas de chirurgie compliquée (métastases osseuses et cérébrales) ou de métastases multiples. Si la SABR peut être combinée avec les ICIs, il est préférable d’arrêter temporairement les TKIs avant et durant la durée de la radiothérapie.
La place de la néphrectomie
La néphrectomie en situation métastatique (appelée alors néphrectomie cytoréductive, CN) a été historiquement associée à une augmentation de la survie à l’ère pré-TKI, probablement suite à une diminution de production de VEGF par la tumeur primitive elle-même (3). L’étude CARMENA a randomisé des patients atteints de ccRCC métastatique entre CN suivie de sunitinib ou sunitinib seul. Même si aucun bénéfice statistique en survie n’a été démontré avec la CN + sunitinib par rapport au sunitinib seul (13.9 vs 18.4 mois, respectivement), une analyse de sous-groupe a montré que les patients présentant un seul facteur IMDC et notamment ceux avec métastases pulmonaires pouvaient bénéficier de la séquence CN-sunitinib par rapport au sunitinib seul (SG médiane de 44 vs 31.5 mois, respectivement) (15). La CN reste donc envisageable pour certains patients sélectionnés. Elle sera également envisagée chez les patients symptomatiques de leur tumeur primitive ou pour les patients ayant obtenu une réponse quasi complète à un traitement systémique (16).
Quelle stratégie thérapeutique adopter après progression ?
En cas de progression malgré le traitement de première ligne, l’utilisation d’un TKI ciblant le VEGF est préconisée en deuxième ligne et le choix se portera sur un TKI qui n’a pas été administré auparavant. Dans l’étude CONTACT-03, le cabozantinib, administré après ICI + TKI, permettait un TRO de 41% et une SSP de 10.8 mois. Par contre, dans cette même étude, l’ajout d’un ICI au cabozantinib après échec d’un ICI, n’apportait aucun bénéfice (17).
Perspectives futures
- L’étude COSMIC-313 a évalué l’efficacité d’une trithérapie (cabozantinib, ipilimumab et nivolumab) par rapport à l’association I+N chez les patients à risque Intermédiaire/Défavorable. Même si ce triplet semble prometteur en terme de SSP et de TRO, il faudra mettre en balance l’efficacité immédiate, le bénéfice en SG et surtout la toxicité induite par trois agents puissants.
- Le belzutifan est une nouvelle molécule orale qui inhibe HIF, pierre angulaire du développement du ccRCC. Dans l’étude de phase III LITESPARK-005, le belzutifan s’est montré supérieur à l’évérolimus dans le ccRCC métastatique progressant après TKI et ICI, montrant un TRO de 22% (3% avec l’évérolimus) et une durée de réponse plus importante (19 vs 13 mois ; respectivement) ; le risque de progression et de décès était également diminué de 26%. Enfin, le belzutifan, de par sa bonne tolérance, était également associé à une meilleure qualité de vie par rapport à l’éverolimus (18). Le belzutifan est actuellement à l’étude en première ligne métastatique en association avec le Pembrolizumab et le Lenvatinib.
- Différentes études évaluent l’effet immunomodulateur de la SABR en combinaison avec un ICI, la radiothérapie pouvant potentialiser l’efficacité de l’immunothérapie. L’étude RADVAX associe I+P et SABR sur 1-2 sites métastatiques alors que l’étude CYTOSHRINK associe I+N et SABR sur la lésion primitive. - - Récemment, nous avons publié l’utilité du PET PSMA, une nouvelle imagerie métabolique, dans l’évaluation précoce (à seulement 6 semaines) de la réponse au traitement. Ceci permettra d’identifier rapidement les patients répondeurs ou non répondeurs afin d’adapter notre stratégie(19).
Conclusion
Différentes associations thérapeutiques sont disponibles pour le traitement du ccRCC métastatique. Une sélection rigoureuse des patients reste essentielle pour proposer la stratégie thérapeutique la plus adaptée. Il est également crucial d’encourager la participation aux essais cliniques, car ceux-ci pourraient offrir des molécules novatrices qui deviendront les traitements de référence de demain.
Recommandations pratiques
- La discussion en concertation multidisciplinaire en centre d’expertise reste la règle
- Sélectionner correctement les patients au départ permet d’offrir le traitement optimal afin d’assurer une efficacité la plus longue possible.
- La participation aux études cliniques est primordiale
Références
- Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022. CA Cancer J Clin. 2022 Jan 12;72(1):7–33.
- Hora M, Albiges L, Bedke J, Campi R, Capitanio U, Giles RH, et al. European Association of Urology Guidelines Panel on Renal Cell Carcinoma Update on the New World Health Organization Classification of Kidney Tumours 2022: The Urologist’s Point of View. Eur Urol. 2023 Feb;83(2):97–100.
- Hu J, Tan P, Ishihara M, Bayley NA, Schokrpur S, Reynoso JG, et al. Tumor heterogeneity in VHL drives metastasis in clear cell renal cell carcinoma. Signal Transduct Target Ther. 2023 Apr 17;8(1):155.
- Schiavoni V, Campagna R, Pozzi V, Cecati M, Milanese G, Sartini D, et al. Recent Advances in the Management of Clear Cell Renal Cell Carcinoma: Novel Biomarkers and Targeted Therapies. Cancers (Basel). 2023 Jun 16;15(12):3207.
- Sellner F, Thalhammer S, Klimpfinger M. Isolated Pancreatic Metastases of Renal Cell Carcinoma—Clinical Particularities and Seed and Soil Hypothesis. Cancers (Basel). 2023 Jan 4;15(2):339.
- Rini BI, Dorff TB, Elson P, Rodriguez CS, Shepard D, Wood L, et al. Active surveillance in metastatic renal-cell carcinoma: a prospective, phase 2 trial. Lancet Oncol. 2016 Sep;17(9):1317–24.
- Motzer RJ, Escudier B, McDermott DF, George S, Hammers HJ, Srinivas S, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med [Internet]. 2015/09/26. 2015;373(19):1803–13. Available from: https://www.ncbi.nlm.nih.gov/pubmed/26406148
- Motzer RJ, Escudier B, McDermott DF, George S, Hammers HJ, Srinivas S, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015 Nov 5;373(19):1803–13.
- Motzer RJ, Tannir NM, McDermott DF, Aren Frontera O, Melichar B, Choueiri TK, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med [Internet]. 2018/03/22. 2018;378(14):1277–90. Available from: https://www.ncbi.nlm.nih.gov/pubmed/29562145
- Rini BI, Plimack ER, Stus V, Gafanov R, Hawkins R, Nosov D, et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med [Internet]. 2019/02/20. 2019;380(12):1116–27. Available from: https://www.ncbi.nlm.nih.gov/pubmed/30779529
- Motzer R, Alekseev B, Rha SY, Porta C, Eto M, Powles T, et al. Lenvatinib plus Pembrolizumab or Everolimus for Advanced Renal Cell Carcinoma. N Engl J Med [Internet]. 2021/02/23. 2021;384(14):1289–300. Available from: https://www.ncbi.nlm.nih.gov/pubmed/33616314
- Choueiri TK, Powles T, Burotto M, Escudier B, Bourlon MT, Zurawski B, et al. Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med [Internet]. 2021/03/04. 2021;384(9):829–41. Available from: https://www.ncbi.nlm.nih.gov/pubmed/33657295
- Tang C, Msaouel P, Hara K, Choi H, Le V, Shah AY, et al. Definitive radiotherapy in lieu of systemic therapy for oligometastatic renal cell carcinoma: a single-arm, single-centre, feasibility, phase 2 trial. Lancet Oncol. 2021 Dec;22(12):1732–9.
- Cheung P, Patel S, North SA, Sahgal A, Chu W, Soliman H, et al. Stereotactic Radiotherapy for Oligoprogression in Metastatic Renal Cell Cancer Patients Receiving Tyrosine Kinase Inhibitor Therapy: A Phase 2 Prospective Multicenter Study. Eur Urol. 2021 Dec;80(6):693–700.
- Méjean A, Ravaud A, Thezenas S, Chevreau C, Bensalah K, Geoffrois L, et al. Sunitinib Alone or After Nephrectomy for Patients with Metastatic Renal Cell Carcinoma: Is There Still a Role for Cytoreductive Nephrectomy? Eur Urol. 2021 Oct;80(4):417–24.
- Bex A, Mulders P, Jewett M, Wagstaff J, van Thienen J V., Blank CU, et al. Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients With Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib. JAMA Oncol. 2019 Feb 1;5(2):164.
- Pal SK, Albiges L, Tomczak P, Suárez C, Voss MH, de Velasco G, et al. Atezolizumab plus cabozantinib versus cabozantinib monotherapy for patients with renal cell carcinoma after progression with previous immune checkpoint inhibitor treatment (CONTACT-03): a multicentre, randomised, open-label, phase 3 trial. Lancet. 2023 Jul;402(10397):185–95.
- Albiges L, Rini BI, Peltola K, De Velasco Oria GA, Burotto M, Suarez Rodriguez C, et al. LBA88 Belzutifan versus everolimus in participants (pts) with previously treated advanced clear cell renal cell carcinoma (ccRCC): Randomized open-label phase III LITESPARK-005 study. Ann Oncol. 2023 Oct;34:S1329–30.
- Seront E, Reichel C, Lhommel R, Tombal B. A Case Series Study of the Role of Prostate-specific Membrane Antigen Positron Emission Tomography/Computed Tomography in Early Evaluation of the Response to Systemic Therapy in Metastatic Renal Cancer. Eur Urol Oncol. 2024 Mar.
Conflit d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêt.
Affiliations
1. Institut Roi Albert II, Département d’oncologie médicale, Cliniques universitaires Saint-Luc, Bruxelles
2. Grand Hôpital de Charleroi, Département d’oncologie, Charleroi
3. Institut Roi Albert II, Département d’urologie, Cliniques universitaires Saint-Luc, Bruxelles
Correspondance
Pr Emmanuel Seront MD PhD
Institut Roi Albert II
Département d’oncologie médicale
Cliniques universitaires Saint-Luc
Avenue Hippocrate 10, B-1200 Bruxelles
emmanuel.seront@saintluc.uclouvain.be