Du bon usage des corticoïdes en Dermatologie clinique
D. Maiter
Les corticoïdes sont un traitement couramment utilisé en dermatologie, parfois pour des traitements au long cours. L’éclairage de l’endocrinologue sur leur bon usage n’est donc pas superflu. La figure 1, tirée de l’exposé du professeur Maiter, rappelle les mécanismes de suppression de l’axe corticotrope par les glucocorticoïdes de synthèse. L’apport externe en glucocorticoïdes provoque un déficit chronique en ACTH responsable de l’atrophie du cortex surrénalien.
Figure 1

Fréquence et facteurs qui conditionnent l’efficacité et la toxicité des glucocorticoïdes (GC)
Dans la population générale, 1% des patients est traité par glucocorticoïdes. Les indications de traitement par voie systémique sont nombreuses, et souvent justifiées, malgré les effets indésirables connus.
Les facteurs influençant l’efficacité et la toxicité des GC sont les propriétés pharmacologiques, la dose et la durée d’utilisation, la voie d’administration, le moment et le rythme de l’administration, ainsi que des facteurs individuels comme la capacité de métabolisation des stéroïdes au niveau hépatique.
L’efficacité mais aussi la toxicité des GC sont influencées par leur activité anti-inflammatoire relative (par rapport au cortisol), leur activité minéralo-corticoïde relative et leur demi-vie pharmacologique, mais surtout biologique. Le tableau 1, présenté par le professeur Maiter, compare ces propriétés pour les principaux glucocorticoïdes utilisés en clinique.

L’utilisation de fortes doses de corticoïdes pour une période limitée (quelques jours) n’occasionne pas ou peu d’effets secondaires. Au-delà de 4 semaines d’utilisation, il existe un risque de complications et de suppression de l’axe corticotrope, variable en fonction des autres facteurs. L’utilisation de méthylprednisolone à une dose supérieure ou égale à 16mg/jour pendant 6 semaines entraine de manière quasi systématique une insuffisance cortico-surrénalienne, plus ou moins rapidement réversible. Les risques sont donc proportionnels à la dose, mais surtout à la durée de traitement.
Les voies d’administration orale, rectale, intramusculaire et intraveineuse ont une absorption comparable. L’administration locale est préférable en terme d’effets indésirables, mais il ne faut pas perdre de vue que les infiltrations intra articulaires, péri-articulaires ou péridurales sont quand même absorbées par voie systémique, souvent de manière lente et prolongée, donc des effets secondaires sont également possibles. Les GC inhalés sont également résorbés partiellement et leur utilisation doit être limitée dans le temps.
Le moment de l’administration importe. Physiologiquement, le taux de corticoïdes est plus élevé le matin. Une administration de GC le soir a donc un pouvoir d’inhibition de l’axe corticotrope plus important. Notons aussi que l’administration du traitement un jour sur deux, qui a parfois été prônée, apporte moins d’effets indésirables, mais présente une efficacité également moins importante.
Enfin, les facteurs individuels conditionnent, de manière prévisible ou non, la réponse aux glucocorticoïdes et leur toxicité. La métabolisation du médicament diffère d’un patient à l’autre, et on distingue les métaboliseurs lents des métaboliseurs rapides. Par ailleurs, l’âge (jeune ou avancé), la dénutrition, l’insuffisance rénale ou hépatique, les maladies sous-jacentes, la prise de médicaments interférant avec le métabolisme des stéroïdes (inhibiteurs CYP3A4, quinolones, pilule contraceptive, immunosuppresseurs…) influent sur ce métabolisme et modifient donc la propension à présenter des effets secondaires, mais aussi la réponse thérapeutique.
L’analyse de l’ensemble de ces facteurs invite à proposer des règles de bonne pratique pour la prescription des traitements par GC :
- n’instaurer un traitement par GC que s’il existe suffisamment d’évidences de bénéfices objectifs dans cette indication;
- sauf urgence, toujours préférer un éventuel traitement alternatif surtout s’il est plus spécifique (anti-histaminique,…);
- administrer le corticoïde à doses suffisantes et pendant une durée suffisante que pour pouvoir évaluer son efficacité;
- évaluer cette efficacité par des critères objectifs, mesurables et reproductibles;
- administrer le corticoïde à la plus faible dose possible qui maintient cette efficacité;
- ne pas prolonger le traitement au-delà de la durée qui est nécessaire pour obtenir la réponse souhaitée;
- arrêter le traitement si aucun bénéfice objectif n’est observé, si des effets secondaires sérieux surviennent ou si un bénéfice maximal a été atteint;
- Traiter les affections associées qui augmentent le risque de toxicité des GC et instaurer les mesures de prévention efficaces.
Effets secondaires: le syndrome de Cushing iatrogène
Le tableau 2 reprend les principaux symptômes du syndrome de Cushing. Il souligne également les symptômes additionnels, observés presque exclusivement dans le syndrome de Cushing iatrogène.
Effets secondaires: la suppression de l’axe corticotrope (axe HPA)
La suppression chronique de la sécrétion d’ACTH entraîne une atrophie durable du cortex surrénalien et donc une insuffisance surrénalienne prolongée à l’arrêt du GC responsable. Elle est présente chez 50% des patients traités par GC pour une maladie inflammatoire systémique.
Cette suppression est inexistante si la dose de méthylprednisolone administrée est inférieure à 8mg/jour, ou si la durée du traitement est inférieure à 3 semaines. Elle est certaine si la dose de méthylprednisolone est d’au moins 16 mg/jour pendant plus de 8 semaines ou de 4 mg/jour le soir pendant plusieurs mois. Elle l’est également si l’on constate un syndrome de Cushing clinique. Dans les situations intermédiaires (dose de 4 à 8 mg/jour pendant quelques mois, durée du traitement de 3 à 6 semaines, prise prolongée d’un traitement local à fortes doses, …) la suppression de l’axe corticotrope est possible et doit donc être recherchée.
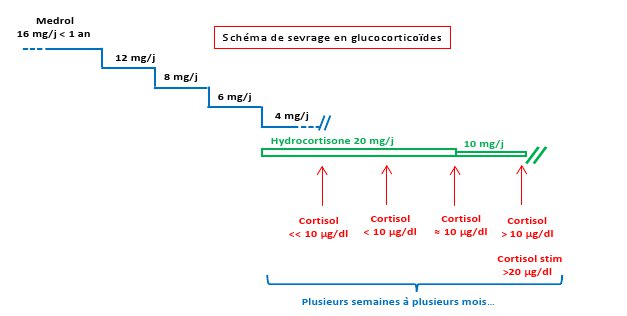
Elle se teste avant l’arrêt complet du corticoïde, lorsque la dose minimale avant l’arrêt a été atteinte, par un dosage du cortisol matinal, 24 heures après la dernière prise. Au-delà de 10 µg/dl, l’axe corticotrope peut être considéré comme normal. En-dessous de 10 µg/dl, il existe souvent une insuffisance corticotrope, et il est indiqué de réaliser un test au Synacthen® (ACTH). Une injection intraveineuse de 250 mg de Synacthen® doit provoquer une augmentation du cortisol supérieure à 540 nmol/L (20 µg/dl) après 1 heure. Le tableau 3, également issu de l’exposé du professeur Maiter, précise l’attitude à adopter dans les différents cas de figue possibles.
Comment arrêter un traitement et éviter l’insuffisance surrénalienne ?
Deux situations imposent l’arrêt en urgence du traitement par GC : l’ulcère herpétique de la cornée et la psychose aiguë ne répondant pas au traitement.
Un arrêt brusque est possible en cas de traitement inférieur à 3-4 semaines ou de traitement alterné (Méthylprednisolone 8 mg/jour, 1 jour/2).
Dans tous les autres cas, un arrêt progressif est à préférer, lorsque l’effet thérapeutique maximal a été obtenu, que l’on ne constate pas d’évidence d’efficacité, ou que des effets secondaires intolérables sont mis en évidence. Le professeur Maiter propose, dans la figure 2, un schéma de sevrage en glucocorticoïdes.
Figure 2
Comment prévenir les complications éventuelles des traitements par glucocorticoïdes?
Il est important de conseiller à nos patients une activité physique régulière et une alimentation iso ou hypocalorique enrichie en protéines et pauvre en sel. Il est utile de prescrire des suppléments de calcium et de vitamine D, ainsi que des oestroprogestatifs chez la femme ménopausée et des bisphosphonates en cas d’ostéoporose. Le traitement par inhibiteurs de la pompe à protons ne se justifie qu’en cas de traitement concomitant par AINS ou AAS ou chez les patients à risque d’ulcère gastrique.
Attention également aux interactions médicamenteuses, notamment aux médicaments qui stimulent ou inhibent l’enzyme CYP3A4 (anticoagulants, diurétiques, quinolones, AINS,…)
Pied diabétique : prise en charge
B. Vandeleene
Le pied diabétique (Figure 3) est une complication classique du diabète de type 2. Il nécessite un suivi multidisciplinaire. Il existe une relation directe entre l’équilibre glycémique et le risque de complications. Les autres complications fréquentes du diabète de type 2 sont la rétinopathie, la néphropathie et l’accident vascu-laire cérébral (AVC) et les événements cardiovasculaires.
La classification WAGNER (tableau 4) ainsi que la classification PEDIS (tableau 5), introduite lors de la conférence de consensus internationale sur le pied diabétique de 2003, représentent un support utile au diagnostic et à la prise en charge du pied diabétique.

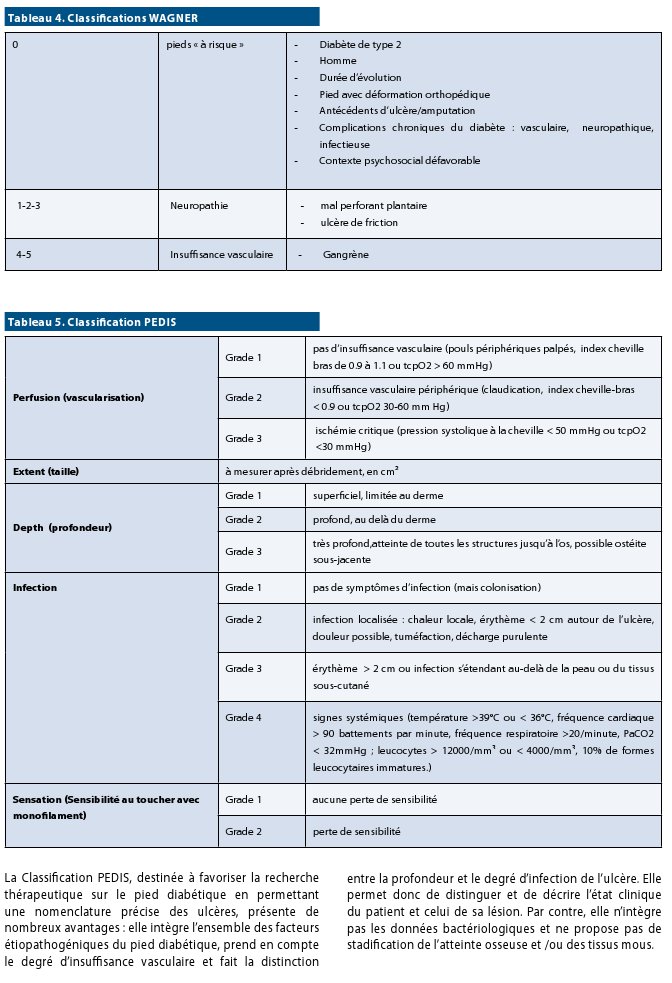
La Classification PEDIS, destinée à favoriser la recherche thérapeutique sur le pied diabétique en permettant une nomenclature précise des ulcères, présente de nombreux avantages : elle intègre l’ensemble des facteurs étiopathogéniques du pied diabétique, prend en compte le degré d’insuffisance vasculaire et fait la distinction entre la profondeur et le degré d’infection de l’ulcère. Elle permet donc de distinguer et de décrire l’état clinique du patient et celui de sa lésion. Par contre, elle n’intègre pas les données bactériologiques et ne propose pas de stadification de l’atteinte osseuse et /ou des tissus mous.
Quand faut-il hospitaliser un patient souffrant d’un pied diabétique ?
Il s’agit d’une question parfois difficile à trancher. Quelques règles claires et simples orientent néanmoins la décision :
- les malades présentant des signes infectieux locaux et/ou généraux, plaie profonde avec un contact osseux, une ischémie critique ou une nécrose (P3), une complication métabolique, ou dont la prise en charge ambulatoire est compromise par le statut psychosocial, nécessitent une hospitalisation en urgence ;
- en l’absence de ces critères, les signes infectieux locaux persistants sous traitement, une plaie profonde sans contact osseux ou une ischémie non critique feront discuter une hospitalisation programmé ;
- Tout traitement en ambulatoire nécessitera un contrôle clinique à 72 heures de traitement.
Le contact osseux (élément clef à rechercher cliniquement dans toute prise en charge de pied diabétique) nécessitera une mise au point par imagerie à la recherche d’une ostéite : radiologies, CT-scan ou résonance magnétique ciblés. En cas d’ostéite sous-jacente, un prélèvement bactériologique en l’absence de prise d’antibiotique est nécessaire afin de proposer une antibiothérapie ciblée.
Le choix de l’antibiothérapie en cas d’infection des tissus mous en l’absence d’ostéite sous-jacente, (à partir du stade PEDIS I2) privilégiera la prise per os d’amoxicilline et acide clavulanique, ou d’une bi-antibiothérapie par ciprofloxacine et clindamycine.
La prise en charge du pied diabétique constitue donc un carrefour des complications du diabète, entre dépistage et traitement médicochirurgical, entre première ligne et centres spécialisés et/ou entre les différents métiers et spécialités concernés.
Endocrinologie et peau
M. Baeck
Le diabète retentit sur l’état cutané à différents niveaux : il provoque un épaississement du derme en diminuant la dégradation des fibres de collagène, et diminue la résistance cutanée par diminution des fibres élastiques et d’ancrage.
En outre, le diabète est responsable de diverses pathologies cutanées, tandis qu’il en aggrave certaines et augmente la fréquence d’autres.
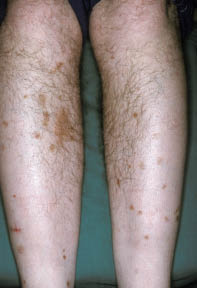
Dermopathie diabétique (Figure 4)
Non spécifique et très fréquente, elle est constituée de macules érythémateuses évoluant vers des lésions atrophiques et pigmentées, localisées à la face antérieure des jambes. Elles seraient favorisées par les infections et les traumatismes (même minimes), et caractérisées à l’histologie par une microangiopathie.
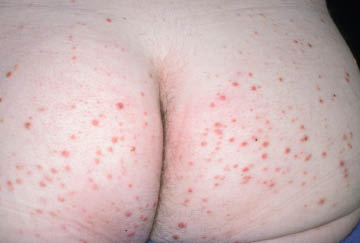
Nécrobiose lipoïdique (Figure 5)
Associée au diabète dans 80 à 90 % des cas, elle se présente sous forme de lésions sclérodermiformes atrophiantes prétibiales, bordées par un anneau érythémateux actif, qui correspondent à une granulomatose cutanée et peuvent se compliquer d’ulcérations. Le traitement du diabète n’a pas d’effet sur l’évolution des lésions. La nécrobiose est plus fréquente chez la femme, et touche 0.3 à 2 % des diabétiques. On peut proposer à ces patients un traitement par corticoïdes locaux sous occlusion ou en injections intralésionelles, un traitement par immunomodulateurs topiques, ou encore par corticoïdes systémiques.

Bullose diabétique (Figure 6)
Il s’agit d’une pathologie bulleuse rare, survenant exclusivement chez le diabétique, d’étiologie inconnue. Elle se caractérise par des bulles tendues sur peau saine d’apparition spontanée, et se traite par des soins locaux symptomatiques. Le rôle des traumatismes et de la neuropathie sous-jacente est débattu.

(Pseudo-)acanthosis nigricans (Figure 7)
Il se présente sous forme de plaques pigmentées, grisâtres, avec un aspect velouté des plis (surtout axillaires). Cette forme bénigne acquise est à distinguer de l’acanthosis nigricans paranéoplasique. Elle accompagne l’hyperinsulinisme chronique et l’obésité. Elle est due à la fixation de l’insuline excédentaire sur des récepteurs de croissance situés sur les kératinocytes et les fibroblastes.

Les infections cutanées
Un diabète mal contrôlé entraine des troubles de la microcirculation et un déficit fonctionnel des polymorphonucléaires neutrophiles. Les mycoses, en particulier, sont très fréquentes chez les patients diabétiques et nécessitent un traitement énergique afin d’éviter de servir de porte d’entrée à une infection bactérienne (érysipèle surtout).
Xanthomes éruptif (Figure 8)
Les xanthomes sont des petites lésions nodulaires jaunes à brunâtres, situées principalement sur les fesses ou les cuisses, mais qui peuvent se disséminer à l’ensemble du corps. Chez les patients diabétiques et dans les formes éruptives, ils sont d’apparition brutale, secondaire à une hypertriglycéridémie majeure dans le cadre d’une acidocétose diabétique.
Vitiligo
Il est plus fréquemment observé chez les patients porteurs d’un diabète de type 1.
Psoriasis
Le psoriasis est significativement associé au syndrome métabolique qui accompagne le diabète de type 2. La prévalence du diabète de type 2 dans la population générale est de 5 à 6 %, et elle grimpe jusque 13 à 20 % parmi les patients atteints de psoriasis. On a récemment constaté que les analogues du GLP-1 (GLP-1rA, Glucagon-like peptide receptor agonists ou incrétines) sont efficaces dans le traitement du psorisasis, mais le mécanisme de l’action anti-inflammatoire des GLP-1rA reste encore incompris.
Insuline et allergies
L’allergie à l’insuline, qui concernait 50% des patients dans les années 1950, est devenue exceptionnelle depuis l’utilisation d’insuline humaine hautement purifiée. Elle touche actuellement moins de 1% des patients traités par insuline. Elle peut être due à une allergie à l’insuline elle-même, ou à l’un des excipients, ou encore au matériel utilisé pour l’injection (antiseptique).