Dermatite atopique : quoi de neuf en 2021 ?
Axel De Greef, Alexia Degraeuwe, Marie Baeck
La dermatite atopique (DA) est une maladie inflammatoire cutanée chronique qui touche 25% des enfants et 2-8% des adultes dans les pays industrialisés (1). Cette affection est également responsable d’un large spectre de comorbidités et d’un impact négatif sur la qualité de vie des patients. Depuis quelques années, la DA connait une nouvel essor avec une meilleure compréhension de son étiopathogénie et en particulier des mécanismes immunologiques impliqués, la mise en évidence et reconnaissance de comorbidités systémiques associées et l’arrivée des traitements biologiques dans l’arsenal thérapeutique.
En 2021, les principales nouveautés sont :
1. Au niveau de la physiopathologie de la DA, des études récentes suggèrent (2) :
- le rôle clé du TSLP (Thymic Stromal Lymphopoietin), de l’interleukine (IL)-25 et de l’IL-33 dans la déviation immunitaire de type 2 ;
- le rôle des cytokines Th2 dans la perturbation du métabolisme lipidique des membranes cellulaires de l’épiderme ;
- l’hyper-innervation de l’épiderme et l’augmentation du nombre de médiateurs pruritogènes dans la peau des patients atopiques, notamment l’IL-4, l’IL-13 et la périostine.
2. La DA n’est plus considérée comme une affection purement cutanée. Un nombre croissant d’études mettent en évidence une association avec des comorbidités non-atopiques, telles que l’anxiété, les troubles du sommeil, la dépression et le suicide, les infections, les maladies cardiovasculaires et auto-immunes (3,4). Cette dimension systémique est importante à considérer dans la prise en charge globale de ces patients.
3. Le tralokinumab (Adtralza ®), anti-IL-13 qui lie l’interleukine-13 soluble, a reçu l’approbation de l’EMA (European Medicines Agency) au mois de juin 2021 (5). Il est indiqué dans le traitement de la dermatite atopique modérée à sévère de l’adulte qui nécessite un traitement systémique et rejoint le dupilumab (Dupixent®), inhibiteur de l’IL4 et IL-13, seule biothérapie actuellement remboursée en Belgique dans la DA. Les études de phase III montrent qu’une excellente efficacité avec 25% à 33% des patients sous tralokinumab qui présente une réduction de 75% de leur EASI (score clinique évaluant l’extension et l’intensité des lésions d’eczéma) après 16 semaines de traitement lorsqu’il est pris seul, voire jusque 56% des patients en association avec les dermocorticoïdes (6,7). Son profil de sécurité est également remarquable, l’initiation du traitement ne requérant pas de bilan spécifique notamment infectieux.
4. Les inhibiteurs de Janus-kinase (JAK) contribue également à la révolution thérapeutique de la prise en charge de la DA. En effet, plusieurs molécules comme le baricitinib, l’upadacitinib ou l’abrocitinib sont maintenant autorisés par l’EMA dans le traitement de la DA modérée à sévère. Ils présentent l’avantage d’une prise orale et leur efficacité semble inédite. Le baricitinib (Olumniant®) (inhibiteur de JAK 1 et 2) permet une amélioration significative de l’atteinte cutanée et du prurit après 16 semaines, qui se maintient après 68 semaines de traitement (8). Deux inhibiteurs spécifiques de JAK 1, l’upadacitinib (Rinvoq®) et l’abrocitinib (Cibinqo®), ont montré leur efficacité dans des études de phase III, efficacité qui semble même supérieure aux anti-IL-4/IL-13 (9,10). Parmi leurs effets secondaires potentiels de ces inhibiteurs de JAK ou « small molecules », notons entres autres le risque infectieux, des troubles lipidiques, une élévation des CK et des accidents thrombo-emboliques. Leur profil de sécurité au niveau oncologique doit également encore être précisé.
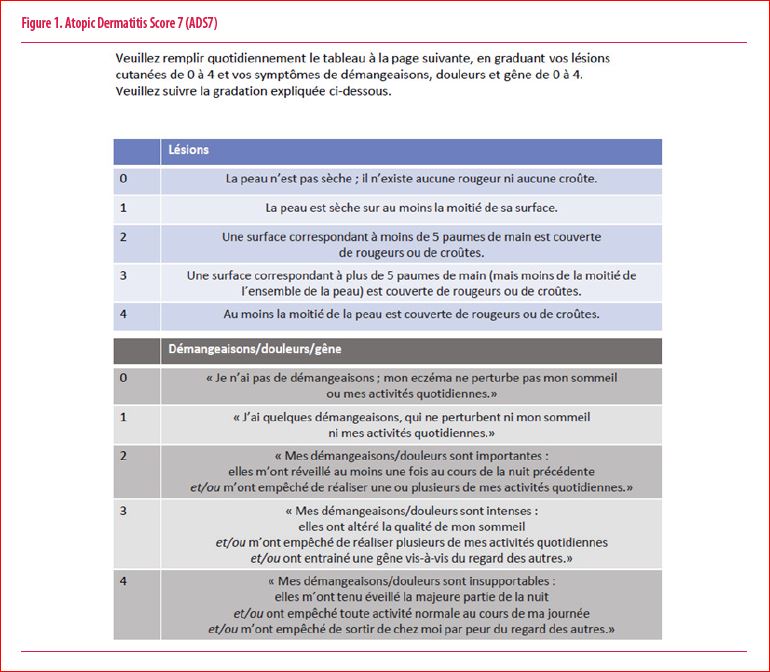
5. Face à toutes ces nouvelles thérapies, une évaluation précise de la sévérité clinique de la maladie et de son impact pour le patient est fondamentale. De nombreux scores cliniques sont disponibles tels que l’EASI, SCORAD pour l’évaluation des symptômes objectifs de la DA et le Prurit-NRS et DLQI pour les symptômes subjectifs. Toutefois, ces scores sont extrêmement « time consuming », évaluent les symptômes objectifs ou subjectifs mais rarement les deux simultanément, et ne reflètent l’état du patient qu’au moment de la consultation. Hors, il est bien connu que la DA est une pathologie dont l’évolution est faite de poussées et rémissions imprévisibles. Notre service de Dermatologie a mis au point un nouveau score clinique de la DA : le Atopic Dermatitis Score 7 (ADS7) (figure 1) (11). Ce score évalue l’extension quotidienne de l’eczéma ainsi que le fardeau de la maladie. Il est extrêmement simple d’utilisation et rempli par le patient lui-même. En comparaison avec les scores existants, ce score semble permettre une meilleure évaluation de l’activité de la maladie entre deux consultations et donc une prise en charge plus adaptée. Une étude est actuellement en cours pour valider ce score sur une large cohorte multicentrique.
Références
- Nutten S. Atopic dermatitis: global epidemiology and risk factors. Ann Nutr Metab. 2015;66 Suppl 1:8-16.
- Nakahara T, Kido-Nakahara M, Tsuji G, Furue M. Basics and recent advances in the pathophysiology of atopic dermatitis. J Dermatol. 2021;48(2):130-139.
- Ben Abdallah H, Vestergaard C. Atopic dermatitis, hypertension and cardiovascular disease. Br J Dermatol. 2021;10.1111/bjd.20802.
- Helmert C, Haufe E, Heinrich L, et al. Atopic dermatitis and depressive symptoms. Results of the German national AD Registry TREATgermany. J Eur Acad Dermatol Venereol. 2021;10.1111/jdv.17812.
- Adtralza | European Medicines Agency [Internet]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/adtralza
- Wollenberg A, Blauvelt A, Guttman-Yassky E, et al. Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol. 2021;184(3):437-449.
- Silverberg JI, Toth D, Bieber T, et al. Tralokinumab plus topical corticosteroids for the treatment of moderate-to-severe atopic dermatitis: results from the double-blind, randomized, multicentre, placebo-controlled phase III ECZTRA 3 trial. Br J Dermatol. 2021;184(3):450-463.
- Silverberg JI, Simpson EL, Wollenberg A, et al. Long-term Efficacy of Baricitinib in Adults With Moderate to Severe Atopic Dermatitis Who Were Treatment Responders or Partial Responders: An Extension Study of 2 Randomized Clinical Trials. JAMA Dermatol. 2021;157(6):691-699.
- Blauvelt A, Teixeira HD, Simpson EL, et al. Efficacy and Safety of Upadacitinib vs Dupilumab in Adults With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial [published correction appears in JAMA Dermatol. 2021 Dec 15;:]. JAMA Dermatol. 2021;157(9):1047-1055.
- Bieber T, Simpson EL, Silverberg JI, et al. Abrocitinib versus Placebo or Dupilumab for Atopic Dermatitis. N Engl J Med. 2021;384(12):1101-1112.
- Darrigade AS, Colmant C, de Montjoye L, et al. Atopic Dermatitis Score 7 (ADS7): A promising tool for daily clinical assessment of atopic dermatitis. Allergy. 2020;75(5):1264-1266.
Recommandations internationales 2021 pour les patients atteints d’urticaire chronique
Laurence de Montjoye
L’urticaire chronique est une maladie inflammatoire qui touche la peau, provoquant des plaques érythémateuses infiltrées, labiles et prurigineuses et/ou des angio-œdèmes. On parle d’urticaire chronique lorsque les symptômes durent depuis plus de six semaines. Au sein des urticaires chroniques, on distingue d’une part les urticaires chroniques inductibles lorsque les symptômes sont uniquement provoqués par des facteurs tels que le soleil, le froid ou la pression, et d’autre part les urticaires chroniques spontanées (UCS) où les symptômes apparaissent sans facteurs déclenchants. Il reste encore de nombreuses inconnues sur les mécanismes physiopathologiques en cause dans l’UCS. Les mastocytes sont des cellules clés mais d’autres cellules sont également impliquées tels que les basophiles, les éosinophiles, les neutrophiles et les lymphocytes (1). La participation de mécanismes autoimmuns et plus particulièrement d’autoanticorps semble être prédominante chez une certaine proportion de patients atteints d’UCS (2).
En 2021, de nouvelles recommandations internationales ont été éditées sur la définition/classification et prise en charge de l’urticaire chronique (3). Plusieurs changements ont été introduits par rapport au dernières recommandations de 2014 (4).
D’un point de vue physiopathologique, deux sous-types d’UCS ont été définis. D’une part, les patients avec des autoanticorps de type IgE dirigés contre des peptides du soi qu’on classe en UCS avec autoimmunité de Type I (ou CSU « autoallergique ») et d’autre part, les patients avec des autoanticorps de type IgG activant directement les mastocytes, qu’on classe en UCS autoimmune de Type IIb.
Le diagnostic de l’urticaire chronique est essentiellement clinique. Pour les urticaires inductibles, des tests de provocations sont indiqués. Pour les UCS, le diagnostic est posé cliniquement et un bilan biologique très sommaire est indiqué comprenant un dosage de la CRP et une formule sanguine. Des examens plus étendus sont uniquement indiqués si des arguments cliniques et biologiques orientent vers un autre diagnostic telles qu’une maladie autoinflammatoire ou une vasculite urticarienne.
Dans les nouvelles recommandations, ont été ajoutés, pour les centres de référence, un dosage des IgE totaux et des IgG anti-TPO. Ces deux analyses sont utiles pour classer les patients en UCS avec autoimmunité de Type I ou de Type IIb.
En routine, nous avons à notre disposition différents scores de type PROM (« Patient-reported outcome measures) pour évaluer l’activité de la maladie, l’impact sur la qualité de vie et également le contrôle de la maladie.
En 2021, il est recommandé de se baser sur le score de contrôle de la maladie (score UCT) pour évaluer la réponse au traitement.
Concernant le traitement, le premier palier sont les antihistaminiques de seconde génération, à majorer à 4x le dose si nécessaire. Le deuxième palier est l’ajout d’omalizumab, un anticorps monoclonal dirigé contre les IgE, à majorer si nécessaire (jusqu’à 600mg/2 semaines au maximum) et le troisième palier est l’ajout de ciclosporine aux antihistaminiques.
L’association de différentes molécules d’antihistaminiques et le majoration d’antihistaminiques à plus de 4x la dose ne sont pas recommandés.
Les corticoïdes systémiques sont à proscrire au long court dans l’urticaire chronique.
Des nouveaux traitements prometteurs sont encore à l’étude tels que les inhibiteurs de tyrosine kinase de Bruton ou le dupilumab (module les effets de l’IL-4/IL-13).
Références
- Giménez-Arnau AM, de Montjoye L, Asero R, et al. The Pathogenesis of Chronic Spontaneous Urticaria: The Role of Infiltrating Cells. J Allergy Clin Immunol Pract. 2021;9:2195-2208.
- Kolkhir P, Church MK, Weller K, Metz M, Schmetzer O, Maurer M. Autoimmune chronic spontaneous urticaria: What we know and what we do not know. J Allergy Clin Immunol. 2017;139:1772-1781.e1771.
- Zuberbier T, Abdul Latiff AH, Abuzakouk M, et al. The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2021.
- Zuberbier T, Aberer W, Asero R, et al. The EAACI/GA(2) LEN/EDF/WAO Guideline for the definition, classification, diagnosis, and management of urticaria: the 2013 revision and update. Allergy. 2014;69:868-887.
La pelade : un espoir thérapeutique ?
Marie Baeck
La pelade est une pathologie dermatologique auto-immune caractérisée par une perte brutale de cheveux ou de poils. Elle fait partie des alopécies acquises non cicatricielles c’est-à-dire qu’elle possède un caractère réversible. Sa prévalence est d’environ 2% dans la population générale (1,2).
Il existe différentes formes de pelade avec des degrés de sévérité variables : la pelade en plaque ou alopecia areata (AA), la pelade décalvante totale (perte de cheveux sur l’entièreté du cuir chevelu mais pas sur le reste du corps) et la pelade universelle (perte de tous les cheveux et poils sur l’entièreté du corps). C’est une maladie imprévisible. Les repousses spontanées sont courantes, néanmoins, une grande majorité des patients subiront plusieurs épisodes de chutes de cheveux au cours de leur vie.
Les facteurs de mauvais pronostics sont les présentations totale et universelle, une atteinte occipitale, un développement à un âge précoce, une évolution de plusieurs années, une association à d’autres affections immunologiques, et une histoire familiale (3). Cette pathologie est régulièrement associée à des comorbidités comme d’autres pathologies auto-immunes (thyroïdites, vitiligo) ou encore à la dermatite atopique (DA). De plus, elle a des conséquences psychologiques et sociales fréquentes et non négligeables (2).
Parmi les traitements proposés, les plus utilisés sont les corticoïdes en topique, en intra-lésionnel ou en systémique, le minoxidil en solution de 2 ou de 5 %, l’immunothérapie locale et les immunomodulateurs systémiques tels que le méthotrexate ou la cyclosporine. Cependant, la réponse à ces traitements est extrêmement variable en fonction des individus et décevante dans la plupart des cas avec un risque élevé de rechute à l’arrêt du traitement.
Un espoir est cependant permis avec la mise en évidence de l’efficacité des inhibiteurs de Janus Kinase (JAK) (4-7). Plusieurs inhibiteurs de JAK sont étudiés dans cette maladie notamment le tofacitinib, le ruxolitinib, et le baricitinib, mais aucun ne bénéficie encore d’une AMM dans le traitement de la pelade. Cependant, ils laissent présager de bons résultats avec un taux élevé de repousse. Plusieurs éléments restent à préciser, notamment, le profil de sécurité de ces molécules, la durée du traitement avec prise en compte du risque des rechutes à l’arrêt.
D’autre part, le dupilumab, traitement ayant l’AMM dans la DA, a montré des résultats positifs dans la prise en charge de la pelade en particulier chez les patients de sexe féminin et en cas d’atopie associée (8,9). Il nécessite toutefois un temps prolongé avant de générer une amélioration mais présente un excellent profil de tolérance et de sécurité.
Références
- Pourang A, Mesinkovska NA. New and Emerging Therapies for Alopecia Areata. Drugs. 2020 May;80(7):635-646.
- Pratt CH, King LE Jr, Messenger AG, Christiano AM, Sundberg JP. Alopecia areata. Nat Rev Dis Primers. 2017 Mar 16;3:17011.
- Sterkens A, Lambert J, Bervoets A. Alopecia areata: a review on diagnosis, immunological etiopathogenesis and treatment options. Clin Exp Med. 2021 May;21(2):215-230.
- Trüeb RM, Dias MFRG. Alopecia Areata: a Comprehensive Review of Pathogenesis and Management. Clin Rev Allergy Immunol. 2018 Feb;54(1):68-87.
- Phan K, Sebaratnam DF. JAK inhibitors for alopecia areata: a systematic review and meta-analysis. J Eur Acad Dermatol Venereol. 2019 May;33(5):850-856.
- Montilla AM, Gómez-García F, Gómez-Arias PJ et al. Scoping Review on the Use of Drugs Targeting JAK/STAT Pathway in Atopic Dermatitis, Vitiligo, and Alopecia Areata. Dermatol Ther (Heidelb). 2019 Dec;9(4):655-683.
- Wang EHC, Sallee BN, Tejeda CI, Christiano AM. JAK Inhibitors for Treatment of Alopecia Areata. J Invest Dermatol. 2018 Sep;138(9):1911-1916.
- Marks DH, Mesinkovska N, Senna MM. Cause or cure? Review of dupilumab and alopecia areata. J Am Acad Dermatol. 2019 Jun 13:S0190-9622(19)30973-9.
- Guttman-Yassky E, Renert-Yuval Y, Bares J et al. Phase 2a randomized clinical trial of dupilumab (anti-IL-4Rα) for alopecia areata patients. Allergy. 2021 Aug 30. doi: 10.1111/all.15071. Epub ahead of print.
Aphtes buccaux et maladie de Behçet : l’apremilast comme nouvelle option thérapeutique
Pierre-Dominique Ghislain
L’aprémilast est déjà bien connu pour le psoriasis et l’arthrite psoriasique ; il s’agit d’un inhibiteur de la phophodiestérase 4, administré sous forme de comprimés (30 mg, 2x/jour). D’autres indications sont actuellement envisagées en particulier le traitement de la maladie de Behçet (1).
Ainsi, la sécurité et l’efficacité de l’aprémilast ont été évaluées dans une étude de phase 3, multicentrique, randomisée et contrôlée versus placebo (RELIEF) chez des patients adultes atteints de la maladie de Behçet (MB) active avec des ulcères buccaux (2). La population étudiée répondait aux critères du Groupe d’étude international (International Study Group, ISG) pour la MB, avec des antécédents de lésions cutanées (98,6 %), d’ulcères génitaux (90,3 %), de manifestations musculo-squelettiques (72,5 %), de manifestations oculaires (17,4 %), de manifestations du système nerveux central (9,7 %), de manifestations gastro-intestinales (9,2 %), d’épididymite (2,4 %) et d’atteinte vasculaire (1,4 %).
Les résultats suivant ont été observés :
1. Mesure des ulcères buccaux : l’aprémilast 30 mg deux fois par jour a entraîné une amélioration significative des ulcères buccaux. La moitié des patients avait une réponse complète à la semaine 12, et les ¾ une réponse partielle ;
2. Changement moyen de la douleur des ulcères buccaux : l’amélioration est deux fois meilleure pour l’aprémilast, par rapport au placebo ;
3. Amélioration de la qualité de vie : l’aprémilast 30 mg deux fois par jour a entraîné une amélioration significativement plus importante de la qualité de vie (QdV) à la semaine 12, comme le démontre le questionnaire sur la QdV de la MB (p = 0,0003);
4. Chez les patients initialement randomisés pour recevoir l’aprémilast 30 mg deux fois par jour qui sont restés dans l’étude, l’amélioration du nombre des lésions, de la douleur associée et de la qualité de vie s’est maintenue à la semaine 64.
L’aprémilast vient de recevoir son autorisation euro-péenne de mise sur le marché dans l’indication « aphtes buccaux liés à la maladie de Behçet » ; les procédures pour le remboursement en Belgique sont en cours.
Références
- Izuka Y, Takase-Minegishi K, Hirahara L, et al. Beneficial Effects of Apremilast on Genital Ulcers, Skin Lesions, and Arthritis in Patients With Behçet’s Disease: A Systematic Review and Meta-Analysis. Mod Rheumatol. 2021 Nov 10:roab098. doi: 10.1093/mr/roab098. Epub ahead of print. PMID: 34752620.
- Hatemi G, Mahr A, Takeno M, et al. Apremilast for oral ulcers associated with active Behçet’s syndrome over 68 weeks: long-term results from a phase 3 randomised clinical trial. Clin Exp Rheumatol. 2021 Sep-Oct;39 Suppl 132(5):80-87.
Le Ledaga® : commercialisation d’un nouveau traitement topique dans le mycosis fongoïde en Belgique
Axel De Greef, Laurence de Montjoye
Disponible sur le marché belge depuis le 15 décembre 2021, la chlorméthine (Ledaga®) est indiquée dans le traitement par voie topique des lymphomes T cutanés de type mycosis fongoïde (MF) chez les patients adultes. Il s’agit d’une chimiothérapie locale en gel (agent alkylant) prescrite dans les stades précoces du MF (en 1ère ligne de traitement) ou en thérapie adjuvante dans les stades avancés (1).
La réponse globale est de 70-80%, avec une réponse complète de 8-20%. Il existe plusieurs profils de réponse (précoce, intermittent et tardif). Une réponse peut être observée dès le premier mois de traitement mais le taux de réponse optimal est observé entre 8 et 10 mois d’où l’importance de poursuivre le traitement (2,3).
Le RCP (résumé de caractéristiques du produit) indique la posologie d’une application par jour. Les centres spécialisés (4) proposent quant à eux en pratique l’application du gel 2 à 3 fois par semaine, ensuite avec une augmentation progressive de la fréquence en fonction du résultat et de la tolérance. Les dermocorticoïdes puissants/très puissants peuvent être appliqués les autres jours. Leur utilisation concomitante augmente l’efficacité globale du traitement, tout en diminuant le risque d’effets secondaires (5). Les effets secondaires sont principalement cutanés, localisés aux zones d’application et apparaissant dans les 2 à 6 premiers mois de traitement. Il s’agit principalement d’un érythème prurigineux, d’origine irritatif, modéré à sévère, rarement érosif. A noter que cet érythème aurait des vertus thérapeutiques, les patients présentant un taux de réponse plus élevé après de fortes réactions locales irritatives (6).
Il n’y a pas de passage systémique rapporté ni de toxicité hématologique. Il est contre-indiqué pendant la grossesse. Des cas d’eczéma de contact allergique ont été décrits (7). Des tests épicutanés peuvent être réalisés mais ils ne sont pas standardisés.
Références
- Kim EJ, Guitart J, Querfeld C, et al. The PROVe Study: US Real-World Experience with Chlormethine/Mechlorethamine Gel in Combination with Other Therapies for Patients with Mycosis Fungoides Cutaneous T-Cell Lymphoma. Am J Clin Dermatol. 2021;22(3):407-414.
- Lessin SR, Duvic M, Guitart J, et al. Topical chemotherapy in cutaneous T-cell lymphoma: positive results of a randomized, controlled, multicenter trial testing the efficacy and safety of a novel mechlorethamine, 0.02%, gel in mycosis fungoides. JAMA Dermatol. 2013;149(1):25-32.
- Geskin LJ, Kim EJ, Angello JT, Kim YH. Evaluating the Treatment Patterns of Chlormethine/Mechlorethamine Gel in Patients With Stage I-IIA Mycosis Fungoides: By-time Reanalysis of a Randomized Controlled Phase 2 Study. Clin Lymphoma Myeloma Leuk. 2021;21(2):119-124.e4.
- Geskin LJ, Bagot M, Hodak E, Kim EJ. Chlormethine Gel for the Treatment of Skin Lesions in All Stages of Mycosis Fungoides Cutaneous T-Cell Lymphoma: A Narrative Review and International Experience. Dermatol Ther (Heidelb). 2021;11(4):1085-1106.
- de Quatrebarbes J, Estève E, Bagot M, et al. Treatment of early-stage mycosis fungoides with twice-weekly applications of mechlorethamine and topical corticosteroids: a prospective study. Arch Dermatol. 2005;141(9):1117-1120.
- D’Incan M. Lymphomes cutanés – flash pratique. Journées Dermatologiques de Paris, 1 décembre 2021, Palais des Congrès, Paris, France.
- Gilmore ES, Alexander-Savino CV, Chung CG, Poligone B. Incidence and types of contact dermatitis after chlormethine gel treatment in patients with mycosis fungoides-type cutaneous T-cell lymphoma: The MIDAS study. Presented at the 4th World Congress of Cutaneous Lymphomas. 12–14 February 2020
La microscopie confocale à réflectance
Evelyne Harkemanne
La microscopie confocale à réflectance (MCR) in vivo est une technique d’imagerie cutanée non invasive dont l’intérêt a été démontré dans le diagnostic des cancers cutanés mélanocytaires et non mélanocytaires (1,2). L’utilisation de cette technique permet de prendre en charge les tumeurs cutanées posant une difficulté diagnostique et/ou une difficulté de prise en charge adéquate en raison principalement de la difficulté à définir les marges chirurgicales.
Une publication récente de 2021 met en lumière l’apport indéniable de la MCR pour la délimitation pré-opératoire des marges latérales des lentigos malins (mélanomes de Dubreuilh) du visage et du cuir chevelu (3). La MCR permet ainsi de limiter les chirurgies extensives et mutilantes pour les patients sans avoir recours à la technique de la collerette ou encore à des examens extemporanés tout en réduisant significativement le temps opératoire et le temps d’anesthésie du patient. Une nouvelle indication de la MCR réside également dans la surveillance clinique des récidives des tumeurs non-mélanocytaires (carcinomes basocellulaires et spinocellulaires) difficilement détecta-bles et le monitoring post-traitement par imiquimod ou photothérapie dynamique des carcinomes basocellulaires superficiels et des champs de cancérisation de kératoses actiniques (4).
En conclusion, la MCR in vivo permet une prise en charge optimisée des patients présentant des tumeurs cutanées malignes ou suspectes de malignité. Elle a la capacité de poser un diagnostic fiable de tumeurs difficiles à différencier cliniquement et en dermoscopie qui imposent souvent des examens histologiques multiples et répétés chez un même patient. À cette morbidité s’ajoute parfois une chirurgie qui doit être large en raison de la mauvaise limitation de ces tumeurs malignes. L’utilisation de la MCR dans ces cas compliqués permet à la fois de poser un diagnostic le jour même de la consultation et d’éviter des biopsies itératives pré-opératoires où un délai minimal d’une semaine est requis pour recevoir le résultat de l’analyse histologique. Ainsi, cette procédure présente l’avantage d’accélérer le délai de prise en charge des tumeurs cutanées malignes. Attention toutefois que l’utilisation de cette technologie nécessite cependant une formation spécifique afin d’interpréter les images générées par la MCR.
Références
- Dinnes, J. et al. Reflectance confocal microscopy for diagnosing cutaneous melanoma in adults. Cochrane Database of Systematic Reviews (2018). doi:10.1002/14651858.CD013190
- Schneider, S. L. et al. Emerging imaging technologies in dermatology: Part I: Basic principles. J. Am. Acad. Dermatol. 80, 1114–1120 (2019).
- Elshot, Y. S. et al. Handheld reflectance confocal microscopy: Personalized and accurate presurgical delineation of lentigo maligna (melanoma). Head Neck 43, 895–902 (2021).
- Shahriari, N., Grant-Kels, J. M., Rabinovitz, H., Oliviero, M. & Scope, A. Reflectance confocal microscopy: Principles, basic terminology, clinical indications, limitations, and practical considerations. J. Am. Acad. Dermatol. 84, 1–14 (2021).
Place de la photothérapie dynamique en lumière du jour artificielle dans la prise en charge des carcinomes cutanés du patient greffé
Romane Thirion, Laura Nobile
Trente-cinq à 50% des patients greffés développeront au moins un cancer de la peau dans les dix ans suivant leur transplantation. Le carcinome spinocellulaire (CSC) est la néoplasie cutanée la plus fréquemment rencontrée dans cette population et il a été démontré que son agressivité et sa capacité à métastaser sont plus élevées que chez les sujets immunocompétents (1).
Les kératoses actiniques (KA) sont considérées comme des lésions cutanées précancéreuses avec un risque annuel de transformation en CSC compris entre 0,03 et 20% selon les facteurs de risque du patient et le degré de dysplasie de la lésion (2). Les principaux facteurs de risque étant l’exposition aux rayons ultraviolets et la durée du traitement immunosuppresseur (1).
Par ailleurs, les KA sont fréquemment associées à un champ de cancérisation, défini comme une zone péritumorale comportant des anomalies infracliniques et multifocales ayant les mêmes modifications génétiques que la KA elle-même, et pouvant être le lit de récidives ou d’apparition de nouveaux CSC (1).
Le traitement des KA du patient greffé doit donc tenir compte de ce champ de cancérisation. Bien que l’application de topiques tels que le 5-fluorouracile ou l’imiquimod soient des techniques validées dans la prise en charge des KA et du champ de cancérisation, la photothérapie dynamique s’est avérée supérieure en terme d’efficacité (1,3).
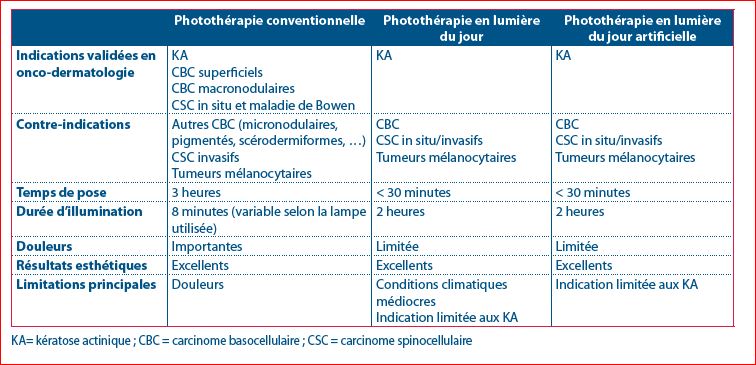
La photothérapie dynamique conventionnelle (PTDc) consiste en l’application topique de méthyl aminolévuli-nate (MAL, Metvix®), un précurseur de protoporphyrine IX (PPIX). La PPIX est un agent photosensibilisant qui va s’accumuler préférentiellement dans les cellules dysplasiques. Après une pose de 3 heures sous occlusion, la zone est nettoyée et exposée à une lumière rouge pour une durée de 8 minutes environ (variable selon la lampe utilisée). Cela va entrainer la formation de dérivés réactifs de l’oxygène et la destruction sélective des cellules dysplasiques (4). Outre le traitement des KA et du champ de cancérisation, la PTDc est efficace dans le traitement des carcinomes basocellulaires (CBC) superficiels, de certains CBC nodulaires et de carcinomes épidermoïdes in situ/maladie de Bowen (5). Elle est également supérieure à la chirurgie en terme de résultat esthétique pour ces lésions superficielles (6). La principale limitation de la PTDc est la douleur ressentie lors de l’illumination, surtout lors de la prise en charge de larges champs, ce qui tend à diminuer la compliance des patients (7).
Une alternative à la PTDc est la photothérapie dynamique en lumière du jour (PTDdl). Le MAL est appliqué sur la zone à traiter après la pose d’une crème photoprotectrice, sans occlusion. Le patient doit ensuite s’exposer à la lumière du jour dans les 30 minutes qui suivent, pour une durée de 2 heures (5). Tous les pics d’absorption de la PPIX se retrouvent dans le spectre de la lumière visible (8) et la production ainsi que l’activation continue de PPIX pendant les 2 heures d’exposition permettent de diminuer fortement les douleurs (9). Le principal inconvénient de cette technique est qu’elle est dépendante des conditions climatiques, avec une diminution de la synthèse de PPIX en cas de faible ensoleillement et de baisse des températures (8).
Plus récemment, des lampes ont été développées dans le but de mimer la lumière du jour et de permettre d’effectuer le traitement quelles que soient les conditions climatiques (photothérapie dynamique en lumière du jour artificielle – PTDdla) (7). En plus de diminuer de façon significative les douleurs, la PTDdl et la PTDdla seraient plus efficaces que la PTDc dans la prise en charge des KA et de leur champ de cancérisation (6). Elles ne sont cependant pas une indication validée dans la prise en charge des CBC ni des CSC.
En conclusion, les cancers cutanés et les KA font partie des complications à long terme les plus fréquentes des patients greffés (1). Le traitement précoce des KA ainsi que la prise en charge du champ de cancérisation par PTDdla permettent de réduire la mortalité et la morbidité liées aux CSC, ce qui lui confère une réelle place dans la prise en charge dermatologique des patients greffés (3). Cette nouvelle technique fera également partie de l’arsenal thérapeutique du dermatologue dans la prise en charge des patients non greffés présentant de multiples KA.
Références
- Hasson A, Navarrete-Dechent C, Nicklas C, de la Cruz C. Topical photodynamic therapy with methylaminolevulinate for the treatment of actinic keratosis and reduction of photodamage in organ transplant recipients: a case-series of 16 patients. Indian J Dermatol Venereol Leprol. 2012;78(4):448-53.
- Sousa ACDS, Campos MAC, Baptista AM, Menezes NMBVN. Daylight photodynamic therapy in 25 patients with actinic keratosis and evaluation of efficacy by confocal microscopy. Photodiagnosis Photodyn Ther. 2019 Mar;25:414-416.
- Basset-Seguin N, Baumann Conzett K, Gerritsen MJ, Gonzalez H, Haedersdal M, Hofbauer GF, et al. Photodynamic therapy for actinic keratosis in organ transplant patients. J Eur Acad Dermatol Venereol. 2013 Jan;27(1):57-66.
- Jetter N, et al. Field Cancerization Therapies for Management of Actinic Keratosis: A Narrative Review. Am J Clin Dermatol. 2018. 2018 Aug;19(4):543-557.
- Morton CA, Braathen LR. Daylight Photodynamic Therapy for Actinic Keratoses. Am J Clin Dermatol. 2018 Oct;19(5):647-656.
- O’Gorman SM, Clowry J, Manley M, McCavana J, Gray L, Kavanagh A et al. Artificial White Light vs Daylight Photodynamic Therapy for Actinic Keratoses: A Randomized Clinical Trial. JAMA Dermatol. 2016 Jun 1;152(6):638-44.
- Kellner C, Bauriedl S, Hollstein S, Reinhold U. Simulated-daylight photodynamic therapy with BF-200 aminolaevulinic acid for actinic keratosis: assessment of the efficacy and tolerability in a retrospective study. Br J Dermatol. 2015 Apr;172(4):1146-8.
- Mordon S, Vignion-Dewalle AS, Thecua E, Vicentini C, Maire C, Deleporte P, et al. Can daylight-PDT be performed indoor? G Ital Dermatol Venereol. 2018 Dec;153(6):811-816.
- Philipp-Dormston WG, Sanclemente G, Torezan L, Tretti Clementoni M, Le Pillouer-Prost A, Cartier H, et al. Daylight photodynamic therapy with MAL cream for large-scale photodamaged skin based on the concept of ‘actinic field damage’: recommendations of an international expert group. J Eur Acad Dermatol Venereol. 2016 Jan;30(1):8-15.
Affiliations
Service de Dermatologie, Cliniques universitaires Saint-Luc, Bruxelles.
Correspondance
Pr. Laurence de Montjoye, M.D., Ph.D.
Cliniques universitaires Saint-Luc (UCLouvain)
Service de Dermatologie
Avenue Hippocrate 10, B-1200 Bruxelles, Belgium
+32 (0)27647955 / Fax: +32 (0)764 89 58
laurence.demontjoye@uclouvain.be