DÉTECTION DU MÉLANOME PAR DERMOSCOPIE OPTIQUE ET DIGITALISÉE : ÉPIDÉMIOLOGIE EN BELGIQUE
Isabelle Tromme
Le mélanome est un cancer de la peau potentiellement agressif, développé au départ des mélanocytes. Le risque cumulatif de développer un mélanome au cours de sa vie est estimé à 1.14% chez l’homme et 1.47% chez la femme. En Belgique, le mélanome est le 5e cancer le plus fréquent chez la femme, et le 8e chez l’homme (Registre national du cancer, année 2013).
Au stade précoce, le mélanome est facilement curable par chirurgie et le pronostic est donc excellent. À l’inverse, en cas de diagnostic tardif, le pronostic s’effondre car il n’existe pas encore à l’heure actuelle de thérapie curative efficace aux stades avancés. Dans ce contexte, la détection précoce du mélanome s’avère capitale si l’on veut parvenir à réduire la morbidité et la mortalité associées à cette tumeur. À ce niveau, la dermoscopie occupe une place centrale dans notre pratique dermatologique.
La dermoscopie optique est une technique non invasive qui permet l’observation de structures invisibles à l’œil nu au sein des tumeurs pigmentées. L’efficacité de la dermoscopie optique dans le diagnostic précoce du mélanome est bien démontrée dans la littérature. La dermoscopie digitalisée permet en plus, d’enregistrer les images dermoscopiques et ainsi, d’observer leur évolution dans le temps afin de détecter précocement toute modification.
La thèse du Dr I. Tromme, dont elle nous a brièvement exposé les résultats au cours de cette conférence, traitait des aspects de la détection du mélanome par dermoscopie optique et digitalisée en Belgique.
La première partie de son travail démontre que l’accès à la dermoscopie digitalisée permet de diminuer considérablement le nombre d’excisions inutiles et par conséquent, conduit à une réduction significative des coûts.
En effet, dans l’étude DEPIMELA, menée par le Dr I. Tomme et ses collaborateurs, le ratio mélanome/non mélanome parmi les lésions excisées était significativement réduit en cas d’accès à la dermoscopie digitalisée (DD) en plus de la dermoscopie optique (DO) : 1/8.14 si DO seule versus 1/2.14 si DO + DD. Ceci témoigne d’une plus grande spécificité dans le diagnostic de mélanome en cas d’accès à la dermoscopie digitalisée.
Chez les patients à faible risque, cette diminution d’excisions inutiles permise par la dermoscopie digitalisée conduit à une réduction des « extra-coûts » par mélanome excisé (frais liés à la chirurgie et à l’analyse histologique des lésions bénignes, lesquels sont plus conséquents que les frais liés à la technique de DD). En pratique, les extra-coûts par mélanome excisé sont estimés à 1 613 euro en cas d’accès à la DO seule contre 1052 euro en cas d’accès à la DO et la DD.
Il est par ailleurs intéressant de mentionner qu’une meilleure connaissance et pratique de la dermoscopie optique permet un diagnostic plus précoce du mélanome. Ainsi, dans l’étude DEPIMELA, on retrouvait une proportion significativement plus importante de mélanomes in situ et de mélanomes invasifs peu épais parmi le groupe de dermatologues expérimentés en dermoscopie optique comparé au groupe de dermatologues peu expérimentés (Breslow moyen de 0.42mm versus 0.84mm).
La deuxième partie des travaux de recherche du Dr I. Tromme avait pour but d’établir les fondements d’une analyse coût/efficacité de la dermoscopie (cost-effectiveness analysis ou CEA en anglais). Pour ce faire, le Dr I. Tromme a commencé par étudier la qualité de vie des patients atteints de mélanome, en fonction du stade de ce dernier. Les valeurs obtenues, associées à une modélisation de la maladie, ont permis d’une part le calcul du DALY (Disability Adjusted Life Years) du mélanome par stades, et d’autre part une étude pilote du coût/efficacité de la dermoscopie, qui pourrait à l’avenir être utilisée à plus grande échelle.
De cette partie du travail, nous retiendrons en particulier que, dans le calcul détaillé du DALY, où morbidité et mortalité peuvent se comparer, la morbidité liée aux mélanomes « indolents » à très faible risque de métastases est moins lourde que la mortalité des mélanomes de stade T1a. En conclusion, on peut en déduire qu’il n’y a pas, en Belgique et à l’heure actuelle, de sur-diagnostic du mélanome.
NOUVEAUX TRAITEMENTS DU MÉLANOME : EN ROUTE VERS LA GUÉRISON
Jean-François Baurain
Il y a quelques années à peine, le pronostic des patients souffrant d’un mélanome métastatique était catastrophique. L’arsenal thérapeutique se limitait en effet à la chimiothérapie par Dacarbazine, avec des résultats peu concluants (survie globale de 6 mois avec une espérance de vie à 3 ans de 6%).
Avec le développement au cours des dernières années de nouveaux traitements, en particulier les thérapies ciblées et l’immunothérapie, le paysage thérapeutique du mélanome métastatique s’est petit à petit éclairci et l’espoir d’une guérison est devenu possible pour les patients.
Prenons donc la peine de détailler davantage ces deux nouvelles approches thérapeutiques.
Les thérapies ciblées
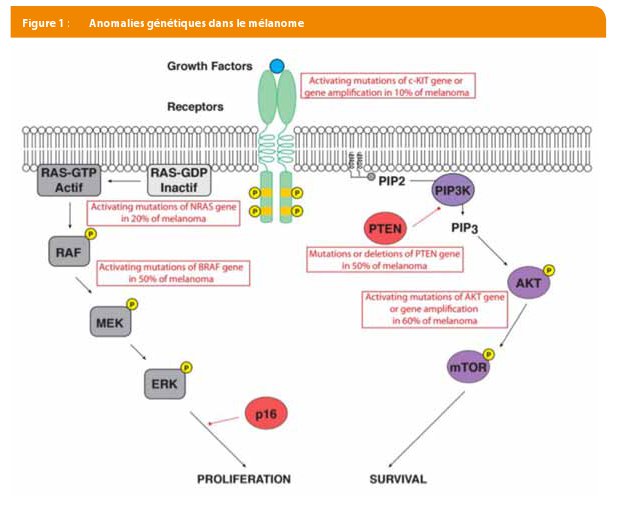
Avec l’émergence des thérapies ciblées, il est désormais possible de proposer aux patients des traitements dits « personnalisés », qui visent spécifiquement la ou les mutation(s) pathologique(s) retrouvées au sein du mélanome. En effet, diverses anomalies génétiques ont été identifiées dans le mélanome, à savoir (Figure 1) :
- Mutations activatrices ou amplification du gène c-KIT (10%)
- Mutations activatrices du gène NRAS (20%)
- Mutations activatrices du gène BRAF (50%)
- Mutations ou délétions du gène PTEN (50%)
- Mutations activatrices ou amplification du gène AKT (60%)
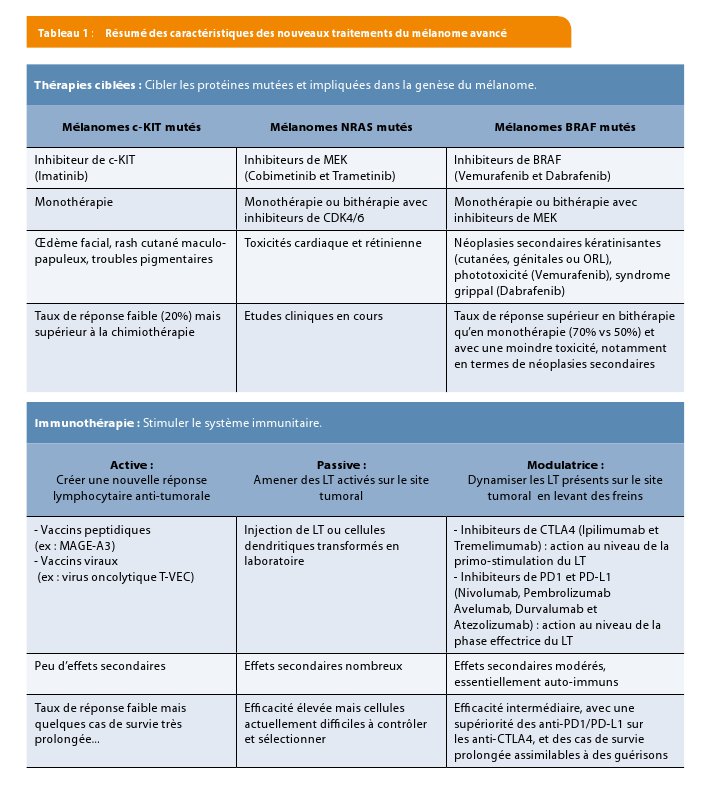
L’identification de ces anomalies a conduit à postuler l’existence de plusieurs «sous- types » de mélanomes, pour lesquels des inhibiteurs spécifiques ont été développés en vue d’une action plus ciblée.
a) Mélanomes c-KIT mutés :
- Monothérapie par Imatinib (Glivec®), inhibiteur de tyrosine kinase
- Taux de réponse : 20%
- Efficacité supérieure à la chimiothérapie
- Durée de la réponse : 6 mois
- Survie globale (médiane) : 9 mois
b) Mélanomes NRAS mutés :
- Etudes cliniques en cours avec des inhibiteurs de MEK (Cobimetinib ou Cotellic® et Trametinib ou Mekinist®), en monothérapie ou bithérapie (en association à des inhibiteurs de CDK4/6)
- Résultats attendus
c) Mélanomes BRAF mutés :
- Surtout retrouvés chez des patients jeunes, en lien avec une exposition solaire aigüe et intermittente.
- 2 inhibiteurs de BRAF actuellement disponibles sur le marché : Vemurafenib (Zelboraf®) et Dabrafenib (Tafinlar®), utilisés en monothérapie ou bithérapie avec des inhibiteurs de MEK (Vemurafenib/Cobimetinib et Dabrafenib/Trametinib).
- Efficacité des 2 molécules globalement comparable en monothérapie : taux de réponse de 50% avec réponse visible en 15 jours, durée de réponse de 6 mois et survie globale médiane de 14 et 18 mois (respectivement pour Vemurafenib et Dabrafenib).
- Profil de toxicité légèrement différent. En commun pour les 2 molécules : apparition ou modification de naevus, mélanomes secondaires, survenue de lésions cutanées kératinisantes pré-cancéreuses ou cancéreuses mais aussi de néoplasies secondaires extra-cutanées (en particulier de la sphère ORL ou génitale). En outre, phototoxicité pour le Vemurafenib et syndrome grippal pour le Dabrafenib.
- La bithérapie par inhibiteurs de BRAF et MEK permet d’augmenter l’efficacité thérapeutique : taux de réponse de 70% avec une durée de réponse de 13 mois et une survie globale médiane avoisinant les 2 ans.
-La bithérapie permet en outre de nettement diminuer les effets secondaires, en particulier en termes de néoplasies cutanées secondaires, au prix toutefois de l’apparition de toxicités rétinienne et cardiaque (liées aux inhibiteurs de MEK).
- Actuellement, la bithérapie par inhibiteurs de BRAF et MEK constitue donc le traitement de choix dans les mélanomes BRAF mutés, et doit être préférée à une monothérapie.
Si ces diverses thérapies ciblées permettent d’obtenir une réponse rapide et d’allonger la survie des patients atteints d’un mélanome métastatique, elles ne permettent toutefois pas de les guérir. Cependant, avant de tirer des conclusions définitives, nous devons disposer d’informations sur la survie à long terme avec ces thérapies ciblées.
L’immunothérapie
Au milieu du 20e siècle, les échecs de l’immunothérapie étaient attribués à l’absence de reconnaissance des tumeurs par le système immunitaire. Le professeur T. Boon de l’UCL a pu démontrer que les cellules tumorales étaient antigéniques et immunogéniques. Le « drapeau » reconnu par les lymphocytes T à la surface des cellules tumorales est appelé un antigène. Il permet au système immunitaire de différencier une cellule du soi d’une autre faisant partie du non-soi. Cette dernière doit être détruite par les lymphocytes.
Toutefois, en situation réelle, il semble que cela ne se passe pas mais qu’il y ait une forme de « tolérance » du système immunitaire vis-à-vis de la tumeur.
L’immunothérapie a pour but de « booster » le système immunitaire afin que les lymphocytes fassent leur travail. On distingue 3 mécanismes d’immunothérapie (Figure 2) :

1. Active : vaccination
- But : créer une nouvelle réponse lymphocytaire anti-tumorale.
- Mécanisme : stimulation du système immunitaire à reconnaître les antigènes présents à la surface des cellules tumorales.
- Types de vaccins : peptidiques ou viraux (virus oncolytiques).
- Peu d’effets secondaires.
- Faible efficacité mais en cas de réponse, survie très prolongée (probablement assimilable à des guérisons !).
a) Vaccins peptidiques
- Vaccins plus anciens contenant des antigènes tumoraux, comme MAGE-A3 (Melanoma-associated antigen 3).
- Faible taux de réponse mais quelques cas de survie très prolongée (survie à 20 ans : 7%).
b) Vaccins viraux
- Virus oncolytique : T-VEC (Talimogene Laherparepvec)
- Injection intralésionnelle de T-VEC, entraînant d’une part une lyse locale des cellules tumorales et déclenchant d’autre part une réponse immunitaire anti-tumorale spécifique permettant une destruction des lésions tumorales à distance.
- Limitation : nécessité de lésions cutanées accessibles.
- Efficacité plus élevée : taux de réponse (complète et partielle) de 26.4%, avec une réponse durable et une survie très prolongée.
- Accord récemment obtenu du FDA pour le traitement de lésions cutanées, sous-cutanées ou ganglionnaires de mélanomes avancés.
2. Passive : transfert adoptif de cellules immunitaires
- But : amener des lymphocytes activés en grand nombre sur le « champ de bataille ».
- Mécanisme : injection de lymphocytes T ou cellules dendritiques, après culture et transformation en laboratoire en vue d’améliorer leurs fonctions.
- Effets secondaires plus nombreux.
- Efficacité élevée.
- Limitations : cellules difficiles à sélectionner et contrôler (au niveau de leur spécificité antigénique).
3. Modulatrice
- But : redynamiser les « soldats » sur le terrain en levant les freins à leur activation.
- Mécanisme : agents immunomodulateurs ciblant des récepteurs ayant une action inhibitrice sur les lymphocytes T, présents à la surface de ces derniers ou des cellules tumorales.
- Effets secondaires et efficacité « intermédiaires ».
- 2 grands types d’agents : inhibiteurs de CTLA-4 et inhibiteurs de PD1 et PD-L1.
a) Inhibiteurs de CTLA4 : Action au niveau de la primo-stimulation du lymphocyte T
- Ipilimumab et Tremelimumab
- Anticorps monoclonaux dirigés contre la protéine CTLA4, présente à la surface du lymphocyte T.
- L’interaction entre CTLA4 et la protéine B7, présente sur la membrane de la cellule présentatrice d’antigène, conduit à une absence d’activation du lymphocyte T.
- L’inhibition du récepteur CTLA4 entraîne donc une activation du lymphocyte T.
- Efficacité modérée (taux de réponse global de 11% avec survie médiane globale de 9.5 mois) mais les réponses prolongées sont vraisemblablement assimilables à des guérisons, de part une activation efficace du système immunitaire (taux de survie globale à 3 ans de 21%).
- Effets secondaires : maladies auto-immunes suite à une dysrégulation du système immunitaire (polyneuropathies, endocrinopathies, hépatites, dermatites, uvéites, colites, pneumopathies ou hémopathies auto-immunes). Ces effets secondaires, parfois sévères, doivent être détectés et traités précocement (Medrol 1mg/kg/j voire anti-TNF).
b) Inhibiteurs de PD-1 et PD-L1 : Action au niveau de la phase effectrice du lymphocyte T
- Nivolumab et Pembrolizumab (anti-PD1)
- Avelumab, Durvalumab et Atezolizumab (anti-PD-L1)
- Anticorps monoclonaux dirigés contre les protéines PD-1 et PD-L1, respectivement présentes à la surface du lymphocyte T et de la cellule tumorale.
- L’interaction entre PD-1 et PD-L1 empêche le lymphocyte T d’exercer son action sur la cellule tumorale.
- L’inhibition de la liaison entre ces 2 molécules lève donc un « frein » exercé sur le lymphocyte T.
- Efficacité supérieure aux inhibiteurs de CTLA4 (taux de réponse globale de 32-40%), surtout en 1e ligne de traitement. Survie médiane d’environ 20 mois.
- Association aux inhibiteurs de CTLA4 surtout utile en cas de tumeur PD-L1 négative mais au prix d’une toxicité plus élevée.
En résumé, les armes thérapeutiques à notre disposition pour la prise en charge du mélanome avancé étant chaque jour plus nombreuses et plus prometteuses, ceci renforce notre conviction qu’une guérison du mélanome est un objectif désormais accessible…
De cet exposé, nous retiendrons les messages-clés suivants :
- La prévention et le diagnostic précoce du mélanome demeurent capitaux.
- Un traitement adjuvant est à espérer pour les patients présentant un mélanome de stade élevé, à haut risque de progression.
- Les thérapies ciblées permettent d’allonger la survie en cas de mélanome métastatique.
- En cas de mélanome BRAF muté, la bithérapie par inhibiteurs de BRAF et MEK est la plus efficace et réduit les effets secondaires par rapport à une monothérapie.
- L’immunothérapie semble pouvoir guérir certains patients métastatiques :
18% des patients traités par Ipilimumab sont encore en vie à 5 ans.
Les anticorps anti-PD1 sont plus efficaces (même en 2e ligne, après Ipilimumab) et moins toxiques.
- Des essais cliniques combinant ces diverses thérapies sont en cours.
- L’espoir est donc permis dans le mélanome, y compris métastatique, et ce n’est que le début…
ÉLECTROCHIMIOTHÉRAPIE
Benoit Lengelé
Dans le traitement des mélanomes avancés, à côté des thérapies ciblées précitées, d’autres voies thérapeutiques se développent, comme l’électrochimiothérapie, qui peut parfois servir d’alternative pour le contrôle local de métastases cutanées de mélanome.
Cette technique récente de chimiothérapie, utilisée depuis environ 10 ans, combine à l’administration systémique d’un agent de chimiothérapie (généralement de la bléomycine ou du 5-FU) une stimulation électrique locale de la tumeur au moyen d’une électrode hexagonale implantée dans cette dernière. Ceci a pour effet d’augmenter la pénétration tumorale de l’agent de chimiothérapie d’un facteur 100 à 1000 et ainsi, d’avoir une plus grande sélectivité cellulaire.
Les paramètres cliniques et histologiques pris en compte lors du choix de cette technique sont les suivants :
- Nodules cutanés multiples (jamais uniques !)
- Personnes âgées, surtout en cas de chirurgie difficile
- Tumeurs douloureuses et/ou très sanglantes
- Diamètre tumoral inférieur à 2-3 cm.
Les principales tumeurs cutanées traitées par cette technique sont :
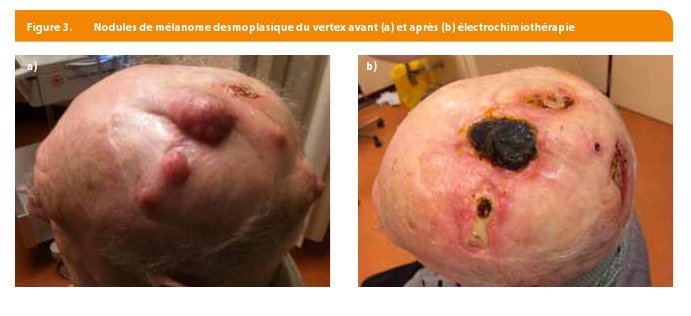
- Métasases de mélanome (Figure 3)
- Sarcome de Kaposi
- Carcinomes spinocellulaires multiples dans un contexte d’immunosuppression
- Carcinomes basocellulaires multiples dans le cadre d’un syndrome de Gorlin
- Angiosarcome cutané et dermatofibrosarcome de Darier-Ferrand (indications relatives).
Outre les tumeurs cutanées, l’électrochimiothérapie est également utilisée dans le traitement de cancers de la sphère ORL ou de métastases cutanées multiples de cancers du sein.
Les principaux avantages liés à cette technique peuvent être résumés ainsi :
- Facilité de réalisation
- Taux élevé de réponse
- Diminution du temps de circulation de l’agent de chimiothérapie avec concentration accrue du produit au site tumoral et réduction des effets secondaires systémiques.
Cette technique séduisante présente toutefois un certain nombre de limitations, à savoir :
- Réponse tumorale variable :
Selon le type histologique (carcinome basocellulaire > mélanome > spinocellulaire)
Entre les différents nodules d’une même tumeur (influence du volume tumoral).
- Faible efficacité en cas de tumeur volumineuse
- Ne remplace pas une chirurgie lorsque cette dernière est possible et potentiellement curative (ex : exérèse et greffe de peau pour des carcinomes spinocellulaires multiples du vertex).
Les effets secondaires de l’électrochimiothérapie sont quant à eux peu nombreux et se limitent essentiellement aux pneumopathies interstitielles induites par la bléomycine et à de possibles nécroses au site de traitement, pour lesquelles une cicatrisation dirigée est préconisée pendant une durée variant entre 3 et 8 semaines.
Affiliations
(1) Service de dermatologie, Cliniques universitaires Saint-Luc, Bruxelles
(2) Service d’oncologie, Cliniques universitaires Saint-Luc, Bruxelles
(3) Service de chirurgie plastique, Cliniques universitaires Saint-Luc, Bruxelles