La maladie rénale chronique, un problème de santé publique
La maladie rénale chronique (MRC) est définie par un débit de filtration glomérulaire (DFG) inférieur à 60 ml/min/1.73 m2 et/ou la présence d’une atteinte structurelle (démontrée par une albuminurie, ou hématurie, ou anomalie morphologique rénale), persistant pendant au moins 3 mois (1). Plus d’une personne sur 10 est atteinte d’une MRC dans le monde et il peut être donc estimé qu’environ 1.1 million de Belges souffrent de MRC en 2024 (2). La MRC est associée à une majoration significative de la morbi-mortalité, une altération de la qualité de vie et entraîne un coût économique très important pour la société.
Les complications cardiovasculaires constituent la principale cause de morbi-mortalité chez les patients avec MRC. Par ailleurs, il est prédit que la MRC devienne d’ici 2040 la cinquième cause de décès au niveau mondial (3-4). La qualité de vie des patients est impactée surtout aux stades sévère et terminal de la MRC et est influencée par la présence d’autres comorbidités (5). Sur le plan économique, le coût des soins de prise en charge de la MRC et de ses complications augmente de façon exponentielle au fur et à mesure que la maladie progresse. Notons à ce sujet que le coût de la dialyse, de la transplantation rénale et de leurs complications représente 2 à 3% du budget annuel des soins de santé dans les pays à revenu élevé (2,6). Parallèlement, sur le plan écologique, l’empreinte carbone est conséquente en cas de recours aux techniques de dialyse, avec une consommation en eau et énergie ainsi qu’une production de déchets non négligeables (6).
Le sous-diagnostic de la maladie rénale chronique
Le diabète et l’hypertension artérielle sont les deux facteurs de risque principaux de MRC. Un cinquième des personnes hypertendues et un tiers des personnes diabétiques sont porteurs d’une MRC (7). Cependant, seulement 35% des diabétiques et 4% des hypertendus ont déjà bénéficié d’une recherche d’albuminurie (8). Selon les régions du monde, entre 80 et 93% des personnes ignorent qu’elles souffrent d’une MRC (7).
La MRC évolue en grande partie de manière indolente et est donc souvent diagnostiquée à un stade avancé, en l’absence de dépistage systématique (1). Un diagnostic précoce de MRC chez les personnes à risque favoriserait l’instauration de mesures hygiéno-diététiques et de traitements néphroprotecteurs permettant de ralentir la progression et de prévenir les complications associées à la MRC.
Le dépistage de la maladie rénale chronique
Le dépistage de la MRC est longtemps resté controversé dans la population générale et dans les groupes à risque (7,9-10). De plus, il n’existe pas de consensus sur le dépistage précoce de la MRC au niveau des systèmes de santé nationaux, contrairement à d’autres maladies chroniques (10). Récemment, une conférence de controverse organisée par KDIGO (Kidney Disease: Improving Global Outcomes, la fondation d’utilité publique qui publie les recommandations mondiales en néphrologie), a été consacrée à l’identification et la prise en charge précoces de la MRC. Une position de consensus a été publiée. Les auteurs estiment que le dépistage de la MRC chez les populations à risque répond aux critères de dépistage établis par l’Organisation Mondiale de la Santé ; notamment parce que la MRC est un problème majeur de santé publique, souvent asymptomatique aux stades débutants mais également parce que les moyens diagnostiques de dépistage sont précis et peu coûteux et que des traitements de plus en plus efficaces existent (10).
KDIGO recommande le dépistage de la MRC chez les patients atteints d’une hypertension, de diabète et/ou de maladie cardiovasculaire. Le dépistage est aussi à envisager chez les patients avec d’autres facteurs de risque tels que l’obésité, les maladies systémiques ou auto-immunes, un antécédent d’insuffisance rénale aigue ou de pré-éclampsie et l’exposition à des néphrotoxiques, une histoire familiale de MRC, en particulier sévère (imposant la dialyse ou la transplantation rénale) (Figure 1) (1).
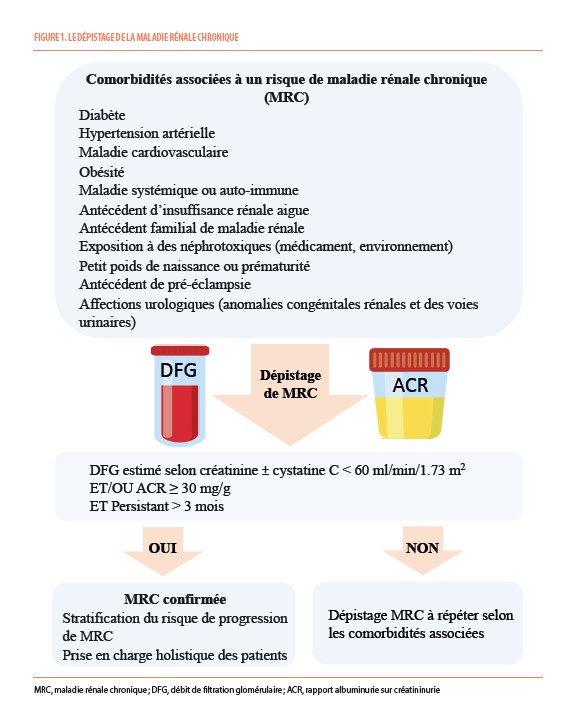
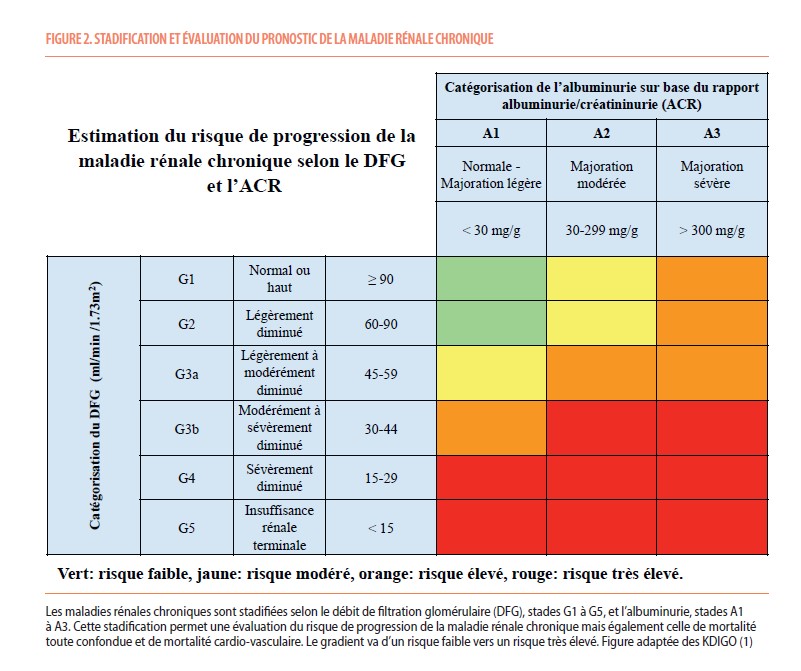
Le dépistage de la MRC doit comporter l’évaluation de la fonction rénale par l’estimation du débit de filtration glomérulaire (DFGe) et de l’existence de lésions rénales par la mesure de l’albuminurie (1,10). Une diminution du DFGe et/ou une majoration de l’albuminurie (rapport albuminurie/créatininurie) sont très significativement associés aux risques de progression de la MRC, de survenue de complications cardiovasculaires et de mortalité (Figure 2) (1).
La mesure du DFGe et de l’albuminurie
Le débit de filtration glomérulaire est estimé en routine à partir du taux de créatinine sérique en utilisant les équations validées CKD-EPI (Chronic Kidney Disease- Epidemiology Collaboration) ou EKFC (European Kidney Function Consortium) (1,11-12). Le DFG estimé à partir du taux de créatinine et de cystatine C est plus précis que celui basé sur la créatinine seule, mais n’est probablement pas nécessaire dans le contexte de dépistage, d’autant plus que le dosage de la cystatine C est actuellement à charge du patient en Belgique. A la différence de la créatinine, la production de cystatine C est stable, indépendante de la masse musculaire et non influencée par l’âge et le sexe. Son dosage est particulièrement utile chez les patients très âgés, cirrhotiques, obèses ou dénutris (1).
Le dosage de l’albuminurie est recommandé pour le dépistage de la MRC. Il est effectué en calculant le rapport de l’albuminurie sur la créatininurie (Albumin Creatinine Ratio ou ACR) mesurées sur un échantillon urinaire. Un échantillon de la première miction du matin est préférable, car il corrèle bien avec l’excrétion d’albumine et/ou de protéines sur 24 heures et présente une variabilité intra-individuelle relativement faible. La mesure de l’albuminurie est privilégiée par rapport à celle de la protéinurie car elle est plus sensible et mieux corrélée aux risques de progression de la MRC et de survenue de complications cardiovasculaires. L’albuminurie peut être classifiée en trois catégories : A1, normale ou majoration légère (ACR < 30 mg/g de créatinine); A2, majoration modérée (ACR 30-300 mg/g); A3, majoration sévère (ACR> 300 mg/g) (Figure 2). En Belgique, seuls les patients diabétiques bénéficient actuellement d’un remboursement du dosage de l’albuminurie. Le dépistage de l’albuminurie via la bandelette urinaire est beaucoup moins sensible.
Cette année, à l’occasion de la Journée Mondiale du Rein (14 mars 2024), le Groupement des Néphrologues Francophones de Belgique et la Nederlandstalige Vereniging voor Nefrologie ont lancé un appel commun en faveur d’un remboursement annuel de l’albuminurie aux patients présentant une hypertension artérielle, une maladie cardiovasculaire ou des antécédents familiaux de maladie rénale (outre les diabétiques, déjà remboursés) ainsi qu’un remboursement tous les cinq ans pour toute personne âgée de plus de 45 ans.
La MRC est confirmée lorsque la baisse du DFGe est inférieure à 60 ml/min/1.73 m2 et/ou l’albuminurie au-delà de 30 mg/g pendant au moins 3 mois (Figure 1). Il est possible d’estimer le risque de progression de la MRC (risque d’insuffisance rénale terminale à 2 et 5 ans par exemple) en utilisant des équations de prédiction telles que la Kidney Failure Risk Equation (KFRE) (https://www.ckdpc.org/risk-models.html). Cette dernière équation prend en compte le DFGe, l’ACR urinaire, l’âge et le sexe du patient. Cette évaluation du risque de progression est utile pour identifier les patients à haut risque de progression, prendre des décisions cliniques éclairées sur la prise en charge thérapeutique et donc personnaliser les soins apportés au patient (1). Elle peut, entre autres, être utile pour déterminer quand il est nécessaire de consulter un néphrologue.
Prise en charge de la maladie rénale chronique
Un argument clé en faveur du dépistage de la MRC est la disponibilité de plusieurs interventions efficaces pour ralentir la progression de la MRC et réduire le risque cardiovasculaire (10). Les recommandations actuelles reposent sur une approche holistique de la prise en charge de la MRC incluant les mesures hygiéno-diététiques, le contrôle des facteurs de risques cardiovasculaires (contrôle du diabète, de l’hypertension artérielle et du profil lipidique) ainsi que l’utilisation des traitements néphro- et cardio-protecteurs. Il est proposé aux patients de suivre un régime sain (régime diversifié, de type méditerranéen, pauvre en sel ; privilégier les aliments d’origine végétale et éviter les aliments ultra-transformés), d’éviter le tabac, de pratiquer si possible un minimum de 150 minutes d’activité physique modérée par semaine et de perdre du poids en cas de BMI supérieur à 25 kg/m2. Pour le contrôle glycémique, la metformine est généralement le traitement de première ligne chez les patients avec un DFGe > 30 ml/min/1.73m2 (1,13).
Les inhibiteurs de l’enzyme de conversion (IEC) et sartans sont privilégiés comme traitement anti-hypertenseur (et antiprotéinurique), particulièrement chez les patients diabétiques et/ou présentant une majoration de l’albuminurie (ACR >30 mg/g) (1,13). Les inhibiteurs SGLT2 (co-transporteur sodium-glucose de type 2) sont recommandés en première ligne chez les patients MRC diabétiques avec DFGe ≥ 20 ml/min/m2, et chez les non-diabétiques avec DFGe ≥ 20 ml/min/m2 et ACR ≥ 200 mg/g, en raison d’une diminution significative du risque de progression de la MRC et du risque cardiovasculaire (1,13-15).
La finerenone, un antagoniste non-stéroïdien du récepteur minéralocorticoïde, est recommandée chez les patients MRC diabétiques présentant un DFGe ≥ 25 ml/min/m2, une kaliémie normale (≤ 4.8 mmol/l) et un ACR ≥ 30 mg/g malgré un traitement par IEC ou sartan bien conduit (+/- inhibiteur SGLT2) (1,13). Le bénéfice néphro- et cardioprotecteur de la finerenone est bien démontré chez les patients diabétiques avec MRC (16). Il faudra attendre les résultats de l’essai FIND-CKD (NCT05047263) pour savoir si ce bénéfice cardio-rénal est également retrouvé chez les patients MRC non-diabétiques.
Les agonistes GLP1 sont proposés chez les patients avec MRC et diabète de type 2 pour le contrôle glycémique si celui-ci est insuffisant malgré l’utilisation de la metformine et d’un inhibiteur SGLT2, particulièrement en présence d’un risque cardiovasculaire important (1). Les résultats de l’étude FLOW, récemment publiés, confirment que le sémaglutide, un agoniste des récepteurs GLP1, est un traitement efficace pour ralentir la progression de la MRC et réduire la survenue d’événements cardiovasculaires chez des patients diabétiques de type 2 (17). Les agonistes GLP1 seraient donc le quatrième pilier du traitement néphro- et cardio-protecteur chez les patients avec MRC et diabète, les 3 premiers étant les inhibiteurs du système rénine-angiotensine-aldostérone, les inhibiteurs SGLT2 et les antagonistes non-stéroïdiens du récepteur minéralcorticoïde (Figure 3). Des études sont en cours pour évaluer l’efficacité des agonistes GLP1 chez les patients atteints de MRC sans diabète.
La réduction du risque cardiovasculaire chez les patients MRC comprend également le contrôle du profil lipidique : les statines et/ou l’ezetimibe sont recommandés chez les patients avec MRC âgés de ≥ 50 ans et/ou ceux à haut risque cardiovasculaire (1).

La sous-utilisation des traitements néphro- et cardio-protecteurs chez les patients avec MRC
Malgré les preuves très solides de l’efficacité des approches thérapeutiques discutées dans le chapitre précédent, leur sous-utilisation chez les patients atteints de MRC est bien documentée (7). Ceci résulte du dépistage insuffisant de la MRC, de la réticence des médecins à initier un nouveau traitement de peur des effets secondaires potentiels, d’un problème d’accès / de remboursement des médicaments dans certains pays et de la faible adhérence du patient associée à la polymédication. Une adoption parfois tardive par les cliniciens des recommandations fréquemment renouvelées peut aussi contribuer à la sous-utilisation des traitements efficaces.
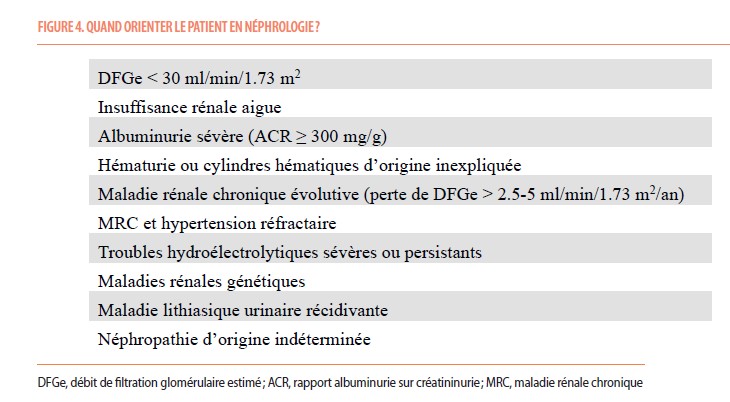
Le dépistage précoce de la MRC, l’augmentation de la sensibilisation au problème de sous-traitement, et le renforcement de la collaboration entre professionnels de soins de santé amélioreraient la prise en charge des patients atteints de MRC. Nous proposons des situations où la consultation en néphrologie pourrait être bénéfique (Figure 4).
Conclusion
La maladie rénale chronique est un problème majeur de santé publique : elle est pourtant très fréquemment sous-diagnostiquée. La mesure du DFG et de l’albuminurie devrait être proposée régulièrement chez les patients porteurs de comorbidités, tels que les patients diabétiques, hypertendus et/ou avec maladie cardiovasculaire notamment. Un diagnostic précoce de la maladie rénale chronique et sa prise en charge permettent de réduire le risque de progression de la MRC et la survenue de complications cardiovasculaires. Les cliniciens doivent être informés des nouvelles thérapies néphro- et cardio-protectrices.
Références
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024; 105(4):S117-S314. doi:10.1016/j.kint.2023.10.à18.
- Jager J K, Kovesdy C, Langham R, Rosenberg M, Jha V, Zoccali C. A single number for advocacy and communication — worldwide more than 850 million individuals have kidney diseases. Nephrol Dial Transplant. 2019; 34(1):1803-1805. doi:10.1093/ndt/gfz174.
- Foreman KJ, Marquez N, Dolgert A, Fukutaki K, Fullman N, McGaughey M, et al. Forecasting life expectancy, years of life lost, and all-cause and cause-specific mortality for 250 causes of death: reference and alternative scenarios for 2016–40 for 195 countries and territories. Lancet. 2018; 392: 2052–2090. doi:10.1016/S0140-6736(18)31694-5.
- Jadoul M, Aoun M, Masimango Imani M. The major global burden of chronic kidney disease. Lancet Glob Health. 2024; 12(3):e342-e343. doi:10.1016/S2214-109X(24)00050-0.
- Krishnan A, Teixeira-Pinto A, Lim WH, Howard K, Chapman JR, Castelis A, et al. Health-Related Quality of life in People Across the Spectrum of CKD. Kidney Int Rep. 2020; 5(12):2264-2274. doi:10.1016/j.ekir.2020.09.028.
- Vanholder R, Annemans L, Brown E, Gansevoort R, Gout-Zwart JJ, Lameire N, et al. Reducing the costs of chronic kidney disease while delivering quality health care: a call to action. Nat Rev Nephrol. 2017; 13(7):393–409. doi:10.1038/nrneph.2017.63.
- Luyckx VA, Tuttle KR, Abdellatif D, Correa-Rotter R, Fung WWS, Haris A, et al. Mind the gap in kidney care: translating what we know into what we do. Kidney Int. 2024; 105:406-417. doi:10.1016/j.kint.2023.12.003.
- Ruilope LM, Ortiz A, Lucia A, Miranda B, Alvarez-Llamas G, Bardaras MG, et al. Prevention of cardiorenal damage: importance of albuminuria. Eur Heart J. 2023; 44(13):1112–1123. doi:10.1093/eurheartj/ehac683.
- Levin A, Okpechi IG, Caskey FJ, Yang CW, Tonelli M, Jha V. Perspectives on early detection of chronic kidney disease: the facts, the questions, and a proposed framework for 2023 and beyond. Kidney Int. 2023; 103(6):1004-1008. doi:10.1016/j.kint.2023.03.009.
- Shlipak MG, Tummalaplli SL, Boulware LE, Grams ME, Ix JH, Jha V, et al. The case for early identification and intervention of chronic kidney disease : conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int. 2021; 99:34-47. doi:10.1016.j.kint.2020.10.012.
- Inker LA, Eneanya ND, Coresh J, Tighiouart H, Wang D, Sang Y, et al. New Creatinine- and Cystatin C- Based Equations to Estimate GFR without Race. N Eng J Med. 2021; 385:1737-1749. doi:10.1056/NEJMoa2102953.
- Pottel H, Bjork J, Rule AD, Ebert N, Eriksen BO, Dubourg L, et al. Cystatin C-Based Equation to Estimate GFR without the Inclusion of Race or Sex. N Eng J Med. 2023; 388(4): 333-343. doi:10.1056/NEJMoa2203769.
- Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2022; 102(5S), S1-S127. doi:10.1016/j.kint.2022.06.008.
- Oguz F, Demoulin N, Thissen JP, Jadoul M, Morelle J. Inhibition of sodium-glucose cotransporter 2 to slow the progression of chronic kidney disease. Acta Clin Belg. 2022; 77(4):805-814. doi:10.1080/17843286.2021.1966583.
- Patel SM, Kang YM, Im KA, Neuen BL, Anker SD, Bhatt DL, et al. Sodium-Glucose Cotransporter-2 Inhibitors and Major Adverse Cardiovascular Outcomes: A SMART-C Collaborative Meta-Analysis. Circulation. 2024; 149(23):1789-1801. doi:10.1161/CIRCULATIONAHA.124.069568.
- Agarwal R, Filippatos G, Pitt B, Anker SD, Rossing P, Joseph A, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022; 43(6):474-484. doi:10.1093/eurheartj/ehab777.
- Perkovic V, Tuttle KR, Rossing P, Mahaffey KW, Mann JFE, Bakris G, et al. Effects of Semaglutide on Chronic Kidney Disease in Patients with Type 2 Diabetes. N Engl J Med. 2024; 391: 109-121. doi:10.1056/NEJMoa2403347.
Conflits d’intérêts
MFP déclare l’absence de conflits d’intérêts. EVR déclare des honoraires de conférence de Bayer, Astellas, Baxter Healthcare, des honoraires de consultance de Bayer et un support financier pour la participation à des congrès de CSL Vifor, Pharmacosmos et Bayer. MJ déclare des honoraires de conférence d’Astra-Zeneca, Bayer, Boehringer-Ingelheim et Menarini; des honoraires de consultance d’Astellas, Astra-Zeneca, Bayer, Boehringer-Ingelheim, Cardiorenal, CSL Vifor, GlaxoSmithKline, Stada Eurogenerics et Vertex; un support financier pour la participation à des congrès d’Astra-Zeneca et Boehringer-Ingelheim; une subvention de recherche d’Astra-Zeneca (sans lien avec cet article); il déclare aussi être co-chair de Kidney Disease: Improving Global Outcomes (KDIGO). Les subventions sont versées sur un compte recherche des Cliniques universitaires Saint-Luc. ND déclare des honoraires de conférence de CSL Vifor, des honoraires de consultance d’Otsuka Pharmaceuticals et GlaxoSmithKline; un support financier pour la participation à des congrès de CSL Vifor, GlaxoSmithKline, Bayer et AstraZeneca; et des subventions de recherche de Otsuka Pharmaceuticals (sans lien avec cet article).
Affiliations
Service de Néphrologie, Cliniques universitaires Saint-Luc, UCLouvain, Bruxelles
Correspondance
Pre Nathalie Demoulin
Cliniques universitaires Saint-Luc
Service de Néphrologie
Avenue Hippocrate 10
B-1200 Bruxelles
T +32 2 7641855, F +32 2 7642836