INTRODUCTION
La fibrillation atriale non valvulaire (FANV) et la maladie thrombo-embolique veineuse (MTEV) représentent les deux indications majeures justifiant l’instauration d’un traitement anticoagulant oral. Introduits au cours des dernières années, de nouveaux anticoagulants oraux, inhibant de façon directe et ciblée soit le facteur Xa (FXa) soit le facteur IIa (thrombine), se sont imposés comme des agents thérapeutiques de choix pour ces deux indications soit en première intention soit en remplaçant un antivitamine K. Il s’agit du dabigatran (Pradaxa®), du rivaroxaban (Xarelto®) et de l’apixaban (Eliquis®) [1-4]. S’y ajoute aujourd’hui l’edoxaban (Lixiana®), un inhibiteur du FXa récemment validé tant chez les patients en FANV qu’avec une MTEV dans le cadre respectivement des vastes études cliniques ENGAGE-AF et HOKUSAI [5;6].
Cet article se propose de synthétiser, d’analyser, d’interpréter et surtout de traduire en recommandations pratiques pertinentes les résultats des principales études qui concernent ce nouvel anticoagulant oral dont le corps médical appréciera la qualité des essais cliniques, les atouts et les avantages.
EDOXABAN ET MALADIE THROMBOEMBOLIQUE VEINEUSE : L’ÉTUDE HOKUSAI-VTE
Le rôle et les propriétés de l’edoxaban dans la prise en charge de la MTEV ont été évalués dans le cadre de l’étude HOKUSAI-VTE publiée dans le New England Journal of Medicine [5].
L’étude HOKUSAI-VTE, ainsi nommée en hommage au peintre japonais Katsushika Hokusai, est une étude randomisée en double-aveugle conçue pour évaluer l’efficacité et la sécurité de l’edoxaban par rapport au traitement classique (HBPM ou HNF et relais par warfarine) dans le traitement de la thrombose veineuse profonde (TVP) proximale (à partir de la veine poplitée) et de l’embolie pulmonaire (EP). L’étude HOKUSAI-VTE a été menée de janvier 2010 à octobre 2012, dans 439 centres répartis dans 37 pays.
PROTOCOLE DE L’ÉTUDE
Etaient éligibles pour l’étude les patients de 18 ans ou plus, présentant une TVP symptomatique impliquant la veine poplitée, fémorale ou iliaque ou une EP symptomatique (avec ou sans TVP associée). Les critères d’exclusion de l’étude étaient définis tel qu’il suit : contre-indications à l’héparine ou à la warfarine, plus de 48h d’héparine à dose anticoagulante, prise de plus d’une dose d’AVK, cancer justifiant un traitement par héparine au long cours, autre indication d’anticoagulation par warfarine, traitement par acide acétylsalicylique (AAS) > 100 mg ou bithérapie antiplaquettaire, insuffisance rénale caractérisée par une clairance de créatinine < 30 ml/min.
De façon originale, tous les patients ont initialement été traités, en ouvert, par une HBPM (enoxaparine) ou une héparine non fractionnée durant au moins 5 jours (durée médiane: 7 jours). L’edoxaban ou la warfarine étaient, au contraire, administrés en double aveugle et double placebo. L’edoxaban (ou le placebo) a été débuté, après l’arrêt du traitement initial par héparine, à la dose de 60 mg/j, en une prise quotidienne avec ou en dehors des repas. Pour les patients à plus haut risque hémorragique, la dose a été réduite de moitié (30 mg/jour), à savoir les patients présentant une clairance de créatinine comprise entre 30 et 50 ml/min (6-7%), un poids ≤ 60 kg (12-13%), ou encore, ceux qui prenaient parallèlement un inhibiteur puissant de la glycoprotéine P, l’edoxaban étant un substrat de ce transporteur (au total près de 18% des patients ont reçu une dose réduite). Au contraitre, la warfarine (ou le placebo) a été débutée en même temps que l’héparine, en visant des valeurs de l’INR entre 2 et 3. Le traitement par héparine n’a été interrompu qu’après obtention de 2 valeurs d’INR dans la fourchette thérapeutique.
Les patients ont été traités pour une période d’anticoagulation minimale de 3 mois. Après 3 mois, les praticiens ont pu adapter la durée du traitement anticoagulant en fonction de leur jugement clinique, de l’évolution des recommandations internationales ou de la préférence des patients. Tous les patients ont été suivis pendant 12 mois au total, quelle que soit la durée du traitement anticoagulant, permettant ainsi une comparaison du suivi entre les groupes.
Les critères de jugement primaires d’efficacité étaient les suivants : incidence de récidives d’événements thromboemboliques veineux symptomatiques, définies comme un critère composite incluant les TVP ou les EP fatales ou non. Les critères de jugement secondaires d’efficacité étaient les critères de jugement primaires et les décès d’origine cardiovasculaire ou autre. Le critère de jugement principal de sécurité était l’incidence de saignements cliniquement significatifs, c’est-à-dire nécessitant l’intervention du médecin ou l’arrêt du traitement ou perturbant les activités habituelles du patient, que ce saignement soit majeur (nécessitant une transfusion ≥ 2 unités) ou non majeur cliniquement significatif. Le bénéfice clinique net était défini sur base du taux de récidive de MTEV symptomatique et de saignements majeurs.
CARACTÉRISTIQUES DES PATIENTS INCLUS
Un total de 8292 patients ont été recrutés, parmi lesquels 4921 (60%) présentaient une TVP, et 3319 (40%) une EP. L’âge moyen était de 55 ans chez les premiers, et 57 ans chez les seconds. On note la présence de 9-10% de patients avec des antécédents de cancer dans les deux groupes, tandis que le taux d’accidents thrombo-emboliques non provoqués ou idiopathiques était de l’ordre de 65%.
Chez les patients ayant une EP, des analyses ont été réalisées dans des sous-groupes prédéfinis en fonction de la présence d’une dysfonction ventriculaire droite. Celle-ci a été définie par un taux de N-terminal pro-Brain Natriuretic Peptide (NT-pro-BNP) à l’inclusion ≥ 500 pg/ml et un rapport diamètre VD/VG (Ventricule Droit/ Ventricule Gauche) ≥ 0,9 évalué par un examinateur indépendant par CT-scan. Parmi les patients victimes d’une EP, une proportion importante soit 35% des patients présentaient une dysfonction ventriculaire droite.
En pratique, 40% des patients ont été traités durant 12 mois. On note que chez les patients traités par la warfarine, l’INR était situé dans la fourchette thérapeutique 63,5% du temps (17,6% > 3 et 18,9% < 2). S’agissant de l’edoxaban, une observance d’au moins 80% a été constatée chez 99% des patients.
RÉSULTATS : UNE NON-INFÉRIORITÉ DÉMONTRÉE
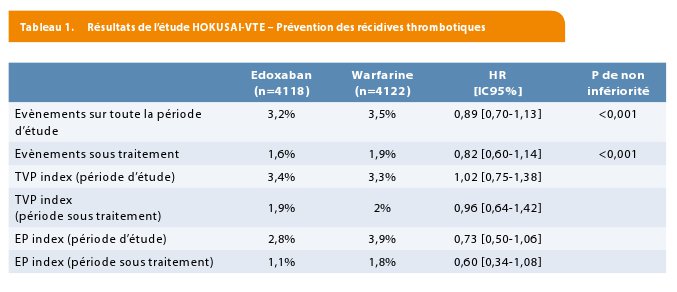
En ce qui concerne l’efficacité, les principaux résultats sont résumés dans le tableau 1. Les données confirment clairement la non-infériorité du traitement par edoxaban par rapport au traitement par Warfarine. Le taux de récidive était en effet de 3,2% dans le groupe edoxaban et 3,5% dans le groupe warfarine (non-infériorité de l’edoxaban).
Parmi les patients avec EP et dysfonction VD (NT-proBNP > 500 pg/mL), 3,3% d’évènements sont survenus durant l’étude dans le groupe traité par edoxaban, contre 6,2% dans le groupe warfarine (HR : 0,52 ; [0,28-0,98]). Lorsque la dysfonction VD a été établie par CT-scan, le HR est de 0,42 ([0,15-1,20]). Chez les patients traités par une dose réduite de 30 mg/j d’edoxaban, par rapport à des patients similaires sous warfarine, 3% ont récidivé contre 4,2% (le HR d’évènement 0,73 ([0,42-1,26]).
UN PROFIL DE SÉCURITÉ HÉMORRAGIQUE TOUT À FAIT FAVORABLE
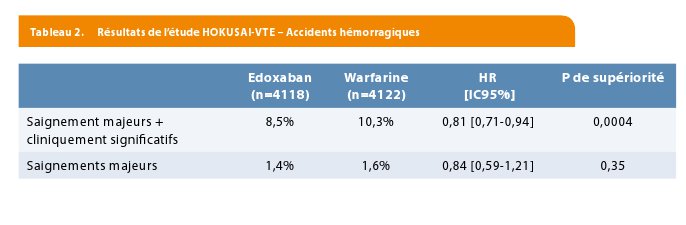
En ce qui concerne la sécurité hémorragique durant la période sous traitement, les résultats sont détaillés dans le tableau 2. On a relevé 8,5% de saignements significatifs (majeurs ou non) dans le groupe edoxaban et 10,3% dans le groupe warfarine (p = 0,004 pour supériorité de l’edoxaban). Il n’y avait toutefois pas de différence pour les saignements majeurs (1,4% sous edoxaban et 1,6% sous warfarine). Dans le groupe traité par 30 mg d’edoxaban, l’incidence de saignement cliniquement significatif était de 7,9% versus 12,8% sous warfarine. On note finalement l’observation de 5 saignements intracrâniens non fatals dans le groupe edoxaban, contre 18, dont 6 fatals, dans le groupe warfarine.
ENSEIGNEMENTS DE L’ÉTUDE HOKUSAI-VTE
Après l’apixaban dans l’étude AMPLIFY, le dabigatran dans l’étude RECOVER, et le rivaroxaban dans l’étude EINSTEIN, un nouveau NACO entre en scène et démontre son efficacité et son profil de sécurité dans le cadre du traitement aigu de la MTEV.
Chez près de 5000 patients présentant une thrombose veineuse profonde (TVP) et 3300 patients victimes d’une embolie pulmonaire (EP), l’étude HOKUSAI-VTE montre la non-infériorité du traitement par HBPM/HNF et relais par edoxaban par rapport au traitement standard (HBPM/ HNF-warfarine) en ce qui concerne l’efficacité, et une supériorité sur le risque hémorragique du moins en ce qui concerne les risques de saignement intra-crânien et fatal (pas d’effet significatif en ce qui concerne les saignements majeurs).
Il s’agit une étude menée avec une très grande rigueur méthodologique et dont les résultats sont sans aucun doute très pertinents. Le recours à une phase initiale d’héparinothérapie pourrait être considéré comme une limite d’HOKUSAI-VTE. Compte tenu de l’acceptation générale et de la confiance dans un traitement parentéral initial, l’initiation par l’héparine a encouragé les investigateurs à enrôler une proportion importante de patients avec des accidents thromboemboliques veineux sévères. L’étude HOKUSAI-VTE se caractérise en effet par la sévérité des accidents thromboemboliques, près de 40% des TVP affectant la veine ilio-fémorale ou la veine fémorale commune et près de 45% des EP étant qualifiées d’anatomiquement étendues (plus de 25%). De nombreux cliniciens hésitent en effet actuellement à traiter un accident thromboembolique veineux sévère d’emblée par un nouvel anticoagulant oral et privilégient un traitement initial par HBPM largement validé. Ceci explique probablement la proportion des patients avec accidents sévères inclus dans l’étude HOKUSAI-VTE.
L’étude HOKUSAI-VTE a également clairement validé l’intérêt d’une réduction de posologies d’un nouvel anticoagulant chez les patients davantage à risque hémorragique compte tenu d’une altération de la fonction rénale, d’un faible poids ou d’une co-médication avec un inhibiteur puissant de la glycoprotéine-P. En termes de durée de traitement, si elle était de minimum 3 mois, une durée fixe n’a pas été imposée à tous les patients qui ont bénéficié d’une durée variable et flexible de 3 à 12 mois, en moyenne de 7 mois. Ceci reflète la réalité de la pratique et la durée souvent variable de traitement anticoagulant dont bénéficient les patients. Soulignons également la qualité de l’anticoagulation obtenue chez les patients traités par AVKs contribuant à la validité de la comparaison, l’excellent degré de compliance des patients et le nombre très limité de patients perdus au cours de l’étude (11 au total sur un effectif initial de plus de 8000 patients).
Dans le groupe traité pour EP sévère, l’edoxaban a clairement démontré sa supériorité par rapport à la warfarine. Ceci confirme la difficulté de gérer l’anticoagulation par AVK en cas d’EP massive, responsable d’une congestion hépatique. Ces résultats démontrent surtout l’intérêt d’avoir recours à des anticoagulants dont l’effet pharmacocinétique et pharmacodynamique est plus prévisible chez les patients avec une EP sévère.
En termes de sécurité, l’étude HOKUSAI-VTE démontre clairement la supériorité de l’edoxaban par rapport aux AVKs, y compris dans le groupe traité par une plus faible dose, par une réduction du taux de saignements intra-crâniens et fatals (mais non significative en ce qui concerne les saignements majeurs).
Malgré ces forces, cette étude laisse quelques questions sans réponses. Même si cela ne fait pas partie des critères d’évaluation classiques dans ce type d’étude, il aurait été utile de faire en sorte que les patients bénéficient d’une évaluation par imagerie (Echo-doppler veineux ou scintigraphie V/P) en fin de traitement pour démontrer objectivement la résolution des thrombi. Ce type de démarche est de plus en plus fréquent en routine clinique. Il serait également utile de bénéficier des résultats d’une étude de prévention secondaire au long cours, comparant l’efficacité d’une faible dose d’edoxaban par rapport au placébo ou à une faible dose d’aspirine dans la prévention prolongée des récidives après une phase de traitement curatif de plusieurs mois. Les bénéfices de l’edoxaban pour le traitement des accidents thrombo-emboliques veineux survenant dans un contexte de cancer actif doivent encore être démontrés. L’étude HOKUSAI-VTE n’a finalement pas inclus de patients avec une TVP distale, qui représentent une importante proportion des patients pris en charge en médecine générale. Finalement, même si une anticoagulation initiale par HBPM est bienvenue chez les patients pris en charge avec une maladie sévère en milieu hospitalier, il serait utile de définir les modalités d’anticoagulation (posologie) et les critères de sélection des candidats pouvant bénéficier d’une monothérapie par l’edoxaban, bien plus facile à manipuler en ambulatoire et en médecine générale.
EDOXABAN ET FIBRILLATION ATRIALE : L’ÉTUDE ENGAGE-AF
L’étude ENGAGE-AF (Effective aNticoaGulation with factor xA next GEneration in Atrial Fibrillation), a comparé une dose de 60 mg et une dose de 30 mg d’edoxaban 1x/j avec la warfarine chez des sujets en FANV à risque modéré à sévère d'accident thrombo-embolique.
Protocole
Pas moins de 1.393 centres répartis dans 46 pays ont pris part à cette étude de phase III, randomisée et en double aveugle, dont la phase d’inclusion a eu lieu entre novembre 2008 et novembre 2010. Une clairance estimée de la créatinine inférieure à 30 ml/min constituait un critère d’exclusion. La dose de warfarine était ajustée de manière à obtenir un INR entre 2 et 3. La dose d’edoxaban, qu’il s’agisse de la dose élevée (60 mg) ou de la dose faible (30 mg), était réduite de moitié lorsque la clairance estimée de la créatinine était située entre 30 et 50 ml/min, lorsque le poids corporel était égal ou inférieur à 60 kg et en cas de prise concomitante d'un inhibiteur puissant de la glycoprotéine-P
Le critère principal d’évaluation retenu pour apprécier l’efficacité était l’incidence combinée des accidents vasculaires cérébraux, ischémiques ou hémorragiques, et des embolies systémiques. Le critère principal d’évaluation sur le plan de la sécurité était le taux de saignements majeurs, ces derniers étant définis en se basant sur les critères de l’International Society on Thrombosis and Haemostasis (6).
Caractéristiques des patients inclus
Un total de 21.105 patients ont été randomisés dont 7036 dans le groupe warfarine, 7035 dans le groupe edoxaban forte dose (60 mg réduite à 30 mg chez 1784) et 7034 dans le groupe edoxaban faible dose (30 mg réduite à 15 mg chez 1785 patients).
Dans cette étude 5251 patients ont finalement reçu une dose de 60 mg, 7033 une dose de 30 mg et 1785 une dose de 15 mg. Si une majorité des patients a reçu une dose de 30 mg, tous ces patients ne sont pas comparables. En effet, 5249 patients ont dès le début de l’étude été assignés par randomisation au bras de traitement à faible dose (30 mg) et leur dose n’a pas été réduite à 15 mg parce qu’ils ne présentaient pas au minimum un des 3 critères de réduction détaillés ci-dessus (insuffisance rénale, faible poids, utilisation concomitante d’un inhibiteur de glycoprotéine-P). S’y sont rajoutés 1784 patients initialement assignés à une dose de 60 mg mais dont la posologie a été réduite compte tenu d’un des critères de réduction de dose. La population de patients de l’étude traitée par une dose de 30 mg/jour est donc hétérogène et son analyse doit tenir compte de cet aspect.
L’âge médian des patients était de 72 ans. Le score CHADS2 moyen était de 2,8. La durée moyenne d’exposition au traitement a été de 907 jours, le suivi médian de 2,8 ans. Le nombre de sujets qui ont terminé l’étude sans interruption de traitement a été moins élevé dans le groupe warfarine (n = 2.420) que dans le groupe edoxaban à dose élevée (n = 2.621) et que dans le groupe edoxaban à dose faible (n = 2.673), la différence étant significative lorsqu’on compare les deux doses d’edoxaban avec la warfarine (P < 0,001).
Dans le groupe warfarine, le temps médian en zone thérapeutique représentait 68,4% de la période de traitement, le temps moyen en représentait 64,9%. Le pourcentage de données manquantes est extrêmement faible, puisqu’il n’est que de 0,5%.
Résultats de l’étude ENGAGE-AF
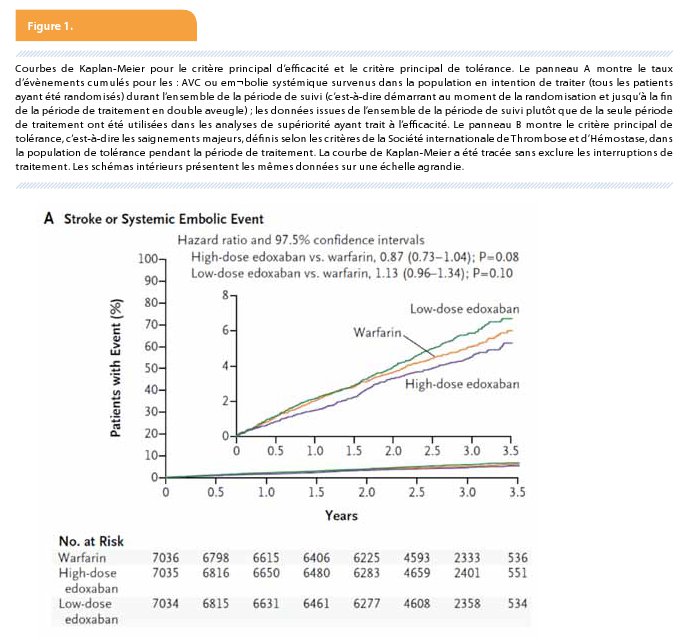
Durant la période de traitement le taux d’accidents vasculaires cérébraux et d’embolies systémiques a été de 1,5%/an dans le groupe warfarine et de 1,18% dans le groupe edoxaban 60 mg 1x/j (HR 0,79 (0,63-0,99), P < 0,001 pour la non-infériorité). Il a été de 1,61% dans le bras edoxaban 30 mg/j (HR 1,07 (0,87-1,31), P = 0,005 pour la non-infériorité). L’analyse pré-spécifiée de supériorité montre une tendance en faveur de la dose élevée d’edoxaban par rapport à la warfarine: taux annualisé pour le critère principal d’évaluation de 1,57% pour l’edoxaban 60 mg 1x/j et de 1,80% pour la warfarine: HR 0,87 (0,73-1,04; P = 0,08).
L’incidence des accidents vasculaires cérébraux ischémiques est comparable chez les patients traités par edoxaban 60 mg Ix/j et chez ceux qui sont traités par warfarine. Elle est toutefois plus élevée pour l’edoxaban 30 mg 1x/j que pour la warfarine. Suite à ce résultat, le dosage 30 mg 1x/j (réduit à 15 mg 1x/j chez les patients présentant l’un des 3 critères de réductions de dose) n’a pas été soumis pour approbation auprès de l’EMA. L’incidence des accidents vasculaires cérébraux hémorragiques est significativement moindre pour les deux doses d’edoxaban comparées avec la warfarine (Figure 1).
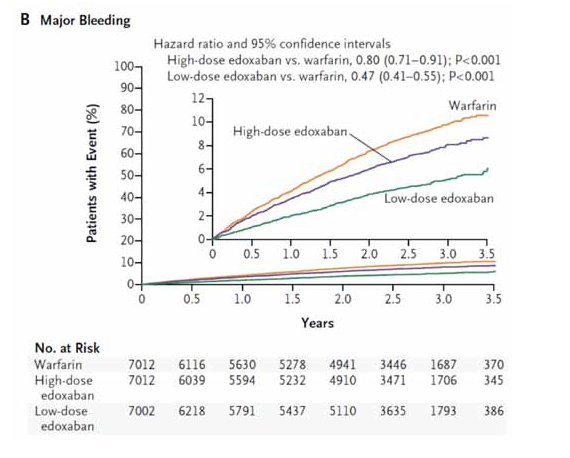
Le taux annualisé de saignements majeurs est de 3,43% avec la warfarine et de 2,75% avec la dose élevée d’edoxaban (HR 0,80; 0,71-0,91; P < 0,001). Il est de 1,61% avec la dose faible d’edoxaban (HR 0,47; 0,41-0,55; P < 0,001). Le bénéfice en sécurité de l’edoxaban par rapport à la warfarine s’étend à tous les types d’hémorragies : saignements mettant en jeu le pronostic vital, hémorragies intracrâniennes, saignements majeurs et saignements non majeurs mais cliniquement significatifs (Figure 1). L’incidence annuelle des hémorragies intracrâniennes est de 0,39% pour l’edoxaban 60 mg, de 0,26% pour l’edoxaban 30 mg et de 0,85% pour la warfarine. Pour les saignements mortels, elle est de, respectivement, 0,21% pour l’edoxaban 60 mg, de 0,13% pour l’edoxaban 30 mg et de 0,38% pour la warfarine. La diminution par rapport à la warfarine est significative pour les deux doses d’edoxaban.
La seule exception concerne les saignements gastro-intestinaux majeurs. Ces derniers sont plus fréquents avec l'edoxaban 60 mg qu’avec la warfarine (taux annualisé de 1,51% versus 1,23%), mais plus fréquents avec la warfarine qu’avec l'edoxaban 30 mg (1,23% versus 0,82%).
L’edoxaban est associé à une réduction significative du taux annualisé de mortalité cardiovasculaire et à une augmentation, significative également, du bénéfice clinique net, paramètre englobant les décès toutes causes confondues, les AVC ou embolies systémiques ainsi que les saignements majeurs. Le taux annualisé pour ce paramètre composite est significativement moindre chez les patients traités par edoxaban, à dose élevée ou faible.
L’ajustement de la dose d’edoxaban de 60 à 30 mg a été validé dans une sous-analyse qui a évalué les résultats des patients du bras de traitement 60 mg qui ont reçu effectivement 60 mg d’edoxaban 1x / jour (environ 5000 patients), et également les résultats des 1784 patients de ce bras de traitement qui ont effectivement reçu 30 mg d’edoxaban [7]. Cette étude conclut que la stratégie de réduction de dose prévient à la fois une concentration excessive de l’edoxaban et des risques hémorragiques excessifs. La modification de la dose d’edoxaban dans cette étude montre une efficacité relative conservée et une sécurité plus élevée. Cette réduction permet donc d’optimaliser l’équilibre entre les évènements ischémiques et hémorragiques.
Enseignements de l’étude ENGAGE-AF
L’edoxaban à la dose quotidienne de 60 mg et réduite à 30 mg chez certains patients n’est pas inférieur à la warfarine en prévention des accidents vasculaires cérébraux et des embolies systémiques chez les patients en FANV à risque modéré à sévère. L’edoxaban permet par ailleurs de réduire de manière significative le risque d’hémorragies majeures et des saignements mettant en jeu le pronostic vital. Le bénéfice est également présent chez les patients pour lesquels une diminution de la dose s’est avérée nécessaire en raison d’une insuffisance rénale, d’un petit poids corporel ou de la prise concomitante d’un inhibiteur de la glycoprotéine P.
L’étude ENGAGE-AF a le mérite d’avoir évalué à large échelle plusieurs doses d’edoxaban à travers un large spectre (15 à 60 mg) sur base d’un processus de randomisation aveugle complété par le recours strict à une réduction de la posologie de moitié en présence de facteurs de risque d’accumulation. Il en ressort que la dose standard est de 60 mg, et celle-ci doit, au bénéfice du patient, être réduite de moitié en cas de facteur de risque d’accumulation de l’edoxaban.
L’étude ENGAGE-AF démontre aussi clairement que l’adoption d’emblée d’une faible dose de 30 mg doit être évitée et que le recours à des doses plus faibles de 15 mg est également inapproprié. Il s’agit d’informations critiques issues de cette étude si l’on tient compte du fait qu’un des grands défis de l’anticoagulation avec les nouveaux anticoagulants oraux est d’identifier individuellement la posologie la plus adéquate. Il est également important de souligner l’importance de l’effectif traité avec une réduction active de la posologie (passage de 60 à 30 mg), ce qui différentie l'edoxaban des autres anti-Xa récemment validés.
Comme les autres anticoagulants ciblant le FXa, l'edoxaban même à la dose de 60 mg n’est pas supérieur à la warfarine pour la prévention des accidents vasculaires cérébraux ischémiques, un atout que seul détient actuellement le Pradaxa® à la dose de 150 mg deux fois par jour. Cependant, à cette posologie de 150 mg, le Pradaxa® montre un profil de sécurité moins favorable. Comme les autres nouveaux anticoagulants oraux, l'edoxaban affiche sa supériorité par rapport aux AVK en termes de survenue d’accidents hémorragiques cérébraux alors que le risque d’hémorragie digestive est pour sa part accru.
Au-delà des résultats de l’étude ENGAGE-AF, l'edoxaban présente plusieurs atouts mis en lumière par le vaste programme de développement clinique que résume le tableau 3.

CONCLUSIONS
Ces deux études cliniques démontrent sans ambiguïté l’efficacité et la bonne tolérance de ce nouvel anticoagulant oral dans ces deux indications par rapport aux anticoagulants classiques. Elles établissent surtout le rôle d’une posologie standard de 60 mg d’edoxaban administrée une fois par jour et démontrent l’intérêt et l’efficacité d’une réduction à 30 mg par jour chez certains patients à risque d’accumulation. Cet article résume également les principales propriétés de l'edoxaban qui devrait s’imposer comme un agent anticoagulant prometteur pour les patients avec MTEV ou FANV.
Correspondance
Pr. Cédric Hermans
Cliniques universitaires Saint-Luc
Hématologie
Hémostase - Thrombose/hémophilie
Avenue Hippocrate 10
B-1200 Bruxelles
Belgique
Références
1 Connolly SJ, Wallentin L, Ezekowitz MD, Eikelboom J, Oldgren J, Reilly PA, et al. The Long-Term Multicenter Observational Study of Dabigatran Treatment in Patients With Atrial Fibrillation (RELY-ABLE) Study. Circulation 2013;128:237-243.
ouvrir dans Pubmed
2 Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139-1151.
ouvrir dans Pubmed
3 Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883-891.
ouvrir dans Pubmed
4 Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981-992.
ouvrir dans Pubmed
5 Buller HR, Decousus H, Grosso MA, Mercuri M, Middeldorp S, Prins MH, et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013;369:1406-1415.
ouvrir dans Pubmed
6 Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369:2093-2104.
ouvrir dans Pubmed
7 Ruff CT, Giugliano RP, Braunwald E2, Morrow DA, Murphy SA, Kuder JF, Deenadayalu N, Jarolim P, Betcher J, Shi M, Brown K, Patel I, Mercuri M, Antman EM. Association between edoxaban dose, concentration, anti-Factor Xa activity, and outcomes: an analysis of data from the randomised, double-blind ENGAGE AF-TIMI 48 trial. Lancet. 2015 Jun 6;385(9984):2288-95.
ouvrir dans Pubmed