Une nouvelle convention 2016 en matière d’autogestion des patients atteints de diabète sucré
Vanessa Preumont, Dominique Maiter
Les patients diabétiques adultes[1] peuvent être inclus dans un programme de soins multidisciplinaires, mis en place par des centres spécialisés. Ce système de convention a été modifié depuis le 1er juillet 2016 (1). Nous résumons ci-dessous les modifications les plus importantes à l’attention de nos confrères médecins généralistes et autres spécialistes.
Tous les bénéficiaires de la convention doivent dorénavant disposer d’un Dossier Médical Global (DMG) ou être inscrits dans une Maison Médicale pour pouvoir bénéficier de la convention. En l’absence de DMG, une prise en charge transitoire de 6 mois peut être obtenue mais celle-ci ne sera renouvelée que si le patient se met en ordre entretemps.
Le matériel d’autosurveillance délivré dépend du groupe de convention. Les nouveaux groupes de convention sont les suivants :
Groupe A.
1. Les patients qui souffrent de diabète de type 1 et les patients avec une perte totale de la fonction endocrine du pancréas (par exemple après une pancréatectomie totale). Tous ces patients ont besoin d’une insulinothérapie complexe (traitement au moyen d’une pompe à insuline ou de schémas de traitement complexes).
2. Les patients souffrant de diabète de type 1 qui n’ont temporairement pas ou moins besoin d’une insulinothérapie complexe (phase « honey-moon »). Pour déterminer leur glycémie et en concertation avec l’équipe de diabétologie, les bénéficiaires de ce groupe peuvent opter pour :
- soit les tests classiques de glycémie capillaire par piqûre au doigt ;
- soit le nouveau système de mesure continue de la glycémie par capteur. La prise en charge est complète sur le plan financier.
Groupe B.
1. Les patients diabétiques qui souffrent de diabète de type 2 ou d’autres formes de diabète et qui ont besoin, pour la gestion de leur diabète, d’un traitement complexe au moyen de minimum 3 injections quotidiennes d’insuline ;
2. Les femmes qui présentent un diabète de grossesse, traitées avec de l’insuline ;
3. Les patients diabétiques après une transplantation d’organe ;
4. Les patients diabétiques sous insuline pris en charge en dialyse rénale. Pour déterminer leur glycémie et en concertation avec l’équipe de diabétologie, les bénéficiaires de ce groupe peuvent opter pour :
- soit les tests classiques de glycémie capillaire par piqûre au doigt;
- soit le nouveau système de mesure continue de la glycémie par capteur.
Dans ce dernier cas, la prise en charge n’est pas complète et l’établissement facture un supplément de 2,52 € au patient, pour chaque jour pour lequel il a fourni du matériel.
Groupe C.
1. Les patients diabétiques traités par deux injections d’insuline et/ou par une injection d’insuline et une injection d’analogue du GLP-1 de manière quotidienne ou hebdomadaire. Ces patients doivent également présenter une multi-morbidité qui se caractérise par l’apparition d’une situation médicale grave à côté du diabète (par exemple : une affection oncologique, une BPCO avec corticoïdes, un nouveau diagnostic de diabète après un infarctus aigu du myocarde, un AVC, …). Ces bénéficiaires sont pris en charge de manière temporaire par l’établissement, pas plus de 6 mois, et seulement après concertation préalable avec le médecin généraliste.
2. Les patients qui répondent à l’une des situations suivantes:
2.1. Les diabétiques non insulino-requérants ayant bénéficié d’une transplantation d’organe ou pris en charge en dialyse rénale ;
2.2. Les patients présentant des hypoglycémies organiques (insulinome, glycogénose,…) ;
2.3. Les femmes présentant un diabète de grossesse, traitées sans insuline ;
2.4. Les femmes diabétiques non insulino-requérantes qui souhaitent être enceintes. Pour déterminer leur glycémie, les bénéficiaires de ce groupe doivent utiliser les tests classiques de glycémie capillaire par piqûre au doigt.
Trajets de soins
Les bénéficiaires visés sont les patients souffrant d’un diabète de type 2 qui ont conclu un « contrat trajet de soins » ou qui ont l’intention de signer un tel contrat. Ces patients sont traités par 1 ou 2 injections quotidiennes d’insuline, 1 injection d’insuline et/ou 1 injection d’analogues du GLP-1 (administré de manière quotidienne ou hebdomadaire), ou sont des patients qui devront prochainement bénéficier d’un traitement injectable. Le programme de soins multidisciplinaires est dans ce cas mis en place par le médecin généraliste. Les modalités pratiques du trajet de soins ne sont pas modifiées.
Référence
1. http://www.inami.fgov.be/SiteCollectionDocuments/convention_diabete_auto....
Le nouveau système flash d’auto-surveillance de la glycémie
Stéphanie Rouhard, Vanessa Preumont
Le 20 juin 2016, l’INAMI a approuvé une nouvelle convention concernant la prise en charge des patients diabétiques (voir ci-dessus). Ces changements permettent notamment le remboursement d’une nouvelle technique d’autocontrôle glycémique par scanning. Elle s’adresse prioritairement aux patients inscrits dans la catégorie A de convention, c’est-à-dire les patients diabétiques de type 1 et/ou ceux présentant une perte totale de la fonction endocrine du pancréas (ex: après pancréatectomie totale).
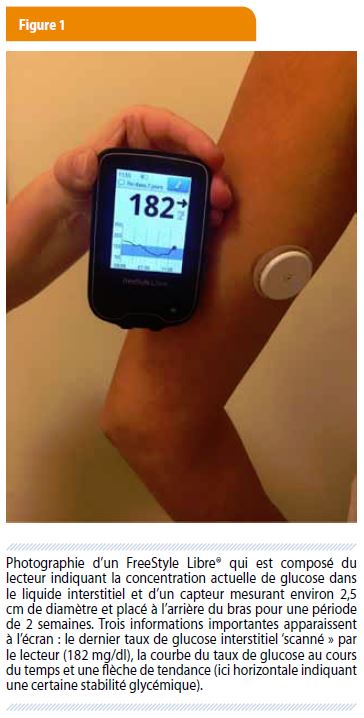
Ce nouveau système d’auto-surveillance de la glycémie (FreeStyle Libre®) peut remplacer les traditionnelles piqûres au bout du doigt. En pratique, cet appareil se compose d’un lecteur et d’un capteur de petite taille (environ le diamètre d’une pièce de 2 euros) qui se place à l’arrière du bras et reste en place pendant 2 semaines (Figure 1). Ce capteur mesure en continu la concentration de glucose dans le milieu interstitiel du sujet, effectue une conversion en ‘glycémie’ et la communique dès lors qu’il est scanné par le lecteur. Le patient diabétique voit alors s’afficher directement sa ‘glycémie’ accompagnée d’une flèche indiquant la tendance glycémique ainsi que, selon l’inclinaison de la flèche, la vitesse de montée ou de descente. Il peut donc prédire l’évolution de sa glycémie et éventuellement anticiper les hyper- ou les hypoglycémies et adapter son comportement en conséquence. De plus, le système fournit des graphiques faciles à lire incluant l’ensemble des glycémies des 24 dernières heures, ce qui permet de connaître les glycémies nocturnes, les valeurs post-prandiales, et la glycémie moyenne permettant d’extrapoler une valeur d’hémoglobine glyquée. Le FreeStyle Libre® permet une meilleure compréhension de la maladie et donc une prise en charge plus efficace (1). Il est cependant important de savoir qu’il existe un délai entre glycémie sanguine et interstitielle d’environ 5 à 20 minutes, dont il faut tenir compte pour interpréter correctement les résultats. Le capteur est par ailleurs étanche et autorise le patient à se doucher, à pratiquer du sport et à nager (maximum 30 minutes). Il est calibré à l’usine et ne nécessite donc pas la réalisation de glycémies capillaires pour étalonner l’appareil.
Une étude prospective (2) menée aux Etats Unis auprès de 72 adultes diabétiques de type 1 et 2 sous insuline a montré une très bonne concordance entre les deux techniques de mesure. La différence moyenne entre les glycémies prises par les deux techniques a été mesurée à 10 %. Une étude chinoise (3) a confirmé l’exactitude des relevés glycémiques obtenus tout en mettant en évidence une amélioration du degré de satisfaction par rapport à la technique. Les comparaisons au système de monitoring glycémique en continu DG4P (Dexcom) montrent également une bonne concordance chez les adultes (4) et chez les enfants (5).
Plusieurs études ont analysé les effets de l’utilisation de ce système sur le contrôle glycémique. Une étude anglaise a mis en évidence une amélioration de 0.5 % du taux d’hémoglobine glyquée dans un groupe de 25 patients diabétiques de type 1 mal équilibrés au départ (HbA1c 8.0 %) après 16 semaines d’utilisation du système (6). Un quart des patients a vu son HbA1c diminuer de 1 % à la fin de l’étude. Les hypoglycémies étaient par ailleurs moins nombreuses. Dans une étude multicentrique, prospective et randomisée, réalisée entre septembre 2014 et février 2015 auprès de 252 patients diabétiques de type 1 bien équilibrés et particulièrement compliants (7), une réduction de 38 % de temps passé en hypoglycémie a été observée après 6 mois dans le groupe de patients utilisant la nouvelle technique. Les questionnaires de satisfaction identifient aussi une réduction de l’anxiété et une amélioration de la qualité de vie chez les utilisateurs du FreeStyle Libre®.
Il faut savoir qu’il existe cependant des effets secondaires liés à ce nouveau dispositif d’auto-surveillance, principalement des réactions allergiques aux capteurs qui sont présentes chez 5-10 % des patients.
En bref, il s’agit d’une technologie innovante et prometteuse qui révolutionne la prise en charge du diabète de type 1. Il sera intéressant d’analyser dans le futur l’effet de cette innovation sur le contrôle glycémique de nos patients diabétiques « dans la vraie vie ».
Références
1. Matthaei S. Assessing the value of the ambulatory glucose profile in clinical practice. Br J Diabetes Vasc Dis 2014; 14: 148-152.
ouvrir dans Pubmed
2. Bailey T, Bode BW, Christiansen MP, Klaff LJ, Alva S. The Performance and Usability of a Factory-Calibrated Flash Glucose Monitoring System. Diabetes Technol Ther. 2015; 17: 787-794.
ouvrir dans PubMed
3. Ji, Guo, Guo, Ren, Yu, Zhang. A multicenter evaluation of the performance and usability of a novel glucose monitoring system in chinese adults with diabetes. J Diabetes Sci Technol 2016; Epub ahead of print, pii 1932296816662884.
ouvrir dans PubMed
4. Bonora B, Maran A, Ciciliot S, Avogaro A, Fadin GP. Head-to-head comparison between flash and continuous glucose monitoring systems in outpatients with type 1 diabetes. J Endocrinol Invest 2016; 39: 1391-1399.
ouvrir dans PubMed
5. Campbell F, Edge J, Acerini C, Hamilton-Shield J, Moudiotis C, Rahman S et al. Clinical accuracy evaluation of freestyle libre flash glucose monitoring system when used by children and young people with diabetes. Diabetes technology and therapeutics 2016; 18: supplement 1.
ouvrir dans PubMed
6. Dover AR, Stimson RH, Zammitt NN, Gibb FW. Flash glucose monitoring improves outcomes in a type 1 diabetic clinic. J Diabetes Sci Technol 2016; Epub ahead of print, pii 1932296816661560.
ouvrir dans PubMed
7. Bolinder J, Antuna R, Geelheod-Duijvestijn P, Kroger J, Weitgasser R. Novel glucose-sensing technology and hypoglycaemia in type 1 diabetes: a multicentre, non-masked, randomised controlled trial. The Lancet 2016; 388: 2254-2263.
ouvrir dans PubMed
Les nouvelles pompes à insuline : une étape supplémentaire vers un pancréas artificiel portable
Laura Orioli, Michel P. Hermans, Bernard Vandeleene
Dans le diabète de type 1, le contrôle strict de la glycémie par une insulinothérapie intensive réduit le risque ainsi que la progression des complications micro- et macro-vasculaires (1,2). Cependant, celui-ci augmente le risque d’hypoglycémies sévères (1), parfois nocturnes et/ou non ressenties, événements parfois vécus de manière dramatique par le patient et son entourage. En conséquence, certains patients entretiennent un sous-dosage chronique en insuline. L’infusion sous-cutanée continue d’insuline par infuseur externe (« pompe ») constitue une alternative au schéma basal-prandial chez des patients sélectionnés (3). Elle présente l’avantage d’individualiser heure par heure l’administration d’insuline alors plus proche de la sécrétion physiologique par le pancréas.
Le couplage d’une pompe à une mesure en continu du glucose interstitiel (CGM ou “continuous glucose monitoring”) a permis la mise au point de logiciels complémentaires pour pompes, interrompant automatiquement l’administration d’insuline en cas d’hypoglycémie et, plus récemment, avant la survenue d’hypoglycémie. Les systèmes en boucle fermée dont le pancréas artificiel bi-hormonal sont en cours d’étude. Ils ont pour but d’adapter automatiquement la quantité d’insuline délivrée sur base des informations du glucose interstitiel transmises par le CGM.
Les avancées que constituent le couplage d’un CGM et d’une pompe ainsi que la fonction d’interruption automatique de l’infusion d’insuline sont présentées dans les paragraphes suivants.
Les apports de la mesure en continu du glucose interstitiel (CGM)
Le CGM est une mesure en continu du glucose interstitiel par un senseur sous-cutané. Il transmet des informations précises relatives au glucose interstitiel, en temps réel et sans fil vers un receveur portable (Figure 2). La mesure du taux de glucose interstitiel est actualisée toutes les 3 à 5 minutes ce qui permet d’identifier les excursions hyper- et hypoglycémiques non détectées par la réalisation d’un profil glycémique habituel à 4 temps et d’établir la tendance de l’évolution du taux de glucose dans les minutes à venir (flèches de tendance).

Le CGM améliore le contrôle glycémique (4) puisqu’il rend possible une adaptation fine et individualisée du traitement insulinique ainsi que des réactions ciblées de la part du patient dans la vie quotidienne. Par exemple, l’alarme « hypo » permet au patient de corriger une hypoglycémie non ressentie qui serait autrement passée inaperçue. Le temps passé en hypoglycémie et plus particulièrement en hypoglycémie sévère diminue (4). Les bénéfices du CGM sont similaires sous schéma basal-prandial et sous pompe (5).
En Belgique, la convention “pompe à insuline” prévoit l’utilisation du CGM chez un nombre limité de patients exclusivement sous pompe. En raison de cette limitation, la survenue d’hypoglycémies sévères peu ou non ressenties reste une des indications principales du CGM.
Les “sensor-augmented pumps” avec et sans interruption automatique de l’infusion d’insuline
Les “sensor-augmented pumps” (SAP) sont des pompes couplées à un CGM. Elles permettent la programmation d’alarmes en cas d’hypo- ou d’hyperglycémies dont les seuils sont déterminés sur base individuelle. Les SAP améliorent le contrôle glycémique comparativement au schéma basal-prandial (6).
Certaines SAP permettent l’interruption automatique de l’infusion d’insuline lorsque le glucose interstitiel chute sous le seuil définissant l’hypoglycémie (Figure 3). L’infusion reprend ensuite automatiquement à la remontée du taux de glucose au-delà de ce seuil. Il a été démontré que la fréquence des épisodes hypoglycémiques modérés à sévères et/ou nocturnes diminue comparativement aux SAP qui ne sont pas dotées de cette fonction d’interruption automatique (7-9).
Récemment introduite, une pompe dotée de la technologie Smartguard® interrompt automatiquement l’infusion d’insuline avant l’hypoglycémie. En effet, l’algorithme de contrôle prévoit la survenue d’une hypoglycémie lorsque le taux de glucose diminue sous un certain seuil et à une certaine vitesse. Les études démontrent l’efficacité et la sécurité d’emploi de cette technologie avec moins d’hypoglycémies et de rebond hyperglycémique et sans davantage de cétose au lever en cas d’interruptions nocturnes.
En ce qui concerne la qualité de vie, les patients sont généralement satisfaits du traitement par pompe. Ils le jugent flexible et compatible avec les activités quotidiennes.
Références
1. The Diabetes Control and Complications Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-986.
ouvrir dans PubMed
2. Lachin JM, Orchard TJ, Nathan DM; the DCCT/EDIC Research Group. Update on cardiovascular outcomes at 30 years of the diabetes control and complications trial/epidemiology of diabetes interventions and complications study. Diabetes Care 2014; 37: 39-43.
ouvrir dans PubMed
3. [No authors listed]. Standards of Medical Care in Diabetes-2016: Summary of Revisions. Diabetes Care 2016; 39: Suppl 1:S4-5.
ouvrir dans PubMed
4. van Beers CA, DeVries JH, Kleijer SJ, Smits MM, Geelhoed-Duijvestijn PH, Kramer MH et al. Continuous glucose monitoring for patients with type 1 diabetes and impaired awareness of hypoglycaemia (IN CONTROL): a randomised, open-label, crossover trial. Lancet Diabetes Endocrinol 2016; 4: 893-902.
ouvrir dans PubMed
5. Garg SK, Voelmle MK, Beatson CR, Miller HA, Crew LB, Freson BJ et al. Use of continuous glucose monitoring in subjects with type 1 diabetes on multiple daily injections versus continuous subcutaneous insulin infusion therapy: a prospective 6-month study. Diabetes Care 2011; 34:574-579.
ouvrir dans PubMed
6. Bergenstal RM, Tamborlane WV, Ahmann A, Buse JB, Dailey G, Davis SN et al; STAR 3 Study Group. Effectiveness of sensor-augmented insulin pump therapy in type 1 diabetes. N Engl J Med 2010; 363: 311-320.
ouvrir dans PubMed
7. Bergenstal RM, Klonoff DC, Garg SK, Bode BW, Meredith M, Slover RH et al; ASPIRE In-Home Study Group. Threshold-based insulin-pump interruption for reduction of hypoglycemia. N Engl J Med. 2013; 369: 224-232.
ouvrir dans PubMed
8. Choudhary P, Shin J, Wang Y, Evans ML, Hammond PJ, Kerr D et al. Insulin pump therapy with automated insulin suspension in response to hypoglycemia: reduction in nocturnal hypoglycemia in those at greatest risk. Diabetes Care 2011; 34:2023-2025.
ouvrir dans PubMed
9. Ly TT, Nicholas JA, Retterath A, Lim EM, Davis EA, Jones TW et al. Effect of sensor-augmented insulin pump therapy and automated insulin suspension vs standard insulin pump therapy on hypoglycemia in patients with type 1 diabetes: a randomized clinical trial. JAMA 2013; 310: 1240-1247.
ouvrir dans PubMed
Les inhibiteurs du SGLT-2: état des lieux
Martin Buysschaert
Les inhibiteurs des transporteurs SGLT-2 sont une classe de médicaments glucorétiques qui amènent en parallèle d’une réduction de l’hémoglobine glycatée une perte pondérale et une amélioration de la tension artérielle chez des patients diabétiques de type 2 (1,2). Pour cet ensemble de raisons, la place de ces médicaments est aujourd’hui – à juste titre – validée dans les recommandations thérapeutiques des Associations internationales de Diabétologie.
En 2015 a été rapporté pour l’empagliflozine (Jardiance®) dans l’essai Empa-Reg un bénéfice cardiovasculaire important chez des patients diabétiques de type 2 à très haut risque et/ou aux antécédents de macroangiopathie (3,4). Pour la dapagliflozine (Forxiga®), nous disposons aussi en 2016 d’une méta-analyse qui a retrouvé chez des sujets diabétiques avec ou sans terrain cardiovasculaire, une tendance identique à la réduction de ce risque avec un hazard ratio (HR) de 0.77 (95% CI : 0.54-1.10) (5).
Sur le plan rénal, comme rapporté par Wanner et al. en 2016, il est intéressant de mentionner que l’essai EMPA-REG a également mis en évidence chez le patient diabétique de type 2 un bénéfice clinique en termes d’évolution de la néphropathie, quelle que soit la filtration glomérulaire à l’inclusion. Une détérioration de la fonction rénale en cours d’étude n’a en effet été constatée que chez 12.7 % des patients traités par empagliflozine vs. 18.8 % sous placebo HR: 0.61 [95 % CI : 0.53-0.70]). Des bénéfices comparables ont été observés dans cette étude pour d’autres paramètres rénaux comme l’évolution vers la macroalbuminurie, le doublement de la créatinine plasmatique ou le recours à la dialyse pendant la période de suivi. Ils pourraient faire suite aux actions « systémiques » déjà décrites des SGLT-2 inhibiteurs, mais aussi, plus spécifiquement, à un effet « intrarénal », avec vasoconstriction de l’artériole afférente du glomérule (correction d’une vasodilatation pathologique) et diminution subséquente de la pression intraglomérulaire, liée à l’activation d’une boucle de rétrocontrôle (dans la macula densa) par l’excès d’apport de sodium urinaire. Des données rénales comparables ont été rapportées pour la dapagliflozine (7,8).
En conclusion, les SGLT-2 inhibiteurs, en 2017, confirment leur intérêt dans la prise en charge de l’hyperglycémie chez les diabétiques de type 2. Ils démontrent également un bénéfice fort en termes de complications cardiovasculaires et rénales.
Références
1. Buysschaert M. Place de la canagliflozine (Invokana®), un nouvel inhibiteur SGLT2 dans le traitement du diabète de type 2. Louvain Med 2014; 133: 686-691.
2. Buysschaert M. La dapagliflozine (Forxiga®) : un nouvel inhibiteur des sglt-2. Quelle position dans le traitement moderne du diabète de type 2 ? Louvain Med 2016; 135: 543-549.
3. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S et al. ; EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373: 2117-2128.
ouvrir dans PubMed
4. Buysschaert M. L’empagliflozine (Jardiance ®), un nouvel hypoglycémiant dans le traitement du diabète de type 2, diminue aussi le risque cardiovasculaire : analyse d’une étude Princeps. Louvain Med 2015; 134: 403-408.
5. Sonesson C, Johansson PA, Johnsson E, Gause-Nilsson I. Cardiovascular effects of dapagliflozin in patients with type 2 diabetes and different risk categories: a meta-analysis. Cardiovasc Diabetol 2016; 15: 37-39.
ouvrir dans PubMed
6. Wanner C, Inzucchi SE, Lachin JM, Fitchett D, von Eynatten M, Mattheus M ; for EMPA-REG OUTCOME Investigators. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016;375: 323-334.
ouvrir dans PubMed
7. Heerspink HJ, Perkins BA, Fitchett DH, Husain M, Cherney DZ. Sodium Glucose Cotransporter 2 Inhibitors in the Treatment of Diabetes Mellitus: Cardiovascular and Kidney Effects, Potential Mechanisms, and Clinical Applications. Circulation 2016; 134: 752-772.
ouvrir dans PubMed
8. Mudaliar S, Alloju S, Henry RR. Can a Shift in Fuel Energetics Explain the Beneficial Cardiorenal Outcomes in the EMPA -REG OUTCOME Study? A Unifying Hypothesis. Diabetes Care 2016 ; 39 : 1115-1122.
ouvrir dans PubMed
Les inhibiteurs de la PCSK9 et évènements cardiovasculaires
Michel P. Hermans
Dans les stratégies destinées à réduire le risque résiduel cardiovasculaire (CV), l’abaissement du cholestérol lié aux lipoprotéines de basse densité (LDL-C) demeure une pierre angulaire. La classe des statines a largement démontré son efficacité clinique, et l’étude IMPROVE-IT a confirmé que baisser davantage le LDL-C par l’adjonction d’ézétimibe à la simvastatine permettait encore de produire un bénéfice en terme CV (-6% d’incidence d’événements CV majeurs au terme de l’essai).
Ceci suggère que des approches thérapeutiques « non-statine » d’abaissement supplémentaire du LDL-C pourraient également se révéler avantageuses en terme CV. Les inhibiteurs de la PCSK9 (PCSK9-I) sont de nouveaux agents hypolipémiants qui inhibent la proprotéine convertase subtilisine/kexine de type 9 (PCSK9), une sérine protéase qui se lie au LDL-R, le récepteur de capture des lipoprotéines de basse densité (LDL). La PCSK9 est un promoteur naturel de la dégradation des LDL-R (Figure 4).

Elle agit en se fixant au complexe [LDL-R+LDL], et empêche le LDL-R de prendre une conformation fermée en milieu acide endosomal, ce qui entrave la libération de la LDL du complexe internalisé formé avec le LDL-R, et le recyclage de ce dernier vers la surface cellulaire, notamment de l’hépatocyte. La diminution de la concentration des LDL-R de surface sous l’effet d’une PCSK9 entraîne une diminution de clairance des LDL circulants et l’élévation du LDL-C sanguin. Les anticorps PCSK9-I actuellement commercialisés se lient aux PCSK9 circulantes, prévenant leur liaison au complexe [LDL-R+LDL], ce qui permet un recyclage en boucle des LDL-R hépatocytaires, augmentant nettement la clairance hépatique des LDL et abaissant le LDL-C sanguin de 60-70% (Figure 5) (1).

Les deux agents PCSK9-I actuellement disponibles en Belgique (Repatha® (évolocumab; Amgen) et Praluent® (alirocumab; Sanofi/Regeneron)) sont des anticorps monoclonaux humains administrés par voie parentérale de manière espacée. Ils sont indiqués pour le traitement de l’hypercholestérolémie, en complément aux mesures diététiques et à un traitement par statine à dose maximalement tolérée, chez des adultes atteints d’hypercholestérolémie familiale hétérozygote (HFH), ou d’une maladie CV clinique d’origine athéroscléreuse (ASCVD), qui nécessitent davantage de réduction du taux de LDL-C, ou en complément à d’autres thérapies ciblant les LDL (telles que statines, ézétimibe, ou aphérèse des LDL) chez des patients atteints d’hypercholestérolémie familiale homozygote (HoFH) nécessitant de réduire davantage leur taux de LDL-C.
Bien que la réduction du LDL-C obtenue par anticorps antiPCSK9 soit considérable et que ces agents soient extrêmement bien tolérés et sûrs d’utilisation, l’effet des PCSK9-I sur la morbidité et la mortalité CV, ainsi que leur sécurité en utilisation prolongée doivent être établies sur des études prospectives, qui sont actuellement en cours. Les résultats de trois essais cliniques récents augurent favorablement du fait que les PSCK9-I soient d’une utilisation sûre et pourraient potentiellement réduire la morbidité et la mortalité CV.
L’étude de Sabatine et coll., une analyse exploratoire pré-spécifiée, avait pour objet d’évaluer l’innocuité et l’efficacité à long terme d’une réduction du LDL-C par l’évolocumab chez des patients à risque CV élevé (2). Cette étude comportait également une analyse exploratoire prédéterminée d’événements CV adjudiqués. L’étude était une extension ouverte, randomisé et contrôlée de l’étude OSLER (OSLER-1 (phase II) et OSLER-2 (phase III)), ayant inclus 4465 patients (80% à haut risque CV; 70% sous statine), avec comme variable primaire l’incidence d’événements indésirables, et comme variables secondaires la réduction du LDL-C, la réduction des évènements CV majeurs (notamment décès, infarctus du myocarde (IM), angor instable, revascularisation coronarienne, AVC, et insuffisance cardiaque). L’évolocumab a réduit le taux de LDL-C de 61%, et l’abaissement du LDL-C a été maintenu au cours du suivi (11,1 mois). Le taux d’événements CV à 1 an était significativement plus faible dans le groupe évolocumab (0,95% vs 2,18% avec le traitement standard). Les auteurs en concluent que l’ajout d’évolocumab à un traitement standard, a considérablement réduit le LDL-C et l’incidence des événements CV.
L’étude de Robinson et coll. avait pour objectif d’évaluer l’efficacité à long terme et l’innocuité de l’alirocumab, avec une analyse exploratoire post-hoc de survenue d’événements CV (3). Cette étude de phase III, randomisée et en double aveugle, contrôlée par placebo, a porté sur 2341 patients à haut risque CV et sous statine. La variable primaire était l’abaissement du LDL-C à 24 semaines, et la variable secondaire la survenue d’événements CV majeurs (décès par maladie coronarienne, IM non mortel, AVC ischémique, et angor instable). La diminution moyenne du LDL-C à la semaine 24 était de -61,0%. Pour les autres critères d’efficacité, le taux d’événements CV majeurs était plus faible avec l’alirocumab qu’avec le placebo (1,7% vs 3,3%, hazard ratio de 0,52, IC 95% 0,31 à 0,90, p 0,02). Le groupe alirocumab a globalement très bien toléré le traitement. Les auteurs concluent qu’à 78 semaines, l’alirocumab, ajouté à une statine à dose maximale tolérée, a significativement réduit le LDL-C, avec en analyse post-hoc, une réduction substantielle des événements CV majeurs.
Dans ces deux investigations, la thérapie par anticorps monoclonaux ciblant la PCSK9 a réduit le taux de LDL-C d’environ 60%, en sus de traitements hypolipémiants en cours selon les bonnes pratiques cliniques fondées sur les preuves, ce qui a entraîné une réduction d’environ 50% des événements CV majeurs. Cependant, il est pertinent de noter que l’inhibition de PCSK9 a aussi des effets bénéfiques au-delà de l’abaissement du LDL-C, puisque les PSCK9-I réduisent aussi de manière importante le taux de lipoprotéine(a), une variété de LDL particulière à la fois athérogène et thrombogène, considérée comme un facteur majeur de risque CV génétiquement déterminé, et insensible à la prise de statines et/ou d’ézétimibe.
L’étude GLAGOV (Global Assessment of Plaque Regression with a PCSK9 Antibody as Measured by Intravascular Ultrasound), un essai clinique de phase III d’imagerie coronarienne évaluant l’efficacité de l’évolocumab (Repatha®), apporte la première preuve qu’un abaissement du LDL-C obtenu par inhibition de PCSK9 modifie favorablement le développement de la maladie athéroscléreuse coronarienne persistant en présence d’un traitement par une statine à dose optimisée (4). Il s’agissait d’une évaluation par échographie intravasculaire, multicentrique, en double aveugle, randomisée et contrôlé contre placebo, évaluant l’impact de l’évolocumab sur le volume d’athérome coronaire (mesuré au cours d’un cathétérisme coronaire) chez 968 patients sous statine à dose optimisée. Le critère d’évaluation primaire était la variation du pourcentage de volume d’athérome (PAV) par rapport à l’inclusion après 78 semaines de traitement, déterminé par échographie intravasculaire (IVUS), une technique d’imagerie à haute définition qui permet de quantifier l’athéromatose dans les parois des artères coronaires. Les paramètres secondaires de GLAGOV étaient la régression du PAV (toute réduction par rapport à la valeur de référence); la variation du volume total d’athérome (TAV), et/ou sa régression.
Ces résultats encourageants en termes de critère clinique intermédiaire seront à confronter aux résultats des essais cliniques destinés à documenter spécifiquement le bénéfice cardiovasculaire des PCSK9-I. Les résultats de l’étude FOURIER sont attendus au premier trimestre de 2017. Cet essai a inclus 27500 patients avec maladie athérosclérotique cliniquement avérée, qui ont reçu de l’évolocumab (ou placebo) en sus d’un traitement optimisé par statine. L’évaluation doit établir si ce PCSK9-I réduit le risque d’événements CV majeurs (définis par un critère principal composite de décès CV, d’IM, d’AVC, d’hospitalisation pour angor instable, ou de revascularisation coronarienne), avec comme critère d’évaluation secondaire un composite de mort CV, d’IM, ou d’AVC.
En ce qui concerne l’alirocumab, l’étude en cours ODYSSEY Outcomes a pour but d’évaluer la réduction de survenue d’événements CV majeurs chez des patients ayant présenté un syndrome coronarien aigu, avec comme critère principal d’évaluation la survenue d’événements CV (composite de décès par maladie coronaire, d’IM, d’AVC, et d’angor instable), avec un enrôlement estimé à 18600 et une date prévue de fin d’étude début 2018.
Références
1. Davignon J, Fruchart JC, Hermans M. PCSK9 and atherosclerosis; ouvrage numérique disponible sur le lien: www.r3i.org
2. Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J et al. Open-Label Study of Long-Term Evaluation against LDL Cholesterol (OSLER) Investigators. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372:1500-159.
ouvrir dans PubMed
3. Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna et al. ODYSSEY LONG TERM Investigators. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372:1489-1499.
ouvrir dans PubMed
4. Nicholls SJ, Puri R, Anderson T, Ballantyne CM, Cho L, Kastelein JJ et al. Effect of Evolocumab on Progression of Coronary Disease in Statin-Treated Patients: The GLAGOV Randomized Clinical Trial. JAMA 2016; 316: 2373-2384.
ouvrir dans PubMed
Les analogues du GLP-1: un nouveau traitement de l’obésité
Audrey Loumaye, Jean-Paul Thissen
Les analogues de l’hormone gastro-intestinale Glucagon-Like Peptide (GLP)-1 sont prescrits depuis plusieurs années comme traitement du diabète sucré de type 2. En effet, outre leurs propriétés insulinostimulantes, ils exercent un effet anorexigène qui favorise la perte de poids. Depuis peu, le liraglutide est disponible en stylos pré-remplis de 18 mg (Saxenda®) pour le traitement de l’excès de poids. En particulier, il est indiqué en cas d’obésité (IMC >30 kg/m²) ou de surcharge pondérale (IMC >27 kg/m²) avec au moins une comorbidité, telle que le diabète de type 2, l’hypertension artérielle, la dyslipidémie ou le syndrome des apnées du sommeil.
Le liraglutide favorise la perte de poids en modifiant le comportement alimentaire sans stimuler la dépense énergétique (1). En effet, il augmente la satiété et atténue la sensation de faim, induisant une diminution de la prise alimentaire. La prise de liraglutide retarde également la vidange gastrique mais cet effet s’atténue rapidement avec le temps, contribuant dès lors peu à la perte de poids. L’effet anorexigène du liraglutide est donc principalement « central » et est médié par la stimulation du récepteur du GLP-1 (GLP-1R) situé dans l’hypothalamus en particulier au niveau du noyau arqué (2).
Les études SCALE, totalisant près de 6000 patients adultes obèses ou en surpoids, ont évalué l’efficacité du liraglutide sur la perte de poids en association à des mesures hygiéno-diététiques sur une durée maximale de 2 ans (3-5). Dans une étude pilote, réalisée chez des sujets obèses non-diabétiques (n=564) traités par liraglutide pendant 20 semaines, la perte de poids était dose-dépendante, allant de 4.8 kg à la dose de 1.2 mg/J à 7.2 kg à la dose de 3 mg/J, contre 2.8 kg sous placebo [4]. L’étude SCALE-Obésity & Prediabetes (n=3731), réalisée pendant 56 semaines chez des sujets obèses dont 61% étaient prédiabétiques, a montré une perte de poids de 8.4 kg sous liraglutide 3 mg contre 2.8 kg sous placebo (3). De même, l’étude SCALE-Diabetes (n=1361), réalisée pendant 56 semaines chez des sujets diabétiques de type 2, a mis en évidence une perte de poids sous traitement de 6.4 kg contre 2.2 kg sous placebo (5). Dans toutes ces études la perte de poids a été significativement plus élevée sous liraglutide 3 mg que sous placebo et la proportion de patients atteignant une perte pondérale de 5 à 10% plus élevée. Cependant, la perte de poids semblait moindre chez les patients avec une obésité morbide (IMC ≥ 40 kg/m²) par rapport aux patients avec un IMC plus bas.
Au cours de ces études, les effets du liraglutide 3 mg sur les comorbidités de l’obésité ont également été évalués. Sans surprise, le liraglutide 3 mg améliore la tolérance glucidique des sujets obèses. En effet, le traitement réduit la prévalence du prédiabète de 65% à 56 semaines par rapport au placebo chez des sujets normoglycémiques et de 54% chez des sujets prédiabétiques (3). De plus, le médicament réduit de 71% l’incidence du diabète chez des sujets obèses. Chez des sujets diabétiques sous traitement hypoglycémiant oral, le liraglutide 3 mg améliore l’HbA1C de 1.3% versus 0.3% sous placebo avec en parallèle une réduction plus importante des médications antidiabétiques (5). La plupart des études ont montré un effet bénéfique du liraglutide 3 mg sur la diminution de la pression artérielle (3). Cet effet hypotenseur peut résulter de la perte de poids mais également de l’effet natriurétique de l’analogue GLP-1 (6). Chez le sujet obèse avec un syndrome des apnées du sommeil traité par liraglutide 3 mg, la perte de poids s’accompagne d’une réduction de l’indice d’apnées/hypopnées (7). L’étude LEAN a également montré les effets bénéfiques du liraglutide 1.8 mg sur les lésions histologiques de stéato-hépatite (8). En revanche, l’amélioration du profil lipidique est discrète et inconstante sous Liraglutide 3 mg. Enfin, la prise de Liraglutide est associée à une augmentation des scores de qualité de vie (3).
Le profil de sécurité du liraglutide a été établi depuis plusieurs années dans le traitement du diabète. Les effets secondaires les plus fréquemment rapportés sont d’ordre digestif (nausées, vomissements…) et sont généralement d’intensité légère à modérée et transitoires (4 à 8 semaines). D’autre part, les complications de lithiase biliaire, sous forme de colique hépatique ou de cholécystite, ont été plus fréquentes sous liraglutide 3 mg par rapport au placebo. Le risque de pancréatite aiguë est augmenté mais est faible (0.3% vs 0.1%) et la relation de cause à effet reste à préciser (9). Enfin, malgré une légère augmentation de la fréquence cardiaque observée, la sécurité cardio-vasculaire du liraglutide chez des sujets diabétiques à risque vient d’être démontrée dans l’étude LEADER (10).
Le liraglutide s’administre quotidiennement par voie sous-cutanée à l’aide d’un stylo prêt à l’injection. Il n’a pas été évalué chez des sujets de moins de 18 ans et les données sont limitées au-delà de 75 ans. Comme clairement indiqué dans les études, son efficacité n’est démontrée qu’en association avec une réduction de l’apport calorique et un programme d’activité physique. Enfin, compte tenu de l’absence de remboursement de ce traitement actuellement et du fait que l’obésité s’apparente à une maladie chronique, une évaluation de son rapport coût-bénéfice devra être réalisée à long terme avant de préciser sa place dans la prise en charge de l’obésité.
Références
1. van Can J, Sloth B, Jensen CB, Flint A, Blaak EE, Saris WH. Effects of the once-daily GLP-1 analog liraglutide on gastric emptying, glycemic parameters, appetite and energy metabolism in obese, non-diabetic adults. Int J Obes (Lond) 2014; 38:784-793.
ouvrir dans PubMed
2. Kanoski SE, Hayes MR, Skibicka KP. GLP-1 and weight loss: unraveling the diverse neural circuitry. Am J Physiol Regul Integr Comp Physiol 2016; 310:R885-895.
ouvrir dans PubMed
3. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med 2015; 373:11-22.
ouvrir dans PubMed
4. Astrup A, Rossner S, Van Gaal L, Rissanen A, Niskanen L, Al Hakim M et al. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet 2009 374:1606-1616
ouvrir dans PubMed
5. Davies MJ, Bergenstal R, Bode B, Kushner RF, Lewin A, Skjoth TV et al. Efficacy of Liraglutide for Weight Loss Among Patients With Type 2 Diabetes: The SCALE Diabetes Randomized Clinical Trial. JAMA 2015; 314:687-699.
ouvrir dans PubMed
6. Lovshin JA, Barnie A, DeAlmeida A, Logan A, Zinman B, Drucker DJ. Liraglutide promotes natriuresis but does not increase circulating levels of atrial natriuretic peptide in hypertensive subjects with type 2 diabetes. Diabetes Care 2015; 38:132-139.
ouvrir dans PubMed
7. Blackman A, Foster GD, Zammit G, Rosenberg R, Aronne L, Wadden T et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE Sleep Apnea randomized clinical trial. Int J Obes (Lond) 2016; 40:1310-1319
ouvrir dans PubMed
8. Armstrong MJ, Gaunt P, Aithal GP, Barton D, Hull D, Parker R et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet 2016; 387:679-690.
ouvrir dans PubMed
9. Jensen TM, Saha K, Steinberg WM. Is there a link between liraglutide and pancreatitis? A post hoc review of pooled and patient-level data from completed liraglutide type 2 diabetes clinical trials. Diabetes Care 2015; 38:1058-1066.
ouvrir dans PubMed
10. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375:311-322.
ouvrir dans PubMed
L’hypothyroxiné mie du premier trimestre de la grossesse : une nouvelle entité à traiter ?
Raluca Maria Furnica, Chantal Daumerie
L’utilité du dépistage thyroïdien systématique chez la femme enceinte dès le début de grossesse reste controversée. Ce dépistage est cependant de plus en plus recommandé dans les pays européens avec déficience en iode et conduit à proposer un traitement aux hormones thyroïdiennes lorsqu’une hypothyroïdie subclinique est diagnostiquée. Aux Cliniques universitaires Saint-Luc, ce dépistage est réalisé de façon systématique depuis 2009.
La grossesse s’accompagne d’une augmentation de la concentration des protéines plasmatiques porteuses, sous l’influence des œstrogènes, ce qui est responsable des modifications des concentrations de T4 libre au premier trimestre et nécessite un ajustement des valeurs normales utilisées en dehors de la grossesse. Les valeurs de référence des concentrations de T4 libre et de la TSH doivent tenir compte de la nature du dosage utilisé, de la population étudiée et de l’apport en iode. Il est donc recommandé d’établir des valeurs de référence institutionnelles pour les paramètres du bilan thyroïdien et ce pour chaque trimestre de la grossesse.
Une nouvelle controverse est apparue récemment : l’hypothyroxinémie maternelle isolée de la grossesse. Conformément aux recommandations de l’ATA (American Thyroid Association) et de l‘ETA (European Thyroid Association), l’hypothyroxinémie maternelle isolée concerne des concentrations de T4 libre inférieures au 2,5-5ème percentile de l’intervalle de référence retenu pour le trimestre de la grossesse associée à une concentration de TSH normale. L’existence, aussi bien que la prévalence, les causes et les conséquences de l’hypothyroxinémie font l’objet actuellement de nombreux débats. Certaines études ont montré un retard du développement psychomoteur chez les enfants dont les mères ont eu une hypothyroxinémie isolée pendant la grossesse (1). La période critique se situe au premier trimestre, lorsque le fœtus est dépendant des hormones thyroïdiennes maternelles nécessaires au bon développement du cerveau fœtal. De plus, une corrélation entre l’hypothyroxinémie et les troubles de déficit d’attention/ hyperactivité et l’autisme chez l’enfant a été rapportée (2).
Si les risques d’une hypothyroïdie maternelle pour la mère et l’enfant sont bien démontrés, les conséquences d’une hypothyroxinémie maternelle sur l’évolution de la grossesse et sur l’évolution fœtale sont moins claires. Dans ce contexte, notre équipe a évalué les conséquences obstétricales et néonatales de l’hypothyroxinémie du premier trimestre de la grossesse (âge gestationnel moyen, 11.8 semaines) en les comparant avec un groupe contrôle en euthyroïdie et les résultats sont en cours de publication (3). Les résultats ont montré une prévalence de l’hypothyroxinémie de 8,7% dans la population étudiée qui est modérément déficiente en iode. L’hypothyroxinémie est associée à un indice de masse corporelle (IMC) maternel plus élevé (25.1 kg/m2 versus 23.3 kg/m2 dans le groupe contrôle) et à la susceptibilité de développer un diabète gestationnel. De plus, notre étude révèle une corrélation significative entre l’hypothyroxinémie au début de grossesse et le risque de présentation de l’enfant en siège ainsi qu’une fréquence accrue de macrosomie.
Deux études prospectives randomisées (« Controlled Antenatal Thyroid Screening Study » (CATS) et « Thyroid Therapy for Mild Thyroid Deficiency in Pregnancy study” (“TSH study”)) ont évalué les bénéfices éventuels du traitement par L-T4 des femmes avec hypothyroxinémie sur le retard de développement neuropsychologique. Les résultats ne montrent pas de différence significative par rapport au groupe contrôle, mais la substitution en hormones thyroïdiennes a été proposé au 2ème trimestre ce qui très tardif par rapport au développement cérébral. En conclusions, il est nécessaire d’établir des valeurs de référence institutionnelles pour les paramètres du bilan thyroïdien pour chaque trimestre de la grossesse. Le surpoids constituerait un facteur de risque potentiel de dysfonction thyroïdienne et en particulier d’hypothyroxinémie, chez les femmes enceintes.
Compte tenu des résultats présents, nous recommandons (i) des mesures hygiéno-diététiques avant la conception et en début de grossesse afin de prévenir un gain excessif de poids et (ii) la prise de manière systématique de vitamines prénatales contenant de l’iode (>150 µg/jour). Des études prospectives restent nécessaires pour mieux définir l’hypothyroxinémie isolée de la grossesse et ses conséquences pour le développement de l’enfant.
Références
1. Henrichs J, Bongers-Schokking JJ, Schenk JJ. Maternal thyroid function during early pregnancy and cognitive functioning in early childhood: the generation R study. J Clin Endocrinol Metab 2010: 95: 4227-4234. Ouvrir dans PubMed
2. Furnica RM, Lazarus JH, Gruson D, Daumerie C. Update on a new controversy in endocrinology: isolated maternal hypothyroxinemia. J Endocrinol Invest 2015; 38: 117-123.
ouvrir dans PubMed
3. Furnica RM, Gruson D, Lazarus JH, Maiter D, Bernard P, Daumerie C. First trimester isolated maternal hypothyroxinemia: adverse maternal metabolic profile and impact on the obstetrical outcome. Clin Endocrinol 2016 Dec 31. doi: 10.1111/cen.13301.
ouvrir dans Pubmed
Actualités dans l’ophtalmopathie thyroïdienne
Maria-Cristina Burlacu, Chantal Daumerie
L’ophtalmopathie reste la complication la plus redoutée de la maladie de Basedow mais sa présentation clinique a beaucoup changé depuis la description initiale faite par Basedow et Graves. Selon des études récentes, seulement 20 à 30% des patients développent une ophtalmopathie, le plus souvent contemporaine à l’hyperthyroïdie et de sévérité minime (1). Les différences dans la présentation clinique sont liées à la modification des certains facteurs de risque, dont le plus connu est la consommation tabagique, mais aussi à une prise en charge plus rapide et plus efficace de la dysfonction thyroïdienne. L’ophtalmopathie n’est pas la marque exclusive de la maladie de Basedow (MB) car environ 3 % patients avec une thyroïdite de Hashimoto peuvent développer une atteinte orbitaire. Chez 5% des patients atteints de la MB, l’ophtalmopathie (OB) évolue dans sa forme la plus sévère qui est la neuropathie optique.
Les facteurs déclenchants de l’inflammation orbitaire sont encore débattus mais parmi les plus étudiés on retrouve les anticorps anti récepteur à la TSH, capables de stimuler les récepteurs exprimés à la surface des fibroblastes orbitaires et ainsi induire l’adipogenèse, la prolifération du tissu conjonctif intraorbitaire et la production de hyaluronan responsable de fibrose. L’évolution naturelle de l’OB connaît une phase active suivie d’une phase inactive et le diagnostic correct de l’activité ainsi que de la sévérité de l’atteinte orbitaire est essentiel pour une prise en charge thérapeutique optimale. Des outils diagnostiques validés comme le CAS (Clinical Activity Score) et les classifications NOSPECS et EUGOGO de la sévérité ainsi que les guidelines européennes de l’EUGOGO mises à jour en 2016 permettent de sélectionner les patients qui doivent bénéficier des traitements immunosuppresseurs (2).
À part les traitements spécifiques, la prise en charge de tous les patients doit viser l’évaluation de l’impact de la maladie sur la qualité de vie, l’instauration prompte de l’euthyroidie, le sevrage tabagique et l’administration prophylactique des stéroïdes en cas de traitement par radioiode de la MB.
Dans la majorité des OB mineures, la restauration de l’euthyroidie s’associe à la disparition des symptômes orbitaires. Les corticoïdes en administration intraveineuse selon un protocole maintenant validé représentent la première ligne thérapeutique des OB actives modérés à sévères. En cas de réponse insuffisante, l’utilisation d’autres immunosuppresseurs, comme le rituximab et la cyclosporine ou une deuxième ligne de corticothérapie associée à la radiothérapie orbitaire sont des solutions possibles. Le sélénium est proposé systématiquement dans les cas mineurs où il a été démontré qu’il prévient la progression vers des formes plus sévères. La chirurgie orbitaire est quasi toujours nécessaire après la phase active pour corriger l’exophtalmie, le strabisme ou l’atteinte palpébrale. Puisque l’OB est une maladie rare, de présentation parfois atypique et dont la pathogénie est insuffisamment comprise, il est impératif qu’on offre aux patients une prise en charge spécialisée, rapide et multidisciplinaire afin d’éviter l’évolution vers des formes sévères et défigurantes et/ou handicapantes. Une consultation multidisciplinaire d’ophtalmopathie thyroïdienne dans laquelle les patients sont vus conjointement par l’endocrinologue et l’ophtalmologue dédiés est disponible depuis quelques années aux Cliniques universitaires St-Luc.
Références
1. Perros P, Zarkovic M, Azzolini C et al. PREGO (presentation of Graves’ orbitopathy) study : changes in referral patterns to European Group On Graves’ Orbitopathy (EUGOGO) centres over the period from 2000 to 2012. Br J Ophthalmol 2015; 99: 1531–1535.
ouvrir dans PubMed
2. Bartalena L, Baldeschi L, Boboridis K et al. The 2016 European Thyroid Association/European Group on Graves’ Orbitopathy Guidelines for the Management of Graves’ Orbitopathy. Eur Thyroid J 2016; 5: 9–26.
ouvrir dans PubMed
Nouvelles recommandations cliniques de la société européenne d’endocrinologie sur la prise en charge de l’incidentalome surrénalien
Orsalia Alexopoulou, Dominique Maiter
L’incidentalome surrénalien est une masse découverte fortuitement au niveau d’une ou des deux glandes surrénales à l’occasion d’un examen radiologique de l’abdomen (échographie, CT scan ou IRM) réalisé au départ pour un autre motif. Leur fréquence est estimée à 1-4% des examens d’imagerie abdominale et elle augmente avec l’âge. Le défi posé par cette problématique moderne est d’identifier et traiter précocement des tumeurs potentiellement délétères (sécrétantes ou malignes) tout en évitant un excès d’investigations inutiles, coûteuses et anxiogènes pour le patient, débouchant sur un traitement inapproprié.
Dans ce contexte, un groupe d’experts de la Société Européenne d’Endocrinologie (ESE) et du Réseau européen pour l’étude des tumeurs surrénaliennes (ENSAT) ont publié en 2016 de nouvelles lignes directrices sur la prise en charge des incidentalomes surrénaliens (1). Ces recommandations sont supportées par un grand nombre d’études cliniques rapportées dans la littérature au cours des dix dernières années (citées dans la référence 1). Nous résumons ici les principales recommandations émises et adoptées par l’ESE.
Imagerie
- Si l’incidentalome surrénalien apparait comme une masse homogène d’un diamètre inférieur à 4 cm et avec une densité ≤ 10 Unités Hounsfield (UH) au premier CT scan sans contraste, la tumeur peut être considérée comme bénigne et un suivi par imagerie n’est pas nécessaire.
- Dans les autres situations (tumeur de nature indéterminée), trois options peuvent être envisagées : (i) une imagerie complémentaire (une élimination lente du produit de contraste au CT, l’absence de baisse significative d’intensité à l’IRM avec atténuation du signal graisseux ou un PET scan FDG positif sont des arguments en faveur d’une tumeur maligne) ; (ii) un nouvel examen radiologique après 6-12 mois ou (iii) l’exérèse chirurgicale de la tumeur sans délai. Idéalement, la décision doit être prise en équipe multidisciplinaire spécialisée dans la prise en charge des tumeurs surrénaliennes.
Bilan hormonal
- L’existence d’une sécrétion autonome de cortisol (SAC) par l’incidentalome peut être testée au moyen du test par dexaméthasone (DEX) 1 mg au coucher. Si le cortisol matinal post-DEX est inférieur à 1,8 μg/dl (50 nmol/L), une SAC est exclue. En revanche, celle-ci peut être confirmée si le cortisol post-DEX est supérieur à 5,0 μg/dl. Dans de telles conditions, le cortisol libre urinaire, l’ACTH plasmatique et le cortisol salivaire vespéral peuvent également être mesurés et la chirurgie peut être envisagée en présence de co-morbidités (hypertension, intolérance au glucose ou diabète, ostéoporose, obésité et dyslipidémie). Si ce n’est pas le cas, un suivi est recommandé et un nouveau test par DEX est réalisé après 3-12 mois. Lorsque le cortisol post-DEX est compris entre 1,8 et 5,0 μg/dl (zone grise), le diagnostic de ‘possible SAC’ doit être envisagé. D’autres tests peuvent être utiles (come le dosage d’ACTH) mais le test ne doit être répété après 6-12 mois que si des co-morbidités sont présentes.
- Les autres dosages à effectuer incluent les métanéphrines plasmatiques fractionnées ou urinaires, le rapport aldostérone/rénine chez les patients souffrant d’hypertension et / ou d’hypokaliémie et les stéroïdes sexuels si la masse est soupçonnée d’être un carcinome cortico-surrénalien.
Chirurgie
- La chirurgie surrénalienne laparoscopique est recommandée pour toute tumeur unilatérale avec hypersécrétion hormonale cliniquement significative. La chirurgie n’est pas indiquée pour les masses surrénales unilatérales non fonctionnelles et asymptomatiques présentant des caractéristiques bénignes évidentes sur les études d’imagerie (voir ci-dessus).
- Si la tumeur est soupçonnée d’être maligne, une chirurgie classique (« open laparotomy ») ou laparoscopique peuvent être envisagées. Si la taille de la lésion est ≤ 6 cm et en l’absence d’invasion locale, aucune différence n’a été observée entre les deux modalités concernant les taux de survie globale ou sans récidive. Cependant, la chirurgie ouverte doit être préférée en cas de très grosse tumeur et/ou d’invasion loco-régionale.
Suivi
- Le risque global pour une tumeur bénigne de devenir maligne est extrêmement faible (0,2%). Si le bilan initial est clairement en faveur d’une lésion bénigne, aucune autre imagerie n’est nécessaire.
- Dans les autres situations, l’imagerie doit être répétée à 6-12 mois pour exclure une croissance significative de la tumeur (définie par une augmentation du diamètre ≥20% et ≥ 5 mm). Si c’est le cas, la chirurgie est indiquée. En cas de croissance moindre, un nouvel examen radiologique est réalisé après 6-12 mois.
- Le risque qu’une tumeur surrénalienne initialement non fonctionnelle devienne sécrétante est également très faible : 0,06% pour les aldostéronomes, 0,38% pour les phéochromocytomes et 0,27% pour le syndrome de Cushing. Il est plus élevé pour un adénome avec une sécrétion de cortisol autonome (jusqu’à 18%) et dans ce cas, un bilan hormonal annuel est conseillé si des co-morbidités sont présentes, apparaissent ou s’aggravent.
Cas particuliers
- En cas d’incidentalomes bilatéraux, les mêmes recommandations s’appliquent pour chacune des masses individuellement. En outre, il faut envisager de mesurer la 17-OH-progestérone pour exclure une ‘hyperplasie surrénale congénitale et évaluer la possibilité d’une insuffisance surrénalienne si les masses sont infiltrantes ou hémorragiques.
- Chez les jeunes patients (âge ≤ 40 ans), il est préférable d’utiliser l’IRM, moins irradiante, que la tomodensitométrie. La probabilité d’une tumeur hormono-sécrétante ou d’une tumeur maligne est augmentée chez les jeunes.
- La biopsie est exceptionnellement indiquée, seulement dans les tumeurs inactives du point de vue hormonal, sans diagnostic de certitude de bénignité et quand le diagnostic histologique changera la prise en charge (par exemple en cas de suspicion de lymphome).
Un algorithme de prise en charge des incidentalomes surrénaliens en 2016 est schématisé dans la Figure 6.

Référence
1. Fassnacht M, Arlt W, Bancos I, Dralle H, Newell-Price J, Sahdev A, Tabarin A, Terzolo M, Tsagarakis S, Dekkers OM. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol 2016; 175: G1-G34. Ouvrir dans PubMed
Affiliations
Correspondance
Pr. Dominique Maiter
Service d’endocrinologie et nutrition
Cliniques universitaires Saint-Luc
Avenue Hippocrate, 10, 1200 Bruxelles
dominique.maiter@uclouvain.be