L’organisation mondiale de la santé (WHO) définit l’arthrose comme une maladie à long terme impliquant un amincissement du cartilage dans les articulations. Cette usure occasionne un frottement des os l’un contre l’autre, provoquant la raideur et la douleur de l’articulation atteinte (1). La douleur est le principal motif de consultation chez le médecin. Elle est présente notamment lors des activités quotidiennes ou lors du sport et elle peut souvent être soulagée par du repos. Jusqu’à 80% des patients ressentent une raideur articulaire et 25% sont limitées dans leurs tâches journalières (1). Patients atteints d’une arthrose peuvent en plus manifester d’autres symptômes généraux tels que la dépression et l’anxiété, des troubles du sommeil. Ainsi, l’arthrose représente une cause majeure de l’invalidité chez le sujet âgé à l’échelle mondiale et pèse lourdement sur les soins de santé et sur le système de protection sociale (1).
L’incidence de l’arthrose augmente mondialement par suite du vieillissement de la population. Les taux d’obésité croissent notamment dans les pays développés : en Europe 52% des adultes présentent une surcharge pondérale. En plus d’imposer une charge à la société, l’obésité augmente le risque individuel de développement de maladies chroniques comme le diabète, les maladies cardiovasculaires, certains types de cancers ainsi que des problèmes psychologiques (2).
Symptômes et diagnostic
La douleur arthrosique est une douleur nociceptive ; elle résulte de la stimulation mécanique directe ou de la stimulation constante des nocicepteurs par l’inflammation chronique (3). Chez certains patients, la douleur neuropathique peut y être associée ; elle est définie comme « la douleur provenant d’une lésion ou affection du système somato-sensorique » (4). Elle peut être présente notamment dans le cas d’une atteinte de l’os sous-chondral vu son innervation très dense. Cette composante neuropathique est responsable de la douleur au repos et se présente comme des brûlures, picotements, engourdissement, sensibilité au toucher ou sensations de chocs électriques (5). Discerner une participation neuropathique à la douleur permet de distinguer les patients qui pourraient se montrer moins satisfaits par une éventuelle prothèse de genou (4).
Le diagnostic de l’arthrose est posé sur base de l’anamnèse investiguant la nature et l’évolution temporelle de la douleur, d’un examen clinique et de la radiographie de l’articulation atteinte. Des critères pour le diagnostic et la classification de l’arthrose de genou ont été développés par le collège américain de rhumatologie (ACR) en 1986 ; ces critères sont cliniques, biologiques et radiographiques (6) (Tableau 1).
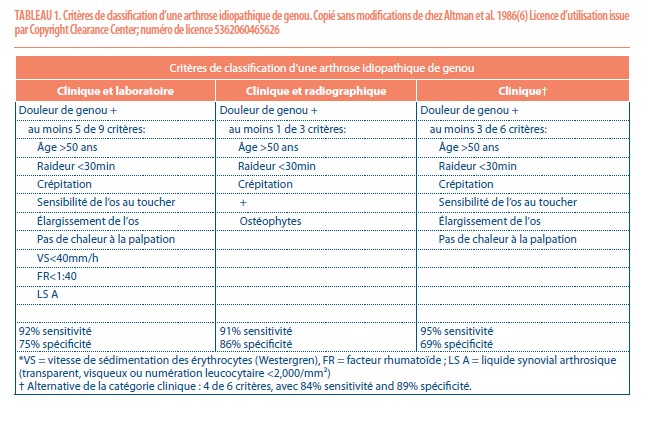
Bien entendu ces critères ont été développés avant que les modalités avancées de l’imagerie (tels que CT-arthrographie ou résonance magnétique) soient devenues plus accessibles. De plus, la radiographie présente plusieurs intérêts à part de déterminer la présence ou non d’ostéophytes ; classifier l’arthrose et guider les décisions thérapeutiques et le planning chirurgical. C’est précisément la radiographie la modalité d’imagerie la plus utilisée parce qu’elle est pratique, peu coûteuse, largement disponible et très bien acceptée par les patientes et les cliniciens (7).
La classification radiologique de l’arthrose la plus souvent utilisé est celle de Kellgren-Lawrence (8). (Tableau 2) Les patients atteints d’une arthrose de grade III ou IV qui présentent une difformité de l’axe mécanique du membre inférieur (mesuré sur la goniométrie) de plus de 10° n’auront plus besoin d’autres examen. Par contre, ceux présentant un alignement normo axé (donc moins de 10°) devraient bénéficier d’une imagerie approfondie, comme l’IRM ou l’arthroscanner, afin d’évaluer l’état cartilagineux de chacun des trois compartiments du genou (fémoro-tibial interne, fémoro-tibial externe et fémoro-patellaire).
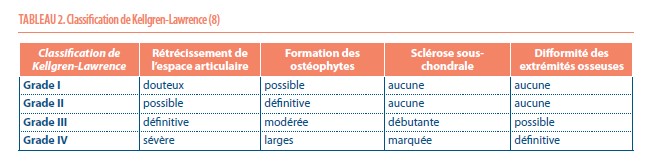
Il est important de noter que les radiographies doivent être effectuées en charge, vu que l’axe mécanique du membre inférieur peut être différent par rapport à une radiographie faite en décubitus dorsal ; notamment chez les patients atteints d’une arthrose de grade III ou IV selon Kellgren-Lawrence (9).
La résonance magnétique (IRM) n’est actuellement pas largement utilisée pour le diagnostic de l’arthrose en raison de son coût élevé, de sa disponibilité limitée et de la longue durée que requiert son exécution. Mais elle offre d’immenses avantages par rapport à la radiographie : haute précision, non-irradiante, visualisation excellente des tissus mous (épaisseur, volume et composition du cartilage, pathologies méniscales, synovite, épanchement articulaire etc.) et une très bonne corrélation avec la gravité clinique de la maladie. De plus, l’IRM est capable de dépister des signes précoces d’arthrose qui ne doivent pas être confondus avec le vieillissement normal de cartilage (7).
Le scanner (CT) permet une visualisation excellente des structures osseuses, mais le contraste au niveau des tissus mous est faible. C’est un examen relativement rapide, moins couteux et plus facilement disponible que l’IRM. En injectant un produit de contraste (arthro-CT), une lésion des structures intra-articulaires (méniscale ou cartilagineuse) peut être parfaitement démontrée. En revanche, l’arthro-scanner comporte des risques associés au produit de contraste (allergie) et à la nature invasive de l’examen. De plus, la dose de rayonnements ionisants est beaucoup plus élevée qu’en radiologie standard (7).
D’autres modalités d’imagerie, telle que la médecine nucléaire, ne sont actuellement pas recommandés pour diagnostiquer l’arthrose de genou.
En résumé, conformément aux recommandations des sociétés scientifiques, la radiographie (antéro-postérieure et de profil en charge, une incidence fémoro-patellaire à 30° de flexion) reste l’examen de choix suivi par la résonance magnétique. Le scanner peut être utilisé en deuxième intention si les résultats de la radiographie sont douteux ou atypiques.
Traitement
À ce jour, il n’existe pas d’intervention permettant de guérir l’arthrose, mais on peut efficacement en contrôler les symptômes. Le développement d’un plan de traitement global comprenant des interventions éducatives, comportementales, psychologiques, physiques, pharmacologiques et chirurgicales, s’avère nécessaire en tenant compte de l’état de santé et les antécédents médicaux ainsi que des convictions personnelles et des préférences des patients (10). L’objectif du traitement est donc de diminuer les symptômes, notamment la douleur, et aussi de ralentir l’évolution de la maladie (11).
Traitement non pharamacologique
L’efficacité du traitement non pharmacologique est généralement considérée comme faible, mais il est dépourvu de risques. Ce type de traitement est actuellement largement sous-utilisé dans le milieu clinique (11). Les mesures ayant pour but d’améliorer le moral, de diminuer le stress, de contrôler le poids et d’améliorer la condition physique peuvent contribuer à la réussite globale du traitement de l’arthrose (10).
L’exercice en tant que partie intégrale du traitement est recommandé dans toute la littérature scientifique. N’importe quel type d’exercice selon les préférences et l’accès du patient peut être efficace et d’autant plus dans un milieu supervisé (par un kinési- ou ergothérapeute). Spécifiquement le Tai Chi montre un impact particulièrement positif sur la douleur, la fonction articulaire, la stabilité ainsi que le bien-être psychosocial (10).
La perte du poids chez le patient obèse est l’autre aspect clef de la gestion de l’arthrose. L’effet clinique est positivement corrélé à la magnitude de la perte pondérale (11).
Une canne peut être fortement recommandée chez les patients avec une déambulation altérée. Il existe également une forte recommandation pour l’emploi des attelles de genou ; elles peuvent retarder la nécessité de la chirurgie et considérablement améliorer la qualité de vie tout en étant bon marché (10).
Traitement pharmacologique
Le Paracétamol a historiquement été prescrit en première intention pour la douleur arthrosique, Compte tenu des effets indésirables (EI) il peut être donné comme analgésie de sauvetage, à court terme et au dosage de 3g/jour maximum.
Actuellement, c’est les « systematic slow-acting drugs for OA » (SYSADOA) qui sont recommandés en première intention pour l’arthrose (11). Ce groupe de médicaments comprend les substances comme la Glucosamine, la Chondroïtine et de la Curcumine. Le mécanisme d’action est la stimulation de synthèse des glycosamineglycanes (un des composants principaux de cartilage) et majoration de l‘expression de collagène de type II ainsi que restriction de leur dégradation en régularisant la production de cytokines inflammatoires. Des multiples études prouvent leur efficacité supérieure tout en ayant un taux d’EI égal à ceux des placébos. Spécialement la Chondroïtine sulfate (CS) et la Glucosamine sulfate cristalline (pCGS) de qualité pharmaceutique, traitent la douleur et troubles fonctionnels aussi bien que les AINS. Les doses recommandées sont 1500mg de pCGS et 800mg de CS une fois par jour; cependant leur emploi simultané est contre-indiqué vu que la CS perturbe l’absorption de la GS (12). En complément de ce traitement de base, l’emploi des AINS topiques est recommandé ; leur efficacité sur la douleur et sur la fonction articulaire est plus élevée que celle du placébo (notamment celle de patches de Diclofénac). Certes, des effets indésirables existent (particulièrement des réactions cutanées), mais le risque des EI systémiques est beaucoup moins important par rapport aux AINS oraux (11).
En deuxième intention, ce sont les AINS oraux qui seront prescrits. Leur efficacité dans le traitement de la douleur arthrosique est modérée. Puisque la prise des AINS est associée avec des EI potentiellement graves (gastro-intestinaux, rénaux et cardiovasculaires), leur prescription se limitera à la dose la plus petite pour la durée la plus courte possible. Spécifiquement, le Celecoxib en dose de 200mg par jour est l’AINS de choix vu son profil risques-avantages relativement favorable (11).
Le traitement intra-articulaire peut être envisagé chez les patients avec contre-indications aux AINS oraux ou dans le cas de symptomatologie persistante malgré un traitement de base bien conduit. L’efficacité de l’acide hyaluronique (HA) a été largement démontré dans la littérature ; il permet de diminuer les besoins antalgiques et de considérablement retarder la chirurgie (13). À part des réactions locales transitoires, l’inconvénient principal est le long délai d’action (4 à 8 semaines) ainsi que le fait que l’injection doit être exécutée par un professionnel de soins de santé (idéalement 2 à 4 fois), ce qui augmente le coût de cette procédure (11). Il est important de noter, que l’injection de le HA n’est pas recommandée pendant la phase inflammatoire aiguë ; ce sont alors les corticoïdes qui seront choisis vu leur meilleur effet à court-terme pour soulager un patient souffrant davantage (10).
Les opioïdes représentent l’ultime traitement pharmacologique de la douleur réfractaire. Ils peuvent considérablement réduire la douleur arthrosique. Cependant leur prise est associée avec un très haut risque d’EI, une mauvaise tolérance et un taux élevé d’arrêt de traitement. C’est pourquoi, la prescription d’opioïdes n’est recommandée que dans les rares cas d’arthrose intensément douloureuse, et ce à très court-terme pour éviter l’accoutumance. L’opioïde de choix est le Tramadol (10).
Traitement chirurgical
Le traitement ultime de la gonarthrose de stade terminal est la chirurgie. Elle est indiquée en présence d’une douleur sévère réfractaire et d’une diminution significative de la qualité de vie. De plus l’arthrose doit avoir été objectivée à l’imagerie et s’être avérée rebelle à tout traitement conservateur (11). Selon le nombre des compartiments atteints, une prothèse totale ou uni-compartimentale peut être proposée.
La prothèse totale de genou (PTG) est la principale intervention réalisée pour l’arthrose en Belgique, mais aussi mondialement. Le taux d’utilisation de la PTG monte en flèche ces dernières années à cause du vieillissement démographique et l’incidence montante de l’obésité; de plus, une augmentation supplémentaire est attendue dans les années qui viennent.
Une partie des patients atteints d’une gonarthrose sont éligibles pour une prothèse unicompartimentale (PUC): ceux souffrant d’arthrose d’un seul compartiment et avec un ligament croisé antérieur intact. La PUC présente des avantages marqués par rapport à la PTG: une mortalité diminuée, une durée de séjour plus courte, moins de complications et une meilleure fonction articulaire absolue. Par contre, la survie de la PUC est inférieure à long-terme et le taux de révisions est plus élevée par rapport à la PTG. Cette différence peut être expliquée par la proportion de PUC qui sont converties en PTG mais aussi par l’âge plus jeune des patients opérés de PUC. En effet, cette population plus jeune est plus active, ce qui exerce une pression plus élevée sur la prothèse. De plus, leur degré d’attente fonctionnelle est plus élevé. La sélection adéquate des patients éligibles reste dès lors cruciale (14).
La prothèse de genou chez le patient obèse pose une difficulté particulière. L’obésité augmente non seulement le risque de nécessiter la PTG (un patient avec un BMI >40 présente 32 fois plus de risques qu’un autre) mais aussi le taux de mortalité, de révision et de complications peri- et post-opératoires, dont notamment l’infection peri-prothétique (3 fois plus de risque chez le patient avec un BMI>40). Dans le passé, l’obésité a même été considérée une contre-indication pour la mise en place d’une PUC. Le patient obèse encourt 1,5 fois plus de risque de nécessiter une révision et présente un taux de complications élevé après une PUC comme après une PTG (15). En outre, l’obésité morbide peut poser une difficulté technique pendant l’opération. L’épaisseur de la couche de graisse sous-cutanée peut restreindre le champ de vision. Ceci peut engendrer des difficultés d’exposition des surfaces articulaires, d’exécution des coupes et finalement de positionnement des implants. La malposition des implants peut être la raison de l’échec et imposer une révision de la prothèse qui peut consister en la conversion vers une prothèse totale (15). Pourtant, tous les patients qui ont bénéficié d’une PTG ou d’une PUC ressentent une amélioration en termes de fonction articulaire et de qualité de vie indépendamment de leur BMI. C’est pourquoi le BMI seul ne devrait pas être considéré comme une contre-indication à la mise en place d’une prothèse de genou, mais les patients doivent être informés sur les complications potentielles liées à l’obésité et ils doivent être encouragés de perdre du poids au préalable (16). Il n’existe pas encore beaucoup de littérature sur l’effet de la prothèse de genou par voie d’abord mini-invasive. Notons que les quelques études récentes montrent un taux réduit d’infections et de lésions des tissus mous permettant aux patients obèses d’accéder à des résultats similaires à ceux des patients non-obèses (17).
Recommandations pratiques
- L’anamnèse et l’examen clinique restent primordiaux dans le diagnostic de l’arthrose de genou. La douleur mécanique et inflammatoire, parfois neuropathique doit être documentée.
- La radiographie (antéro-postérieure, profil en charge et une incidence fémoro-patellaire à 30° de flexion) est l’examen d’imagerie de choix pour le patient suspect de gonarthrose. Si la gonarthrose n’est pas terminale (donc grade I à III selon la classification de Kellgren-Lawrence), la radiographie peut être suivie d’une résonance magnétique ou un arthro-CT pour évaluer la maladie focale ou la pathologie méniscale.
- Le traitement non-pharmacologique peut nettement améliorer le bien-être général et diminuer la nécessité du traitement pharmacologique et chirurgical: l’exercice (sous supervision) ou simplement le vélo d’appartement et la perte du poids en sont les mesures les plus décisives.
- Le traitement pharmacologique de première intention en phase non algique, ni inflammatoire sont les SYSADOA (1500mg de la Glucosamine sulfate cristalline de qualité pharmaceutique une fois par jour) combiné avec une Curcumine, suivi par les NSAIDs topiques puis oraux à court-terme (p.e. Celecoxib 200mg par jour) et les injections intra-articulaires d’acide hyaluronique (2 à 4 fois) ou de corticoïdes dans la phase aigüe de la maladie. Le paracétamol peut être recommandé pour une courte durée en phase très aigue d’arthrose. Les opioïdes ne sont recommandés que dans les cas exceptionnels pour traiter la douleur intense à très court-terme pour éviter l’accoutumance.
- Le traitement chirurgical par prothèse chez le patient obèse, si indiqué, doit être proposé indépendamment de son BMI. Le patient doit être informé des complications potentielles liées à l’obésité (un taux élevé des complications peri- et post-opératoires, ainsi qu’un résultat potentiellement médiocre) et il doit être encouragé à perdre du poids au préalable.
Affiliations
Cliniques universitaires Saint Luc, Orthopédie et de traumatologie de l'appareil locomoteur, B-1200 Bruxelles
Correspondance
Pr. Emmanuel Thienpont
Cliniques universitaires Saint Luc
Orthopédie et de traumatologie de l'appareil locomoteur
Avenue Hippocrate 10, B-1200 Bruxelles
Conflits d’intérêts
Les auteurs déclarent n'avoir aucun conflit d’intérêt par rapport au contenu de cet article.
Références
- Wittenauer R, Smith L, Aden K. Update on 2004 Background Paper 6.12 Osteoarthritis. Priority Medicines for Europe and the World “A Public Health Approach to Innovation.” 2013
- Eurostat. Overweight and obesity-BMI statistics Statistics Explained. 2014
- Ohtori S, Orita S, Yamashita M, Ishikawa T, Ito T, Shigemura T, et al. Existence of a Neuropathic Pain Component in Patients with Osteoarthritis of the Knee. Yonsei Med J. 2012 Jul 7;53(4):801.
- Hasegawa M, Tone S, Naito Y, Sudo A. Possible Neuropathic Pain in Patients with Osteoarthritis of the Knee Before and After Total Knee Arthroplasty. J Pain Res. 2021;14:3011–5.
- Polat CS, Doğan A, Sezgin Özcan D, Köseoğlu BF, Koçer Akselim S. Is There a Possible Neuropathic Pain Component in Knee Osteoarthritis? Arch Rheumatol. 2017 Dec 1;32(4):333.
- Altman R, Asch E, Bloch D, Bole G, Borenstein D, Brandt K, et al. Development of criteria for the classification and reporting of osteoarthritis: Classification of osteoarthritis of the knee. Arthritis Rheum. 1986;29(8):1039–49.
- Lee LS, Chan PK, Fung WC, Chan VWK, Yan CH, Chiu KY. Imaging of knee osteoarthritis: A review of current evidence and clinical guidelines. Musculoskeletal Care. 2021 Sep 1;19(3):363–74.
- Kohn MD, Sassoon AA, Fernando ND. Classifications in Brief: Kellgren-Lawrence Classification of Osteoarthritis. Clin Orthop Relat Res. 2016 Aug 1;474(8):1886.
- Paternostre F, Schwab PE, Thienpont E. The difference between weight-bearing and non-weight-bearing alignment in patient-specific instrumentation planning. Knee Surgery, Sport Traumatol Arthrosc. 2014 Mar;22(3):674–9.
- Kolasinski SL, Neogi T, Hochberg MC, Oatis C, Guyatt G, Block J, et al. 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee. Arthritis Care Res. 2020;72(2):149–62.
- Bruyère O, Honvo G, Veronese N, Arden NK, Branco J, Curtis EM, et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum. 2019 Dec 1;49(3):337–50.
- Reginster JY, Dudler J, Blicharski T, Pavelka K. Pharmaceutical-grade Chondroitin sulfate is as effective as celecoxib and superior to placebo in symptomatic knee osteoarthritis: the ChONdroitin versus CElecoxib versus Placebo Trial (CONCEPT). Ann Rheum Dis. 2017 Sep 1;76(9):1537–43.
- Delbarre A, Amor B, Bardoulat I, Tetafort A, Pelletier-Fleury N. Do intra-articular hyaluronic acid injections delay total knee replacement in patients with osteoarthritis – A Cox model analysis. PLoS One. 2017 Nov 1;12(11):e0187227.
- Price AJ, Dodd CAF, Svard UGC, Murray DW. Oxford medial unicompartmental knee arthroplasty in patients younger and older than 60 years of age. J Bone Joint Surg Br. 2005 Nov;87(11):1488–92.
- Ng HJH, Loke WJ, James WLH. The Influence of Obesity on Unicompartmental Knee Arthroplasty Outcomes: A Systematic Review And Meta-Analysis. Arch Bone Jt Surg. 2021 Nov;9(6):618.
- Boyce L, Prasad A, Barrett M, Dawson-Bowling S, Millington · Steven, Hanna SA, et al. The outcomes of total knee arthroplasty in morbidly obese patients: a systematic review of the literature. 2019;139:553–60.
- Chalidis BE, Petsatodis G, Christodoulou AG, Christoforidis J, Papadopoulos PP, Pournaras J. Is obesity a contraindication for minimal invasive total knee replacement? A prospective randomized control trial. Obes Surg. 2010 Dec;20(12):1633–41.