Médecine régénérative
Thomas Schubert, Robin Evrard, Julie Manon, Julia Vettese, Chiara Rafferty, Marie-Paule Soro, Olivier Cornu
Introduction
Contrairement au traitement des pseudarthroses où de nombreuses approches biologiques ont vu le jour (1), le traitement des pertes de substance osseuse, qu’elles soient d’origine traumatique, tumorale ou des suites de complications mécaniques ou infectieuses d’implants, constitue encore actuellement un défi si l’on veut rendre la fonction du membre au patient. Les implants métalliques posent le problème de leur intégration biologique, de leur résistance en fatigue et du risque infectieux et il en va de même de nos implants biologiques basés sur les allogreffes osseuses ou des reconstructions composites associant l’un et l’autre élément (2-3). Le recours à des techniques de reconstruction par transfert vascularisé libre ou transport osseux posent également de nombreux problèmes (4). C’est dans ce cadre que notre équipe développe de nouvelles approches pour accroître le potentiel biologique des allogreffes en leur conférant une meilleure biocompatibilité et en favorisant leur pouvoir biologique. L’usage des cellules souches adipeuses dans le secteur locomoteur semble prometteur.
Biocompatibilité
L’incorporation des allogreffes osseuses semble plus favorable lorsque celles-ci sont décellularisées et déhydratées (5). Si ce procédé est couramment utilisé par la banque de tissus de l’appareil locomoteur pour des greffes de petites tailles, utilisées en traumatologie, en chirurgie de reprise prothétique ou dans le comblement des cavités tumorales, il n’avait été appliqué qu’imparfaitement à des greffes massives. Un procédé de décellularisation d’os massif par perfusion a été développé avec succès permettant l’élimination du matériel cellulaire immunogène et ouvrant la place à la réhabitation de la structure par les cellules du receveur (6-8). Aux principes acquis pour définir la décelluarisation (disparition de noyaux visibles en histologie, dosage d’ADN inférieur à 50 ng/mg et absence de fragments de chaines d’ADN de plus de 200 bases (9), nos travaux suggèrent la nécessité d’un critère supplémentaire : l’absence de réaction immunitaire induite par des résidus du système HLA (10).
Pouvoir ostéogénique et chondrogénique
La réparation osseuse naturelle provient en première intention du périoste. Dans les pertes de substance osseuse massive, celui-ci fait défaut. Le recours à la bandelette iliotibiale a été considéré pour le remplacer car l’architecture s’en rapproche (11-13) et cette membrane peut-être colonisée par des cellules souches au pouvoir ostéogénique (14). Les cellules souches qu’elles soient d’origine périostée ou adipeuse sont susceptibles de se différencier au contact de la matrice d’intérêt vers la lignée ostéogénique ou chondrogénique. Elles peuvent donc contribuer à la réparation osseuse au contact de tissu osseux dans nos évaluations pré-cliniques ou à traiter l’arthrose dans un essai randomisé de phase 3, quoique l’(imagerie radiologique ne démontre pas de réelle réparation à ce stade (15-16).
Conclusion
Les modèles pré-cliniques et les essais cliniques laissent présager des perspectives extrêmement enthousiasmantes dans le domaine de la réparation ostéo-articulaire. Le défi d’amener la vascularisation nécessaire au maintien des cellules et au remodelage au sein des tissus bio-ingénieriées reste encore entier et représente une frontière jusqu’à présent difficile à surmonter. Si l’usage des cellules souches adipeuses dans l’arthrose semble prometteur sur le plan clinique, l’absence de rétablissement ad integrum du cartilage articulaire et le coût relatif de ce genre de thérapie pourrait cependant en limiter l’usage. De nouveaux essais cliniques et d’autres modes d’administration des cellules souches doivent probablement être encore considérés
Références
- Olivier Barbier, Emmanuël Thienpont, Olivier Cornu, François Barbier, Pauline Gonzalez, Radegonde Versyck et al. Innovations 2023 en Chirurgie Orthopédiques et Traumatologie. Louvain Med. 2024 ;143 :145-156
- Hao KA, Gutowski CT, Bindi VE, Srinivasan RC, Wright JO, King JJ et al. Reverse Allograft Prosthetic-Composite Versus Endoprosthesis Reconstruction for Massive Proximal Humerus Bone Loss: A Systematic Review and Meta-analysis of Outcomes and Complications. Indian J Orthop. 2024;58(10):1339-1348. doi: 10.1007/s43465-024-01248-7.
- Hones KM, Gutowski CT, Srinivasan RC, Wright JO, King JJ, Wright TW et al. Allograft-Prosthetic Composite Reconstruction for Proximal Humerus Bone Loss: A Systematic Review and Meta-Analysis of Outcomes and Complications. JBJS Rev. 2023;11(8). doi: 10.2106/JBJS.RVW.23.00061.
- Kukreja K, Reyaz S, Kumar MN. Outcome of Bone Transport Using Ilizarov External Fixator in Infected Non-union of Tibia with Large Bone Defects: Comparison of Those with 5-10 cm Bone Defect with Those Having ≥ 11 cm Bone Defect. Indian J Orthop. 2024;58(4):345-353. doi: 10.1007/s43465-024-01101-x.
- Ajami E, Fu C, Park SJ, Wang X, Wen HB. Comparison of the Effects of Tissue Processing on the Physicochemical Properties of Bone Allografts. Int J Oral Maxillofac Implants. 2023;38(1):169-180. doi: 10.11607/jomi.9781.
- Evrard R, Manon J, Maistriaux L, Rafferty C, Fieve L, Heller U et al. Decellularization of Massive Bone Allografts By Perfusion: A New Protocol for Tissue Engineering. Tissue Eng Part A. 2024;30(1-2):31-44. doi: 10.1089/ten.TEA.2023.0182.
- Evrard R, Manon J, Maistriaux L, Fievé L, Darius T, Cornu O et al. Enhancing the biological integration of massive bone allografts: A porcine preclinical in vivo pilot-study. Bone. 2024;187:117213. doi: 10.1016/j.bone.2024.117213.
- Evrard R, Feyens M, Manon J, Lengelé B, Cartiaux O, Schubert T. Impact of NaOH based perfusion-decellularization protocol on mechanical resistance of structural bone allografts. Connect Tissue Res. 2024;65(4):279-292. doi: 10.1080/03008207.2024.2356586.
- Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011;32(12):3233-3243. doi:10.1016/j.biomaterials.2011.01.057
- Manon J, Evrard R, Maistriaux L, Fieve L, Xhema D, Heller U et al. HLA Awareness in tissue decellularization: A paradigm shift for enhanced biocompatibility, studied on the model of the human fascia lata graft. Biomaterials. 2025;312:122741. doi: 10.1016/j.biomaterials.2024.122741.
- Manon J, Evrard R, Maistriaux L, Fievé L, Heller U, Magnin D et al. Periosteum and fascia lata: Are they so different? Front Bioeng Biotechnol. 2022; 19;10:944828. doi: 10.3389/fbioe.2022.944828.
- Manon J, Gallant L, Gérard P, Fievé L, Schneidewind P, Pyka G et al. 2D and 3D microstructural analysis of the iliotibial tract. J Anat. 2024;245(5):725-739. doi: 10.1111/joa.14125.
- Vettese J, Manon J, Chretien A, Evrard R, Fievé L, Schubert T, et al. Collagen molecular organization preservation in human fascia lata and periosteum after tissue engineering. Front Bioeng Biotechnol. 2024;12:1275709. doi: 10.3389/fbioe.2024.1275709.
- Manon J, Evrard R, Fievé L, Bouzin C, Magnin D, Xhema D et al. A New Osteogenic Membrane to Enhance Bone Healing: At the Crossroads between the Periosteum, the Induced Membrane, and the Diamond Concept. Bioengineering (Basel). 2023;10(2):143. doi: 10.3390/bioengineering10020143.
- Manon J, Englebert A, Evrard R, Schubert T, Cornu O. FixThePig: a custom 3D-printed femoral intramedullary nailing for preclinical research applications. Front Bioeng Biotechnol. 2024 Oct 17;12:1478676. doi: 10.3389/fbioe.2024.1478676.
- Kim KI, Lee MC, Lee JH, Moon YW, Lee WS, Lee HJ, Hwang SC et al. Clinical Efficacy and Safety of the Intra-articular Injection of Autologous Adipose-Derived Mesenchymal Stem Cells for Knee Osteoarthritis: A Phase III, Randomized, Double-Blind, Placebo-Controlled Trial. Am J Sports Med. 2023 Jul;51(9):2243-2253. doi: 10.1177/03635465231179223.
Avancées récentes dans la gestion des infections ostéoarticulaires
Tancrede Depoortere, Elvis Antibe, Randy Buzisa Mbuku, Hervé Poilvache, Audrey Lentini, Karim Tribak, Dan Putineanu, Xavier Libouton, Olivier Barbier, Jean-Emile Dubuc, Jean-Cyr Yombi, Olivier Cornu
Introduction
L’infection reste l’une des complications les plus redoutées en chirurgie orthopédique. La complexité de sa prise en charge réside dans le développement par les bactéries de biofilm bactérien dans lequel les bactéries développent des comportements les rendant moins susceptibles aux traitements anti-infectieux. La morbidité et la mortalité de cette pathologie est même supérieure à celle des cancers les plus courants (1). Réaliser un diagnostic précoce et veiller à un traitement chirurgical précoce pour détruire le biofilm sont deux éléments essentiels de la prise en charge qui lorsqu’elle est retardée demande davantage de moyens et une approche multidisciplinaire.
Établir le diagnostic
La société européenne pour les infections ostéoarticulaires a proposé différents critères pour assoir rapidement le diagnostic d’infection de prothèse articulaire et surtout veiller à ce que les praticiens aient en tête le diagnostic de l’infection avant d’établir une approche thérapeutique (Tableau 1) (2). En effet, passer à côté du diagnostic multiplie les chirurgies et faute d’une stratégie adéquate conduit à l’échec et la récidive de l’infection, rendant son traitement plus complexe. Les éléments essentiels qui conduisent à poser le diagnostic proviennent de l’examen et l’histoire clinique, l’imagerie radiologique de base et surtout de la ponction articulaire et de l’analyse attentive du liquide synovial. Il est essentiel de sensibiliser dans ce cadre le microbiologiste car la période de culture doit être prolongée en raison de l’inoculum souvent faible ou d’infections à faibles pathogènes et germes difficiles à cultiver.
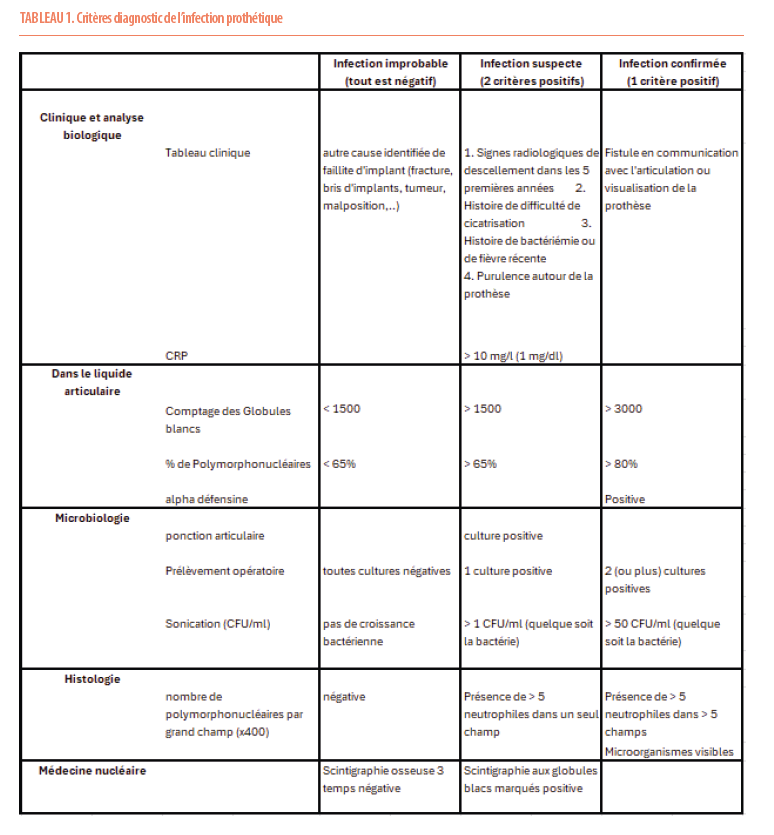
Reconnaître la complexité
Pouvoir classifier les patients infectés selon la gravité de leur état permet d’établir des stratégies thérapeutiques raisonnables et de préciser au patient les chances qu’il présente de pouvoir guérir. L’université de Oxford a proposé une classification applicable aussi bien aux infections de prothèses articulaires qu’aux ostéomyélites (3). Le tableau 2 reprend les différents éléments pris en compte : la complexité de la situation au niveau osseux, la difficulté de traiter la bactérie, la nécessité ou non de disposer d’un geste de couverture et l’état général du patient (Tableau 2). Un patient en situation 1 ou 2 présentera des chances de guérison de l’ordre de 85% alors qu’un patient classé en situation 3 verra ses chances de guérison plus proches de 65%. Ceci n’est cependant pas une raison pour ne pas proposer de prise en charge. Notre équipe a rapporté d’excellents résultats dans la gestion des infections osseuses classées B3, associées à des complications des tissus mous, telles que des cicatrices sévères, des fistules ou des ulcérations (4). L’importance d’un débridement complet des tissus infectés, associé à une reconstruction stable de l’os et à une couverture tissulaire adéquate, le tout complété par une antibiothérapie prolongée sont les clefs du succès. Les résultats de cette série rejoignent ceux observés dans des situations moins complexes. L’approche multidisciplinaire, combinant les expertises orthopédiques, plastiques, infectieuses et microbiologiques est la seule manière d’offrir aux patients des résultats prometteurs. Etablir la guérison nécessite une période de deux ans sans signe de récidive infectieuse. Pouvoir prédire celle-ci serait de nature à rassurer le patient et l’équipe soignante. La valeur prédictive de la CRP et du rapport neutrophiles/lymphocytes (NLR) comme marqueurs prédictifs de succès dans les traitements en deux temps des infections prothétiques n’a cependant malheureusement pas été confirmée sur ce plan (5).
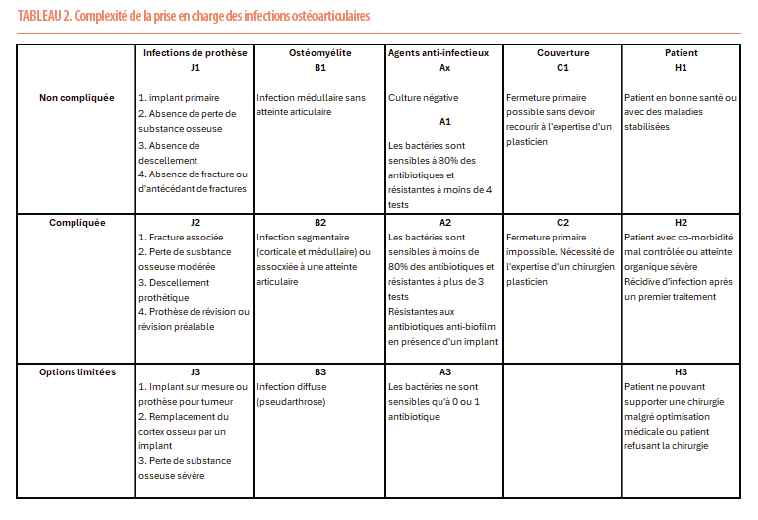
Conclusion
Le diagnostic précoce permet de réduire la complexité de la prise en charge en ne permettant pas au biofilm de maturer. Des critères clairs permettent d’éveiller le praticien à ne pas manquer ce diagnostic. Une approche multidisciplinaire permet d’établir des résultats satisfaisant, même dans les situations complexes et doit devenir la règle dans l’approche de la pathologie orthopédique septique. De nouvelles stratégies thérapeutiques prometteuses sont explorées en associant des cocktails enzymatiques pour rompre la biofilm et des hautes doses d’antibiotiques locaux, permettant de réduire la toxicité systémique et de disposer de concentrations élevées d’antibiotiques au site de l’infection (6). Celles-ci pourraient trouver le chemin de la clinique dans le cadre d’essais thérapeutiques.
Références
- Sandiford NA, Francescini M, Kendoff D. The burden of prosthetic joint infection (PJI). Ann Joint 2020. doi: 10.21037/aoj-2020-pji-11
- McNally, M.A., Sousa, R., Wouthuyzen-Bakker, M., Chen, A.F., Soriano, Á., Vogely, H.C et al. (2021). The EBJIS definition of periprosthetic joint infection. The Bone & Joint Journal. 103-B, 18 - 25.
- Hotchen AJ, Wismayer MG, Robertson-Waters E, McDonnell SM, Kendrick B, Taylor A, et al. The Joint-Specific BACH classification: A predictor of outcome in prosthetic joint infection. EClinicalMedicine. 2021;42:101192. doi: 10.1016/j.eclinm.2021.101192.
- Lentini A, Djoko J, Putineanu D, Tribak K, Coyette M, Yombi JC et al. Septic ortho-plastic reconstruction surgery:; outcomes from a 6-year collaborative study. Orthop Procs. 2024;106-B(SUPP_19):86-86. doi:10.1302/1358-992X.2024.19.086
- Ecki M, Poilvache H, Buzisa M, Van Cauter M, Rodriguez-Villalobos H, Yombi JC et al. Are C-reactive protein (CRP) and neutrophil to lymphocyte ratio (NLR) predictive markers of successful two-stage prosthetic joint infection management? Acta Orthop. Belg. 2023;89:659-664.
- Mbuku RB, Poilvache H, Van Bambeke F, Cornu O. Enhanced efficacy against MRSA biofilms: evaluation of enzymatic cocktail adjuvant with Rifampicin and Vancomycin dual therapy. Orthopaedic Proceedings. 2024;106(SUPP_19):64-64.
Les développements de l’Intelligence artificielle en Orthopédie-Traumatologie
Alexandre Englebert, Pierre-Louis Docquier, Xavier Banse, Thomas Schubert, Christophe de Vleeschouwer, Olivier Cornu
Introduction
L’intelligence artificielle (IA) révolutionne la médecine, notamment l’orthopédie-traumatologie. Grâce à des algorithmes avancés et des approches centrées sur l’explicabilité, l’IA permet d’améliorer le diagnostic, la planification chirurgicale et le suivi des patients (1). L’IA, en particulier les réseaux neuronaux convolutionnels (CNN), est utilisée pour interpréter les radiographies, scanners et IRM avec une précision croissante (2-3). Ces systèmes permettent une détection rapide et fiable des fractures, lésions articulaires ou complications postopératoires. Les algorithmes d’apprentissage automatique permettent d’analyser des données cliniques et biomécaniques pour prédire les résultats chirurgicaux. Ces outils offrent des recommandations personnalisées pour chaque patient, réduisant ainsi le risque de complications. Un défi majeur reste de comprendre comment les algorithmes prennent leurs décisions (4-5). Notre équipe s’est concentrée sur l’explicabilité, un élément clé pour intégrer ces outils dans la pratique clinique.
Amélioration de l’interprétabilité des modèles d’IA
Les modèles d’apprentissage profond, notamment les réseaux neuronaux convolutionnels (CNN) et les Transformers, jouent un rôle essentiel dans l’analyse des données médicales. Cependant, leur nature souvent considérée comme « boîte noire » limite leur adoption clinique, où la compréhension des processus décisionnels est cruciale. Les travaux tels que « Poly-CAM » (6)] et « Backward recursive Class Activation Map refinement » (7) répondent à ce besoin en proposant des méthodes avancées pour générer des cartes d’activation à haute résolution. Ces cartes permettent de visualiser les régions précises des images médicales qui influencent les prédictions du modèle, offrant ainsi aux cliniciens des outils explicatifs plus fiables pour évaluer et valider les résultats de l’IA. Les techniques d’alignement auto-supervisé entre les représentations visuelles et linguistiques, développées dans les travaux sur les radiographies osseuses (8), permettent une interprétation plus cohérente des données cliniques. Cela est particulièrement pertinent pour identifier des pathologies complexes, comme les fractures intra-articulaires ou les remaniements osseux subtils. L’adoption de l’IA en milieu clinique repose en grande partie sur la confiance des praticiens. Les travaux d’évaluation des méthodes d’explicabilité fournissent des critères objectifs pour juger de la fiabilité et de la pertinence des algorithmes (9-10). Ces recherches favorisent un dialogue plus transparent entre les cliniciens et les technologies d’IA, tout en élargissant les frontières de leur utilisabilité.
Perspectives futures
L’intégration des méthodes IA dans notre spécialité ouvre la voie à une médecine personnalisée et prédictive. Nos travaux montrent que l’amélioration de l’explicabilité, combinée à des approches innovantes comme les Transformers et les modèles auto-supervisés, peut transformer la façon dont les pathologies sont diagnostiquées, traitées et surveillées. Ces recherches constituent donc un pas significatif vers une adoption clinique responsable et efficace de l’intelligence artificielle, tout en renforçant la collaboration entre les domaines de l’ingénierie et de la médecine.
Références
- Guezou-Philippe, A, Clav’e, A, Maguet, E, Maintier, L, Garraud, C, Fouefack, J, et al. Fully automated workflow for designing patient-specific orthopaedic implants: application to total knee arthroplasty. arXiv:2403.15353v3 [cs.CV] 7 Jan 2025 (https://api.semanticscholar.org/CorpusID:268667078}
- Kutbi M. Artificial Intelligence-Based Applications for Bone Fracture Detection Using Medical Images: A Systematic Review. Diagnostics (Basel). 2024;14(17):1879. doi: 10.3390/diagnostics14171879.
- Ju, R., & Cai, W. Fracture detection in pediatric wrist trauma X-ray images using YOLOv8 algorithm. Scientific Reports. 2023 ; 13.
- Farron A, Hannouche D. Intelligence artificielle en orthopédie: à quels risques serons-nous confrontés ? Rev Med Suisse. 2019;15(675):2271-2272. French. PMID: 31840953.
- Amirian, S, Carlson, LA, Gong, MF, Lohse, I, Weiss, K., Plate, JF, Tafti, AP. Explainable AI in Orthopedics: Challenges, Opportunities, and Prospects. Congress in Computer Science, Computer Engineering, & Applied Computing (CSCE)2023; 1374-1380.
- Englebert A, Cornu O, De Vleeschouwer C. Poly-CAM: High resolution class activation map for convolutional neural networks. Machine Vision and Applications. 2024.
- Englebert A, Cornu O, De Vleeschouwer C. Backward recursive Class Activation Map refinement for high resolution saliency map. 26th International Conference on Pattern Recognition (ICPR). 2022 ; 2444-2450.
- Englebert A, et al. Explaining through Transformer Input Sampling. Proceedings of the IEEE/CVF International Conference on Computer Vision (ICCV). 2023 ; 806-815.
- Stassin S, Englebert A, et al. An experimental investigation into the evaluation of explainability methods. arXiv preprint arXiv. 2023; 2305.16361
- Englebert A, Collin AS, Cornu O, De Vleeschouwer C. Self-supervised vision-language alignment of deep learning representations for bone X-rays analysis. arXiv preprint arXiv. 2405.08932.
Affiliations
Service de Chirurgie Orthopédique et Traumatologie, Cliniques universitaires Saint-Luc UCL, Université Catholique de Louvain, Bruxelles, Belgique.
* Service de Chirurgie Reconstructrice et Plastique, Cliniques universitaires Saint-Luc UCL, Université Catholique de Louvain, Bruxelles, Belgique
$ Contributeurs équivalents
# ICTEAM, EPL, UCLouvain
Correspodnance
Pr Olivier Cornu
Cliniques universitaires Saint-Luc - UCLouvain
Service de Chirurgie Orthopédique et Traumatologie
Avenue Hippocrate 10
B-1200 Bruxlles