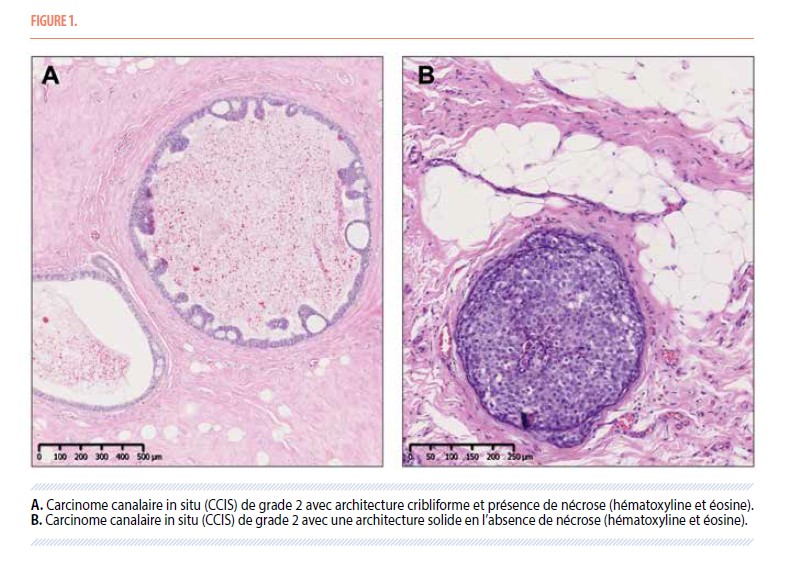
Introduction
Le Carcinome Canalaire In Situ (CCIS) est une lésion mammaire dans laquelle est observée une augmentation de la croissance des cellules épithéliales atypiques qui restent confinées dans les canaux du sein. Par opposition aux cancers du sein invasifs qui eux franchisent la membrane basale des canaux mammaires et envahissent le parenchyme environnant.
Depuis la généralisation des programmes de dépistage mammographique, l’incidence des CCIS s’est considérablement majorée. Ils représentent à l’heure actuelle 20% de tous les cancers du sein détectés (1). Malgré l’augmentation du nombre de cas diagnostiqués et de prise en charge thérapeutique de ces lésions, on n’observe pas de diminution significative des cancers mammaires invasifs(2,3). Cela suggère que la prise en charge des CCIS ne réduit ni l’incidence des cancers du sein invasif, ni la mortalité liée au cancer du sein. On pourrait subséquemment parler de sur-diagnostic et de sur-traitement.
Progression des CCIS en carcinomes mammaires invasifs
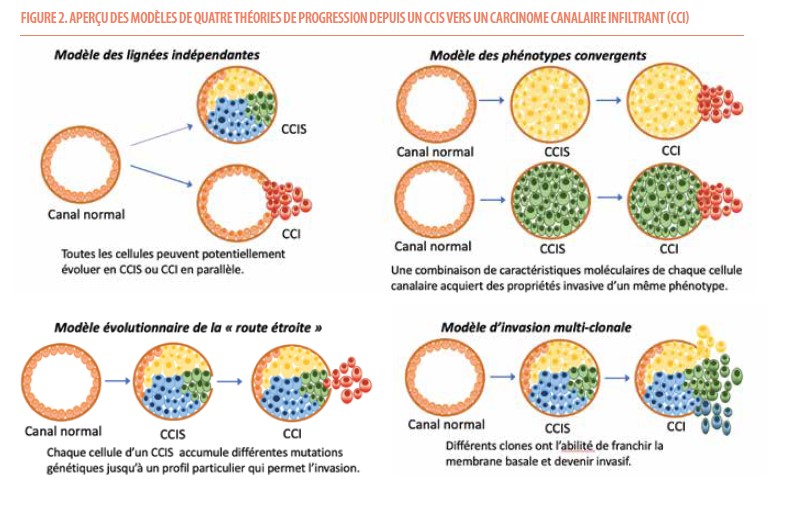
Les CCIS ne sont pas dangereux de manière inhérente mais ils sont considérés comme des précurseurs potentiels de carcinome invasif et leur excision est dès lors recommandée. Ils sont associés à un sur-risque de cancer du sein invasif. Plusieurs modèles d’évolution potentiels ont été proposés par Van Seijen et al. (3) :
Le modèle des lignées indépendantes soutient l’hypothèse que le CCIS et le cancer invasif viennent de lignées cellulaires parallèles et indépendantes les unes des autres. C’est le fait qu’il existe des différences moléculaires entre ces deux types de lésions qui plaide en faveur de cette théorie (4,5,6). L’association fréquente entre CCIS et cancer du sein invasifs viendrait alors de leurs facteurs de risques communs (âge, parité, antécédents familiaux, densité mammaire élevée, mutations génétiques telles que BRCA1/BRCA2) (1).
Le modèle des phénotypes convergents est une théorie selon laquelle différents génotypes de CCIS pourraient mener à un cancer infiltrant d’un phénotype unique. Le fait qu’une combinaison d’aberrations peut différer entre les différents canaux d’un même CCIS plaide en faveur de cette hypothèse. Une étude de Hernandez et al. soutient cette théorie en montrant que même si les profils génétiques sont généralement similaires entre le CCIS et la tumeur infiltrante adjacente, dans un certain nombre de cas, ces tumeurs diffèrent d’un point de vue génétique. La progression serait alors menée par des clones spécifiques qui mènent au même phénotype (7).
Le modèle évolutif de la « route étroite » (de l’anglais « Bottleneck ») décrit que chaque cellule au sein d’un même canal accumule différentes variations génétiques et seulement une sous-population de cellules, avec un profil génétique particulier, est capable de franchir une « route étroite » et envahir le tissu adjacent. Plusieurs études soutenant cette théorie rapportent une concordance génétique élevée entre CCIS et cancer invasif (4,5).
Le modèle d’invasion multi-clonale est soutenu par le fait que différents clones d’une même lésion in situ ont la capacité de s’échapper des canaux et de co-migrer vers les tissus adjacents pour devenir des carcinomes invasifs. Il démontre par ailleurs que plusieurs mutations et aberrations d’un gène ont lieu dans le canal mammaire avant même le processus d’invasion (4,5).
Ces modèles présumés illustrent la complexité du processus potentiel d’invasion du CCIS et indiquent que les lésions indolentes pourraient devenir invasives via une combinaison de plusieurs des mécanismes proposés.
À l’heure actuelle, il est impossible d’identifier les types de CCIS à risque de progression.
En effet, le délai requis pour qu’ils deviennent invasifs diffère d’une lésion à l’autre. Comme l’instigateur précis de l’invasion est encore inconnu, nous ne sommes actuellement pas en mesure de prédire quelle lésion CCIS deviendra invasive dans un cours laps de temps après son diagnostic initial, et quelle lésion de CCIS se comporte de manière plus indolente et nécessitera plus de 10 ans avant d’évoluer vers un carcinome invasif.
Le traitement standard est dès lors proche de celui des cancers infiltrants : chirurgie conservatrice ou radicale associée ou non à une radiothérapie et/ou hormonothérapie adjuvantes. Il a été démontré que lorsqu’ils sont traités, le taux de mortalité spécifique au cancer du sein à 15 ans est de 1,93% pour les DCIS contre 11,5% pour les cancers mammaires infiltrants (8,9). Le risque d’évolution en tumeur invasive depuis un CCIS à bas risque (ER+, grade I-II, taille < 2cm) est estimé à 0,92% à 5 ans et 3,02% à 10 ans (10), 6,5% à 7,5 ans (11). Ce risque a également été évalué à 14-53%, tous grades confondus (26).
La perception du risque
Plusieurs études ont démontré que les conséquences psychologiques lors de l’annonce du diagnostic et du traitement sont comparables entre les patientes atteintes d’un CCIS et d’une tumeur mammaire infiltrante. (8,12–14) Van Gestel et al. ont identifié une préoccupation similaire autour du risque de développer une récurrence de la maladie, de mourir du cancer du sein, et rapportent une morbidité psychologique comparable chez les patientes atteintes de CCIS ou de tumeur invasive (13). Dans l’étude de Rakovitch et al., un tiers des patientes atteintes d’un CCIS pensent qu’elles ont un risque significatif de développer des métastases, un tiers pensent qu’elles ont un risque notoire de mourir d’un cancer du sein et seulement 50% pensent qu’elles sont susceptibles de mourir d’une autre cause que le cancer du sein. Ces résultats sont similaires dans le groupe de patientes souffrant d’un cancer invasif débutant (8). L’étude de Lauzier et al. démontre aussi qu’il n’existe pas de différence entre ces groupes en termes de détresse psychologique, de santé mentale et de santé physique. Elle démontre également que ces effets persistent dans le temps (14). Une autre étude met en évidence que 25% des patientes perçoivent un risque au moins modéré de développer des métastases à distance (12). Or une très faible proportion de patientes développera une maladie métastatique après un diagnostic de CCIS. Par ailleurs, leur mortalité spécifique au cancer du sein est très basse (1-2% à 10 ans et jusqu’à 6,3% à 30 ans) (3,15,16).
La perception erronée du risque n’exerce pas uniquement des conséquences sur la morbidité psychologique mais mène également à des choix inappropriés de prise en charge. Les cliniciens devraient insister sur le caractère in situ des CCIS et sur la distinction qu’il existe avec les tumeurs invasives du sein (8).
Une nouvelle terminologie est-elle nécessaire ?
Dans le diagnostic du cancer du sein, comme dans tous les diagnostics de cancer, la manière de communiquer les résultats aux patients est essentielle et la terminologie utilisée par les cliniciens peut avoir un impact important sur le vécu des patients (17-19).
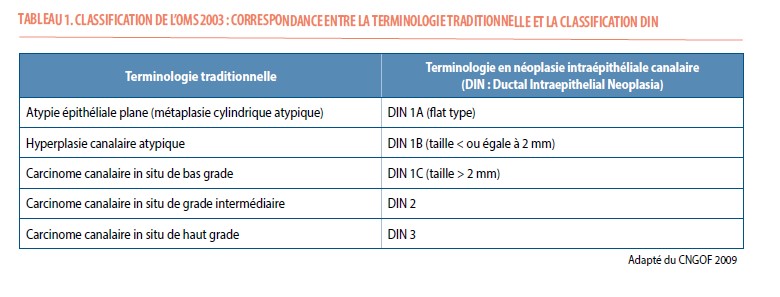
Certains chercheurs suggèrent que le mot « carcinome » devrait être changé (20-24). Au début des années 2000, Tavassoli proposait déjà de réserver la dénomination de « carcinome » aux lésions qui envahissent le stroma (22). Elle a alors soumis une nouvelle terminologie qui supprimerait l’étiquette de « cancer » du diagnostic, à l’instar des dénominations existantes dans les néoplasies du col, du vagin, de la vulve ou encore de la prostate et du pancréas. Cette terminologie : DIN pour « Ductal Intraépithélial Neoplasia », présentée dans le tableau ci-dessous, a été reprise par l’OMS en ٢٠٠٣ mais n’a pourtant pas été adoptée en pratique quotidienne (25) (Tableau 1).
De nombreuses études soutiennent la nécessité d’une nouvelle terminologie en expliquant que le terme de carcinome n’est pas adapté puisque ces tumeurs n’ont pas le potentiel de métastaser (2,17,20,21,23). Plusieurs études ont montré les conséquences de l’utilisation de la dénomination de « cancer » dans les cas de CCIS. Omer et al. ont confirmé que les prises en charges sont plus agressives que ce soit par le biais des professionnels de la santé ou sur demande des patientes (18). En effet, la manière dont les praticiens orientent leurs recommandations thérapeutiques est elle aussi influencée par l’étiquette attribuée à la maladie (22). Plusieurs facteurs, même inconscients, peuvent mener au sur-diagnostic et au sur-traitement. Un changement de terminologie intégrant une nouvelle classification pourrait aider à re-calibrer le diagnostic et, par-là, modifier l’attente autour de la détection, du suivi et du traitement des CCIS à bas risque.
Certaines études mettent en lumière de nombreux avantages potentiels à ce changement de terminologie (17-19,22) tels que la diminution de la confusion qui peut exister autour du diagnostic de CCIS chez les professionnels et les patients (22). Comme décrit ci-dessus, la terminologie utilisée a de nombreuses conséquences psychologiques sur les patients qui influencent les choix de traitement exprimés par les patientes (17-19) Une étude menée sur 394 femmes a montré que lorsque le CCIS était décrit comme « un cancer non invasif », 47% des patientes préféraient une chirurgie par rapport à une alternative non chirurgicale, qu’elle consiste en un traitement médical ou une surveillance active. En comparaison, lorsque le CCIS était décrit comme une « lésion mammaire », seulement 34% des patientes ont opté pour le traitement chirurgical et 31% lorsque les termes de « cellules anormales » étaient utilisés (p< 0,001) (18).
D’autres études ont quant à elles pointé les raisons qui plaident en défaveur d’un changement de terminologie. La création d’une nouvelle nomenclature pourrait au contraire entrainer une augmentation de la confusion, les termes choisis pouvant être mal-interprétés (2).
Avec l’étiquette de « cancer » les patientes bénéficient plus facilement du soutien dont elles ont besoin, que ce soit de la part des professionnels mais aussi de leurs proches ou encore de la société elle-même. Des aides et avantages spécifiques sont mis en place par le système de santé pour certaines patientes dont l’éligibilité dépend de la dénomination de « cancer » (2,17).
Par ailleurs, les conséquences sur les patientes qui ont déjà été prises en charge pour un CCIS sont également à prendre en considération. Cela pourrait leur donner l’impression d’avoir été mal-diagnostiquées et/ou sur-traitées, ce qui leur apporterait encore plus de confusion et de détresse psychologique. Cela entraînerait aussi des conséquences pratiques sur leur suivi ou des traitements en cours (17).
Une nouvelle dénomination qui n’inclurait pas le mot « cancer » ou « carcinome » ne suffirait pas pour éliminer les conséquences psychosociales sérieuses, d’autant plus si des suivis à long terme sont recommandés (2).
Une nouvelle dénomination ne diminuerait pas à elle seule la perception de leur maladie, par les patientes atteintes de CCIS. Il serait également indispensable de travailler sur la communication entre médecins et patientes. C’est toute la communication entre médecins et patiente qui doit être améliorée. Mais pour cela, il faudrait compenser les lacunes quant au potentiel invasif de cette maladie par une discussion ouverte avec la patiente.
Dans un dialogue idéal, le praticien devrait expliciter la nature peu agressive des affections à faible risque et l’éventualité de sur-diagnostic et de sur-traitement. Il serait important qu’il fournisse des informations sur les risques d’évolution en utilisant des chiffres pour montrer les résultats à long terme que l’on obtient dans chaque option de prise en charge présentée. Malheureusement ces informations fiables manquent et des études supplémentaires sont nécessaires sur le sujet.
La surveillance active
Dans les affections à bas risque, l’option de la surveillance active devrait être abordée.
Pour ce faire, les cliniciens doivent être convaincus que certaines patientes ne tirent aucun bénéfice des traitements standards actuels et qu’elles pourraient donc être prise en charge de manière sûre par le monitoring seul. Ils auraient également besoin d’une définition claire de ce qu’est une affection à bas risque et de méthodes fiables pour les identifier.
Actuellement, trois essais cliniques prospectifs sont en cours. Ils visent à comparer la surveillance active par mammographie et examen clinique 1-2x/an, aux traitements conventionnels actuels (chirurgie +- radiothérapie ± hormonothérapie) sur le long terme pour les CCIS de bas risque. Ces trois études cliniques : COMET au Etats Unis, LORIS au Royaume Unis, LORD au Pays-Bas, ont comme objectif primaire de montrer une non-infériorité de la surveillance active par rapport aux traitements conventionnels actuels en termes de survie sans cancer invasif ipsilatéral (LORIS), en termes de pourcentage de cancer invasif à 2 ans (COMET) et à 10 ans (LORD) (27-29).
Il faut cependant rester prudent quant à la désescalade thérapeutique. On retrouve dans la littérature quelques études qui mettent en lumière certains défauts de la surveillance active. Le diagnostic du CCIS se fait sur base d’une biopsie qui ne représente qu’une fraction de la tumeur et qui n’est pas toujours représentative de la tumeur dans son ensemble. On pourrait manquer la composante à plus haut risque dont seule l’excision complète permettrait un diagnostic de certitude (2). Le taux de diagnostic initial de CCIS sur biopsie présentant une invasion stromale sur la pièce opératoire s’élève entre 15 et 30 %. (30,31). La difficulté majeure de ces 3 études réside dans la difficulté de recrutement des patientes, très réticentes à participer à ce type d’études et il faut malheureusement craindre qu’elles ne pourront pas- en raison du recrutement insuffisant - apporter les réponses espérées.
De plus, il peut également y avoir des effets psychologiques négatifs dans la surveillance active des lésions précancéreuses de bas risque. En effet une étude prospective menée sur 341 hommes atteints d’un cancer prostatique de faible risque chez qui une surveillance active avait été proposée a démontré que leur niveau d’anxiété, leur risque de dépression et leur peur de la récurrence étaient supérieurs aux patients traités par radiothérapie (19).
Les outils de prédiction du risque
Pour informer au mieux les patients sur leur possibilité de prise en charge, en plus des informations sur l’histoire naturelle de la maladie, les cliniciens auront également besoin d’outils de prédiction. Ils seront nécessaires pour classifier les patients en groupes de risque après avoir identifié et validé des biomarqueurs moléculaires, génétiques et micro-environnementaux de récurrence afin d’apporter desPour informer au mieux les patients sur leur possibilité de prise en charge, en plus des informations sur l’histoire naturelle de la maladie, les cliniciens auront également besoin d’outils de prédiction. Ils seront nécessaires pour classifier les patients en groupes de risque après avoir identifié et validé des biomarqueurs moléculaires, génétiques et micro-environnementaux de récurrence afin d’apporter des données précises et exactes qui guideraient les patients et les professionnels pour le choix de prise en charge.
Il est donc indispensable d’effectuer plus de recherches autour des aspects moléculaires, génétiques et micro-environnementaux de la progression du CCIS vers le cancer du sein invasif.
Dans la littérature, il existe déjà de nombreuses études qui se penchent sur des biomarqueurs prédictifs d’évolution d’un CCIS (1,7,32-34). Cependant, dans la majorité des cas, ces études comportent de toutes petites séries ainsi qu’une absence de suivi à long terme et les associations que certaines études mettent en évidence ne sont pas validées par d’autres (1,3). Malgré de nombreuses années de recherche, aucun biomarqueur robuste pouvant prédire de manière fiable la récurrence d’un CCIS ou sa progression vers l’invasion n’a été mis en évidence. Les marqueurs les plus intéressants semblent concerner le microenvironnement de la tumeur. Il reste cependant des avancées significatives attendues dans ce domaine (32). Par ailleurs, les nouvelles technologies telles que l’intelligence artificielle et le machine learning, pourraient offrir une nouvelle direction prometteuse vers la compréhension de ces mécanismes.
Une revue récente de la littérature n’a retrouvé que quelques outils de prédiction de risque et d’aide à la décision pour les patientes atteintes d’un CCIS. Elle conclut que les modèles de prédiction décrits (VNPI, MSKCC, Oncotype DCIS) sont prometteurs mais nécessitent des études de validation à plus grande échelle et des améliorations pour maximiser leur utilité et leur usage en clinique (7).
De plus, il parait nécessaire d’étendre ces modèles de prédiction afin d’intégrer l’option de la surveillance active chez les patientes avec un CCIS de bas risque pour aligner les futurs outils prédictifs avec le champ des essais cliniques en cours de développement.
Conclusion
Le dialogue actuel entre cliniciens et patientes autour du diagnostic de CCIS résulte en un impact émotionnel disproportionné qui génère un potentiel sur-traitement pour de nombreuses patientes. Le besoin de recadrer la perception du risque est un sujet d’actualité compte tenu des préjudices physiques et émotionnels endurés par les patientes et du surcoût pour la société, amenés par le sur-diagnostic et le sur-traitement. En outre, il parait nécessaire de notifier que cette perception du risque par les patientes ait surtout été évaluée par d’anciennes études américaines et que ces données mériteraient d’être actualisées et confirmées avec des cohortes européennes.
Des recherches approfondies à la frontière entre épidémiologie, biologie moléculaire, études cliniques et psycho-sociales sont nécessaires sur la progression et l’évolution des CCIS. Elles permettraient de re-calibrer la classification de ces lésions dans l’intention d’aider à ajuster la perception du risque chez les patientes et les cliniciens. Ces nouvelles connaissances, alors basées sur des faits solides, autoriseront l’optimisation de la communication entre ces derniers à dessein d’éclairer leurs prises de décision de manière à éviter le sur-traitement, sans compromettre le succès des prises en charges chez les patientes qui le nécessitent.
Une telle demande est difficile vu la complexité et l’hétérogénéité du carcinome canalaire in situ, le tout associé à une difficulté d’obtenir des cohortes assez larges de patients. Elle nécessitera une approche collaborative, interdisciplinaire et multicentrique pour avoir des résultats statistiquement puissants. Les défis à relever sont complexes mais très motivants…
Affiliations
1. Service de gynécologie-obstétrique du Grand Hôpital de Charleroi
2. Service de pathologie des cliniques universitaires Saint-Luc; Clinique du sein , Institut Roi Albert II (IRA II); Pôle de Morphologie (MORF), Institut de Recherche Expérimentale et Clinique, Université catholique de Louvain
3. Service de pathologie des Cliniques universitaires Saint-Luc; Pôle de Morphologie (MORF), Institut de Recherche Expérimentale et Clinique, Université catholique de Louvain
4. Clinique du sein, Institut Roi Albert II (IRA II) ; Service de gynécologie, Cliniques universitaires Saint-Luc
5. Service de pathologie des Cliniques universitaires Saint-Luc
Correspondance
Dr. Mieke Van Bockstal
Cliniques universitaires Saint-Luc
Service de pathologie
Avenue Hippocrate 10
B-1200 Bruxelles
mieke.vanbockstal@saintluc.uclouvain.be
Références
- Gorringe KL, Fox SB. Ductal Carcinoma In Situ Biology, Biomarkers, and Diagnosis. Front Oncol. 23 oct 2017;7:248.
- Esserman LJ, Varma M. Should we rename low risk cancers? BMJ. 23 janv 2019;k4699.
- van Seijen M, Lips EH, Thompson AM, Nik-Zainal S, Futreal A, Hwang ES, et al. Ductal carcinoma in situ: to treat or not to treat, that is the question. Br J Cancer. août 2019;121(4):28592.
- Hernandez L, Wilkerson PM, Lambros MB, Campion‐Flora A, Rodrigues DN, Gauthier A, et al. Genomic and mutational profiling of ductal carcinomas in situ and matched adjacent invasive breast cancers reveals intra‐tumour genetic heterogeneity and clonal selection. J Pathol. mai 2012;227(1):4252.
- Casasent AK, Schalck A, Gao R, Sei E, Long A, Pangburn W, et al. Multiclonal Invasion in Breast Tumors Identified by Topographic Single Cell Sequencing. Cell. janv 2018;172(12):205-217.e12.
- Casasent AK, Edgerton M, Navin NE. Genome evolution in ductal carcinoma in situ : invasion of the clones. J Pathol. nov 2016;241(2):20818.
- Schmitz R, Wilthagen E, Van Duijnhoven F, Van Oirsouw M, Verschuur E, Lynch T, et al. Prediction Models and Decision Aids for Women with Ductal Carcinoma In Situ: A Systematic Literature Review. Cancers. 2 juill 2022;14(13):3259.
- Rakovitch E, Franssen E, Kim J, Ackerman I, Pignol JP, Paszat L, et al. A comparison of risk perception and psychological morbidity in women with ductal carcinoma in situ and early invasive breast cancer. Breast Cancer Res Treat. févr 2003;77(3): 28593.
- Cutuli B. Les carcinomes canalaires in situ en 2019 : diagnostic, traitement, pronostic. Presse Médicale. oct 2019;48(10):111222.
- Byng D, Retèl VP, Schaapveld M, Wesseling J, van Harten WH, Grand Challenge PRECISION consortium. Treating (low-risk) DCIS patients: What can we learn from real-world cancer registry evidence? Breast Cancer Res Treat. mai 2021;187(1):18796.
- Ryser MD, Weaver DL, Zhao F, Worni M, Grimm LJ, Gulati R, et al. Cancer Outcomes in DCIS Patients Without Locoregional Treatment. J Natl Cancer Inst. 1 sept 2019;111(9):95260.
- Ruddy KJ, Meyer ME, Giobbie-Hurder A, Emmons KM, Weeks JC, Winer EP, et al. Long-Term Risk Perceptions of Women With Ductal Carcinoma In Situ. The Oncologist. 1 avr 2013;18(4):3628.
- van Gestel YRBM, Voogd AC, Vingerhoets AJJM, Mols F, Nieuwenhuijzen G a. P, van Driel OJR, et al. A comparison of quality of life, disease impact and risk perception in women with invasive breast cancer and ductal carcinoma in situ. Eur J Cancer Oxf Engl. 1990. févr 2007;43(3):54956.
- Lauzier S, Maunsell E, Levesque P, Mondor M, Robert J, Robidoux A, et al. Psychological distress and physical health in the year after diagnosis of DCIS or invasive breast cancer. Breast Cancer Res Treat. avr 2010;120(3):68591.
- Worni M, Akushevich I, Greenup R, Sarma D, Ryser MD, Myers ER, et al. Trends in Treatment Patterns and Outcomes for Ductal Carcinoma In Situ. J Natl Cancer Inst. déc 2015;107(12):djv263.
- He W, Sofie Lindström L, Hall P, Czene K. Cause-specific mortality in women with breast cancer in situ: Mortality in women with breast cancer in situ. Int J Cancer. 1 juin 2017;140(11):241421.
- Nickel B, Moynihan R, Barratt A, Brito JP, McCaffery K. Renaming low risk conditions labelled as cancer. BMJ. 12 août 2018;k3322.
- Omer ZB, Hwang ES, Esserman LJ, Howe R, Ozanne EM. Impact of Ductal Carcinoma In Situ Terminology on Patient Treatment Preferences. JAMA Intern Med. 28 oct 2013;173(19):1830.
- Egger SJ, Calopedos RJ, O’Connell DL, Chambers SK, Woo HH, Smith DP. Long-term Psychological and Quality-of-life Effects of Active Surveillance and Watchful Waiting After Diagnosis of Low-risk Localised Prostate Cancer. Eur Urol. juin 2018;73(6):85967.
- Galimberti V, Monti S, Mastropasqua MG. DCIS and LCIS are confusing and outdated terms. They should be abandoned in favor of ductal intraepithelial neoplasia (DIN) and lobular intraepithelial neoplasia (LIN). The Breast. août 2013;22(4):4315.
- Tavassoli FA, Sakorafas GH. ‘Ductal Carcinoma In Situ of the Breast’ – Is It Time to Replace This Term by ‘Ductal Intraepithelial Neoplasia of the Breast’? Oncol Res Treat. 2009;32(4):218218.
- Kennedy F, Harcourt D, Rumsey N. Perceptions of ductal carcinoma in situ (DCIS) among UK health professionals. The Breast. avr 2009;18(2):8993.
- Ma T, Semsarian CR, Barratt A, Parker L, Pathmanathan N, Nickel B, et al. Should low-risk DCIS lose the cancer label? An evidence review. Breast Cancer Res Treat. juin 2023;199(3):41533.
- Tavassoli FA. Ductal intraepithelial neoplasia (Idh, aidh and dcis). Breast Cancer. oct 2000;7(4):31520.
- Corce S, Mathelin C, Bellocq J. Lésions épithéliales atypiques : point de vue sur les classifications. In 2009. p. 25362.
- Erbas B, Provenzano E, Armes J, Gertig D. The natural history of ductal carcinoma in situ of the breast: A review. Breast Cancer Res Treat. 2006;97(2):13544.
- Schmitz RSJM, Engelhardt EG, Gerritsma MA, Sondermeijer CMT, Verschuur E, Houtzager J, et al. Active surveillance versus treatment in low-risk DCIS: Women’s preferences in the LORD-trial. Eur J Cancer Oxf Engl. 1990. oct 2023;192:113276.
- Wheelwright S, Matthews L, Jenkins V, May S, Rea D, Fairbrother P, et al. Recruiting women with ductal carcinoma in situ to a randomised controlled trial: lessons from the LORIS study. Trials. 14 oct 2023;24(1):670.
- Hwang ES, Hyslop T, Lynch T, Frank E, Pinto D, Basila D, et al. The COMET (Comparison of Operative versus Monitoring and Endocrine Therapy) trial: a phase III randomised controlled clinical trial for low-risk ductal carcinoma in situ (DCIS). BMJ Open. mars 2019;9(3):e026797.
- Mannu GS, Groen EJ, Wang Z, Schaapveld M, Lips EH, Chung M, et al. Reliability of preoperative breast biopsies showing ductal carcinoma in situ and implications for non-operative treatment: a cohort study. Breast Cancer Res Treat. nov 2019;178(2):40918.
- Marques LC, Marta GN, de Andrade JZ, Andrade D, de Barros ACSD, Andrade FEM. Is it possible to predict underestimation in ductal carcinoma in situ of the breast? Yes, using a simple score! Eur J Surg Oncol J Eur Soc Surg Oncol Br Assoc Surg Oncol. juill 2019;45(7):11525.
- Yeong J, Thike AA, Tan PH, Iqbal J. Identifying progression predictors of breast ductal carcinoma in situ. J Clin Pathol. févr 2017;70(2):1028.
- Loudig O, Mitchell MI, Ben-Dov IZ, Liu C, Fineberg S. MiRNA expression deregulation correlates with the Oncotype DX® DCIS score. Breast Cancer Res BCR. 12 sept 2022;24(1):62.
- Doebar SC, Sieuwerts AM, De Weerd V, Stoop H, Martens JWM, Van Deurzen CHM. Gene Expression Differences between Ductal Carcinoma in Situ with and without Progression to Invasive Breast Cancer. Am J Pathol. juill 2017;187(7):164855.