Historique et développement d’une immunothérapie « next generation »
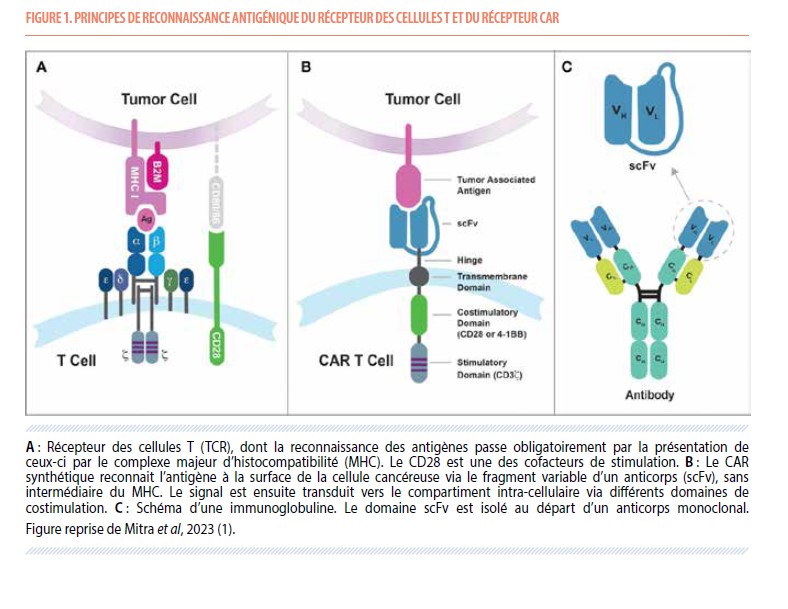
Au cours des deux dernières décennies, l’immunothérapie a transformé le paysage thérapeutique oncologique en offrant un regain d’espoir à un nombre toujours croissant de patients atteints de maladies réfractaires aux chimiothérapies conventionnelles. Le Prix Nobel de Médecine 2018 en a d’ailleurs couronné une des révolutions, connues aujourd’hui sous le nom d’inhibiteur des checkpoints immunitaires. En parallèle, et ce depuis les années 80, s’est construit un champ de recherche visant à activer et à forcer les lymphocytes T à reconnaitre un antigène donné, et tuer la cellule porteuse de celui-ci. Le concept de récepteur T chimérique, combinant les régions variables des immunoglobulines aux domaines constants du récepteur, était né (1) ; CAR T-cell signifiant « chimeric antigen receptor ». La Figure 1 illustre la construction de biologie moléculaire. La portion extracellulaire du CAR permet la reconnaissance de l’antigène ciblé, et le domaine de signalisation intra-cellulaire permet la prolifération, l’activité cytolytique et la production de cytokines du lymphocyte T.
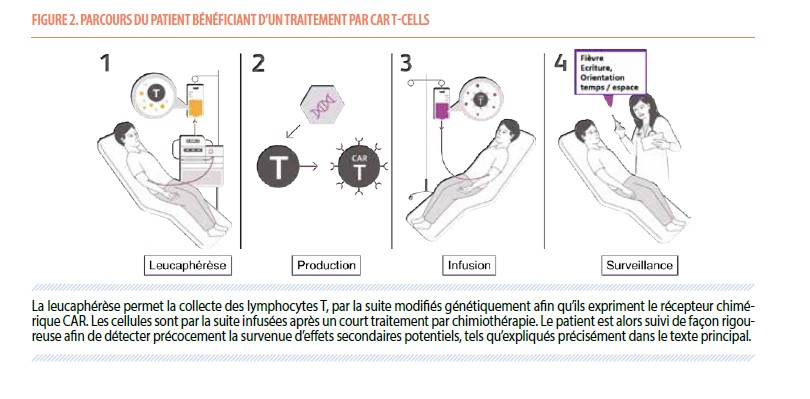
Dans la grande majorité des cas, la source de lymphocytes T est obtenue au départ du sang périphérique du patient. Ces lymphocytes sont ensuite modifiés génétiquement de telle manière à exprimer le CAR en question et réinfusés au patient après une courte chimiothérapie dite « de conditionnement lymphodéplétif ». Leur parcours est illustré dans la Figure 2. Cette méthodologie de thérapie cellulaire autologue a parmi ses avantages un risque extrêmement faible de maladie du greffon contre l’hôte (GVHD). Bien qu’évalués dans nombre de tumeurs solides et hématologiques, le succès sans précédent des CAR T-cell dirigés contre la lignée lymphoïde, en visant les marqueurs membranaires CD19 (lymphomes B et leucémies aiguës lymphoblastiques B) et BCMA (myélome multiple), est à l’origine de leur utilisation croissante et constitue le sujet du présent article.
CAR T-Cells en clinique
Les CAR T-cells sont donc des lymphocytes T modifiés génétiquement. Leur manufacture est actuellement centralisée au sein de laboratoires de référence en Europe, selon la firme pharmaceutique productrice. Certains centres académiques de référence sont en cours de développement et de production de CAR T-cells produits localement dans le cadre d’études cliniques afin de tester de nouvelles cibles thérapeutiques mais également de nouvelles indications thérapeutiques tant dans les pathologies malignes que bénignes (certaines maladies auto-immunitaires réfractaires).
La collecte de ces lymphocytes T se fait par aphérèse, dans une unité spécialisée de l’hôpital de jour hématologique. Les lymphocytes ainsi collectés sont envoyés vers le centre de production où le processus de fabrication prend environ 3 semaines. Pendant cette période d’attente, le patient doit parfois bénéficier d’un traitement complémentaire s’il est nécessaire de contrôler l’hémopathie maligne sous-jacente (comme c’est souvent le cas avec les lymphomes agressifs). Ce traitement peut consister en une radiothérapie, éventuellement associée à une thérapie ciblée ou une autre immunothérapie. L’objectif de cette étape n’est pas d’obtenir une rémission complète mais bien de contrôler suffisamment la maladie afin que la réinfusion des lymphocytes T modifiés, devenus les fameux CAR T-cells, se déroule dans les meilleures conditions cliniques possibles au prix d’une toxicité minimale. Malheureusement, le traitement par CAR T ne permet pas d’éviter toute chimiothérapie et impose une hospitalisation de 2-3 semaines sous surveillance étroite. Cette hospitalisation commence par une chimiothérapie dite lymphodéplétive visant à créer les conditions biologiques idéales pour la réactivité et l’expansion des CAR T-cells (2). Celle-ci consiste en l’association de cyclophosphamide et de fludarabine, ou, dans une moindre mesure, de bendamustine. Ce traitement est essentiellement immunosuppresseur. Il a un faible impact myéloablatif, et par conséquent l’aplasie médullaire subséquente reste généralement limitée à quelques jours.
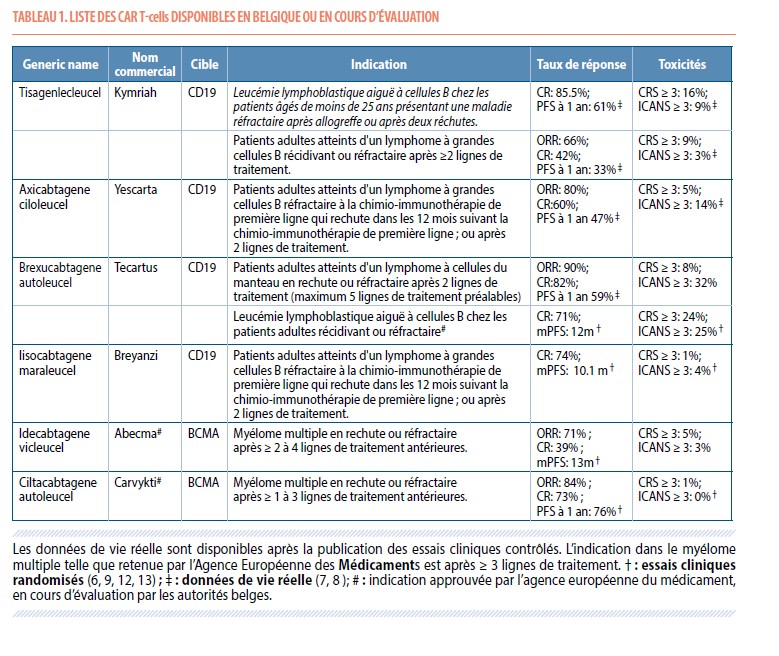
Le tableau 1 reprend les différents CAR T-cells approuvés par la FDA et l’EMA dans le cadre du traitement des hémopathies malignes, ainsi que leurs indications et taux de réponses cliniques tels que rapportés par les études pivots.
Le CAR T-cell axi-cel (Yescarta®, Gilead) est disponible depuis le 1er décembre 2023 en deuxième ligne thérapeutique dans le traitement des lymphomes B diffus agressifs (Lymphome B diffus à grande cellules, lymphome de haut grade avec ou non réarrangement C-MYC et BCL-2 et lymphome folliculaire transformé). Ceci fait suite à la publication des résultats de l’étude ZUMA-7 démontrant leur supériorité sur le traitement de seconde ligne standard, associant chimiothérapie intensive et autogreffe de cellules souches hématopoïétiques (3). Le temps médian de survie sans progression (PFS) des patients traités par axi-cel y était de 14,7 mois et de 3,7 mois dans le groupe de traitement standard, menant à un taux de survie sans lymphome à 4 ans de 42% et de 24%, respectivement. Une étude en cours, dont les résultats seront présentés au Congrès général de la Société Belge d’Hématologie, démontrent également le caractère « cost-effective » de ce traitement de haute technologie (4). Le tisa-cel, ciblant de la même manière le CD-19, (Kymriah®, Novartis) est accessible en 3e ligne pour les lymphomes B diffus à grandes cellules (5). Cette thérapie cellulaire s’applique également au patient de moins de 25 ans souffrant d’une rechute de leur leucémie lymphoblastique aiguë à cellules B après une greffe de cellules souches ou avec une seconde récidive de la maladie (6). Le profil de risque, tel que détaillé ci-dessous, est inférieur à celui du Yescarta®, mais au prix d’une efficacité moindre dans le lymphome agressif (7). Ces deux CAR T-cells furent les premiers à être approuvés par les agences américaines et européennes en 2017 et 2018, respectivement. Le brexu-cel (Tecartus®, Gilead) est un traitement validé en Belgique pour le lymphome du manteau en troisième ligne (8). Notons que le brexu-cel est également approuvé par les agences américaines et européennes dans le traitement de la leucémie lymphoblastique aiguë du sujet âgé de 26 ans ou plus (9), mais actuellement indisponible en Belgique. À ces trois thérapies cellulaires s’ajoute encore le liso-cel, autre CAR T-cell ciblant le CD-19, actuellement à l’étude pour le marché belge et d’ores et déjà approuvé par les agences de régulation dans le traitement des lymphomes non-Hodgkiniens à cellules B agressifs. Forts de leur grande efficacité associée à un profil de risque modéré, l’axi-cel et le liso-cel ont tous les deux été étudiés dans les populations de patients non-éligibles à l’intensification thérapeutique suivie d’autogreffe de cellules souches hématopoïétiques, démontrant une efficacité similaire aux études initiales (10,11). Enfin, deux CAR T-cells ciblant l’antigène B-cell maturation antigen (BCMA) sont en cours d’évaluation en Belgique dans le cadre du traitement du myélome multiple. Ceuci sont l’ide-cel (Abecma®, BMS) et le cilta-cel (Carvykti®, Janssen), dont les études pivots sont respectivement KarMMa (12) et CARTITUDE (13). L’ensemble de ces six traitements est repris dans le Tableau 1.
Un nouveau paradigme de toxicités
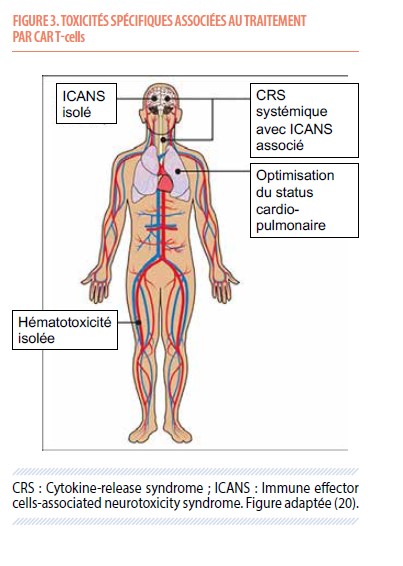
Si on vient de mettre en avant l’efficacité de cette thérapie innovante, les premières études cliniques ont révélé l’incidence élevée d’un type de toxicité rarement observé par le passé, secondaire à un état pro-inflammatoire induit par la réinfusion des CAR T-cells (résumé dans la Figure 3). C’est ainsi que lors de leur autorisation de mise sur le marché par les agences européenne et américaine des deux premiers CAR T-cells en 2017 et 2018, l’accent avait mis sur la nécessité d’implémenter des stratégies de prévention et de prise en charge de ces effets secondaires, potentiellement violents, inhérents à ce type de thérapie cellulaire. Ces toxicités sont essentiellement de trois types :
a.) Le syndrome de relargage cytokinique (« cytokine release syndrome », CRS). Celui-ci se manifeste par une sévérité variable, allant de la simple fièvre jusqu’à l’instabilité hémodynamique avec défaillance d’organe. Une collaboration étroite avec les réanimateurs est dès lors indiquée dans la prise en charge des CRS (et ICANS, vide infra) sévères. L’incidence du CRS est en diminution progressive avec l’expérience et l’expertise accumulée progressivement par les équipes spécialisées, et est actuellement d’environ 6% pour les grade III et supérieurs. Les facteurs de risque principaux de la survenue d’un CRS sévère sont le type de CAR T-cell utilisé (axi-cel et brexu-cel sont plus pourvoyeurs de CRS étant donné leur meilleure expansion in vivo), le degré d’activité de la maladie (élévation des LDH, volume tumoral actif élevé) et l’état général du patient (indice de performance, comorbidités, infection active). Il survient essentiellement entre les jours 3 et 10 après réinfusion des cellules. Au-delà d’une prise en charge supportive visant à soutenir les différentes fonctions vitales, son traitement est basé sur l’administration d’un anticorps anti-récepteur de l’interleukine-6, le tocilizumab. Son administration est indiquée sitôt que le patient souffre d’une fièvre prolongée, une chute de sa tension artérielle ou le besoin en oxygène. Cette stratégie peut être adaptée en fonction du profil de risque du patient, et de ses comorbidités.
b.) Le syndrome de neurotoxicité associé aux cellules immunes effectrices (« immune effector cell-associated neurotoxicity syndrome », ICANS). Celui-ci se traduit par des manifestations de sévérité variable (14), de la simple désorientation spatio-temporelle aux crises d’épilepsie avec état de mal et troubles de la conscience nécessitant une protection des voies aériennes. De même que pour le CRS, l’incidence de la neurotoxicité a diminué au fil des années, aujourd’hui aux alentours de 20%. En plus de l’activité tumorale initiale, la survenue d’un CRS sévère, les maladies neurologiques préexistantes et le type de CAR T-cells sont autant de facteurs de risque d’ICANS sévère. Le tocilizumab a une activité limitée dans la neurotoxicité, et est utilisé surtout en cas de CRS sévère associé. Le seul médicament ayant totalement fait ses preuves est la dexaméthasone, à dose croissante et « proportionnelle » au degré de sévérité de l’ICANS. Il existe des données, en grande partie rétrospectives, sur l’usage d’un anticorps dirigé contre le récepteur d’une cytokine pro-inflammatoire, l’interleukine-1. Celui-ci, l’anakinra, est encore en cours d’évaluation rigoureuse. La survenue de la neurotoxicité est plus tardive, classiquement entre les 7e et 14e jours, mais 10% de ces complications surviennent tardivement, jusqu’au jour 30 et même parfois après, surtout dans le cadre des traitements anti-myélome. La dysgraphie étant un signe précoce de ce type de complications, il est demandé au patient d’écrire tous les jours la même phrase, choisie à l’avance et chargée de pensées positives !
c.) Un syndrome d’activation macrophagique atypique (« hemophagocytic lymphohistiocytosis (HLH)-like ») associant fièvre, cytopénies profondes et hépatosplénomégalie (15). Son incidence est nettement plus rare que les complications sus-citées. Sa prise en charge et son contrôle est souvent plus complexe, et fait également intervenir glucocorticoïdes, tocilizumab et anakinra.
À ces effets secondaires propres à la plateforme de thérapie cellulaire que sont les CAR T-cells s’ajoutent les complications plus classiques des traitements hématologiques. En effet, bien que l’aplasie chimio-induite soit de courte durée après le conditionnement lymphodéplétif décrit ci-dessus, le patient passe par une période de neutropénie et de thrombopénie de quelques jours, rarement plus longue qu’une semaine. Il est néanmoins vulnérable aux infections durant cette période du fait du traitement qu’il vient de recevoir mais également de par les expositions aux précédentes lignes de traitement. Sans oublier que certains candidats arrivent au traitement par CAR-T dans un état hautement réfractaire qui peut rapidement progresser après l’infusion. Pour toutes ces raisons, la mise au point diagnostique des événements enregistrés après infusion de CAR-T requiert une grande rigueur clinique afin de ne pas méconnaître une complication associée, comme un ICANS sévère associé à une encéphalite infectieuse sous-jacente ou un CRS réfractaire associé à une infection fongique invasive.
Vu la nécessité d’une surveillance étroite, on comprend mieux pourquoi l’hospitalisation classique d’un patient pour prise en charge par CAR T-cells est d’environ 3 semaines. Il existe certains protocoles d’étude évaluant un traitement plus précoce de ces effets secondaires dans les sous-groupes à risque, voire une véritable prophylaxie de ceux-ci. L’expérience future nous permettra certainement de mieux définir les différents sous-groupes de patients ; ceux nécessitant une approche prophylactique agressive, et ceux, au contraire, au profil de risque faible permettant un suivi rapproché en ambulatoire, tout en profitant du confort du domicile ! Notons enfin que ces effets secondaires sont hautement contrôlables et font de ce traitement une thérapie dont le risque reste finalement limité. Ceci permet aux hématologues traitants de proposer ce type de prise en charge à des patients qui n’auraient pas été éligibles à des traitements de plus grande intensité, comme une autogreffe de cellules souches hématopoïétiques. Deux essais cliniques ont démontré, dans ce groupe de patients plus fragiles, que les résultats sont similaires à ceux obtenus chez les patients plus jeunes, avec une tolérance excellente.
Suivi à moyen et long terme
Après la prise en charge aiguë intra-hospitalière, le suivi clinique est classiquement réalisé de façon hebdomadaire ou bimensuelle dans un premier temps. Après les effets secondaires décrits plus haut, les cytopénies (l’hématotoxicité) constituent la toxicité principale et peuvent durer plusieurs semaines, voire plusieurs mois (16, 17). Dans ce cas, certains patients développent un risque infectieux non-négligeable (18). La mise au point hématologique comprend alors un examen médullaire et la recherche d’infections opportunistes virales (CMV et EBV). L’usage transitoire de facteurs de croissance est classique, et la grande majorité des patients finit par récupérer une numération sanguine normale, ou à tout le moins sans risque clinique associé.
Sur le plan immunitaire, l’aplasie des cellules B après traitement par CAR T-cells anti-CD19 (dans le cadre des lymphomes et leucémies aiguës lymphoblastiques B) est souvent prolongée (19). Cette caractéristique est par ailleurs associée à un pronostic favorable en termes de contrôle à long terme de la maladie, et la perte de celle-ci est un signe potentiel, précoce, d’une éventuelle rechute. Néanmoins, ceci plonge le patient dans un état d’immunodépression prolongée avec une réponse faible aux vaccins dans les mois suivants le traitement. L’hypogammaglobulinémie est souvent profonde et persistante, et il convient en général de la supplémenter par infusion mensuelle d’immunoglobulines. Cette aplasie B est accompagnée d’une période d’altération globale de l’immunité, typiquement les 3 premiers mois, indiquant également une prophylaxie anti-virale et anti-pneumocystis jirovecii.
En ce qui concerne la vaccination, il semblerait que les vaccinations réalisées préalablement au traitement par CAR T-cells maintiennent une immunité satisfaisante (18), contrairement aux autres thérapies cellulaires que sont l’auto- et l’allogreffe de cellules souches hématopoïétiques. Les vaccinations anti-pneumococcique, influenza et SARS-Cov-2 sont dès lors fortement recommandées avant le traitement. Cette attitude n’est pas toujours applicable car avant le traitement par CAR-T, le patient est souvent sous d’autres traitements qui empêchent également une bonne réponse vaccinale comme le rituximab ou autre anticorps anti-CD20. Après le traitement par CAR-T, les patients en rémission et ne nécessitant pas de traitement complémentaire peuvent recevoir des vaccins morts/inactivés après 6 mois et des vaccins vivants 12 mois après.
Conclusion – Take home messages
Les CAR T-cells constituent une nouvelle plateforme de thérapie cellulaire à l’origine d’une révolution thérapeutique pour des patients auparavant atteints de maladies incurables. Ceux-ci sont des lymphocytes T modifiés génétiquement pour exprimer un récepteur T spécifique d’une cible antigénique précise. Les CAR T-cells actuellement disponibles en Belgique et utilisés en routine clinique sont dirigés contre le CD19, marqueur membranaire des lymphocytes B. Deux nouveaux CAR T-cells seront disponibles dans un futur proche, ciblant le marqueur membranaire BCMA des plasmocytes et permettant une nouvelle avancée thérapeutique dans le myélome multiple. Cette thérapie cellulaire est associée à un nouveau type de toxicité, dont l’origine est la réaction inflammatoire secondaire à l’interaction entre cette immunothérapie et les cellules cancéreuses. Ces effets secondaires sont néanmoins hautement contrôlables pour autant qu’ils soient pris en charge par des équipes d’hématologues expérimentés et font de ce traitement une thérapie bien supportée par le patient.
Affiliation
1. Département d'Hématologie adulte, Cliniques universitaires Saint-Luc, B-1200 Bruxelles, Belgique
Correspondance
Dr Guillaume Dachy, MD, PhD
Cliniques universitaires Saint-Luc
Service d’Hématologie
Avenue Hippocrate 10
B-1200 Bruxelles
Références
- Mitra A, Barua A, Huang L, Ganguly S, Feng Q, He B. From bench to bedside: the history and progress of CAR T cell therapy. Front Immunol. 2023; 14: 1188049. e-pub ahead of print 20230515; doi: 10.3389/fimmu.2023.1188049
- Neelapu SS. CAR-T efficacy: is conditioning the key? Blood. 2019; 133(17): 1799-1800. doi: 10.1182/blood-2019-03-900928
- Westin JR, To C, Locke FL. Axicabtagene Ciloleucel in Large B-Cell Lymphoma. Reply. N Engl J Med 2023; 389(12): 1152-1153. doi: 10.1056/NEJMc2309399
- Dachy G RM, Jacobs B, Libert C. The cost-effectiveness of Axicabtagene Ciloleucel versus standard of care as second line therapy in patients with large-cell B cell lymphoma (LBCL) in Belgium In: BHS General annual meeting. Belgium, 2023.
- Maziarz RT, Gauthier J. Clash of the titans: axi-cel versus tisa-cel for advanced-stage DLBCL. Nat Rev Clin Oncol. 2023; 20(1): 5-6. doi: 10.1038/s41571-022-00711-4
- Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H et al. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018; 378(5): 439-448. doi: 10.1056/NEJMoa1709866
- Bachy E, Le Gouill S, Di Blasi R, Sesques P, Manson G, Cartron G et al. A real-world comparison of tisagenlecleucel and axicabtagene ciloleucel CAR T cells in relapsed or refractory diffuse large B cell lymphoma. Nat Med. 2022; 28(10): 2145-2154. e-pub ahead of print 20220922; doi: 10.1038/s41591-022-01969-y
- Wang Y, Jain P, Locke FL, Maurer MJ, Frank MJ, Munoz JL et al. Brexucabtagene Autoleucel for Relapsed or Refractory Mantle Cell Lymphoma in Standard-of-Care Practice: Results From the US Lymphoma CAR T Consortium. J Clin Oncol. 2023; 41(14): 2594-2606. e-pub ahead of print 20230208; doi: 10.1200/JCO.22.01797
- Shah BD, Ghobadi A, Oluwole OO, Logan AC, Boissel N, Cassaday RD et al. Two-year follow-up of KTE-X19 in patients with relapsed or refractory adult B-cell acute lymphoblastic leukemia in ZUMA-3 and its contextualization with SCHOLAR-3, an external historical control study. J Hematol Oncol. 2022; 15(1): 170. e-pub ahead of print 20221210; doi: 10.1186/s13045-022-01379-0
- Houot R, Bachy E, Cartron G, Gros FX, Morschhauser F, Oberic L et al. Axicabtagene ciloleucel as second-line therapy in large B cell lymphoma ineligible for autologous stem cell transplantation: a phase 2 trial. Nat Med. 2023; 29(10): 2593-2601. e-pub ahead of print 20230914; doi: 10.1038/s41591-023-02572-5
- Sehgal A, Hoda D, Riedell PA, Ghosh N, Hamadani M, Hildebrandt GC et al. Lisocabtagene maraleucel as second-line therapy in adults with relapsed or refractory large B-cell lymphoma who were not intended for haematopoietic stem cell transplantation (PILOT): an open-label, phase 2 study. Lancet Oncol. 2022; 23(8): 1066-1077. e-pub ahead of print 20220712; doi: 10.1016/S1470-2045(22)00339-4
- Rodriguez-Otero P, Ailawadhi S, Arnulf B, Patel K, Cavo M, Nooka AK et al. Ide-cel or Standard Regimens in Relapsed and Refractory Multiple Myeloma. N Engl J Med. 2023; 388(11): 1002-1014. e-pub ahead of print 20230210; doi: 10.1056/NEJMoa2213614
- San-Miguel J, Dhakal B, Yong K, Spencer A, Anguille S, Mateos MV et al. Cilta-cel or Standard Care in Lenalidomide-Refractory Multiple Myeloma. N Engl J Med. 2023; 389(4): 335-347. e-pub ahead of print 20230605; doi: 10.1056/NEJMoa2303379
- Santomasso BD, Gust J, Perna F. How I treat unique and difficult-to-manage cases of CAR T-cell therapy-associated neurotoxicity. Blood. 2023; 141(20): 2443-2451. doi: 10.1182/blood.2022017604
- Lichtenstein DA, Schischlik F, Shao L, Steinberg SM, Yates B, Wang HW et al. Characterization of HLH-like manifestations as a CRS variant in patients receiving CD22 CAR T cells. Blood. 2021; 138(24): 2469-2484. doi: 10.1182/blood.2021011898
- Rejeski K, Wang Y, Albanyan O, Munoz J, Sesques P, Iacoboni G et al. The CAR-HEMATOTOX score identifies patients at high risk for hematological toxicity, infectious complications, and poor treatment outcomes following brexucabtagene autoleucel for relapsed or refractory MCL. Am J Hematol. 2023; 98(11): 1699-1710. e-pub ahead of print 20230816; doi: 10.1002/ajh.27056
- Rejeski K, Subklewe M, Aljurf M, Bachy E, Balduzzi A, Barba P et al. Immune effector cell-associated hematotoxicity: EHA/EBMT consensus grading and best practice recommendations. Blood. 2023; 142(10): 865-877. doi: 10.1182/blood.2023020578
- Hill JA, Seo SK. How I prevent infections in patients receiving CD19-targeted chimeric antigen receptor T cells for B-cell malignancies. Blood. 2020; 136(8): 925-935. doi: 10.1182/blood.2019004000
- Yakoub-Agha I, Chabannon C, Bader P, Basak GW, Bonig H, Ciceri F et al. Management of adults and children undergoing chimeric antigen receptor T-cell therapy: best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the Joint Accreditation Committee of ISCT and EBMT (JACIE). Haematologica. 2020; 105(2): 297-316. e-pub ahead of print 20200131; doi: 10.3324/haematol.2019.229781
- Heslop HE. Introduction to a How I Treat series on emergent CAR T-cell toxicities. Blood. 2023; 141(20): 2405-2407. doi: 10.1182/blood.2023020228