Chaque jour en Belgique, 52 personnes en moyenne présentent un accident vasculaire cérébral (AVC). L’AVC est la première cause de handicap acquis, la 2e cause de démence (après la maladie d’Alzheimer) et la 3e cause de mortalité de l’adulte. Il cause hémiplégie, troubles de la marche et aphasie, et se complique régulièrement d’épilepsie, de troubles cognitifs ou de dépression.
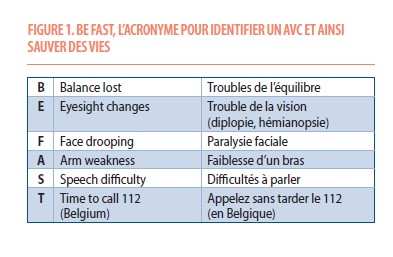
L’accident vasculaire cérébral se présente par un ou plusieurs signes neurologiques focaux d’installation rapide. Les symptômes dépendent de la zone touchée. L’acronyme « BE FAST » (= « soyez rapides ») permet de retenir les signes et symptômes devant faire évoquer un AVC. On attire ainsi l’attention non seulement sur l’asymétrie faciale, la perte de force ou le trouble du langage, mais aussi sur les troubles de l’équilibre ou de la vue (Figure 1). Une altération brutale de la conscience peut également résulter d’un AVC, alors généralement associée à un de ces signes neurologiques.
Ces signes focaux peuvent aussi bien être causés par une hémorragie cérébrale (10-15% des AVC, environ) que par l’occlusion d’un vaisseau (AVC ischémique (AVCi) ou thrombose cérébrale). Seule une imagerie cérébrale (scanner ou imagerie par résonance magnétique (IRM)) permet de faire la différence et il est inutile, voire dangereux, d’administrer un traitement (que ce soit un thrombolytique, un antihypertenseur ou un anticoagulant) avant l’admission dans un centre spécialisé.
Le reste de cet article est consacré aux AVCi, car ils sont plus fréquents et les avancées médicales diagnostiques et thérapeutiques y ont été plus nombreuses ces dernières années. Ces avancées permettent d’identifier un plus grand nombre de patients pouvant bénéficier d’un traitement aigu par thrombolyse intraveineuse (en anglais, « intravenous thrombolysis », TIV) ou par traitement endovasculaire (en anglais, « endovascular treatment », TEV), et ainsi réduire totalement ou partiellement leur handicap et le risque de récidive.
Lorsque les signes disparaissent spontanément en moins de 24h (le plus souvent, en moins d’une heure), et qu’aucune lésion ischémique récente n’est visualisée à l’IRM (séquences de diffusion, DWI), on parle d’un accident ischémique transitoire (AIT) (1). L’AIT, faussement rassurant car réversible, reste une urgence thérapeutique, car le risque de récidive peut-être très élevé. Ce risque dépend de la nature et de la durée de l’épisode ainsi que des facteurs de risque cardio-cérébro-vasculaire du patient : le score le plus utilisé pour quantifier le risque de récidive est le score ABCD² (Figure 2) (2). Un score ABCD2 supérieur à 4 étant associé à un risque de récidive précoce (>6% endéans la semaine), une hospitalisation et un traitement de prévention secondaire à base d’une bithérapie (clopidogrel et aspirine), ou trithérapie (associant la bithérapie à une statine hautement dosée) sont recommandés, car ils permettent de diminuer ce risque de récidive (3). Toutefois, comme démontré dans des études plus anciennes, MATCH et CHARISMA, et confirmé dans les études plus récentes CHANCE et POINT, le risque de saignement augmente avec la bithérapie et cette dernière doit donc être limitée dans le temps (3 semaines, le plus souvent) (1). En outre, le bilan réalisé pour l’AIT permet parfois de mettre en évidence une cause nécessitant un traitement spécifique, comme une fibrillation auriculaire (FA) (traitement par anticoagulant), une sténose carotidienne ou une plaque d’athérome sténosante ou instable (endartériectomie chirurgicale urgente).

Face à un patient présentant un AVCi, la décision thérapeutique va se baser sur trois informations :
- Le temps écoulé depuis l’apparition des symptômes. Par convention, l’heure retenue correspond au dernier moment où le patient a été vu dans son état habituel (« Dernière preuve de bonne santé » ou en anglais « Last seen well »). Ce moment peut donc différer de l’heure à laquelle les symptômes ont réellement débuté (AVC survenant pendant la nuit, ou de jour, mais sans témoin).
- La sévérité du déficit neurologique, évalué selon le « National Institute of Health Stroke Scale» (NIHSS). Le score obtenu varie entre 0 et 42. Plus le score est élevé, plus l’atteinte neurologique est importante. De façon générale, on distingue les AVC mineurs (NIHSS < 5), les AVC sévères (NIHSS > 10) et, entre ces extrêmes, les AVC modérés. Toutefois, l’impact fonctionnel du déficit est également pris en compte pour déterminer la sévérité de l’atteinte (cas d’un musicien professionnel développant une maladresse isolée d’une main, par exemple) (4). Le degré d’autonomie préalable du patient, son éventuel traitement habituel, la présence de comorbidités ou intervention chirurgicale récente sont des informations nécessaires à la prise en charge du patient et restent importantes à communiquer au neurologue.
- L’imagerie cérébrale par scanner (CT) ou imagerie par résonance magnétique (IRM). Le choix de l’examen va dépendre de sa disponibilité, des contre-indications (présence d’un ancien pacemaker non compatible avec l’IRM, allergie au produit du contraste), du temps écoulé depuis l’apparition des symptômes et de la possibilité d’être face à un « stroke mimic ». Une migraine accompagnée, une crise d’épilepsie avec déficit résiduel ou un trouble de conversion peuvent mimer un AVC, et sont donc des « stroke mimics » : l’imagerie par IRM ne mettra pas en évidence d’ischémie
La rapidité à laquelle le traitement est administré est primordiale (« time is brain »). Une imagerie cérébrale doit donc être réalisée le plus rapidement possible :
- Scanner sans contraste (NCCT). En raison de sa grande disponibilité, de sa rapidité d’exécution et de sa haute sensibilité pour détecter une hémorragie, cette modalité est généralement préférée à l’IRM. Pour les patients présentant un tableau clinique net d’AVC modéré ou sévère datant de moins de 4,5h, le NCCT ayant exclu un saignement (contre-indication formelle à une TIV), ou une lésion tumorale intra-axiale (à haut risque de saignement en cas de TIV), une TIV sera administrée. La décision thérapeutique est donc prise sur base de la clinique et en l’absence de contre-indications cliniques ou radiologiques.
- AngioCT cérébral (CTA) : visualisation de l’arbre vasculaire extra- et intra-crânien à l’aide d’un agent de contraste iodé, et mise en évidence d’un éventuel thrombus artériel accessible pour un TEV.
- Scanner cérébral de perfusion (CTP) : étude du flux de produit de contraste, permettant de déterminer les zones du tissu cérébral qui connaissent des dommages irréversibles (zone infarcie, « core ») ou réversibles (zone d’hypoperfusion, pénombre). On utilise cette technique lorsque le délai est inconnu (AVC au réveil ou pas de personne présente pour noter le début des symptômes).
- IRM cérébrale : technique particulièrement utile pour identifier les lésions de la fosse postérieure, moins bien visualisées au scanner. En outre, en comparant les volumes cérébraux de signal anormal en séquence DWI (qui correspond globalement à l’AVC constitué) aux volumes visualisés en séquence fluid-attenuated inversion recovery (FLAIR), il est possible d’estimer si un patient peut bénéficier d’une TIV et/ou d’un TEV, même si le délai de l’AVC est inconnu, comme lorsqu’il est mis en évidence au réveil (5). Ces séquences sont surtout utilisées en cas de doute diagnostic (vertiges et autres « stroke mimic ») ou en cas de contre-indication à l’utilisation de rayons X ou de produit de contraste iodé. La séquence Time-of-flight (TOF), permet une reconstruction du réseau vasculaire sans nécessiter l’injection de produit de contraste et ouvre la perspective d’une TIV en cas de thrombus. Notons qu’il existe aussi des séquences de perfusion en IRM, dont l’utilité est similaire au CTP.
Le traitement par TIV et/ou par TEV a amélioré de façon importante la prise en charge des AVC ischémiques à leur phase aiguë.
- Thrombolyse IV : la TIV permet une réduction du taux de handicap chez les patients atteints d’un AVCi, si l’on agit rapidement. La TIV a montré des bénéfices chez les patients présentant un déficit fonctionnellement important. La TIV n’est généralement pas retenue pour des scores NIHSS < 4, sans répercussion fonctionnelle, car la double anti-agrégation semble aussi efficace, avec moins de complications hémorragiques (6,7). Elle est contre-indiquée chez les patients ayant un risque de saignement important dans une zone non compressive (période post-opératoire d’une chirurgie profonde), ou lorsque l’imagerie cérébrale met en évidence une large zone déjà infarcie (risque accru de « transformation hémorragique » de l’AVCi déjà constitué).
En 2019, la fenêtre thérapeutique d’administration de la thrombolyse a été étendue de 4,5h à 9h, sous certaines conditions iconographiques (8) : si l’imagerie de perfusion réalisée démontre la présence d’une viabilité parenchymateuse significative (volume zone infarcie < 70mL, ratio entre la zone de pénombre et la zone infarcie > 1,2 ; et volume absolu de ce mismatch > 10mL), on note un bénéfice à traiter les patients par TIV. La European Stroke Organisation retient ces critères pour une TIV « tardive » et l’étend actuellement aux AVC du réveil si la TIV est réalisée moins de 9h après le milieu de la période de sommeil (9) (Figure 3). Des études plus larges permettront peut-être de valider la TIV au réveil, uniquement sur base du mismatch de CT de perfusion.
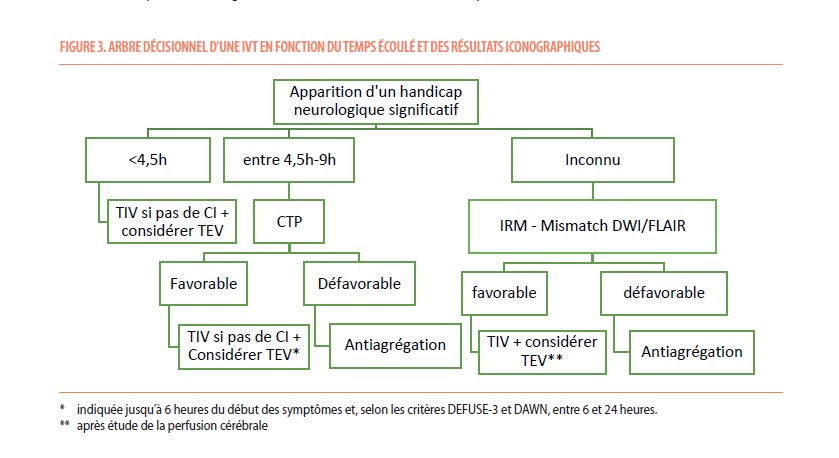
La prise d’un traitement anticoagulant par le patient devra faire l’objet d’investigations complémentaires s’il a été administré dans les 48 précédentes heures. Dans le cas du Dabigatran il est envisageable de réaliser une TIV après neutralisation par l’idarucizumab (9). Pour les autres anticoagulants directs (DOCAC), la neutralisation par andexanet alfa avant TIV n’est pas recommandée. Si la dernière prise du traitement remonte à moins de 48h, il est recommandé de mesurer le taux circulant des DOAC.Une TIV pourrait être administrée si ce dosage est faible. De façon surprenante, plusieurs publications récentes ont rapporté un effet bénéfique de la TIV sans risque de saignement accru chez des patients sous DOAC, indépendamment du taux résiduel de DOAC (10). Cette information, si elle se confirme, pourrait mener à une actualisation des recommandations. Dans le cas des antivitamines K (AVK), un INR >1,6 contre-indique la TIV. Une série de TIV réalisées après neutralisation de l’AVK demande à être reproduite avant de pouvoir être recommandée (11).
Toutefois, face à un AVC important chez un patient sous anticoagulant, le premier choix sera sans doute de considérer un TEV sans TIV.
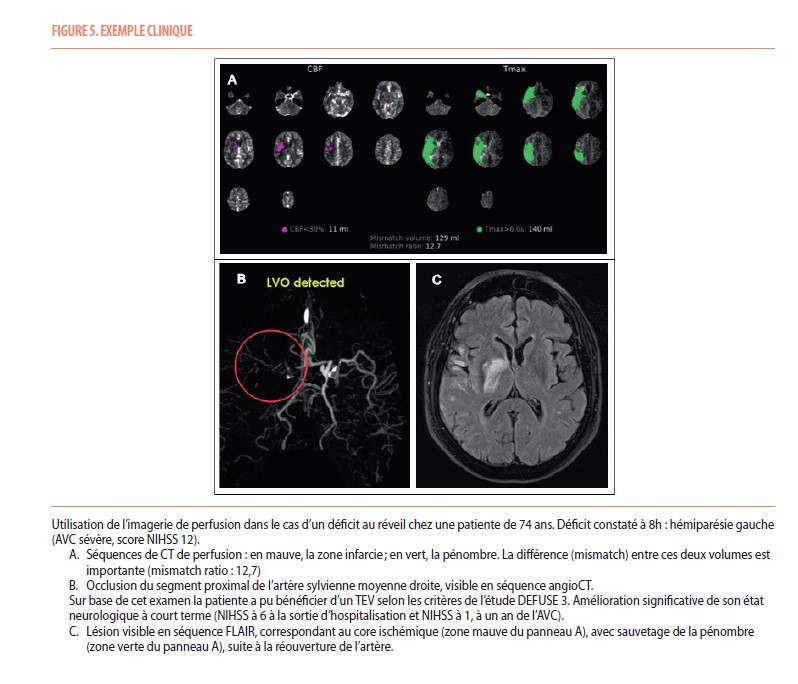
- Traitement endovasculaire (TEV) : le TEV consiste à introduire un cathéter intra artériel, depuis la périphérie (le plus souvent l’artère fémorale) jusqu’au niveau intracrânien, afin d’enlever le thrombus par aspiration ou à l’aide d’un stent. Ce traitement peut être réalisé en association avec la TIV, ou de manière isolée chez les patients n’étant pas éligibles à ce premier traitement. Tout comme la TIV le bénéfice attendu est dépendant du temps entre la recanalisation et le début des symptômes. L’efficacité de ce traitement est maximale si la recanalisation est effectuée dans les premières 6h du début des symptômes et si l’occlusion est proximale (nombre de patients à traiter pour diminuer voir un patient dont le score de handicap mRS diminue de 1 point = 2,6) (12). Des études sont en cours pour déterminer si le TEV apporte un bénéfice supplémentaire dans des occlusions plus distales. En outre, le TEV peut être efficace jusque 24h après le début des symptômes chez des patients bien sélectionnés par une imagerie de perfusion (Figure 4 et 5) (13,14). Le TEV reste un geste invasif nécessitant parfois une anesthésie générale afin de garantir l’immobilité du patient. Les comorbidités et l’anatomie des vaisseaux du patient peuvent parfois rendre cette procédure délicate.
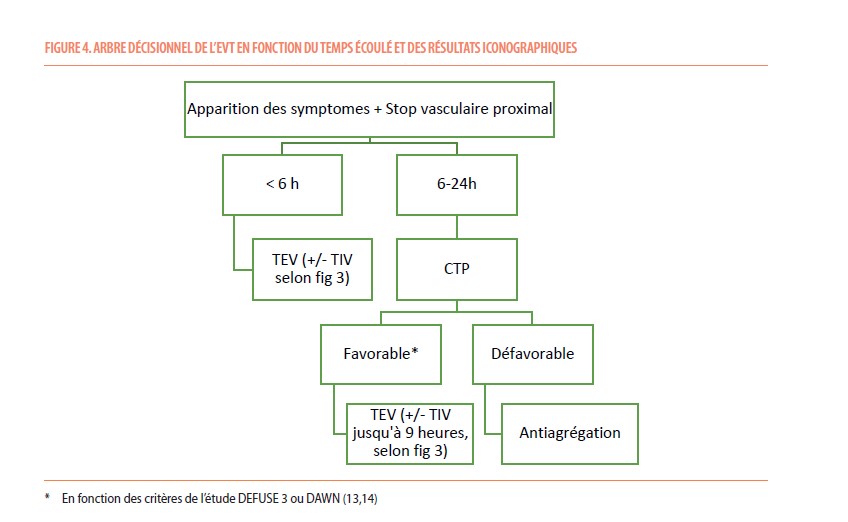
En hospitalisation, le recours à une unité de surveillance cérébrovasculaire (« stroke unit ») a fait ses preuves, tant pour le suivi clinique (troubles de la déglutition ou de la parole), que pour le traitement aigu (surveillance de la pression artérielle, de la température, de la glycémie), ou encore la coordination des examens et la prise en charge paraclinique, jusqu’à la revalidation éventuelle (7). La Belgique prévoit l’attribution d’un label S1 pour des centres de soins disposant d’un tel programme de prise en charge. Ces centres S1 doivent être capables d’administrer rapidement la TIV et travaillent en collaboration avec des centres S2, qui disposent en sus d’une expertise en TEV. Le patient est donc transféré du centre S1, dont sa proximité géographique en fait un endroit stratégique pour la réalisation rapide du bilan diagnostic et d’une éventuelle TIV, vers un centre S2, si l’indication d’un TEV est retenue.
Afin d’éviter la récidive d’un phénomène vasculo-ischémique, il est recommandé de réaliser un contrôle strict des facteurs de risque cardiovasculaire (hypertension artérielle, dyslipidémie, diabète, consommation de tabac ou d’alcool, …) ainsi que de réaliser un bilan étiologique fouillé.
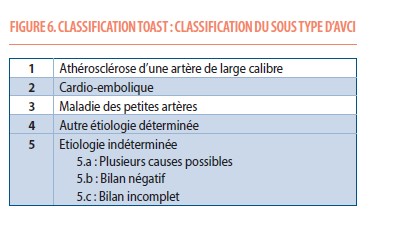
Identifier la cause de l’AVC permet de proposer le traitement le plus à même de diminuer le risque de récidive (15). Après un bilan classique (biologie complète, ECG, imagerie des vaisseaux du cou par CTA ou MRA, échographie Doppler extra- et trans-crânienne, échographie cardiaque trans-thoracique, ECG Holter d’au moins 24h), on peut identifier la cause dans environ 75% des cas, selon la classification TOAST (Figure 6). Ce chiffre est plus bas pour les patients âgés de moins de 50 ans. Lorsque la cause ne peut être identifiée, on parle d’AVC cryptogéniques. Des progrès ont été faits pour trouver (chez environ 20% d’entre eux) une FA paroxystique (grâce à des dispositifs implantables, « loop recorder »), justifiant l’introduction d’un traitement anticoagulant. Chez les patients souffrant d’une FA non valvulaire, les DOACs présentent un meilleur profil que les antivitamines K. Dans certains cas (antécédent d’hémorragie), on préférera la fermeture de l’appendice auriculaire, conférant la même protection contre l’AVC d’origine cardio-embolique que l’utilisation d’un traitement anticoagulant. La présence d’un foramen ovale perméable dont la fermeture est parfois conseillée après un exhaustif bilan complémentaire prouvant que la cause de l’AVC est bien une embolie « paradoxale » et discussion multidisciplinaire avec les collègues cardiologues.
Conclusion
Face à un patient présentant des symptômes neurologiques déficitaires, faisant évoquer un AVCi depuis moins de 24h, une prise en charge la plus rapide possible est recommandée, dont un point fondamental est la réalisation d’une imagerie cérébrale en urgence.
Selon le délai d’apparition des symptômes, et en l’absence de contre-indication, une TIV pourra être administrée. En cas d’occlusion d’une large artère cérébrale, visualisée sur les séquences angiographiques, le TEV pourra également être proposé.
Sous conditions d’une analyse de la perfusion cérébrale (CTP) favorable, l’TIV pourrait être administrée si les symptômes sont apparus dans les 4,5h à 9h et/ou l’TEV pourrait être réalisé jusqu’à 24h de délai.
Lorsque le timing d’apparition est incertain, il est possible de réaliser une IRM cérébrale, (séquences de diffusion et FLAIR), ce qui permet de sélectionner les patients candidats à une TIV/ un TEV. Cette dernière méthode a une sensibilité supérieure au scanner pour détecter les stroke « mimics » et est recommandée lorsqu’il faut éviter les radiations ionisantes (enfants, femmes enceintes).
Il reste important de souligner que le délai de réalisation des différentes procédures par rapport au début des symptômes influence nettement le pronostic du patient.
Recommandations pratiques
L’objectif de la prise en charge thérapeutique en phase aiguë d’un AVCi, est de diminuer le handicap, et donc l’état de dépendance du patient, à moyen et long terme, à travers une reperfusion cérébrale rapide. La rapidité de la prise en charge a montré un impact important sur ces paramètres. Bien que chaque minute compte pour espérer maintenir le niveau d’autonomie du patient à son maximum, un geste thérapeutique peut parfois être proposé jusqu’à 24h du début des symptômes, et ce grâce à de nouveaux outils iconographiques.
Références
- Amin HP, Madsen TE, Bravata DM, Wira CR, Johnston SC, Ashcraft S et al. Diagnosis, Workup, Risk Reduction of Transient Ischemic Attack in the Emergency Department Setting: A scientific Statement From the American Heart Association. Stroke. 2023; 54:e109-e121.
- Johnston SC, Rothwell PM, Nguyen-Huynh MN, Giles MF, Elkins JS, Bernstein AL, et al. Validation and refinement of scores to predict very early stroke risk after transient ischaemic attack. Lancet. 2007; 369:283-92.
- Tse D, Hill MD, Coutts SB. Early Secondary Prevention in Transient Ischemic Attack (TIA) and Minor Stroke. Current Neurology and Neuroscience Reports. 2019; 19:34-40.
- Schwartz JK, Capo-Lugo CE, Akinwuntan AE, Roberts P, Krishnan S, Belagaje SR, et al. Classification of Mild Stroke: A Mapping Review. PM R. 2019; 11:996-1003.
- Thomalla G, Simonsen CZ, Boutitie F, Andersen G, Berthezene Y, Cheng B, et al. MRI-Guided Thrombolysis for Stroke with Unknown Time of Onset. N Engl J Med. 2018; 379:611-622.
- Chen HS, Cui Y, Zhou ZH, Zhang H, Wang LX, Wang WZ, et al. Dual Antiplatelet Therapy vs Alteplase for Patients With Minor Nondisabling Acute Ischemic Stroke: The ARAMIS Randomized Clinical Trial. JAMA. 2023 Jun 27;329(24):2135-2144.
- Powers WJ. Acute ischemic stroke. N Engl J Med. 2020; 383:252-60.
- Campbell BC, Ma H, Ringleb PA, Parsons MW, Churilov L, Bendszus M, et al. Extending thrombolysis to 4·5–9 h and wake-up stroke using perfusion imaging: a systematic review and meta-analysis of individual patient data. Lancet. 2019; 394: 139–47.
- Berge E, Whiteley W, Audebert H, De Marchis GM, Fonseca AC, Padiglioni C, et al. European Stroke Organisation (ESO) guidelines on intravenous thrombolysis for acute ischaemic stroke. European Stroke Journal. 2021; 6: I–LXII.
- Meinel TR, Wilson D, Gensicke H, Scheitz JF, Ringleb P, Goganau I, et al. Intravenous thrombolysis in patients with ischemic stroke and recent ingestion of direct oral anticoagulants. JAMA. 2023; 80:233-243.
- Chausson N, Soumah D, Aghasaryan M, Altarcha T, Alecu C, Smadja D. Reversal of vitamin K antagonist therapy before thrombolysis for actute ischemic stroke. Stroke. 2018; 49: 01-03.
- Goyal M, Menon BK, van Zwam WH, Dippel DW, Mitchell PJ, Demchuk AM, et al. Endovascular thrombectomy after large-vessel ischaemic stroke: a meta-analysis of individual patient data from five randomized trials, Lancet. 2016; 387: 1723-31.
- Albers GW, Marks MP, Kemp S, Christensen S, Tsai JP, Ortega-Gutierrez S, et al. Thrombectomy for Stroke at 6 to 16 Hours with Selection by Perfusion Imaging. New Engl J Med. 2018; 378:708-18.
- Nogueira RG, Jadhav AP, Haussen DC, Bonafe A, Budzik FR, Yavagal DR, et al. Thrombectomy 6 to 24Hours after Stroke with a mismatch between Deficit and Infarct, New Engl J Med. 2018; 379 :11-21.
- Kleindorfer DO, Towfighi A, Chaturvedi S, Cockroft KM, Gutierrez J, Lombardi-Hill D, et al. Guideline for the Prevention of Stroke in Patients With Stroke and Transient Ischemic Attack. A Guideline From the American Heart Association/American Stroke Association. Stroke. 2021; 52:364-467.
Conflit d’intérêts
Les auteurs ne déclarent aucun conflit d’intérêt.
Affiliations
1. CHU UCL Namur - Sainte Elisabeth, Neurologie, B-5000 Namur
2. Clinique Saint Pierre Ottignies, Neurologie-Neurochirurgie, B-1340 Ottignies
Correspondance
Dre Julie Wénin
CHU UCL Namur - Ste Elisabeth
Pl Louise Godin 15
B-5000 Namur
julie.wenin@chuuclnamur.uclouvain.be