Cas clinique
Il s’agit d’une patiente de 77 ans s’étant présentée au service d’urgences pour gonalgie droite en majoration progressive depuis une dizaine de jours avec impotence fonctionnelle à la marche sans notion de traumatisme ou de fièvre.
L’examen clinique d’admission se caractérisait principalement par une tuméfaction d’allure inflammatoire du genou droit. Le diagnostic initial de tendinite retenu en salle d’urgences a rapidement été réfuté dans le service de Gériatrie et la ponction articulaire réalisée le lendemain de l’admission a confirmé la suspicion d’arthrite septique. Après réalisation de deux paires d’hémocultures, une antibiothérapie empirique par amoxicilline + acide clavulanique a été débutée de même qu’un traitement par paracétamol oral et oxycodone en raison des gonalgies importantes. Trois jours après l’admission, étant donné la persistance de la fièvre et la majoration du syndrome inflammatoire biologique, l’antibiothérapie a été élargie vers la piperacilline + tazobactam. Dès la mise en évidence d’un Staphylococcus Lugdunensis sensible à l’oxacilline dans le liquide de ponction articulaire, un relais vers une antibiothérapie ciblée par flucloxacilline à raison de 12gr par jour répartie en 6 prises a été débuté. La patiente a également bénéficié d’un lavage articulaire qui sera répété au cours de l’hospitalisation.
Après une évolution clinique et biologique initialement favorable, la patiente a progressivement développé une hypokaliémie persistante malgré supplémentation IV et orale ainsi qu’une insuffisance rénale AKIN 1. Elle a également présenté un syndrome confusionnel correspondant à un délirium hypoactif motivant un relais de la flucloxacilline par la céfazoline et un arrêt de l’oxycodone étant donné l’origine iatrogène probable. Dix-huit jours après l’admission, une acidose métabolique à 7.12 de pH (normes : 7.15-7.25) à trou anionique corrigé par l’albuminémie augmenté à 25 (nomes : 16-17mmol) et un excès de base mesuré à -23.8 mmol/l (normes : -3.0 à -2.0 mmol/l) a été mis en évidence devant un tableau de polypnée et de cyanose des extrémités. La décision a été prise de transférer la patiente dans le service de Soins Intensifs pour poursuite de la prise en charge.
En unité de Soins Intensifs, le diagnostic d’acidose pyroglutamique a rapidement été évoqué après discussion avec le néphrologue étant donné le trou anionique augmenté, le traitement récent par flucloxacilline et paracétamol ainsi que l’état de dénutrition avéré de la patiente. Par ailleurs, les autres causes principales d’acidose métabolique à trou anionique augmenté résumées par le moyen mnémotechnique GOLD MARK (Glycols, Oxoproline, L-lactate, D-lactate, Methanol, Aspirin, Renal insuffisiency, Ketoacidosis) avaient été écartées. Le paracétamol a donc été stoppé et un traitement par infusion intra-veineuse continue de N-acetyl-cystéine a été débuté. Sous ce traitement, la fonction rénale s’est progressivement améliorée et le pH sanguin normalisé.
Lors de son retour en unité de Gériatrie aiguë, la patiente a bénéficié d’une prise en charge pluridisciplinaire en parallèle de la poursuite de l’antibiothérapie (céfazoline puis clindamycine par voie orale afin de compléter une durée totale de 6 semaines) et a été autorisée à quitter le service pour rejoindre une maison de repos et de soins.
Le diagnostic ne sera confirmé qu’après la sortie d’hospitalisation avec un dosage de pyroglutamate à 100009 mmol/mol de créatinine dans l’échantillon urinaire (normes <100).
Discussion
L’acidose pyroglutamique due à l’accumulation de 5-oxoproline a d’abord été décrite dans sa forme héréditaire chez des patients pédiatriques souffrant d’erreurs innées du métabolisme. Sa forme acquise est une cause de plus en plus reconnue d’acidose métabolique à trou anionique augmenté.
En cas d’ingestion de paracétamol, la molécule est métabolisée dans le foie et excrétée par les voies urinaires sous forme glucuroconjuguée (environ 60%) ou sulfoconjuguée (environ 40%). Cependant, une fraction plus modeste de 4-5% va se retrouver oxydée par le cytochrome P450 et donner un métabolite hépatotoxique : le N-acétyl-p-quinonimine (NAQPI) (5). Cependant, le NAPQI est rapidement conjugué au glutathion et réduit avant d’être à son tour excrété dans les urines.
L’hépatotoxicité de l’ingestion aiguë d’une grande quantité d’acétaminophen, liée à la déplétion des réserves en glutathion, a été abondamment décrite et étudiée. Cependant, son ingestion chronique dans des quantités jugées « thérapeutiques » entraine également une consommation des stocks de glutathion ainsi que d’acides aminés soufrés impliqués dans le cycle du gamma-glutamyl.
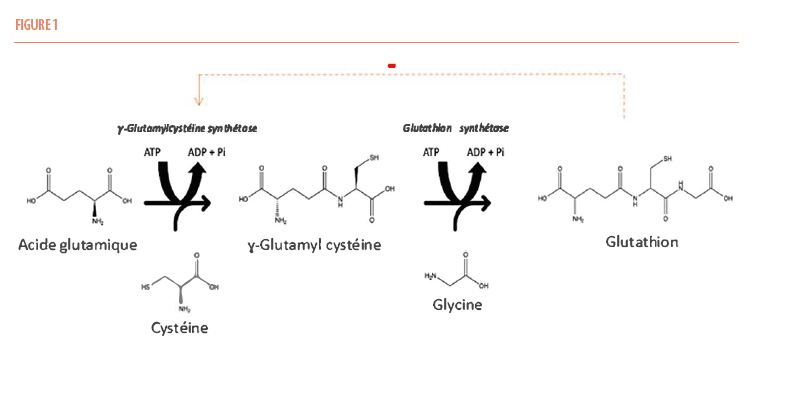
Pour comprendre la physiopathologie de l’acidose pyroglutamique, il convient de rappeler certains éléments du métabolisme normal du glutathion. Cette molécule aux propriétés antioxydantes puissantes est un tripeptide composé de trois acides aminés : le glutamate, la cystéine et la glycine. Sa synthèse (Figure 1) fait intervenir principalement deux enzymes : la γ-glutamylcysteine synthétase qui lie le groupe γ-carboxyl du glutamate au groupe nitrogène de la cystéine et la glutathion synthétase qui permet d’ajouter la glycine à l’extrémité C-terminale de la γ –glutamylcystéine afin de former le glutathion. Ces deux réactions enzymatiques nécessitent de l’énergie fournie par l’hydrolyse de molécules d’adénosine triphosphate. Un système de feed-back négatif entraine une inhibition de la γ-glutamylcystéine synthétase en présence de concentrations physiologiques de glutathion. Par ailleurs, le réactif limitant de cette synthèse est le taux intracellulaire de cystéine cytosolique (6).
Ces deux réactions enzymatiques font partie d’un cycle, appelé le cycle γ-glutamyl (Figure 2), consistant en six réactions enzymatiques distinctes : les deux réactions de synthèse suscitées et quatre réactions de dégradation.
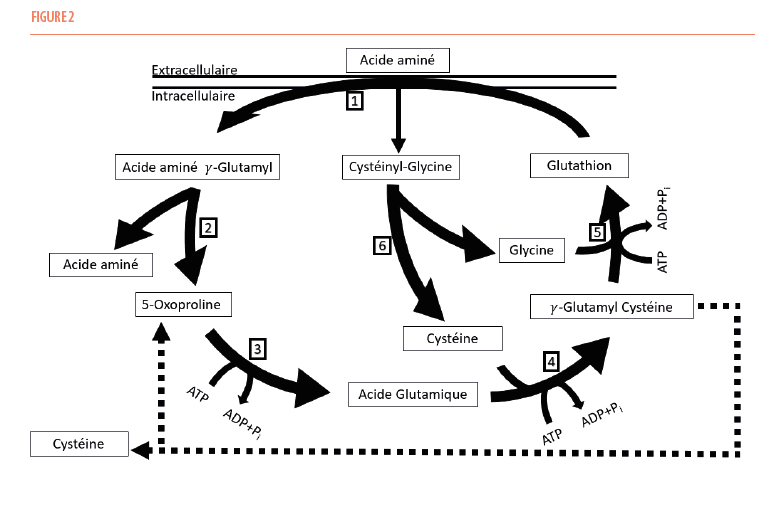
Le travail net de ce cycle requérant l’énergie fournie par l’hydrolyse de trois molécules d’ATP est le transport d’un acide aminé du compartiment extra-cellulaire vers le compartiment intra-cellulaire et non pas la synthèse d’une nouvelle molécule de glutathion puisque cette dernière est formée puis désassemblée. Pour synthétiser une nouvelle molécule de glutathion, les ressources en acides aminés nécessaires doivent donc être puisées en dans le stock intracellulaire.
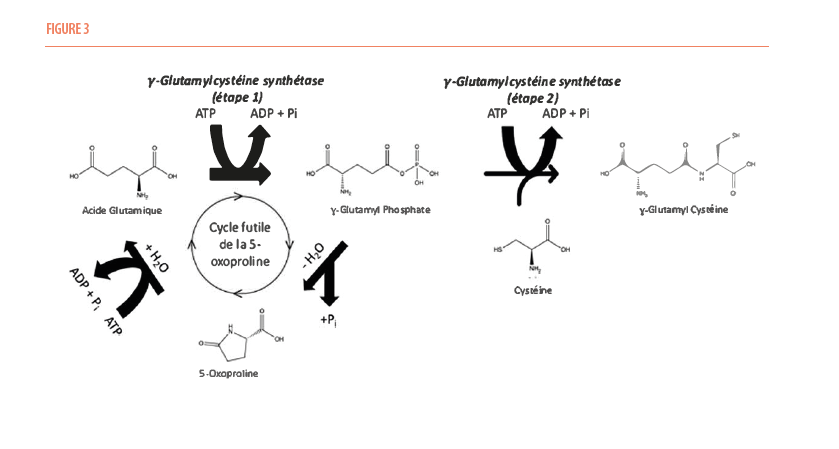
Il existe plusieurs hypothèses permettant d’expliquer l’accumulation de 5-oxoproline en cas d’ingestion chronique de paracétamol. La plus répandue attribue cette accumulation à une voie métabolique annexe faisant intervenir la γ-glutamyl cyclotransférase et qui aboutit, à partir de la γ-glutamyl cystéine à la formation de 5-oxoproline et de cystéine. Cette voie annexe serait favorisée par le déficit en glycine intra-cellulaire observé chez les sujets dénutris (2). Dans un article publié en 2014 dans le Clinical Journal of the American Society of Nephrology, Michael Emmet proposait une autre explication (6). La réaction catalysée par la γ-glutamylcystéine synthétase se fait en 2 étapes. Dans la première étape, le glutamate est phosphorylé par hydrolyse d’une molécule d’ATP afin de former le γ-glutamyl phosphate. Ce dernier est ensuite combiné à la cystéine pour former la γ-glutamylcystéine.
Cependant, en cas de déficit en glycine, on peut observer une cyclisation spontanée du γ-glutamyl phosphate en 5-oxoproline. La 5-oxoproline est ensuite retransformée en glutamate par la 5-oxoprolinase via l’hydrolyse d’une nouvelle molécule d’ATP. Ce cycle futile entraine donc la consommation de deux molécules d’ATP. La consommation chronique de paracétamol peut le favoriser de deux manières : en stimulant la γ-glutamylcystéine synthétase par déplétion des stocks de glutathion d’une part, et en favorisant la déplétion des stocks en cystéine via l’excrétion urinaire de métabolite sulfoconjugués (acetaminophen cysteine). Lorsque les stocks d’ATP sont épuisés, la 5-oxoproline ne peut plus être transformée en glutamate et s’accumule, entrainant l’acidose pyroglutamique.
Le rôle joué par la flucloxacilline dans le développement de l’acidose pyroglutamique est moins clair. En effet, bien que les cas décrits dans la littérature soient nombreux, son hypothétique effet inhibiteur sur la 5-oxoprolinase (7) n’a jamais été démontré.
Concernant la patiente, celle-ci présentait plusieurs facteurs de risques associés au développement d’une acidose pyroglutamique : sexe féminin, dénutrition, insuffisance rénale aiguë et prise concomitante de paracétamol et de flucloxacilline. Une fois le diagnostic d’acidose pyroglutamique suspecté, le traitement par paracétamol a été interrompu et un traitement par infusion continue de N-acétylcystéine a été débuté. L’utilité de ce dernier traitement fait encore débat, et plusieurs cas cliniques publiés font état d’une correction de l’acidose métabolique sans y avoir recours (7,8).
Le mécanisme par lequel l’insuffisance rénale favorise l’accumulation de 5-oxoproline n’est pas clairement établi. Nous pouvons émettre l’hypothèse qu’il précipite l’acidose en diminuant la fraction de paracétamol excrétée par les voies urinaires sous forme glucuroconjuguée et favorise ainsi la déplétion en glutathion.
Il nous semble très intéressant de noter que les facteurs de risque avérés de développer une acidose pyroglutamique sont particulièrement fréquents chez les patients hospitalisés dans les unités de Gériatrie aiguë. Il parait raisonnable d’en conclure que cette entité, bien que facilement traitable, est largement sous-diagnostiquée chez ces patients. Les gériatres devraient donc y être conscientisés afin d’y penser devant toute acidose métabolique à trou anionique augmentée d’origine peu claire.
De manière pratique et sur base de recommandations solides et récentes (9), nous proposons d’utiliser le moyen mnémotechnique GOLDMARK dans la recherche étiologique d’une acidose métabolique à trou anionique augmentée après correction en fonction de l’albuminémie. Après exclusion d’une acidocétose par dosage des corps cétoniques (Ketoacidosis), d’une acidose lactique (L-lactic acidosis et D-lactic-acidosis), d’une insuffisance rénale aiguë (Renal failure) d’une intoxication à l’acide acétylsalicylique (Aspirin), et d’une intoxication au Méthanol et aux Glycols toxiques (éthylène, propylène et diéthylène), le diagnostic d’acidose pyroglutamique doit être envisagé.
De manière plus pragmatique, nous aurions tendance à recommander l’arrêt du paracétamol ainsi que des autres médications associées à l’acidose pyroglutamique (vigabatrin et isoxazolyl-pénicillines) devant toute acidose métabolique à trou anionique augmentée d’origine indéterminée chez les patients présentant les facteurs de risques associés : dénutrition, sexe féminin, insuffisance rénale aiguë et/ou hépatique et prise chronique de paracétamol. En effet, en considérant la morbi-mortalité de l’acidose métabolique chez les personnes âgées et le délai nécessaire à l’obtention du dosage de pyroglutamate dans les urines (près d’un mois dans notre laboratoire), on ne peut se permettre d’attendre une confirmation diagnostique avant d’agir.
Il nous semble enfin utile de rappeler que la dose quotidienne maximale de paracétamol doit être limitée à 3000mg/24h pour les patients de moins de 50kg et à 500mg toutes les 6 heures chez les patients présentant une filtration glomérulaire inférieure à 50ml/min (10). Un bon respect de la posologie recommandée devrait probablement réduire le risque d’acidose pyroglutamique dans la population gériatrique.
RECOMMANDATIONS PRATIQUES
- L’acidose pyroglutamique doit être évoquée devant toute AMTAA sans origine clairement identifiée
- Les facteurs de risques classiquement décrits sont : le sexe féminin, la dénutrition, l’insuffisance rénale et hépatique, la prise chronique de Paracétamol ainsi que d’autres médicaments parmi lesquels la Flucloxacilline
- Le traitement consiste en l’arrêt des médicaments incriminés et permet le plus souvent la résolution de l’acidose. L’intérêt de l’infusion continue de N-acetyl-cystéine et du bicarbonate n’est pas clairement démontré
Affiliations
- CHU UCL Namur -Site Godinne, Gériatrie, B-5530 Yvoir
- Grand Hôpital de Charleroi, Gériatrie,Chef de Service et chef de Pôle Gériatrique, B-6000 Charleroi
- Grand Hôpital de Charleroi, Néphrologie, B-6000 Charleroi
- Grand Hôpital de Charleroi, Réanimation, B-6000 Charleroi
- Grand Hôpital de Charleroi, Gériatrie, B-6000 Charleroi
Correspondance
Dr. Maxime Cuylits
CHU UCL Namur -Site Godinne
Gériatrie
Avenue G. Thérasse 1
B-5530 Yvoir
Références
- Hunter RW, Lawson C, Galitsiou E, Gifford F, Neary JJ. Pyroglutamic acidosis in association with therapeutic paracetamol use. Clin Med. 2016; 16 (6): 524-529.
- Pitt JJ, Hauser S. Transient 5-oxoprolinuria and high anion gap metabolic acidosis: clinical and biochemical findings in eleven subjects. Clin Chem. 1998; 44: 1497–503.
- Tummers S, Oei SDX, Nooteboom F, Meenks SD, Wilting R.M. Severe metabolic acidosis induced by 5-oxoproline accumulation after paracetamol and flucloxacillin administration. Neth J Crit Care. 2019; 28: 22-26.
- Berbee JK, Lammers LA, Krediet CTP, Fischer JC, Kemper EM. Metabolic acidosis caused by concomitant use of paracetamol (acetaminophen) and flucloxacillin? A case report and a retrospective study. Eur J Clin Pharmacol. 2017 ; 73 : 1459–65.
- Ramlawi M, Marti C, Sarasin F. Intoxication aiguë au paracétamol. Rev Med Suisse. 2013; 394: 1478–1482.
- Emmett M. Acetaminophen toxicity and 5-oxoproline (pyroglutamic acid): a tale of two cycles, one an ATP-depleting futile cycle and the other a useful cycle. Clin J Am Soc Nephrol. 2014; 1: 191-200.
- Lanoy C, Bouckaert Y. Metabolic acidosis and 5-oxoprolinuria induced by flucloxacillin and acetaminophen: a case report. J Med Case Reports. 2016; 10: 184.
- Zand Irani A, Borchert G, Craven B, Gibbons H. Flucloxacillin and paracetamol induced pyroglutamic acidosis. BMJ Case Rep. 2021 ; 8: 14.
- Jung B, Martinez M, Claessens YE, Darmon M, Klouche K, Lautrette A. Diagnostic et Prise en Charge de l’Acidose Métabolique, Recommandation Formalisée d’Experts, Société de Réanimation de Langue Française et Société Française de Médecine d’Urgence. Ann Fr Med Urgence. 2019 ; 9: 387-408.
- https://www.cbip.be/fr/chapters/9?frag=6437&trade_family=20875