Depuis plusieurs années, les pathologistes ont acquis différents outils améliorant la compréhension et la caractérisation de certains cancers grâce à l’identification de marqueurs tumoraux réalisée notamment via l’immunohistochimie basée sur l’utilisation d’anticorps ou encore l’hybridation in situ qui permet de visualiser certains types d’anomalies génétiques.
Ce n’est qu’assez récemment que le pathologiste est devenu un acteur central grâce à son implication directe dans la prédiction à la réponse thérapeutique par l’observation des modifications moléculaires propres à certaines entités tumorales. En effet, la combinaison des progrès, tant en biologie moléculaire, permettant l’analyse simultanée de nombreux gènes impliqués dans la pathogenèse des cancers, qu'en traitement par thérapies ciblées visant beaucoup plus spécifiquement les tissus tumoraux, ont révolutionné la prise en charge des cancers en permettant une approche plus personnalisée du diagnostic, du pronostic et des traitements.
Le séquençage des acides nucléiques, qui consiste à déterminer l’ordre d’enchaînement des nucléotides pour un fragment d’ADN donné, est utilisé depuis des dizaines d’années. Avec l’avancée des nouvelles technologies, est apparue la première génération des appareils de séquençage à haut débit, couramment nommés NGS (Next Generation Sequencing). Ces automates permettent d’analyser des dizaines de milliers de séquences ADN en une seule fois. Dès lors, nous sommes devenus capables de rechercher un ensemble d’anomalies potentielles dans une multitude de gènes ou portions de gènes répartis dans tout le génome humain.
L’utilisation du NGS a entraîné une révolution dans le cadre de la gestion des prélèvements tissulaires et cellulaires pris en charge dans les laboratoires d’anatomie pathologique. Le point de départ de cette analyse est une extraction de l’ADN tumoral sélectionné à partir d’échantillons tissulaires ou cellulaires. Ensuite, les régions d’intérêts sont spécifiquement amplifiées et séquencées. Après les étapes d’évaluation morphologique et de diagnostic histologique, le pathologiste travaille en association étroite avec le plateau de biologie moléculaire où seront recherchées les différentes altérations moléculaires.
Plus de la moitié des thérapies ciblées disposent d’un biomarqueur conditionnant leur prescription dans une partie ou la totalité de leurs indications autorisées. La réalisation des tests moléculaires est donc indispensable pour permettre aux patients d’avoir un accès à ces traitements. Pour exemple, la recherche des mutations des gènes KRAS et NRAS dans le cancer colorectal métastatique, des mutations du gène EGFR dans les cancers du poumon non à petites cellules, et la mutation du gène BRAF dans les mélanomes cutanés sont devenues incontournables à l’heure actuelle pour sélectionner un traitement approprié du patient. Ces thérapies ciblées sont relativement coûteuses, dépassant plusieurs milliers d’euros pour un mois de traitement. Elles font partie des spécialités remboursables, chapitre IV, autorisant leur remboursement uniquement si la présence ou l’absence d’une altération génétique a été confirmée par une analyse moléculaire réalisée dans un laboratoire accrédité (ISO15189). Les procédures adoptées par le laboratoire sont donc sous le contrôle d’une stricte standardisation nécessitant la réalisation régulière de contrôles qualité (internes et externes) et le respect des délais fixés pour ces analyses, comme décrit dans les guidelines belges (1,2).
NGS ET CANCER COLORECTAL MÉTASTATIQUE
Depuis de nombreuses années la recherche des mutations RAS est devenue incontournable pour un traitement optimal des patients atteints de cancer colorectal métastatique (mCRC). Il est maintenant bien établi dans la littérature que seuls les patients ayant une tumeur RAS non mutée bénéficient d’un traitement anti-EGFR. L’administration d’anti-EGFR avec la chimiothérapie augmente la survie sans progression (10.1 mois vs 7.8 mois / rapport de risque 0.72) ainsi que la survie globale.
Environ 50 % des cancers colorectaux présentent une mutation des gènes RAS entraînant une activation constitutive de la voie de signalisation EGFR induisant ainsi une transformation oncogénique. La majorité de ces mutations (> 90%) sont observées dans le gène KRAS au niveau des codons 12 et 13 situés dans l’exon 2. Différentes études, dont les travaux de Douillard et al. ont démontré que la recherche des mutations doit également être étendue aux exons 3 et 4 du gène KRAS, ainsi qu’à ces même exons 2, 3 et 4 du gène NRAS pour tous les patients présentant un mCRC (3). Ces mutations sont en effet présentes à une fréquence de 4,3% et 6,7% respectivement dans les exons 3 et 4 du gène KRAS, et à une fréquence de 3,8%, 4,8% et 0,5% dans les exons 2, 3 et 4 du gène NRAS. Le screening de l’ensemble de ces mutations est donc requis avant de pouvoir initier une thérapie anti-EGFR chez les patients atteints d’un mCRC, ce de façon à pouvoir prédire la (non-) réponse au traitement.
NGS & CANCERS PULMONAIRES NON À PETITES CELLULES
Le cancer pulmonaire est une des pathologies malignes les plus fréquemment diagnostiquées, et est la première cause de décès par cancer dans le monde. Ces dernièresannées, nous observons une diminution d’incidence chez les hommes mais une augmentation chez les femmes, avec une augmentation des adénocarcinomes par rapport aux carcinomes épidermoïdes. De plus en plus d’adénocarcinomes apparaissent également chez des patients petits ou non-fumeurs (tabagisme passif, radon, agents toxiques environnementaux ou professionnels voire domestiques) (4).
La majorité des patients sont malheureusement diagnostiqués à des stades avancés, rendant la résection chirurgicale impossible. Différentes anomalies moléculaires sont décrites dans le cancer pulmonaire. Il est important de préciser que ces mutations sont considérées comme exclusives. A priori donc, une tumeur présentant une mutation dans un gène ne présentera pas de mutation dans les autres gènes ciblés (5).
Les altérations génétiques visées par les thérapies ciblées, et pour lesquelles la recherche est réalisée en routine par NGS, concernent principalement le gène EGFR et se retrouvent en particulier dans l’adénocarcinome du poumon sensible aux inhibiteurs de tyrosine kinases de l’EGFR (erlotinib, gefitinib et afatinib) (6). Cette sensibilité décrite par Lynch en 2004 permet d’obtenir d’excellentes réponses lorsque les patients présentent une mutation activatrice (7). Elles sont plus fréquentes chez les femmes, les patients nonfumeurs et les patients d’origine asiatique. Elles sont observées dans 10 % de la population caucasienne et dans plus de 20% de la population asiatique. Les délétions de l’exon 19 et la mutation ponctuelle de l’exon 21 L858R représentent plus de 80% des mutations activatrices sensibles à la médication par les inhibiteurs spécifiques. Ces mutations augmentent l’activité tyrosine kinase de l’EGFR entrainant une hyperactivation de différentes voies de signalisation.
Malheureusement, la majorité des tumeurs répondant à ces traitements développe par la suite des résistances, avec une durée médiane de progression de 9 mois. En cas de résistance au traitement, les récentes études ont démontré l’importance de rechercher dans les cellules tumorales en croissance la présence de nouvelles mutations de résistance (le type le plus fréquent étant la mutation T790M, dans l’exon 20 du gène EGFR). Dans ces cas, des traitements à base d'inhibiteurs de tyrosine kinase de seconde génération peuvent alors être utilisés de façon ciblée pour combattre la maladie (8).
Parallèlement aux mutations présentes dans le gène EGFR, des mutations des gènes BRAF et KRAS semblent également être corrélées aux adénocarcinomes du poumon. Concernant les mutations dans le gène KRAS, elles sont principalement situées dans l’exon 2 (codons 12 et 13 essentiellement) et sont généralement corrélées au tabagisme mais certaines mutations comme la G12D sont retrouvées plutôt chez le non-fumeur (2). Pour les mutations du gène BRAF dans le cancer pulmonaire, une distinction doit être faite entre la mutation V600E et les mutations non-V600E, ce qui permettra de sélectionner une thérapie anti-BRAF/anti-MEK versus l’immunothérapie.
Il est à noter que d’autres gènes sont décrits à l’heure actuelle dans l’étiopathogénie du cancer pulmonaire et que cette liste devra être complétée par des gènes pour lesquels on disposera également très bientôt de thérapies ciblées.
NGS & MÉLANOMES CUTANÉS
Le mélanome cutané est une tumeur rare, représentant seulement 1 % de tous les cancers. Bien que le mélanome ne compte que pour moins de 5% des cancers dermatologiques, il est responsable de 75% de la mortalité induite par un cancer de la peau. Son incidence a nettement augmenté entre les années 1970 et fin des années 1990 pour ensuite se stabiliser dans les années 2000. La survie à 5 ans à augmenter de 82% en 1975 à 92%, mais la mortalité globale reste malheureusement inchangée (9).
Plusieurs mutations somatiques dans des oncogènes ont été identifiées dans le mélanome : BRAF, NRAS, c-KIT, etc...
Environ 40% des mélanomes présentent une mutation BRAF dont la principale est la mutation V600E (80-90%) (10). BRAF est une protéine kinase de type sérine/thréonine activant la voie de signalisation des MAP kinase (RASRAF- MEK-ERK). Les mutations BRAF (et NRAS) entraînent une activation continue de cette voie de signalisation, induisant la prolifération tumorale et la résistance à l’apoptose. Un des premiers inhibiteurs sélectifs des tumeurs « BRAF muté » (V600E ou V600K), sur le marché, a été le vemurafenib. Les résultats ont montré une réduction relative de 63% du risque de mortalité et de 74% pour le risque de progression tumorale (11).
À côté des mutations BRAF, environ 20% des mélanomes contiennent une mutation NRAS (80% dans le codon 61, 20% dans les codons 12 et 13). Les mutations présentes dans le gène C-KIT sont quant à elle plus rares. L’identification de ces mutations somatiques activatrices permet de sélectionner les patients métastatiques (stade IV) pouvant bénéficier d’une thérapie ciblée par un inhibiteur BRAF ou MEK ou une association de ces 2 inhibiteurs. Aucun inhibiteur direct de NRAS n’est à ce jour disponible.
NGS & GLIOMES DIFFUS
Environ 70 à 80 % des gliomes diffus de grade intermédiaire (II et III) et des glioblastomes secondaires présentent une mutation dans les gènes IDH1 (codon 132) ou IDH2 (codon 172). La mutation la plus fréquemment retrouvée est la mutation R132H du gène IDH1 (90% des cas), celle-ci pouvant être mise en évidence par immunohistochimie. Les mutations minoritaires d’IDH1 et les mutations d’IDH2 doivent, quant à elles, être mises en évidence par d’autres techniques, notamment par NGS. Ces mutations sont retrouvées tant dans les lésions astrocytaires qu’oligodendrogliales, suggérant que ces anomalies surviennent de façon précoce dans la tumorogenèse. De plus, elles s’observent plusfréquemment chez les personnes jeunes (< 55 ans) mais ne sont qu’exceptionnellement retrouvées chez les personnes plus âgées ou les enfants. La recherche de ces mutations est à la fois une aide diagnostique et pronostique car elles sont souvent associées à une progression plus lente de la maladie et une amélioration de la survie globale des patients (12,13,14).
NGS et GIST
Les tumeurs stromales digestives, ou tumeurs stromales gastro-intestinales (GIST), sont des tumeurs du tube digestif qui étaient très largement méconnues des médecins et du grand public jusqu’en 2000. Les GIST sont les tumeurs mésenchymateuses les plus fréquentes du tube digestif. Ce sont toutefois des tumeurs assez peu fréquentes en comparaison aux carcinomes, car leur incidence est évaluée à 15 nouveaux cas par million d’habitants par an (15).
La plupart des GIST présentent des mutations activatrices dans les gènes KIT et PDGFRA. Détecter ces mutations est important, la réponse au traitement varie en effet en fonction du statut mutationnel de la tumeur. KIT et PDGFRA sont des protéines réceptrices pour les facteurs de croissance, activées dans les tissus normaux quand la cellule en a besoin. Des mutations de KIT (exon 11 principalement, mais également dans les exons 9, 13 et 17) et PDGFRA conduisent à une activation indépendante de ces récepteurs et à une prolifération spontanée et non contrôlée des cellules (16,17). Ces dernières années, différentes mutations ont été détectées dans le gène KIT et sont observées dans ~80% des GISTs. Environ 8% des GISTs présentant un KIT normal montrent une mutation dans le gène PDGFRA (18,19).
EN PRATIQUE AUX CLINIQUES UNIVERSITAIRES SAINT-LUC
Aux Cliniques universitaires Saint-Luc (CUSL), le NGS est appliqué dans le cadre d’analyses en routine clinique qu’elles soient liées au diagnostic, au pronostic ou encore à la prédiction de la réponse thérapeutique depuis janvier 2016. Cette analyse qui est accréditée suivant la norme ISO15189, est réalisée selon la standardisation imposée par les guidelines belges (1,2), impliquant la réalisation régulière de contrôles qualité et le respect des délais de réalisation de l’analyse (10 jours ouvrables).
Actuellement, le panel utilisé aux CUSL permet d’identifier des mutations présentes dans différents exons de 8 gènes particulièrement impliqués en oncologie et pour lesquels l’impact de la présence d’une mutation a été clairement démontré au niveau thérapeutique et pronostique. Les 8 gènes repris dans le panel sont les gènes BRaf, c-Kit, EGFR, IDH1, IDH2, KRas, NRas et PDGFRA.
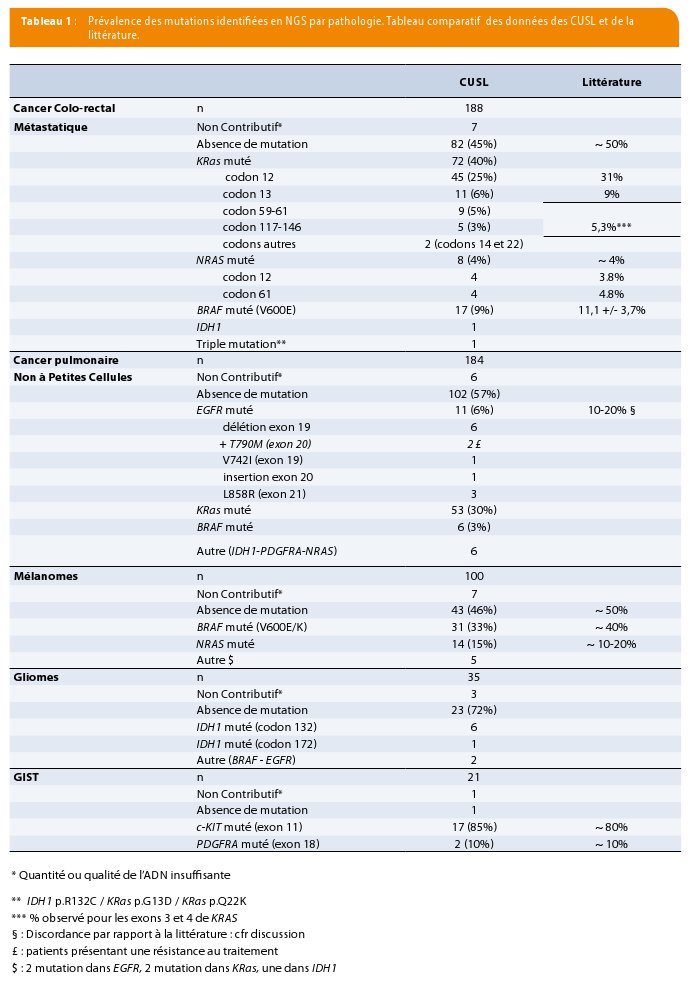
Durant l’année 2016, 532 analyses NGS ont été réalisées en routine clinique. La répartition des analyses correspondait à 188/532 (35%) liées aux cancers colorectaux, 184/532 (35%) au cancer pulmonaire, 100/532 (19%) aux mélanomes, 35aux gliomes ,21 aux GIST et 4 à des cancers thyroïdiens. Le détail des résultats comparatifs est repris en Table 1.
Hormis pour le gène EGFR dans le cadre des cancers pulmonaires, tous ces pourcentages de mutations identifiées dans les différentes pathologies sont en concordance avec les données de la littérature (3, 11, 18-21). Concernant EGFR, la plupart des données de la littérature ne prennent en compte que certaines sous-catégories de carcinomes non à petites cellules (NSCLC). Nos analyses sont réalisées de façon plus globale sur l’ensemble des NSCLC. Ceci peut expliquer notre plus faible pourcentage observé : pourcentage en accord avec les données obtenues auprès d’autres centres d’analyses moléculaire que ce soit en Belgique ou aux Pays-Bas.
En conclusion, la technique de NGS, accréditée et réalisée en routine clinique depuis 2016 aux Cliniques universitaires Saint-Luc, permet de séquencer rapidement, simultanément, et pour un coût relativement raisonnable, plusieurs gènes d’intérêt. Cette méthode est devenue un excellent outil diagnostique et/ou pronostique permettant également de déterminer individuellement le meilleur traitement pour chaque patient, avec pour avantages de meilleures chances de succès thérapeutique et la diminution de traitements inutiles. Dans un avenir proche, nous allons étendre notre panel à d’autres recherches mutationnelles, permettant ainsi de couvrir de nouveaux gènes d’intérêt et ainsi cibler d’autres pathologies.
Affiliations
* Plateau de Biologie Moléculaire, Tour des laboratoires, Cliniques universitaires Saint-Luc,UCL, Bruxelles
** Service d’Anatomie Pathologique, Tour des laboratoires, Cliniques universitaires Saint-Luc, UCL, Bruxelles
Correspondance
Pr Anne Jouret-Mourin
Service d’Anatomie Pathologique
Cliniques universitaires Saint-Luc
Avenue Hippocrate 10
B-1200 Bruxelles
Références
- Jouret-Mourin A, Cuvelier C, Demetter P. et al. RAS-testing in colorectal cancer: Belgian guidelines. Belgian Journal of Medical Oncology 2015; 9 : 183-190.
- Pauwels P, Remmelink M, Hoton D, et al. Pathological diagnosis and molecular testing in non-small cemm mung cancer: Belgian guidelines. Belgian Journal of Medical Oncology 2016 ; 10 : 123- 131.
- Douillard JY, Oliner KS, Siena S et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013 ; 369 : 1023-1034.
ouvrir dans Pubmed - Morgensztern D, Campo M J, Dahlberg SE, et al. Molecularly Targeted therapies in non-small cell lung cancer. Annual upadte 2014. J Thorac Oncol 2015; 10 : S1–S63.
ouvrir dans Pubmed - Li T, Kung H-J, Mack P, et al. Genotyping and Genomic Profiling of Non Small-Cell Lung Cancer: Implications for current and Future therapies. J Clin Oncol 2013 ; 31 : 1039- 1049.
ouvrir dans Pubmed - Dietel M, Bubendorf L, Dingemans A-M, et al. Diagnostic procedures for non-small- cell lung cancer (NSCLC): recommendations of the European Expert Group. BMJ 2015 ; 0 : 1-8.
- Lynch TJ, Bell DW, Sordella R et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non–Small-Cell Lung Cancer to Gefitinib. N Engl J Med 2004 ; 350 : 2129-2139.
ouvrir dans Pubmed - Sequist LV, Waltman BA, Santagata DD et al. Genotypic and Histological Evolution of Lung Cancers Acquiring Resistance to EGFR Inhibitors. Science Translational Medicine 2011; 3 : 75ra26.
ouvrir dans Pubmed - Berrios-Colon E, Williams S. Melanoma Review: Background and Treatment. US Pharm 2012 ; 37 : HS-4-HS-7.
- Solit DB, Rosen N. Resistance to BRAF inhibition in melanomas. N Engl J Med 2011; 364 : 772-4.
ouvrir dans Pubmed - Ascierto P A, Kirkwood J M , Grob JJ , et al. The role of BRAF V600 mutation in melanoma. J Translational Medicine 2012; 10 : 85 12.
ouvrir dans Pubmed - Appin CL, Brat DJ. Biomarker-driven diagnosis of diffuse gliomas. Mol Aspects Med 2015 Nov;45:87-96.
ouvrir dans Pubmed - Louis DN, Ohgaki H, von Deimling A et al. WHO Classification of Tumours of the Central Nervous System. IARC (2016).
ouvrir dans Pubmed - Yan H, Parsons W, Bigner DD et al. IDH1 and IDH2 Mutations in Gliomas. N Engl J Med 2009; 360 : 765-773.
ouvrir dans Pubmed - Nilsson B, Bumming P, Meis-Kindblom JM, et al. Gastrointestinal stromal tumors: The incidence, prevalence, clinical course and prognostication in the pre-imatinib mesylate era. Cancer 2005; 103 : 821-829.
ouvrir dans Pubmed - Heinrich MC, Corless CL, Duensing A et al. PDGFRA Activating Mutations in Gastrointestinal Stromal Tumors. Science 2003; 299 : 708-710.
ouvrir dans Pubmed - Subramanian S, West RB, Corless CL et al. Gastrointestinal stromal tumors (GISTs) with KIT and PDGFRA mutations have distinct gene expression profiles. Oncogene 2004; 23 : 7780-7790.
ouvrir dans Pubmed - Nishida T, Hirota S. Biological and clinical review of stromal tumors in the gastrointestinal tract. Histol Histopathol 2000; 15: 1293–301.
ouvrir dans Pubmed - Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006; 130 : 1466–78.
ouvrir dans Pubmed - Boleij, Tack, Taylor et al. RAS testing practices and RAS mutation prevalence among patients with metastatic colorectal cancer: results from a Europewide. BMC Cancer 2016; 16 : 825. 21.
- Kim SY, Hahn HJ, Lee YW. Metaanalysis of BRAF mutations and clinicopathologic characteristics in primary melanoma. J Am Acad Dermatol 2015;72:1036-1046.
ouvrir dans Pubmed