Introduction
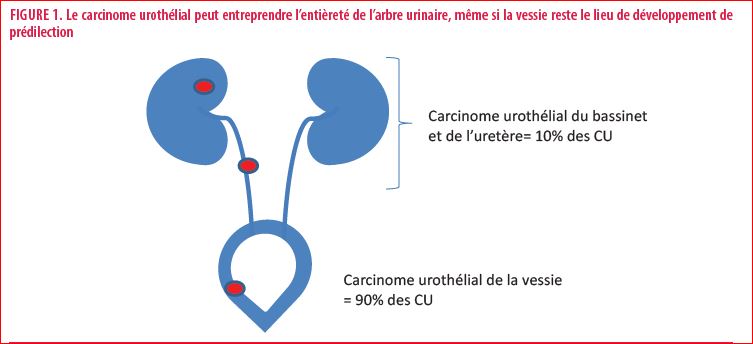
Le Carcinome Urothélial (CU), appelé également carcinome transitionnel, est le 7ème cancer le plus fréquemment diagnostiqué avec plus de 350,000 nouveaux cas diagnostiqués et plus de 150,000 décès dans le monde chaque année. Le CU entreprend le plus souvent la muqueuse de la vessie mais peut également apparaître dans l’entièreté de l’arbre urinaire (CU du bassinet rénal, de la vessie, de l’uretère ou de l’urètre) (1) (Figure 1).
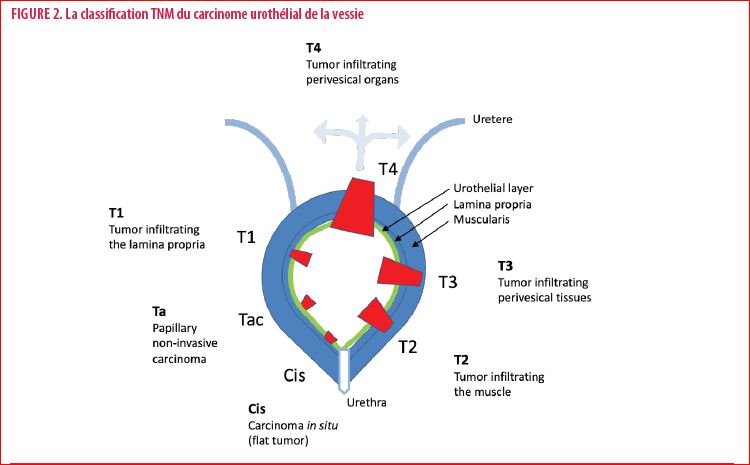
Dans la vessie, lorsque le CU reste superficiel et n’infiltre pas le muscle (Tis, Ta, T1), le traitement consiste en une résection endoscopique associée ou non, en fonction du grade, à des instillations de Bacille Calmette et Guerin (BCG) ou d’épirubicine ; le pronostic est excellent. Lorsqu’il envahit la couche musculaire, devenant musculo-invasif (T2-T4), un traitement multimodal est requis, combinant soit une chimiothérapie néoadjuvante (cisplatine + gemcitabine, 4 cycles) suivi d’une chirurgie de type cystectomie radicale soit une radiothérapie + chimiothérapie (cisplatine hebdomadaire ou 5-Fluorouracyl + mitomycine) concomitante (Figure 2). Cependant, malgré un traitement radical et mutlimodal, jusqu’à 50% des patients peuvent présenter une récidive néoplasique avec développement de métastases à distance. Le pronostic est alors extrêmement sombre avec une médiane de survie ne dépassant pas 14 mois (2,3).
L’immunothérapie : mécanisme et rationnel
L’immunothérapie a considérablement amélioré le pronostic de nombreux patients dans différents types de cancers, y compris les cancers urothéliaux.
Le but de l’immunothérapie est de stimuler notre propre système immunitaire à reconnaitre et détruire les cellules cancéreuses en développement (4).
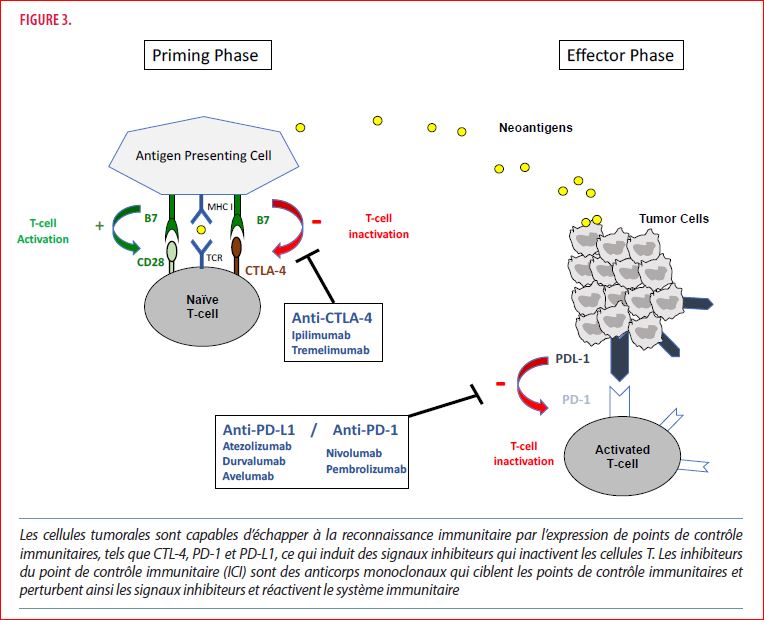
Les cellules tumorales libèrent, sous forme de fragments protéiques, des antigènes tumoraux, appelés néoantigènes, qui sont captés par les cellules présentatrices d’antigènes (CPA) via le complexe majeur d’histocompatibilité (CMH) de classe I. Les CPA migrent ensuite vers les organes lymphoïdes, où ils activent les cellules T effectrices, via une liaison entre CD28 sur les lymphocytes T et B7 sur CPA (Priming phase). Les lymphocytes activés infiltrent à leur tour les tumeurs et déclenchent une cascade inflammatoire visant à détruire les cellules cancéreuses (Effector phase).
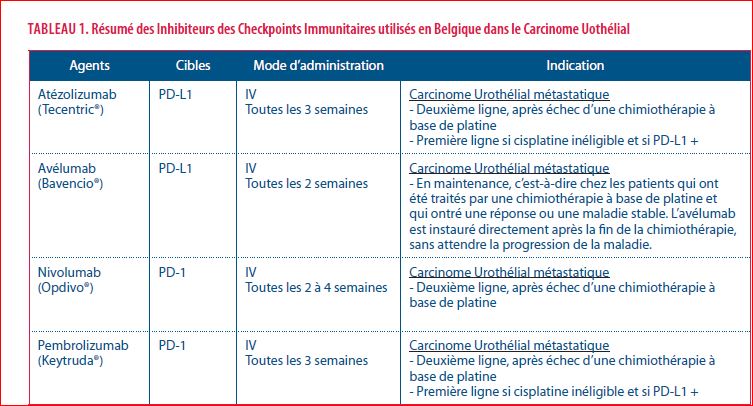
Cependant, les cellules cancéreuses ont développé différents mécanismes pour échapper à la reconnaissance immunitaire ; une des stratégies implique la surexpression de récepteurs cellulaires, appelés Checkpoints Immunitaires (CTLA-4, PD-1 et PD-L1) et présents physiologiquement sur les lymphocytes. Ces checkpoints immunitaires, via cette up-régulation, vont bloquer l’activation de ces lymphocytes et empêcher la reconnaissance et la destruction des cellules tumorales par ces derniers. CTLA-4 exprimé sur les lymphocytes T exerce son effet inhibiteur en rivalisant avec CD28 et en se liant à B7, entraînant ainsi l’inactivation des lymphocytes T dans les tissus lymphoïdes. PD-1 quant à lui est un récepteur inhibiteur exprimé sur les lymphocytes T qui, lors de sa liaison avec le PD-L1 exprimé sur les cellules tumorales, transmet un signal inhibiteur aux lymphocytes T. Les inhibiteurs des Checkpoints immunitaires (ICI) sont des anticorps monoclonaux qui ciblent les points de contrôles immunitaires et perturbent ainsi les signaux inhibiteurs avec pour effet une réactivation du système immunitaire (Figure 3 et Tableau 1) (4).
Le CU est un bon candidat pour l’utilisation des ICIs ; en effet, la présence de lymphocytes T CD8+ infiltrant les lésions tumorales urothéliales est corrélée avec un meilleur pronostic. De plus, le CU est associé à une production importante de néoantigènes en raison d’une charge tumorale mutationelle (TMB) élevée, ce qui favorise l’immunogénicité de la tumeur et une meilleure réponse aux ICIs (5).
L’immunothérapie dans le CU musculo-invasif, non métastatique (T2-4): néo-adjuvant et adjuvant
La place de l’immunothérapie en néo-adjuvant est actuellement évaluée à travers différentes études cliniques en monothérapie et en association avec la chimiothérapie. Deux essais cliniques de phase II, PURE-01 et ABACUS, ont évalué le pembrolizumab (3 cycles, toutes les 3 semaines) et l’atézolizumab (2 cycles toutes les 3 semaines), respectivement, avant la réalisation d’une cystectomie chez des patients atteints d’un CU de vessie musculo-invasif non métastatique (T2-T4aN0 pour ABACUS et T2-T3N0 pour PURE-01). Le taux de réponse pathologique complète (pCR) était de 31% pour ABACUS et de 42% pour PURE-01, ce qui est comparable aux résultats obtenus avec une chimiothérapie standard. La présence d’une expression PD-L1 était associée à une meilleure réponse dans l’étude PURE-01 (54% de pCR) mais pas dans l’étude ABACUS, ce qui reflète la difficulté de prédire l’efficacité des ICIs sur base seule du PD-L1 (6,7).
L’étude non-randomisée de phase II BLASST-1 a évalué l’efficacité de l’association de la chimiothérapie (4 cures de cisplatine + gemcitabine) au nivolumab chez 41 patients atteints d’un CU de vessie. Sur 41 patients (cT2N0 90%, cT3N0 7% et cT4N1 3%), 66% présentaient une réponse pathologique et 49% présentaient une réponse pathologique complète (pT0, pTis). Des effets secondaires de grade 3-4 étaient rencontrés chez 24% des patients, la majorité d’entre eux étant attribués à la chimiothérapie, suggérant que cette association est faisable. Il est cependant difficile de comparer cette association à la chimiothérapie standard vu l’absence de bras contrôle (8). Actuellement, vu l’absence d’étude randomisée et l’absence de biomarqueur correct, nous ne recommandons donc pas l’immunothérapie en monothérapie ni en association avec une chimiothérapie en néo-adjuvant dans le cancer de vessie musculo-invasif localisé. Des études randomisées sont actuellement en cours (étude ENERGIZE évaluant le nivolumab en association avec la chimiothérapie) et devront dans un futur proche nous aider à évaluer la place des l’ICIs en néo-adjuvant.
La place des ICIs en adjuvant, c’est-à-dire, après un geste chirurgical radical, est également évaluée dans plusieurs études. L’étude de phase III IMvigor-010 a évalué l’atézolizumab pendant 1 an par rapport à une observation seule chez 800 patients atteints d’un CU du tractus supérieur ou de la vessie à haut risque de récidive après geste radical. L’atézolizumab n’a montré aucune amélioration de la survie sans récidive par rapport au bras contrôle. Le taux de survie sans maladie à 18 mois était de 51 % avec l’atézolizumab et de 49 % avec l’observation; de plus, la survie sans maladie était similaire quel que soit l’expression du PD-L1 (9).
L’étude de phase III Checkmate 274 a évalué le nivolumab par rapport à un placébo chez 709 patients atteints d’un CU invasif à haut risque de récidive après geste radical. Le nivolumab a réduit le taux de récidive de la maladie de 30% par rapport au placébo, améliorant la médiane de survie sans récidive de 10.9 mois avec le placébo à 21 mois avec le nivolumab (P<0.001). Les données concernant la survie globale ne sont pas disponibles (10). Une troisième étude de phase III évaluant le pembrolizumab pendant un an (AMBASSADOR) est toujours en cours de recrutement et nous aidera à mieux évaluer le rôle exact de l’immunothérapie en adjuvant. À l’heure actuelle, le nivolumab n’a pas encore reçu l’approbation de l’European Medical Agency (EMA) en adjuvant, en raison du manque de résultats concernant la survie globale.
L’immunothérapie dans le stade avancé (métastatique ou non résécable) : les ICIS après échec de la chimiothérapie de première ligne
Historiquement, le traitement de première ligne de ces patients consistait en une chimiothérapie à base de cisplatine avec un taux de réponse d’approximativement 50% et une survie globale médiane ne dépassant pas 14 mois. La carboplatine remplace la cisplatine chez les patients jugés inéligibles à la cisplatine (mauvais état général, clairance de la créatinine <60ml/min, neuropathie ou perte auditive) mais avec une efficacité moindre et aucune amélioration prouvée de la survie. Ces traitements ne sont en rien curatifs et la maladie progressait assez rapidement. Avant l’ère de l’immunothérapie, les traitements de deuxième ligne consistaient en l’administration de paclitaxel ou de vinflunine avec un taux de réponse inférieur à 20% et une survie médiane inférieure à 7 mois (11).
L’immunothérapie dans le stade avancé : après échec d’une chimiothérapie à base de platine
Depuis 2017, cinq ICIs ont été évalués en seconde ligne, après échec d’un traitement de chimiothérapie à base de platine. Ces agents ont été approuvés sur base d’études de phase II (nivolumab, atézolizumab, avelumab et durvalumab), reflétant le besoin médical dans cette situation à ce moment là. Seul le pembrolizumab a démontré un bénéfice de survie dans le CU avancé dans une étude de phase III randomisée (KEYNOTE-045). Cette étude a randomisé 524 patients atteints de CU métastatique entre pembrolizumab (200 mg toutes les 3 semaines) ou chimiothérapie (docétaxel, paclitaxel ou vinflunine). Le pembrolizumab a amélioré la survie des patients par rapport à la chimiothérapie (10.3 vs 7.4 mois, respectivement ; P= 0.002;) ainsi que le taux de réponse (21.1 % vs 11.4 %, respectivement). Une des particularités de toutes les immunothérapies est la durabilité de la réponse avec une durée de réponse de 29.7 mois dans le bras pembrolizumab par rapport à 4.4 mois dans le bras chimiothérapie. La survie à 4 ans est de 16% dans le bras pembrolizumab contre 10% dans le bras chimiothérapie. Le pembrolizumab était également associé à moins d’effets secondaires de tout grade comparé à la chimiothérapie (60.9 % vs 90.2 %, respectivement), y compris moins d’effets secondaires de grade 3-5 (15 % vs 49.4 %). Le statut PD-L1, basé sur un « score positif combiné », qui a été mesuré comme le pourcentage de cellules immunitaires et tumorales PD-L1 positives par rapport au nombre de cellules tumorales, n’était pas associé à une meilleure survie ni à une meilleure réponse dans le bras pembrolizumab (12). En Belgique, le pembrolizumab est donc actuellement remboursé dans le traitement du CU métastatique, après échec d’une chimiothérapie à base de platine, de même que le nivolumab et l’atézolizumab (13,14).
L’immunothérapie dans le stade avancé (métastatique ou non résécable) : améliorer la première ligne de traitement, association ou monothérapie ?
Deux études de phase III, randomisées, ont évalué le bénéfice de la combinaison ICI + chimiothérapie dans le CU avancé (IMvigor 130 évaluant l’atézolizumab et KEYNOTE-361 évaluant le pembrolizumab). Ces deux études ont utilisé un design similaire, randomisant les patients en 3 bras : 1) ICI + chimiothérapie, 2) ICI seule, 3) chimiothérapie (15,16).
L’essai IMvigor130 a randomisé 1,213 patients atteints de CU avancé en 3 bras: atezolizumab (1,200 mg IV toutes les 3 semaines) plus chimiothérapie (cisplatine/carboplatine plus gemcitabine); atezolizumab en monothérapie (1,200mg IV toutes les 3 semaines) et placebo plus chimiothérapie. Par rapport à la chimiothérapie, l’association chimiothérapie + atezolizumab n’a pas augmenté significativement la survie globale sans progression (6.3 vs 8.2 mois, respectivement, P non significatif) ni la survie globale (13.4 vs 16 mois, respectivement ; P non significatif) ni le taux de réponse (44% vs 47%, respectivement). Les analyses de sous-groupes ont montré que les patients traités par cisplatine, les patients avec une expression PD-L1 plus élevée et un meilleur état de performance ECOG, présentaient un plus grand bénéfice de cette association.
Aucune analyse comparative statistique n’a pu être réalisée entre le bras atézolizumab seul et la chimiothérapie (méthode statistique de type hiérarchique, qui permettait une analyse statistique entre ICI et chimiothérapie seulement si la survie globale et la survie sans progression étaient supérieures à la chimiothérapie dans le bras ICI + chimiothérapie). L’atézolizumab seul a montré une légère augmentation de la survie par rapport à la chimiothérapie seule (15.7 contre 13.1 mois, respectivement) mais ce bénéfice est apparu tardivement après plusieurs mois de traitement, la chimiothérapie se montrant plus efficace au début de traitement. Cela peut s’expliquer par un taux de réponse plus important avec la chimiothérapie qu’avec l’atézolizumab (44.1% vs 23.4%, respectivement).
Cependant, comme souvent observé avec l’immunothérapie, la durée de réponse avec l’atézolizumab était prolongée par rapport à la chimiothérapie (29.6 vs 8.1 mois, respectivement). L’expression de PD-L1 pourrait être associée à une meilleure efficacité de l’atézolizumab par rapport à la chimiothérapie en terme de survie globale (27.5 vs 16.7 mois, respectivement), bien que ceci n’ait pas fait l’objet d’une analyse statistique. L’étude KEYNOTE-361 a randomisé 1,000 patients en 3 bras: pembrolizumab + chimiothérapie (6 cycles de cisplatine/carboplatine plus gemcitabine), pembrolizumab (200mg IV toutes les 3 semaines), et chimiothérapie (6 cycles de cisplatine/carboplatine plus gemcitabine). Cette étude a montré des résultats similaires; ni l’association chimiothérapie + pembrolizumab ni le pembrolizumab seul ne font mieux en terme de survie ou de réponse que la chimiothérapie. Au contraire, le taux de réponse observé avec le pembrolizumab est inférieur à celui observé avec la chimiothérapie seule. Ces deux études suggèrent que l’association chimiothérapie + ICI n’est pas supérieure à la chimiothérapie standard et n’augmente ni la survie ni le taux de réponse. Ces associations ne sont donc pas approuvées actuellement. Même si la majorité de ces résultats axés sur l’efficacité de l’ICI en monothérapie sont exploratoires, ces différents essais semblent conclure à une faible efficacité de l’ICI en monothérapie par rapport à la chimiothérapie (taux de réponse plus faible et survie médiane non améliorée) chez les patients atteints de CU métastatique. L’expression de PD-L1 pourrait être associée à une meilleure efficacité (mais non évaluée sur le plan statistique). Cela souligne le fait que la chimiothérapie à base de platine demeure, chez les patients éligibles au platine, la norme de soins dans ce contexte.
L’immunothérapie dans le stade avancé (métastatique ou non résécable) : le challenge des patients inéligibles a la cisplatine
Une proportion significative de patients atteints de CU, localisé ou métastatique, ne sont pas éligibles à un traitement de chimiothérapie par cisplatine. Deux études cliniques non randomisées de phase II ont évalué l’atézolizumab (IMVigor 210) et le pembrolizumab (KEYNOTE-052) en monothérapie chez des patients non éligibles à la cisplatine (taux de filtration glomérulaire > 30 et < 60 mL/min, perte auditive ≥ G2, neuropathie périphérique ou état de performance ECOG 2) (17,18).
Ces deux études ont montré que le taux de réponse à ces traitements atteignait 30%, dont près de 9% de réponse pathologique complète, avec un taux de contrôle de la maladie (réponse complète, partielle et maladie stable) de 46.8%). La durée de réponse était de 30 mois. La survie sans progression était comprise entre 2 et 3 mois avec une survie globale atteignant 11.3 mois et un taux de survie à 12 et 24 mois de 46.9% et 31.2%, respectivement. Les analyses de sous-goupe ont montré, au moins dans l’étude IMvigor210, que la population de patients avec une expression importante de PD-L1 présentait une survie sans progression (4.1 mois) et une survie globale prolongée (19.1 mois).
Malgré l’absence de comparaison tête-à-tête avec un régime à base de carboplatine chez les patients non éligibles au cisplatine, l’atézolizumab et le pembrolizumab en monothérapie semblent montrer un bénéfice en terme de réponse et de survie globale. Cela a permis l’approbation de l’atézolizumab et du pembrolizumab pour les patients avec un CU métastatique non éligibles au cisplatine en première intention en 2017. Cependant, les données observées dans l’essai IMvigor 130 montrant un bénéfice supérieur de l’atézolizumab en monothérapie chez les patients PD-L1 positif ont conduit à réserver l’atézolizumab ou le pembrolizumab en monothérapie chez les patients avec un CU métastatique inéligible à la cisplatine uniquement en cas d’expression PD-L1.
L’immunothérapie dans le stade avancé (métastatique ou non résécable) : le concept de maintenance
Le concept de maintenance, c’est-à-dire l’introduction d’un ICI après la chimiothérapie de première ligne sans attendre la progression de la maladie, a montré une amélioration dans le pronostic des patients métastatiques. L’étude randomisée de phase III JAVELIN Bladder 100 a recruté 700 patients atteints de CU avancé qui n’avaient pas connu de progression de la maladie après une chimiothérapie à base de platine ; ces patients devaient présenter une réponse complète (RC), une réponse partielle (PR) ou une maladie stable (SD) après 4 à 6 cycles de cisplatine ou de carboplatine plus gemcitabine. Les patients ont été randomisés (1:1) pour recevoir un traitement d’entretien par avélumab (10 mg/kg IV toutes les 2 semaines) ou une observation. L’avélumab n’est donc pas introduit dans ces conditions au moment de la progression après une chimiothérapie mais directement après la chimiothérapie, sans attendre la progression de la maladie. Cette stratégie de maintenance apport un bénéfice de 6 mois en terme de survie médiane (21.4 vs 14.3 mois) avec une diminution du risque de décès de 31% (P = 0.0005). La survie globale à 1 an est de 71.3% dans le groupe maintenance contre seulement 58% dans le groupe observation, en sachant que ces derniers pouvaient bénéficier d’une immunothérapie en cas de progression. Cela souligne le fait que l’introduction de l’avelumab avant la progression de la maladie, directement après la chimiothérapie, améliore la survie par rapport à l’attente de la progression de la maladie après la chimiothérapie (19).
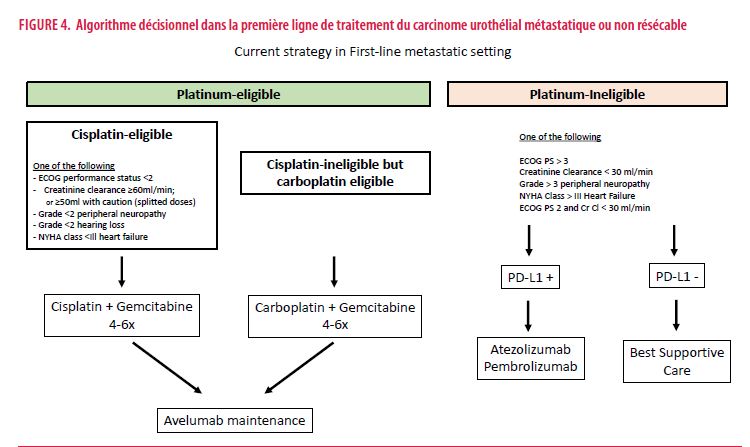
Avec les résultats de JAVELIN Bladder 100, le patient mUC jugé inéligible au cisplatine devrait recevoir un régime à base de carboplatine (4 à 6 cycles), puis de l’avelumab en maintenance. L’analyse en sous-groupe a montré un bénéfice en terme de survie à la fois chez les patients recevant un régime à base de cisplatine (réduction du risque de 31%) ou de carboplatine (réduction du risque de 34%). Cela suggère que, sur la base des critères d’éligibilité au cisplatine, les patients doivent être traités soit avec du cisplatine, soit avec du carboplatine, suivi d’un entretien par avelumab. La figure 4 résume la prise en charge thérapeutique du CU métastatique.
À la recherche de nouveaux biomarqueurs
L’immunothérapie est donc devenue un traitement standard dans le CU avancé.
Cependant, tous les patients ne répondent pas aux ICIs et, même si des patients présentent une réponse prolongée, in fine, la majorité des patients progressent. Il est donc important de trouver de nouvelles combinaisons, de nouvelles stratégies, …et des biomarqueurs efficaces dans la prédiction d’un réponse (ou non réponse) aux ICIs.
Même si les patients atteints d’une tumeur exprimant PD-L1 ont une plus grande chance de réponse aux ICI, une proportion non négligeable de patients PD-L1 négatifs bénéficient également de ces agents, soulignant la limitation clinique du PD-L1 comme biomarqueur. Ceci peut être expliqué par le fait que l’expression PD-L1 est dynamique et évolue avec le temps et les traitements administrés. De plus, en fonction de l’étude et de l’ICI utilisé, les critères de positivité de l’expression PD-L1 sont différents en raison d’un manque de standardisation; dans les études évaluant le nivolumab, l’expression PD-L1 sera évaluée sur les cellules immunitaires avec un taux de positivité de 1-5% alors qu’avec les études évaluant le pembrolizumab, l’expression sera évaluée sur les cellules tumorales et immunitaires avec un taux de positivité de 10%. D’autres biomarqueurs font actuellement l’objet d’évaluation tels que le TMB. Récemment, le Tumor Cancer Genome Atlas (TCGA) a identifié deux sous-ensembles moléculaires de CU (Cluster III et Cluster II) qui sont associés à une meilleure sensibilité aux ICIs, suggérant d’incorporer la signature moléculaire dans cette quête de biomarqueurs (20).
Recommandations pratiques
Dans un contexte de carcinome urothélial métastatique, la chimiothérapie première à base de platine (cisplatine ou carboplatine) reste le traitement standard à débuter, à raison de 4 à 6 cycles. L’immunothérapie est à débuter immédiatement, sans attendre la progression de la maladie, ce qui permet d’améliorer le pronostic de ces patients.
Il n’y a actuellement, hors étude, aucune indication d’immunothérapie dans le cancer urothélial localisé.
Affiliations
1 Departement d’oncologie médicale, Hopital de Jolimont, Haine Saint-Paul, Belgique
Correspondance
Pr. Emmanuel Seront MD PhD
Hopital de Jolimont
Departement d’oncologie médicale
Haine Saint-Paul, Belgique
Tel : +32 64 23 4166
emmanuel.seront@jolimont.be
Références
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7–30.
- Grossman HB, Natale RB, Tangen CM, Speights VO, Vogelzang NJ, Trump DL, et al. Neoadjuvant chemotherapy plus cystectomy compared with cystectomy alone for locally advanced bladder cancer. N Engl J Med. 2003;349:859–66.
- von der Maase H, Hansen SW, Roberts JT, Dogliotti L, Oliver T, Moore MJ, et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol. 2000;18:3068-77.
- Bellmunt J, Powles T, Vogelzang NJ. A review on the evolution of PD-1/PD-L1 immunotherapy for bladder cancer: The future is now. Cancer Treat Rev. 2017;54:58-67.
- Sharma P, Shen Y, Wen S, Yamada S, Jungbluth AA, Gnjatic S, et al. CD8 tumor-infiltrating lymphocytes are predictive of survival in muscle-invasive urothelial carcinoma. Proc Natl Acad Sci U S A. 2007;104:3967-72.
- Necchi A, Raggi D, Gallina A, Madison R, Colecchia M, Lucianò R, et al. Updated Results of PURE-01 with Preliminary Activity of Neoadjuvant Pembrolizumab in Patients with Muscle-invasive Bladder Carcinoma with Variant Histologies. Eur Urol. 2020;77:439-446.
- Powles T, Kockx M, Rodriguez-Vida A, Duran I, Crabb S, Van Der Heijden M et al. Clinical efficacy and biomarker analysis of neoadjuvant atezolizumab in operable urothelial carcinoma in the ABACUS trial. Nat Med. 2019;25:1706–1714
- Gupta S, Sonpavde G, Weight CJ, McGregor BA, Gupta S, Maughanet BL et al. Results from BLASST-1 (Bladder Cancer Signal Seeking Trial) of nivolumab, gemcitabine, and cisplatin in muscle invasive bladder cancer (MIBC) undergoing cystectomy.J Clin Oncol.2020;38(suppl 6; abstr 439)
- Bellmunt J, Hussain M, Gschwend JE, Albers P, Oudard S, Castellano D, et al. IMvigor010 Study Group. Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2021;22(4):525-537.
- Bajorin DF, Witjes JA, Gschwend JE, Schenker M, Valderrama BP, Tomita Y, et al. Adjuvant Nivolumab versus Placebo in Muscle-Invasive Urothelial Carcinoma. N Engl J Med. 2021;384(22):2102-2114.
- Galsky MD, Chen GJ, Oh WK, Bellmunt J, Roth BJ, Petrioli R, et al. Comparative effectiveness of cisplatin-based and carboplatin-based chemotherapy for treatment of advanced urothelial carcinoma. Ann Oncol. 2012;23:406-10.
- Bellmunt J, Necchi A, De wit R, Lee JL, Fong L, Vogelzang NJ, et al. Pembrolizumab (pembro) versus investigator’s choice of paclitaxel, docetaxel, or vinflunine in recurrent, advanced urothelial cancer (UC): 5-year follow-up from the phase 3 KEYNOTE-045 trial. J Clin Oncol. 2021;39:4532-32.
- Powles T, Durán I, van der Heijden MS, Loriot Y, Vogelzang NJ, De Giorgi U, et al. Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211): a multicentre, open-label, phase 3 randomised controlled trial. Lancet. 2018;391:748-57.
- P, Retz M, Siefker-Radtke A, Baron A, Necchi A, Bedke J, et al. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. Lancet Oncol. 2017;18:312-22.
- Galsky MD, Arranz Arija JA, Bamias A, Davis ID, De Santis M, Kikuchi E, et al. Atezolizumab with or whithout chemotherapy in metastatic urothelial cancer (IMvigor130) : a multicentre, randomised, placebo-controlled phase 3 trial. Lancet. 2020;395:1547-57.
- Powles T, Csoszi M, Ozguroglu Matsurbara N, Géczil L, Cheng SYS, et al. Pembrolizumab alone or combined with chemotherapy versus chemotherapy as first-line therapy for advanced urothelial carcinoma (KEYNOTE-361): a randomised, open-label, phase 3 trial. Lancet Oncol .2021;22:931-45.
- Rosenberg JE, Galsky MD, Balar AV, Loriot Y, Necchi A, Hoffman-Censits J et al. Atezolizumab monotherapy in cisplatin-ineligible patients with previously untreated metastatic urothelial carcinoma: 5-year response and survival analysis from the phase II IMvigor210 study (cohort 1). Annals of Oncology. 2021;32:S678-S724.
- Balar AV, Castellano D, O’Donnell PH, Grivas P, Vuky J, Powles T, et al. First-line pembrolizumab in cisplatin-ineligible patients with locally advanced and unresectable or metastatic urothelial cancer (KEYNOTE-052): a multicentre, single-arm, phase 2 study. Lancet Oncol. 2017;18(11):1483-1492.
- Powles T, Park SH, Voog E, Caserta C, Valderrama BP, Gurney H, et al. Avelumab maintenance therapy for advanced or metastatic urothelial carcinoma. N. Engl. J. Med. 2020; 383:1218–30
- Powles T, Walker J, Williams JA, Bellmunt J. The evolving role of PD-L1 testing in patients with metastatic urothelial carcinoma. Canc Treat Rev. 2020;82:1019-25