Recommandations pratiques
- Il existe désormais une dénomination claire pour la maladie stéatosique du foie avec des critères diagnostiques pour la MASLD et l’ALD qui sont les deux pathologies hépatiques les plus fréquentes.
- Il est important de reconnaître les facteurs de risque et de questionner la consommation d’alcool. L’association d’alcool et de critères cardio-métaboliques (MetALD) constitue un facteur de risque.
- La présence d’une stéatohépatite (sous-groupe de patients), plus que d’une stéatose simple, entraîne un risque de complications. En cas de stéatose, un algorithme de dépistage de la fibrose est donc recommandé se basant en première intention sur le calcul du score FIB-4.
Première cause de cirrhose, les maladies hépatiques stéatosiques bénéficient désormais de critères diagnostiques clairs. Sans prise en charge, elles peuvent évoluer vers des maladies hépatiques sévères et entraîner des complications extra-hépatiques. Il est donc important de parler le même langage pour les diagnostiquer et de connaître leur évolution naturelle ainsi que de pouvoir estimer leur sévérité pour donner des informations appropriées au patient et les prendre en charge.
Maladie stéatosique du foie : MASLD, ALD, MetALD : de quoi s’agit-il ?
Jusqu’en juin 2023 où plusieurs sociétés scientifiques se sont enfin mises d’accord pour un consensus, il existait des dénominations peu claires pour décrire et diagnostiquer les différents types de maladies hépatiques stéatosiques (1). Jusqu’alors, les termes « maladie alcoolique du foie », « hépatite alcoolique », « hépatite alcoolique aiguë » étaient utilisés pour faire référence aux pathologies hépatiques liées à l’alcool et les termes « stéatohépatite non-alcoolique », « NAFLD », « NASH » … étaient employés pour signifier un diagnostic de maladie hépatique stéatosique qui survenait chez un individu ne consommant pas ou peu d’alcool et chez qui les autres causes de maladie chronique du foie avaient été exclues. Il est en effet important de noter que l’introduction d’aliments riches en fructose dans les années 1960 coïncide avec l’incidence d’obésité (qui a triplé de 1975 à 2018), de diabète et de syndrome métabolique. Les termes NAFLD et NASH avec la description histologique et le risque de cirrhose qui y sont liés ont été proposés en 1980 par Jurgen Ludwig, pathologiste de la Mayo Clinic, suite à la description de 20 patients présentant une stéatohépatite de cause inconnue, ressemblant à l’alcool et pouvant évoluer vers une cirrhose (3 cas sur les 20 décrits). La plupart des patients de cette série présentaient une obésité et un diabète (2).
Quarante ans plus tard, en 2020, grâce à l’impulsion de Jacob George, hépatologue australien, un panel d’experts internationaux a proposé une nouvelle définition pour la stéatose d’origine dysmétabolique, qui, devenant si fréquente et à la physiopathologie et aux facteurs de risque désormais connus, méritait désormais une appellation claire et des critères positifs. Le terme « MAFLD » pour « metabolic dysfunction-associated fatty liver disease » a donc vu le jour pour remplacer les termes « NAFLD » et « NASH » et désigner une stéatose chez une personne en surpoids ou avec un diabète de type 2 ou des critères de syndrome métabolique. Ceci a été apprécié par de nombreux scientifiques (3) et critiqué par d’autres. Les points négatifs étaient principalement l’absence de consensus issu de plusieurs sociétés scientifiques, le terme « fatty » qui pouvait être perçu comme stigmatisant, l’absence de dénomination pour la forme sévère auparavant appelée « NASH ou stéatohépatite non-alcoolique » qui fait l’objet de nombreuses recherches, y compris de traitements et le fait que certaines personnes, bien qu’en surpoids ou atteintes d’un diabète de type 2, consomment également des boissons alcoolisées.
Un large travail de consensus a donc été mené, s’intéressant à classer et correctement nommer l’ensemble des maladies hépatiques stéatosiques. Les résultats ont été communiqués en juin 2023 et publiés en décembre 2023 (1).
La maladie stéatosique du foie (SLD) peut désormais être diagnostiquée à l’imagerie ou définie histologiquement (Figure 1). Elle peut être liée à l’alcool (ALD) en cas de consommation importante de boissons alcoolisées (♂ >3 verres/jour, ♀ >2 verres/jour), d’origine mixte (MetALD) en cas de critère cardio-métabolique et d’alcool (♂ 3-6 verres/jour, ♀ 2-5 verres/jour), liée à une dysfonction métabolique (MASLD) en cas de présence d’au-moins un critère cardio-métabolique (Table) ou liée à une étiologie spécifique, comme une hépatite médicamenteuse, une hépatite virale C (principalement de génotype 3), un déficit en alpha1-anti-trypsine, une maladie cœliaque, une maladie de Wilson… À noter qu’en cas de forte consommation d’alcool (♂ ≥7 verres/jour, ♀ ≥6 verres/jour), les patients sont classés dans la catégorie ALD même en présence d’un critère cardio-métabolique (Figure 1).
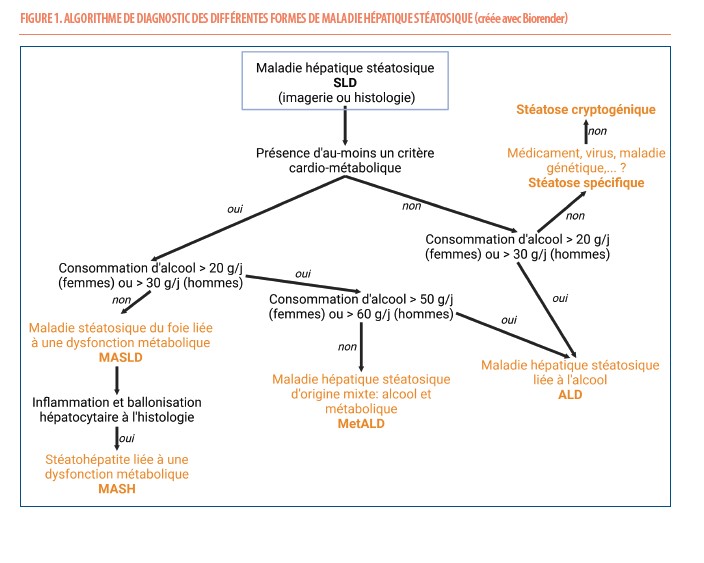
Le groupe MetALD correspond à une réalité de patients mêlant critère cardio-métabolique et consommation d’alcool, parfois « bon-vivants ». Il met en évidence un risque accru de maladie sévère du foie en présence de ces deux cofacteurs qu’il convient d’évaluer (4). Il est toutefois important de souligner qu’il faut rester attentif car les critères cardio-métaboliques (Table) sont très larges. Plus de 90% des individus de plus de 45 ans présentent en effet au-moins un critère cardio-métabolique. Ceci pourrait mener à un grand nombre de diagnostics de MASLD si la consommation d’alcool n’était pas quantifiée de manière systématique ou si des causes plus rares de maladie hépatique ne sont pas recherchées en cas de profil biologique ou clinique suggestif (5). Il est important de noter qu’une consommation importante d’alcool peut entraîner des maladies cardio-vasculaires, une hypertriglycéridémie et une hypertension artérielle. Toute perturbation des tests hépatiques (par exemple, hépatite aiguë ou cholestase) ne doit donc pas être interprétée comme une MASLD uniquement même si le radiologue suggère la présence d’une stéatose et qu’un critère cardio-métabolique est présent. Par ailleurs, de très nombreux cas de maladies mixtes existent en effet et il n’est pas rare de découvrir sur une biopsie hépatique une hépatite auto-immune ou une hépatite virale B coexistant avec une stéatose métabolique (5). Face à cette nouvelle nomenclature, il est donc utile de garder notre esprit critique afin de ne pas restreindre toutes les perturbations de tests hépatiques aux seules MASLD, ALD ou MetALD.

L’évolution de la maladie hépatique stéatosique
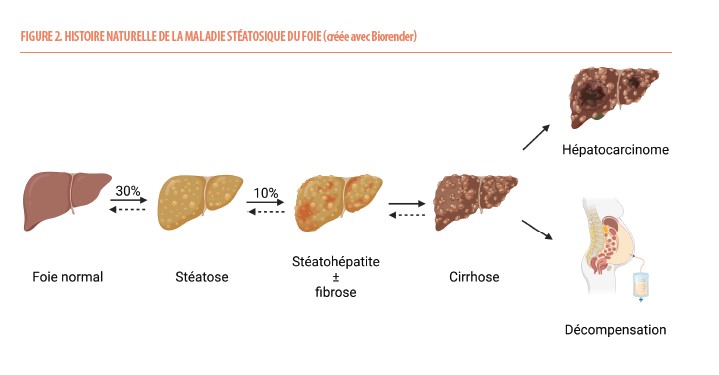
Actuellement, dans le monde, il y a environ 40% des individus adultes en surpoids, 16% avec une obésité et 6% avec un diabète. Par ailleurs, 50% de la population consomment de l’alcool régulièrement et 16% ont une consommation problématique d’alcool. Plus de 30% de la population présente donc une SLD avec des différences selon les régions du monde en fonction des habitudes de vie (6). Toutefois, seule une minorité de personnes présentant une SLD évolue vers une maladie sévère (Figure 2). Ceci est lié à l’inflammation hépatique et à la souffrance hépatocytaire qui peuvent être associées à la stéatose et résulter en l’apparition de fibrose progressive. Dans un contexte métabolique, l’association d’inflammation lobulaire et de ballonisation hépatocytaire à l’histologie constitue le diagnostic de stéatohépatite liée à une dysfonction métabolique (MASH) (Figures 1 et 2). En raison du risque lié à cette maladie, c’est bien la MASH fibrosante qui fait l’objet d’études médicamenteuses (7).Des facteurs de risque, notamment génétiques, expliquent une disparité dans l’évolution de cette maladie (8). La prédisposition génétique majeure à développer une MASLD repose sur un variant d’un seul nucléotide dans le gène PNPLA3, codant pour la protéine adiponutrine (impliquée dans le métabolisme au sein de la gouttelette lipidique). Le portage de ce variant entraîne l’accumulation de graisse au niveau hépatique, favorise l’apparition de MASH, de fibrose et d’hépatocarcinome. La fréquence de ce variant délétère est d’environ 25% dans la population et en accord avec la prévalence de la stéatose hépatique dans les différents groupes ethniques : 57% chez les Hispaniques, 38% chez les Asiatiques, 23% chez les Européens et 14% chez les Africains (8). Suite à l’évolution de la fibrose hépatique progressive, une cirrhose est possible (Figure 2). La cirrhose est la 11e cause de décès dans le monde et 2 à 4% des décès sont attribués à une cirrhose (6). En cas de cirrhose, il existe un risque de décompensation hépatique ou d’hépatocarcinome (Figure 2). Certains hépatocarcinomes peuvent également apparaître avant le développement d’une cirrhose. En cas de MASLD, il faut également noter que les maladies cardiovasculaires sont la principale cause de décès suivies des cancers non-hépatiques. Il existe un lien entre la sévérité de la MASLD (MASH, fibrose) et le risque cardio-vasculaire. La présence d’une MASLD prédispose également au développement d’un diabète de type 2 (9). Le foie stéatosique est en effet plus résistant à l’insuline (ce qui participe à une production hépatique de glucose non-contrôlée) et sécrète des hépatokines capables d’induire une insulinorésistance à distance du foie (dans le tissu adipeux et les muscles squelettiques) (10). Le risque de maladie cardio-vasculaire et celui de cancer augmentent également avec la consommation d’alcool (6).
Diagnostic de la maladie stéatosique du foie
La maladie stéatosique du foie est la plupart du temps asymptomatique et découverte sur une prise de sang de routine ou une imagerie réalisée pour une autre raison. En cas de découverte fortuite de stéatose hépatique, il est recommandé d’évaluer la cause de SLD (métabolique, alcool, mixte ou spécifique éventuellement en fonction du contexte) ainsi que de déterminer la présence éventuelle d’une fibrose avancée, car cela peut avoir un impact sur le risque de complication hépatique ou extra-hépatique (maladie cardio-vasculaire, diabète) (11).
La quantification de la prise d’alcool par jour et par semaine est capitale. Ceci peut prendre du temps en consultation mais il est important de ne pas trop vite classer un patient dans le groupe MASLD en cas de présence juste d’un critère cardio-métabolique (cf supra). Cet interrogatoire systématique nécessite de l’empathie. Cette consommation doit également être ré-évaluée au cours du temps car les comportements peuvent changer suite à des épisodes de vie, des difficultés ou des événements de société (6).
Une perturbation des tests hépatiques peut permettre de suspecter la présence d’une SLD. Le profil de celle-ci est évocateur : les transaminases ALT et AST sont modérément élevées et associées à une élévation isolée des gGT en cas de MASLD avec des ALT supérieures aux AST. Une cholestase enzymologique (élévation conjointe des gGT et des phosphatases alcalines) doit faire rechercher d’autres diagnostics mais peut être toutefois présente en cas de cirrhose ou de MASLD sévère. Une élévation plus importante des AST que les ALT évoque soit une cirrhose (peu importe la cause) ou une ALD (12). Le profil ALT/AST s’inverse donc avec la progression de la fibrose, peu importe la cause de la maladie (12). Une ALD est également évoquée en cas de macrocytose ou de thrombopénie par toxicité directe de l’alcool. Il est également important de noter qu’une SLD, même au stade de fibrose ou de cirrhose, est possible sans élévation des transaminases. Une hyperferritinémie (avec saturation normale de la transferrine), d’origine dysmétabolique ou liée à l’alcool, est également un motif fréquent de découverte de SLD. En cas de perturbation chronique des tests hépatiques, un dépistage standard de l’étiologie doit également comprendre une échographie abdominale, l’antigène de surface de l’hépatite B, l’anticorps de l’hépatite C, les anticorps anti-mitochondries (en cas de cholestase), les immunoglobulines sériques, le taux de céruloplasmine chez les personnes de moins de 40 ans, les taux d’alpha 1-antitrypsine et le taux de ferritine et de saturation de la transferrine, afin d’exclure d’autres causes de maladie chronique du foie qu’une SLD. Enfin, au stade de cirrhose, plusieurs éléments cliniques ou biologiques peuvent participer au diagnostic comme une thrombopénie liée à l’hypertension portale ou l’insuffisance hépatique, une élévation de la bilirubine, de l’INR, une hypoalbuminémie, des œdèmes ou de l’ascite en cas de maladie décompensée.
Une quantification de la stéatose peut être réalisée en calculant l’index de foie gras (Fatty Liver Index ou FLI) sur base de critères cliniques (indice de masse corporelle, périmètre abdominal) et biologiques (gGT, triglycérides) de conforter l’hypothèse d’une stéatose. La mesure de l’atténuation de l’onde ultrasonore (Controlled Attenuation Parameter ou CAP) disponible sur le Fibroscan® permet aussi une estimation chiffrée de la quantité de graisse dans le foie. La « Resonance Imaging Proteon Density Fat Fraction (MRI-PDFF) » procure une estimation encore plus fiable mais elle nécessite un examen de résonance magnétique. Toutefois, une quantification précise de la stéatose a peu d’intérêt étant donné le fait que les risques de la MASLD résident principalement dans la présence d’inflammation. Comme il n’existe à ce jour aucun moyen non-invasif satisfaisant permettant de suspecter la présence d’une MASH, il est donc recommandé d’estimer en première intention la fibrose indirectement par un score simple (13).
En effet, idéalement, la sévérité de la maladie devrait être dépistée précocement. Cependant, de nombreux cas de SLD sont encore diagnostiqués aux urgences face à une cirrhose décompensée. Face aux nombreux cas potentiels de MASLD, un algorithme simple a été développé pour rechercher la présence d’une fibrose hépatique dans les groupes à risque (syndrome métabolique, obésité, diabète de type 2). Il se base sur le profil des transaminases qui évolue selon le degré de fibrose avec pour rappel, un profil ALT/AST qui s’inverse et l’apparition d’une thrombopénie (cf supra). Prenant en compte 4 paramètres simples (l’âge, les AST, les ALT et les plaquettes), le score recommandé est dénommé score FIB-4 et est aisément calculable avec la formule reprise (Figure 3) (11). Des calculateurs automatiques existent également sur internet gratuitement. Bien qu’il ne soit pas idéal pour un dépistage fin, il convient pour un dépistage à large échelle. Il est recommandé de réaliser un bilan complémentaire par élastométrie transitoire (Fibroscan®) en cas de FIB-4 supérieur à 1.3 (supérieur à 2 après 65 ans) (11). Un FIB-4 inférieur à 1.3 est en effet associé à un faible risque de complications hépatiques. L’élastométrie transitoire (Fibroscan®) qui étudie la propagation d’une onde de choc de faible amplitude à travers le parenchyme hépatique constitue en effet la technique la plus validée dans l’indication MASLD/MASH (13). Le calcul d’un autre score appelé Enhanced liver Fibrosis (ELF) est également possible si le Fibroscan® n’est pas disponible. Ce marqueur de fibrose est calculé à partir d’un algorithme basé sur la mesure de trois biomarqueurs sériques impliqués dans le renouvellement de la matrice extracellulaire : l’acide hyaluronique (HA), le peptide N-terminal du procollagène III (PIIINP) et l’inhibiteur tissulaire de la métalloprotéinase matricielle-1 (TIMP-1) (11). Ils ne sont toutefois pas dosés en routine et l’utilisation de la formule pour le calcul du score est payant.
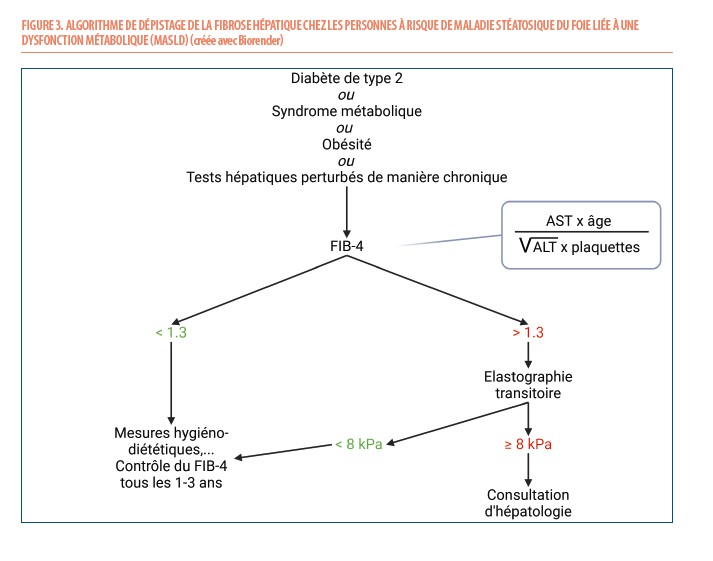
Le dépistage de la fibrose chez les patients MASLD permet d’orienter les patients à risque vers l’hépatologue pour permettre une prise en charge thérapeutique et un suivi adéquats. La réalisation d’une biopsie hépatique ne sera réservée qu’aux diagnostics incertains, aux suspicions de maladies fibrosantes pour établir un score précis et permettre un suivi approprié ou l’inclusion du patient dans un protocole thérapeutique (13).
Les résultats de l’élastométrie transitoire sont également bien corrélés à la fibrose hépatique en cas d’ALD (14). Il est important de noter que le dépistage de cette fibrose hépatique a été montré comme efficace pour augmenter l’abstinence en boissons alcoolisées dans une population de personnes présentant une dépendance aux boissons alcoolisées (15).
Conclusion
Il existe désormais une dénomination claire et appropriée pour la maladie stéatosique du foie, prenant en compte les causes fréquentes et parfois associées (MetALD). Des complications sérieuses sont possibles dans une minorité de cas et justifient un dépistage des patients à risque par une attitude simple alliant scores clinico-biologiques dans un premier temps (à répéter), élastométrie si nécessaire et prise en charge spécialisée selon la sévérité. Celle-ci inclura la prise en charge des facteurs de risque, des mesures hygiéno-diététiques et un suivi éventuel. Dans le cadre de la MASH fibrosante, des traitements pourraient être disponibles prochainement, réservés aux formes sévères, afin d’éviter l’apparition de cirrhose et réduire la nécessité de transplantation hépatique (6).
Références
- Rinella ME, Lazarus J V., Ratziu V, et al. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. J Hepatol. 2023;79(6):1542–56.
- Lanthier N, Vanuytsel T. Metabolic dysfunction-associated fatty liver disease: A new clearer nomenclature with positive diagnostic criteria. Acta Gastroenterol Belg. 2020;83(4):513–5.
- Méndez-Sánchez N, Bugianesi E, Gish RG, et al. Global multi-stakeholder endorsement of the MAFLD definition. Lancet Gastroenterol Hepatol. 2022;7(5):388–90.
- Binet Q, Loumaye A, Hermans MP, Lanthier N. A Cross-sectional Real-life Study of the Prevalence, Severity, and Determinants of Metabolic Dysfunction-associated Fatty Liver Disease in Type 2 Diabetes Patients. J Clin Transl Hepatol. 2023;11(6).
- Henin G, Baldin P, Frans C, et al. Metabolic dysfunction-associated steatotic liver disease : the tree that hides the forest? Acta Gastro Enterologica Belgica. 2024;87(2):344–5.
- Israelsen M, Francque S, Tsochatzis EA, Krag A. Steatotic liver disease. Lancet. 2024;404(10464):1761–78.
- Lanthier N. New therapies in non-alcoholic steatohepatitis | Les nouveaux traitements de la stéatohépatite non-alcoolique. Nutr Clin Metab. 2020;34(3):216–22.
- Lanthier N. Physiopathologie de la NASH: de nouveaux facteurs de risque identifiés ? Louvain Med. 2020;139(7):405–10.
- Binet Q, Loumaye A, Preumont V, Thissen JP, Hermans MP, Lanthier N. Non-invasive screening, staging and management of metabolic dysfunction-associated fatty liver disease (MAFLD) in type 2 diabetes mellitus patients: what do we know so far? Acta Gastroenterol Belg. 2022;85(2):346–57.
- Lanthier N, Lebrun V, Molendi-Coste O, van Rooijen N, Leclercq IA. Liver Fetuin-A at Initiation of Insulin Resistance. Metabolites. 2022;12(11):1023.
- Tacke F, Horn P, Wai-Sun Wong V, et al. EASL–EASD–EASO Clinical Practice Guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD). J Hepatol. 2024;81(3):492–542.
- Bale G, Clarembeau F, Stärkel P, Dahlqvist G, Horsmans Y, Lanthier N. Patients with chronic liver diseases are at risk for diabetes even before development of cirrhosis. Clin Res Hepatol Gastroenterol. 2024;48(8):102428.
- Lanthier N. La NASH en 2018. Louvain Med. 2018;137(5):308–13.
- Salavrakos M, Piessevaux H, Komuta M, Lanthier N, Stärkel P. Fibroscan Reliably Rules Out Advanced Liver Fibrosis and Significant Portal Hypertension in Alcoholic Patients. J Clin Gastroenterol. 2019;53(10).
- Avitabile E, Gratacós-Ginès J, Pérez-Guasch M, et al. Liver fibrosis screening increases alcohol abstinence. JHEP Reports. 2024;6(10):101165.
Affiliations
1. Service d’Hépato-Gastroentérologie, Cliniques universitaires Saint-Luc, UCLouvain, Bruxelles, Belgique.
2. Laboratoire d’Hépato-Gastroentérologie, Université catholique de Louvain, Bruxelles, Belgique.
Correspondance
Pr Nicolas Lanthier, MD, PhD
Service d’Hépato-Gastroentérologie,
Cliniques universitaires Saint-Luc, UCLouvain
Avenue Hippocrate, 10
B-1200 Bruxelles
02/764.28.22
nicolas.lanthier@saintluc.uclouvain.be