Observation clinique : manifestations du COVID-19 d’origine tubulaire ?
La pandémie de COVID-19 a un impact sanitaire et socio-économique majeur. L’infection affecte principalement les poumons et est caractérisée par une importante variabilité inter-individuelle dont les déterminants restent peu connus. Identifier les personnes à risque de développer les formes les plus sévères est capital pour assurer un suivi optimal et une prise en charge adéquate. La COVID-19 affecte potentiellement d’autres organes, tels le cœur, le tube digestif, la peau, les organes sensoriels, et les reins (1). Cette atteinte multi-systémique pourrait refléter l’expression dans ces différents organes de l’angiotensin converting enzyme 2 (ACE2), le récepteur permettant l’internalisation du virus dans les cellules.
Au plus fort de la pandémie, les néphrologues des Cliniques universitaires Saint-Luc ont été interpellés par une prévalence élevée de taux sanguins anormalement bas d’acide urique (hypouricémie), associés à un défaut de réabsorption tubulaire et à une protéinurie modérée, présents dès l’admission en salle d’urgence. L’expression du récepteur ACE2 au niveau des cellules tubulaires proximales ; les premiers rapports histologiques décrivant des lésions tubulaires étendues ; et le possible tropisme rénal du virus (2-4) suggéraient que ces manifestations pourraient résulter d’une atteinte spécifique du tube proximal au cours de l’infection à SARS-CoV-2.
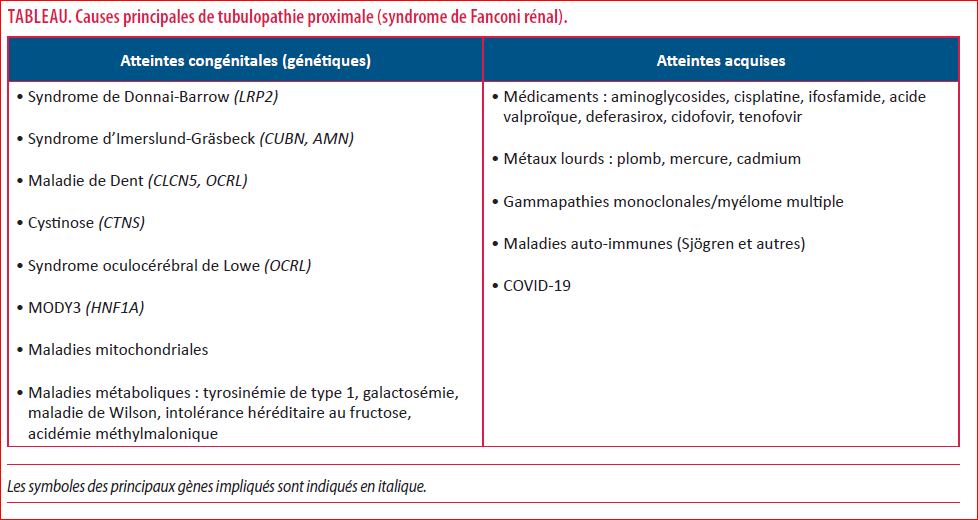
Le tube proximal du rein réabsorbe une quantité importante d’ions, de solutés et de protéines de bas poids moléculaire filtrés par le glomérule (5). Cette fonction vitale dépend de la différentiation cellulaire et de l’expression de récepteurs multi-ligands (p.ex. mégaline) et systèmes de transport (e.a. URAT1, pour l’acide urique ; NaPi-IIa/c, pour le phosphore ; B0AT1, pour certains acides aminés) dans la bordure en brosse. L’importance des fonctions du tubule proximal est illustrée par la perte inappropriée de solutés dans les urines (syndrome de Fanconi rénal) causée par diverses maladies congénitales ou acquises (Tableau) (5). La caractéristique la plus constante de ces tubulopathies proximales est la perte de protéines de bas poids moléculaire (p.ex. β2-microglobuline) dans les urines (6).
Le SARS-CoV-2 cause une dysfonction du tube proximal du rein
Afin de tester l’hypothèse d’une tubulopathie proximale associée à la COVID-19, nous avons recherché la présence d’anomalies biologiques caractéristiques dans une cohorte de 49 patients (âge médian 64 ans, 69% d’hommes) infectés par le SARS-CoV-2 et hospitalisés aux Cliniques universitaires Saint-Luc en mars et avril 2020 (7). Ces analyses ont confirmé la présence d’une protéinurie d’origine tubulaire (médiane, 0.7 g/g créatinine, normale <0.2) chez 80% des patients (Figure 1A), associée à une fuite tubulaire d’acide urique (18/39, 46%) et de phosphore (6/32, 19%), sans perte urinaire de glucose. Certains patients (6/13, 46%) présentaient également une fuite urinaire d’acides aminés neutres, ressemblant à l’aminoacidurie de la maladie de Hartnup. La maladie de Hartnup est une maladie ultra-rare, causée par des mutations récessives du gène SLC6A19, codant pour le transporteur d’acides aminés neutres B0AT1 (8). De façon intéressante, le récepteur ACE2 facilite l’expression de B0AT1 dans la membrane apicale des cellules tubulaires, et donc son fonctionnement (9).
Ces anomalies biologiques sont associées à des lésions structurelles du tube proximal à l’examen post-mortem de reins de patients décédés du COVID-19. L’analyse histologique montre la présence constante de signes de souffrance tubulaire, avec de la nécrose et une perte de la bordure en brosse du tubule proximal, ainsi qu’une réduction importante (50%) de l’expression du récepteur mégaline à ce niveau (Figure 1B). L’analyse en microscopie électronique de certains de ces prélèvements a révélé la présence de particules inhabituelles, ayant toutes les caractéristiques du coronavirus, dans les cellules tubulaires (Figure 1C). Ces résultats suggèrent que le SARS-CoV-2 infecte directement les cellules du tube proximal via le récepteur ACE2, causant une dysfonction tubulaire proximale caractérisée par la fuite de de protéines et de solutés dans les urines (Figure 1D).

Ces observations établissent donc que l’infection à SARS-CoV-2 cause une dysfonction spécifique du tube proximal, une observation confirmée de manière indépendante par des équipes chinoise et française (10,11) (Tableau). Les stigmates biologiques qui la caractérisent – en particulier l’hypouricémie - sont associés à des formes plus sévères de COVID-19 et à un risque accru de progression vers l’insuffisance respiratoire et le besoin de mise au respirateur, suggérant leur utilité potentielle comme biomarqueurs (7).
Conclusions
L’infection à SARS-CoV-2 cause fréquemment une dysfonction du tube proximal du rein, caractérisée par une protéinurie de bas poids moléculaire, une fuite tubulaire d’acide urique et de phosphore, et une aminoacidurie neutre. Ces anomalies, indépendantes des comorbidités, des médications ou de la charge virale, sont associées à une évolution vers des formes plus sévères de COVID-19 et le besoin de ventilation mécanique invasive. Ce tableau de tubulopathie est reflété par des lésions structurelles avec altération de l’expression de récepteurs et transporteurs et la présence de particules virales à l’intérieur des cellules du tube proximal, supportant l’hypothèse d’une infection directe des cellules tubulaires par le SARS-CoV-2.
Affiliations
1 Services de Néphrologie et de 2 Maladies Infectieuses, Cliniques universitaires Saint-Luc, B-1200 Bruxelles
3 Institut de Recherche Expérimentale et Clinique, UCLouvain, B-1200 Bruxelles
4 Mechanisms of Inherited Kidney Disorders Group, Université de Zurich, Zurich
Remerciements
Nous remercions les collègues impliqués dans ce travail, et en particulier : Marie Perrot, Gregory Schmit, Selda Aydin, Andrea Penaloza, Julien De Greef, Halil Yildiz, Lucie Pothen, Jean Cyr Yombi, Joseph Dewulf, Anais Scohy, Ludovic Gérard, Xavier Wittebole, Pierre-François Laterre, Sara E. Miller, Yvette Cnops, Sébastien Druart, Huguette Debaix, et Caroline Bouzin. Nous remercions également toutes les personnes ayant participé et participant à la prise en charge des patients COVID-19 aux Cliniques universitaires Saint-Luc.
Ce travail a été financé en partie par le Fonds National pour la Recherche Scientifique, la Fondation Saint-Luc et le programme URPP-ITINERARE de l’Université de Zurich.
Références
- Gupta A, Madhavan MV, Sehgal K, Nair N, Mahajan S, Sehrawat TS, Bikdeli B, Ahluwalia N, Ausiello JC, Wan EY, Freedberg DE, Kirtane AJ, Parikh SA, Maurer MS, Nordvig AS, Accili D, Bathon JM, Mohan S, Bauer KA, Leon MB, Krumholz HM, Uriel N, Mehra MR, Elkind MSV, Stone GW, Schwartz A, Ho DD, Bilezikian JP, Landry DW. Extrapulmonary manifestations of COVID-19. Nat Med. 2020 Jul;26(7):1017-1032. doi: 10.1038/s41591-020-0968-3.
- Vijayan A, Humphreys BD. SARS-CoV-2 in the kidney : bystander or culprit. Nat Rev Nephrol 2020, in press. doi : 10.1038/s41581-020-00354-7.
- Puelles VG, Lütgehetmann M, Lindenmeyer MT, Sperhake JP, Wong MN, Allweiss L, Chilla S, Heinemann A, Wanner N, Liu S, Braun F, Lu S, Pfefferle S, Schröder AS, Edler C, Gross O, Glatzel M, Wichmann D, Wiech T, Kluge S, Pueschel K, Aepfelbacher M, Huber TB. Multiorgan and Renal Tropism of SARS-CoV-2. N Engl J Med. 2020 Aug 6;383(6):590-592. doi: 10.1056/NEJMc2011400.
- Braun F, Lütgehetmann M, Pfefferle S, Wong MN, Carsten A, Lindenmeyer MT, Nörz D, Heinrich F, Meißner K, Wichmann D, Kluge S, Gross O, Pueschel K, Schröder AS, Edler C, Aepfelbacher M, Puelles VG, Huber TB. SARS-CoV-2 renal tropism associates with acute kidney injury. Lancet. 2020 Aug 29;396(10251):597-598. doi: 10.1016/S0140-6736(20)31759-1.
- van der Wijst J, Belge H, Bindels RJM, Devuyst O. Learning Physiology From Inherited Kidney Disorders. Physiol Rev. 2019 Jul 1;99(3):1575-1653. doi: 10.1152/physrev.00008.2018.
- Chen Z, Luciani A, Mateos JM, Barmettler G, Giles RH, Neuhauss SCF, Devuyst O. Transgenic zebrafish modeling low-molecular-weight proteinuria and lysosomal storage diseases. Kidney Int. 2020 Jun;97(6):1150-1163. doi: 10.1016/j.kint.2019.11.016.
- Werion A, Belkhir L, Perrot M, Schmit G, Aydin S, Chen Z, Penaloza A, De Greef J, Yildiz H, Pothen L, Yombi JC, Dewulf J, Scohy A, Gérard L, Wittebole X, Laterre PF, Miller SE, Devuyst O, Jadoul M, Morelle J; CUSL COVID-19 Research Group. SARS-CoV-2 Causes a Specific Dysfunction of the Kidney Proximal Tubule. Kidney Int. 2020 Aug 10:S0085-2538(20)30912-1. doi: 10.1016/j.kint.2020.07.019.
- Kleta R, Romeo E, Ristic Z, Ohura T, Stuart C, Arcos-Burgos M, Dave MH, Wagner CA, Camargo SR, Inoue S, Matsuura N, Helip-Wooley A, Bockenhauer D, Warth R, Bernardini I, Visser G, Eggermann T, Lee P, Chairoungdua A, Jutabha P, Babu E, Nilwarangkoon S, Anzai N, Kanai Y, Verrey F, Gahl WA, Koizumi A. Mutations in SLC6A19, encoding B0AT1, cause Hartnup disorder. Nat Genet. 2004 Sep;36(9):999-1002. doi: 10.1038/ng1405.
- Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 2020 Mar 27;367(6485):1444-1448. doi: 10.1126/science.abb2762.
- Liu L, He F, Cai SS, Hu KL, Yu C, Huang Y, Zeng R, Xu G. Clinical characteristics of hospitalized patients with 2019 novel coronavirus disease indicate potential proximal tubular dysfunction. Chin Med J (Engl). 2020 Aug 20;133(16):1983-1985. doi: 10.1097/CM9.0000000000000945.
- Kormann R, Jacquot A, Alla A, Corbel A, Koszutski M, Voirin P, Garcia Parrilla M, Bevilacqua S, Schvoerer E, Gueant JL, Namour F, Levy B, Frimat L, Oussalah A. Coronavirus disease 2019: acute Fanconi syndrome precedes acute kidney injury. Clin Kidney J. 2020 Jun 8;13(3):362-370. doi: 10.1093/ckj/sfaa109.