Introduction
L’accident vasculaire cérébral (AVC) peut se présenter sous forme de différents tableaux cliniques, dont le locked-in-syndrome (LIS), pathologie neurologique rare, en particulier dans la population pédiatrique. Nous décrivons ici le cas d’un jeune garçon de 6 ans, développant un tableau de LIS, secondaire à un accident vasculaire ischémique post-varicelle (PVCI) du tronc cérébral. Nous aimerions également attirer l’attention sur la vasculopathie post-varicelle, complication pouvant survenir dans le décours de cette maladie infantile fréquente.
Si le premier cas de LIS fut décrit dans la littérature par Plum et Posner en 1966 (1), ce n’est qu’en 1974 que le premier cas pédiatrique fut décrit par Latchaw et al. (2) Cinq critères cliniques le caractérisent : (1) persistance de l’ouverture des yeux et présence de mouvements oculaires verticaux; (2) fonctions corticales supérieures préservées ; (3) aphonie ou hypophonie sévère ; (4) tétraplégie ou tétraparésie; (5) mode de communication initial consistant en clignements des paupières ou mouvements oculaires verticaux (3).
La rareté de ce tableau clinique en pédiatrie en fait un diagnostic difficile à poser. Les soins à ce type de patient et la réadaptation représentent un réel défi. Le pronostic et la qualité de vie en dépendent.
Vignette clinique
Un garçon de 6 ans, sans antécédents médicaux particuliers, à l’exception d’une varicelle à l’âge de 5 ans et 8 mois est admis en salle d’urgence dans un contexte de céphalées, vomissements, démarche ébrieuse puis altération de la conscience.
À l’admission, l’enfant est comateux (Score de Glasgow à E2V2M3). Sur le plan neurologique, il présente un myosis bilatéral ainsi qu’une hypertonie généralisée, avec membres inférieurs en extension et membres supérieurs en flexion. Le Babinski est bilatéralement positif. L’examen systématique est par ailleurs sans particularité. Le patient est alors sédaté, intubé et ventilé.
L’imagerie cérébrale, réalisée à J1, met en évidence une thrombose de l’artère vertébrale droite et du tronc basilaire avec accident vasculaire cérébral (AVC) artériel ischémique étendu du pont et de l’hémisphère cérébelleux droit. La PCR réalisée sur le liquide céphalo-rachidien est positive pour l’Herpès Zoster. Les bilans cardio-embolique, toxicologique, hématologique - hémostatique (Facteur V, Protéine C et S, homocystéine, antithrombine, prothrombine, schizocytes, électrophorèse de l’hémoglobine), immunitaire (IgA , IgG, IgM, C3, C4, ANCA, ASCA, FAN), et métabolique (acides organiques urinaires, lactates) réalisés sont négatifs.
Après levée de l’analgosédation à J15, le diagnostic de LIS est posé. Le patient présente un état de conscience préservé, avec mouvements oculaires verticaux et clignements contrôlés des paupières, aphonie, trouble de la déglutition, diplégie faciale, et une quadriplégie spastique associée à une hypotonie axiale.
Il bénéficiera d’un traitement anticoagulant intraveineux par Héparine de bas poids moléculaire (HBPM) de J1 à J19, puis d’un relais par antiagrégant (Acide acétylsalicylique) seul à partir de J20. Il bénéficiera également d’un traitement par Aciclovir IV de J1 à J16 et d’une corticothérapie IV par Methylprednisolone de J5 à J10. Une trachéotomie et gastrostomie sont respectivement réalisées à J15 et J40.
L’enfant est transféré à J50 en centre de revalidation neurologique et un retour au domicile est réalisé au bout d’un an et demi d’évolution. Il bénéficie d’une prise en charge pluridisciplinaire intensive comportant de la kinésithérapie, de l’ergothérapie, de la logopédie, une scolarisation, un suivi psychologique, de l’hydrothérapie, de la zoo- et de l’hippothérapie.
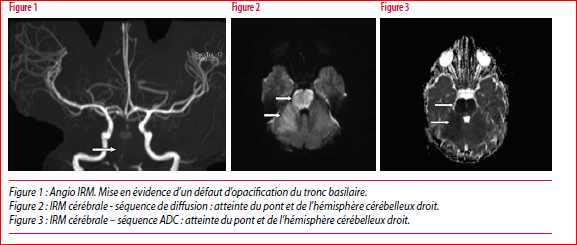
L’angio-IRM cérébrale de contrôle à 6 mois confirme la présence de lésions séquellaires protubérantielles étendues avec aspect de cavitation et l’occlusion de la distalité des deux artères vertébrales et du tronc basilaire, reperméabilisé en distalité par les artères communicantes postérieures.
Après 3 ans d’évolution, l’enfant reste totalement dépendant dans les activités de la vie quotidienne. Il présente une labilité émotionnelle avec crises de pleurs fréquents. Sur le plan clinique, la motricité reste limitée. Notons l’apparition d’un contrôle de la tête et de petits mouvements au niveau du membre supérieur droit ainsi que des mouvements de retrait au niveau des membres inférieurs. Il y a également une amélioration de la motricité de la sphère orale avec apparition de mouvements de mastication et déglutition. La trachéotomie a été retirée à J100 et des vocalisations involontaires sont présentes, mais pas de mots compréhensibles. Concernant la communication, un code par mouvements oculaires a été établi, il bénéficie également d’un ordinateur visuel et d’un contacteur au niveau de la tête et du membre supérieur droit. Le traitement par acide acétylsalicylique est actuellement maintenu.
Locked-in syndrome
Une classification en 3 types, peut être réalisée sur base de l’étendue de l’atteinte motrice des patients présentant un LIS : (1) LIS classique - immobilité complète à l’exception de mouvements oculaires verticaux ou clignements des paupières ; (2) LIS incomplet - persistance de mouvements volontaires autre que des mouvements oculaires verticaux ou clignements des paupières ; (3) LIS total - immobilité complète incluant tous mouvements oculaires, avec conscience préservée (4).
Le locked-in-syndrome se caractérise par une lésion pontique ventrale bilatérale, secondaire le plus souvent à une thrombose de l’artère basilaire.
Une revue de la littérature réalisée en 2009 par Bruno et al. (5) basée sur 33 cas pédiatriques a pu mettre en évidence un pourcentage de 61 % de LIS secondaire à un AVC du tronc cérébral, 10 % à une lésion tumorale du tronc, et 6 % à un traumatisme du tronc. D’autres étiologies comme la myélinolyse centro-pontine, l’encéphalite, la méningite, le syndrome de Reye, le syndrome de Guillain Barré, et l’atrophie spinale sont également retrouvées.
Pour rappel, une lésion pontique ventrale bilatérale mène à une interruption du faisceau cortico-bulbaire et cortico-spinale et donc à une atteinte de la voie pyramidale et des noyaux moteurs du tronc cérébral, menant ainsi secondairement au tableau de quadriplégie et aphonie typique du LIS. La préservation de mouvements oculaires verticaux et de clignement des paupières est secondaire à la préservation du tegmentum du pont. Par définition, le diagnostic de LIS est avant tout clinique.
Ainsi, face à tout patient présentant un état végétatif ou de coma supposé avec atteinte du tronc cérébral mise en évidence à l’imagerie, une évaluation de l’oculomotricité à la commande verbale devra être systématique et répétée. Une attention toute particulière devra être portée au tableau de LIS total.
Il n’existe pas d’examens complémentaires permettant de poser avec certitude le diagnostic de LIS. Le bilan initial comprend une imagerie cérébrale structurelle (idéalement IRM avec séquence de diffusion et angio IRM) permettant de mettre en évidence la lésion au niveau de la portion ventrale du tronc cérébral. L’EEG ne permet pas avec certitude de distinguer le LIS d’un autre état de coma mais peut être utile. Une étude réalisée par Bassetti et al. (6) a mis en évidence chez des patients présentant un LIS, un tracé d’EEG normal ou légèrement ralenti avec prédominance d’une activité alpha relative. L’imagerie fonctionnelle comme le Pet scan peut également trouver sa place dans le diagnostic différentiel du LIS et de l’état végétatif en mettant en évidence une activité métabolique plus intense dans le premier cas (7).
Une évaluation neuropsychologique systématique de ces patients reste difficile. Il semblerait cependant qu’une atteinte isolée du tronc cérébral ne s’associe pas à un déficit cognitif, à contrario des patients présentant une lésion corticale ou thalamique associée (8). La revue de la littérature réalisée en 2009 par Bruno et al. (5), a pu mettre en évidence un pourcentage de récupération motrice partielle chez 35 % des patients, de quadriplégie et anarthrie persistantes chez 16 % des patients, d’une certaine autonomie de vie chez 26% des patients et de décès chez 23 % des patients. Il a également été établi, dans une population adulte, qu’après stabilisation initiale et tableau de LIS persistant plus d’un an, l’espérance de vie à 10 ans est de 80 % et 40 % à 20 ans (9).
Le pronostic associé à une occlusion de l’artère basilaire chez l’enfant est pauvre avec un pourcentage de mortalité de 25% et une morbidité élevée (10). Une rééducation intensive et précoce améliore le pronostic moteur.
Vascularite et AVC post-varicelle en pédiatrie
La varicelle est une maladie infantile fréquente. On estime que l’incidence dans la population pédiatrique d’un AVC ischémique post-varicelle (PVCI), s’élèverait à 1/15.000 enfants et correspondrait jusqu’à un tiers des cas d’AVC pédiatriques ischémiques (11,12). Une revue de la littérature réalisée par Miravet et al. en 2007 et concernant 97 patients de moins de 18 ans ayant présenté un PVCI (12), met en évidence une prédominance masculine (62 %) et un âge médian de présentation de l’épisode de varicelle de 4 ans et 6 mois. Le délai moyen entre le PVCI et l’épisode de varicelle était de 3 mois. Une prédisposition génétique au PVCI est suspectée mais pas encore actuellement prouvée (11).
La présentation clinique classique consiste en une hémiparésie. La portion proximale de l’artère cérébrale moyenne est le plus souvent atteinte, mais l’ensemble de la circulation cérébrale antérieure est concerné. Les ganglions de la base sont secondairement infarcis (11) (12). La pathogénie sous-jacente de la vasculopathie post-varicelle est encore actuellement discutée mais l’hypothèse la plus fréquente évoque une migration du virus à partir du ganglion trigéminal vers le nerf trijumeau et jusqu’aux artères cérébrales du polygone de Willis qu’il innerve, associé à un phénomène inflammatoire local suite à la réplication virale (11). Rappelons ici l’importance anamnestique de la mise en évidence d’un antécédent de varicelle chez les patients présentant un AVC ischémique des ganglions de la base sans autre facteur de risque sous-jacent mis en évidence.
La mise en évidence sur le LCR d’IgG anti-VZV (Herpès Zoster) semblerait, chez l’adulte, être la méthode diagnostique la plus sensible de vasculopathie post- varicelle, au contraire de la PCR VZV qui aurait une sensibilité plus faible (13).
Les données de la littérature mettent en évidence des résultats contradictoires en ce qui concerne l’évolution de la vasculopatie post-varicelle. Une artériopathie progressive pourrait secondairement survenir, avec risque de récidive d’AVC ischémique dans les premières semaines ou premiers mois suivant l’épisode aigu (12).
Dans ce contexte, l’initiation d’un traitement anticoagulant en phase aigu afin de prévenir l’extension locale du thrombus et l’embolisation secondaire, mais aussi un relai par traitement antiagrégant en prévention secondaire, comme l’Acide Acétylsalicylique semblent être justifiés (11,14). Le traitement est poursuivi en moyenne 18 mois à deux ans (14). Les récidives semblent par ailleurs rares lorsque l’imagerie met en évidence une stabilisation ou une régression de l’artériopathie (14). Notons toutefois que les recommandations thérapeutiques actuelles reposent sur un consensus professionnel établi à partir des données de l’observation et par analogie avec la pathologie adulte.
De plus, du fait de la composante inflammatoire associée aux PVCI, certains proposent une corticothérapie initiale associée à un traitement par Acyclovir. Toutefois, une différence significative n’a pu être mise en évidence en ce qui concerne l’évolution des enfants traités par anti thrombotiques seuls versus antiviraux et corticothérapie (15).
Discussion et conclusion
Nous avons décrit ici un tableau de LIS incomplet secondaire à un AVC ischémique du tronc cérébral, avec thrombose du tronc basilaire et de l’artère vertébrale droite. Suite à la mise en évidence d’une PCR HZV positive sur LCR, le diagnostic de vasculopathie post-varicelle a pu être retenu. Notre patient a bénéficié d’un traitement antiviral et d’une corticothérapie associée à un traitement anti thrombotique, ce dernier encore poursuivi actuellement. Nous avons un recul clinique de plus de 3 ans.
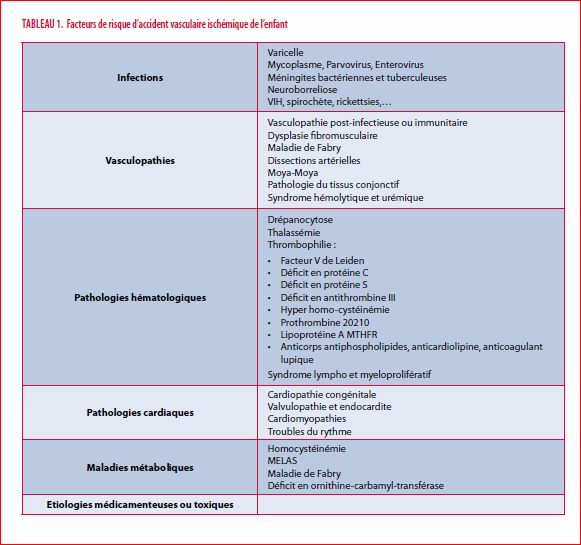
Nous n’avons pas pu mettre en évidence, chez notre patient, d’autre facteur étiologique et favorisant d’AVC ischémique, que la vasculopathie post-varicelle. Nous insistons toutefois sur le fait que l’AVC ischémique pédiatrique est à considérer, dans la majorité des cas, comme une problématique à facteurs de risque multiples. Outre l’étiologie infectieuse et la vasculopathie pouvant en découler et représentant les facteurs de risque les plus fréquents, il n’est pas rare qu’ils puissent y être associés un ou plusieurs autres facteurs favorisants sous-jacents. Identifier ces facteurs permet de mieux évaluer le pronostic, notamment en termes de risque de récidive, mais également d’adapter le traitement et la prévention à long terme. Le tableau 1 reprend, en résumé et de façon non exhaustive, les différents facteurs de risque de l’AVC ischémique pédiatrique.
Par ailleurs, le traitement de la vasculopathie cérébrale post-varicelle de l’enfant reste controversé, et repose essentiellement sur la pratique adulte et avis d’experts, d’où la nécessité de la réalisation d’études contrôlées et randomisées en ce domaine. La prévention primaire passe par la vaccination.
Enfin, rappelons, la rareté du LIS en pédiatrie, et la difficulté diagnostique secondaire qui en découle avec d’autres tableaux cliniques tels que le coma ou l’état végétatif. Les soins à ce type de patient, la revalidation et la réadaptation représentent un réel défi, néanmoins le pronostic moteur et la qualité de vie en dépendent, et ce d’autant plus dans une population pédiatrique.
Recommandations pratiques
- Face à tout patient présentant un état végétatif ou de coma supposé avec atteinte du tronc cérébral à l’imagerie, une évaluation de l’oculomotricité à la commande verbale devra être systématique.
- Importance anamnestique de la mise en évidence d’un antécédent de varicelle chez les patients présentant un AVC ischémique des ganglions de la base sans autre facteur de risque sous-jacent.
Affiliations
1. Cliniques universitaires Saint Luc, pédiatrie
2. Centre hospitalier neurologique William Lennox, neuropédiatrie
3. Cliniques universitaires Saint Luc, neuropédiatrie
4. Hôpital de Jolimont, neuropédiatrie
Correspondance
Dr. Laura Wulleman
Cliniques universitaires Saint Luc
Pédiatrie
Avenue Hippocrate 10
B-1200 Woluwe-Saint-Lambert
laura.wulleman@skynet.be
Références
- Plum F, Posner JB. The diagnosis of stupor and coma, 3rd ed. Philadelphia: F.A. Davis Co. 1983; 363-364.
- Latchaw RE, Seeger JF, Gabrielsen TO. Vertebrobasilar arterial occlusions in children. Neuroradiology. 1974; 8: 141- 147.
- American Congress of Rehabilitation Medecine. Recommendations for use of uniform nomenclature pertinent to patients with severe alteration of consciousness. Arch Phys Med Rehabil. 1995; 76: 205-209.
- Bauer G, Gerstenbrand F, Rumpl E. Varieties of locked in syndrome. J Neurol. 1979; 221: 77-91.
- Bruno MA, Schnakers C, Damas F, Pellas F, Lutte I, Bernheim J, et al. Locked-In Syndrome in children: report of five cases and review of the literature. Pediatric Neurology. 2009; 41 :237-246.
- Bassetti C, Hess CW. Electrophysiology in locked-in syndrome. Neurology. 1997; 49:309.
- Laureys S, Owen AM, Schiff ND. Brain function in coma, vegetative state and related disorders. Lancet Neurol. 2004; 3: 537-546.
- Schnakers C, Majerus S, Goldman S, Boly M, Van Eeckhout P, Gay S, et al. Cognitive function in the locked-in syndrome. J Neurol. 2008; 255: 323-330.
- Doble JE, Haig AJ, Anderson C, Katz R. Impairment, activity, participation, life satisfaction, and survival in persons with locked-in syndrome for over a decade: follow-up on a previously reported cohort. J Head Trauma Rehabil. 2003; 18: 435-444.
- Pascual-Pascual JI, Pascual-Castroviejo I, Tendero A, Roche MC. Vertebral and basilar arterial occlusion in children: a case report and review of the literature. An Esp Pediatr. 1977; 10: 665-672.
- Askalan R, Laughlin S, Mayank S, Chan A, MacGregor D, Andrew M, et al. Chickenpox and Stroke in Childhood - A study of Frequency and Causation. Stroke. 2001; 32: 1257-1262.
- Miravet E, Danchaivijitr N, Basu H, Saunders DE, Ganesan V. Clinical and radiological cerebral infarction following varicella zoster virus infection. Developmental Medicine & Child Neurology. 2007; 49: 417-422.
- Nagel MA, Cohrs RJ, Mahalingam R, Wellish MC, Forghani B, Schiller A, et al. The varicella zoster virus vasculopathies: clinical, CSF, imaging and virologic features. Neurology. 2008; 70: 853-860.
- Chabrier S, Kossorotoff M, Darteyre S. Place des antithrombotiques dans l’accident vasculaire cérébral de l’enfant. Presse Med. 2013; 42: 1259-1266.
- Monteventi O, Chabrier S, Fluss J. Prise en charge diagnostique et thérapeutique actuelle de l’accident vasculaire cérébral post-varicelleux chez l’enfant: revue de la littérature. Arch Pediatr. 2013; 20: 883-889.