La maladie thrombo-embolique veineuse (MTEV) (qui inclut la thrombose veineuse profonde et l’embolie pulmonaire) représente dans les pays occidentaux la 3ème cause de mortalité d’origine vasculaire, après l’infarctus du myocarde et l’accident vasculaire cérébral (1,2). Le traitement de la MTEV repose sur l’administration d’un traitement anticoagulant d’une durée minimale de 3 mois, voire davantage. Il est parfois prolongé au long cours, ce qui nécessite une réévaluation régulière des risques hémorragiques et des bénéfices antithrombotiques, à savoir la prévention des récidives (2,3) (schéma 1). Le risque de récidive d’accident thrombo-embolique veineux n’est en effet pas négligeable : il peut s’élever de 6 à 10% par an chez les patients ayant présenté une TVP et/ou une EP idiopathique, c’est-à-dire survenu(e) sans qu’un facteur favorisant réversible n'ait pu être mis en évidence (2).
Schéma 1. Prise en charge de la MTEV.

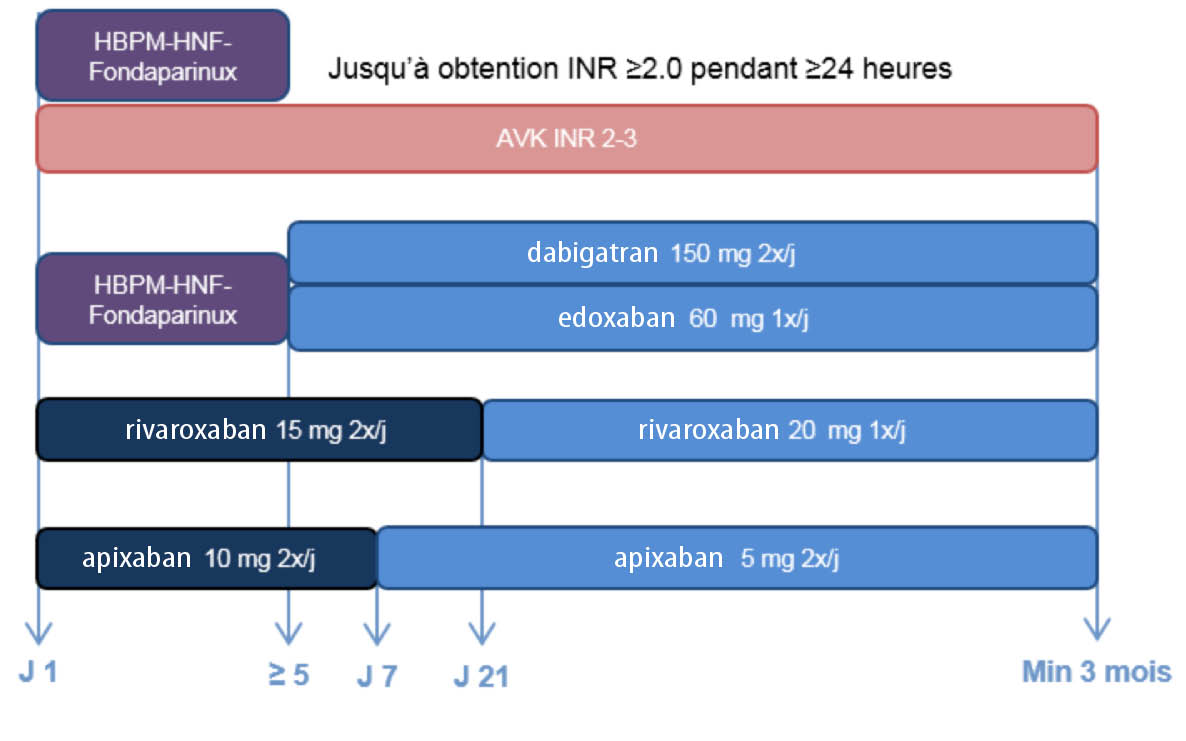
Pendant des décennies la thérapie anticoagulante de la MTEV a consisté, dans sa phase initiale, en un traitement parentéral par une héparine non fractionnée administrée par voie IV ou SC, une héparine de bas poids moléculaire ou du fondaparinux SC pendant quelques jours, avec ensuite un relais oral par anti-vitaminique K (AVK), en visant un Ratio International Normalisé (INR) entre 2 et 3. L’utilisation des AVK présente toutefois de nombreux inconvénients associant une fenêtre thérapeutique très étroite, une variabilité inter- et intra-individuelle de la réponse pouvant nécessiter de multiples adaptations du dosage, un délai d’action et de réversibilité, l’impérative nécessité de monitorings fréquents des INR, de nombreuses interactions médicamenteuses et alimentaires et des risques hémorragiques liés aux surdosages (4).
Depuis quelques années, le paysage thérapeutique s’est toutefois étoffé avec la validation des nouveaux anticoagulants oraux (NOACs) – également nommés anticoagulants directs (DOACs ) – dans le traitement et la prévention des récidives de la MTEV, à travers 10 études et plus de 24.000 patients enrôlés. Les principales études ayant permis de démontrer l’efficacité et d’établir les bénéfices des NOACs sont listées dans le tableau n°1.
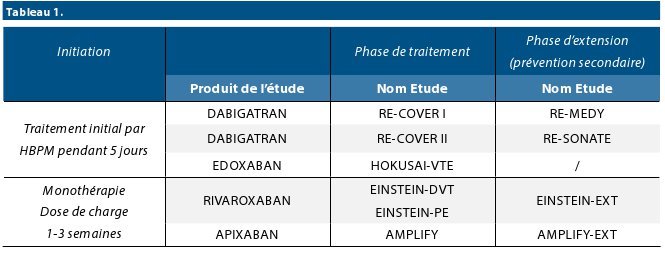
Rappelons que la famille des NOACs se compose de 4 molécules, une ciblant le facteur II activé (le dabigatran-Pradaxa®) et 3 ciblant le facteur X activé (le rivaroxaban-Xarelto®, l’apixaban-Eliquis® et l’edoxaban-Lixiana®). Le traitement de la MTEV par le dabigatran et l’edoxaban est précédé par une thérapie parentérale minimale de 5 jours avec une HBPM. Par contre, une dose de charge est de mise avec l’apixaban (1 semaine) et le rivaroxaban (3 semaines) utilisés en monothérapie, sans traitement préalable par une HBPM (Schéma n°2).
Schéma 2. AVK et NOACs dans le traitement aigu de la MTEV
Dans la première partie de son exposé, le Professeur Agnelli a passé en revue les résultats des études qui ont démontré l’efficacité et la sécurité des NOACs dans la prise en charge de la MTEV (traitement initial et prolongé et prévention des récidives au long cours).
Dabigatran et études RECOVER
RE-COVER I est une étude de non infériorité, randomisée, en double aveugle, qui compare le dabigatran 150 mg 2x/j avec la warfarine (INR cible entre 2 et 3). Le critère primaire d’efficacité portait sur la récidive endéans 6 mois d’événements thrombo-emboliques symptomatiques documentés, entraînant oui ou non le décès. Pendant les 6 mois d’observation, parmi les 1274 patients inclus dans le bras dabigatran, 30 (2,4%) ont présenté une récidive thrombo-embolique veineuse versus 27 (2,1%) parmi les 1265 patients du bras AVK. La différence du risque est de 0.4% (intervalle de confiance 95% - 0.8 à 1.5; p<0.001 pour la marge pré-spécifiée de non infériorité), ce qui confirme la non infériorité du dabigatran sur le critère primaire d’efficacité. En termes de sécurité, sous dabigatran, on a noté 1,6% d’hémorragies majeures (major), 5,6 % d’hémorragies majeures ou non majeures mais cliniquement pertinentes (major + NMCR) et 16,1 % pour l’ensemble des hémorragies majeures et mineures (all) versus respectivement 1,9%, 8,8% et 21,9% pour les patients sous warfarine. Le risque hémorragique sous dabigatran était donc similaire ou plus faible que sous warfarine (5). L’étude RE-COVER II a confirmé les résultats de non infériorité du dabigatran dans la prévention de récidive de la MTEV ainsi que la réduction en termes de saignement de tout type (all) et de la combinaison des saignements majeurs + saignements non majeurs mais impactant sur la clinique (major + NMCR) (6).
Rivaroxaban et études EINSTEIN
Les études EINSTEIN-DVT et EINSTEIN-PE sont des essais de non infériorité conduits en ouvert, randomisés, guidés par un événement (event-driven), comparant le rivaroxaban seul (15mg 2x/j pendant 21 jours puis 20 mg/j) avec un traitement parentéral par enoxaparine puis relais par AVK (avec un INR cible entre 2 et 3). Le traitement était poursuivi pendant 3, 6 ou 12 mois selon les cas, chez des patients présentant une thrombose veineuse profonde aigüe symptomatique (EINSTEIN-DVT) ou une embolie pulmonaire (EINSTEIN-PE). Le critère principal d’efficacité était la récidive d’un événement thrombo-embolique et le critère principal de sécurité la survenue d’un saignement majeur ou cliniquement significatif. La non infériorité du rivaroxaban sur le critère primaire d'efficacité a été obtenue avec 2.1% de récidive sous rivaroxaban versus 1.8% sous enoxaparine-AVK (intervalle de confiance 95% - 0.44 à 1.04; p <0.001 pour la marge pré-spécifiée de non infériorité) dans l’étude EINSTEIN-DVT. Elle a également été démontrée dans l’étude EINSTEIN PE avec 2.1% de récidive sous rivaroxaban versus 1.8% dans le bras enoxaparine-AVK (intervalle de confiance 95% - 0.75 à 1.68; p <0.003 pour la marge pré-spécifiée de non infériorité). L’incidence de l’ensemble des événements hémorragiques (major + NMCR) s’est révélée similaire chez les patients traités par rivaroxaban ou par enoxaparine-AVK (8,1% dans les 2 groupes pour EINSTEIN-DVT et 10,3% pour le groupe rivaroxaban versus 11,4% pour le bras enoxaparine-AVK pour EINSTEIN-PE) (7,8).
Apixaban et études AMPLIFY
AMPLIFY est une étude randomisée, double aveugle, comparant l’apixaban (dose de 10 mg 2x/j pendant 7 jours suivi de 5 mg 2x/j pendant 6 mois) avec un traitement standard par enoxaparine puis warfarine, chez 5395 patients victimes d’un événement thrombo-embolique veineux aigu. Le critère primaire d’efficacité portait sur la récidive d’événements thrombo-emboliques veineux symptomatiques ou les décès relatifs aux TVP. Le critère de sécurité primaire était les saignements majeurs. On a noté des récidives chez 2,3% des patients du groupe apixaban versus 2,7 dans le groupe HBPM-AVK (risque relatif, 0,84; intervalle de confiance 95% - 0.6 à 1.18 ; p <0.001 pour la marge pré-spécifiée de non infériorité) ce qui confirme la non infériorité de l’apixaban sur le critère primaire d'efficacité. Il n’y a pas eu plus de récidives de TVP au cours des 2 premières semaines de traitement malgré l’absence d’utilisation d’HBPM, souligne le Professeur Agnelli (9). On a noté 0,6% d’hémorragies majeures (major) dans le bras apixaban versus 1,8% dans le bras HBPM-AVK (risque relatif, 0,31; intervalle de confiance 95% - 0.17 à 0.55; p <0.001 pour la supériorité). Le critère composite d’accidents hémorragiques majeurs additionnés aux hémorragies non majeures mais cliniquement significatives (major + NMCR) a été présent chez 4,3% des patients sous apixaban versus 9,7% des patients sous HBPM-AVK (risque relatif, 0,44; intervalle de confiance 95% - 0.36 à 0.55; p <0.001 pour la supériorité). Le recours à l’apixaban a donc été associé à significativement moins de saignements que le traitement standard (1).
Edoxaban et études HOKUSAI
Hokusai est une étude de non infériorité, randomisée, double aveugle, comparant des patients avec un événement thrombo-embolique aigu traités initialement par une héparine puis randomisés dans le bras warfarine ou edoxaban 60 mg/j (30 mg/ jour selon la fonction rénale et le poids du patient). La durée du traitement était de 3 à 12 mois. Le critère primaire d’efficacité portait sur la récidive d’événements thrombo-emboliques symptomatiques. L’edoxaban s’est montré non inférieur à la warfarine avec 3,2% de récidive de MTEV versus 3,5% (risque relatif, 0,89; intervalle de confiance 95% - 0.7 à 1.13 ; p <0.001 pour la non infériorité). Le critère de sécurité principal était la survenue d’hémorragies majeures (major) et non majeures mais cliniquement significatives (NMCR) (8,5% des patients sous edoxaban et 10,3% des patients sous warfarine (risque relatif, 0,81; intervalle de confiance 95% - 0.71 à 0.94; p <0.004 pour la supériorité). En ce qui concerne les saignement majeurs seuls, on en a observé 1,4% dans le bras edoxaban versus 1,6% dans le bras warfarine (risque relatif, 0,84; intervalle de confiance 95% - 0.59 à 1.21; p <0.35, négatif pour la supériorité). A nouveau, cette étude démontre un profil de sécurité favorable pour l’edoxaban sur les hémorragies cliniquement significatives mais pas sur les saignements majeurs (10).
NOACS et MTEV : résultats des méta-analyses
Pour résumer ces résultats, 3 méta-analyses des études évaluant les NOACs par rapport aux AVK dans le traitement de la TVP et la PE ont montré une efficacité similaire et une réduction significative du risque de saignement majeur avec les NOAC par rapport aux AVK. Même s’il existe des résultats spécifiques à chacun des NOAC et si chaque molécule apporte une contribution différente au résultat total, aucune étude n’a comparé les NOACs directement entre eux (11-12-13) (schéma 3).

MTEV et Anticoagulation prolongée par NOACs
L’extension du traitement anticoagulant de la MTEV a été étudiée pour le Rivaroxaban (EINSTEIN-EXT), le dabigatran (RE-SONATE et REMEDY) et l’apixaban (AMPLIFY-EXT). Les critères évalués étaient l’efficacité en termes de prévention de récidive de thrombose veineuse et la sécurité hémorragique. Le design de ces études est détaillé dans le tableau 2. L’efficacité d’un traitement prolongé par NOAC a été comparée soit à un AVK (warfarine) soit à un placebo. Le dabigatran s’est montré efficace pour la prévention de la MTEV létale ou non (0,4% pour le dabigatran versus 5,6% pour le placebo dans RE-SONATE et 1,8% pour le Dabigatran versus 1,3% pour la warfarine dans RE-MEDY). Le traitement par dabigatran s’est accompagné d’un risque plus faible pour les saignements majeurs et pour les majeurs plus les saignements relevants non majeurs (0,9% (major) et 5,6% (major + NMCR)) par rapport la warfarine (1,8% (major) et 10,2% (major + NMCR)). Par contre l’ensemble des saignements majeurs et non majeurs mais relevants (major + NMCR) a été plus élevé dans le groupe dabigatran (5,3%) que dans le groupe placebo (1,8%) (14).
Des résultats similaires ont été obtenus avec le rivaroxaban : récidive des MTEV chez 1,3% des patients sous rivaroxaban versus 7,1% sous placebo et saignements majeurs et cliniquement relevants (major + NMCR) plus élevés dans le groupe rivaroxaban (6%) que le groupe placebo (1,2%) (7).
L’étude AMPLIFY EXTENSION se démarque par une prophylaxie prolongée utilisant soit une dose de 2,5 mg 2x/j soit une dose de 5mg 2x/j d’apixaban versus un bras placebo. Un accident thrombo-embolique létal ou non est survenu chez 1,7% des patients dans les groupes apixaban, tant pour 2,5mg 2x/j que pour 5mg 2x/j versus 8.8% des patients sous placebo. La réduction des doses d’apixaban dans cette phase de prévention secondaire n’a donc pas modifié l’efficacité. La mortalité toute cause confondue a été de 0,8% pour la faible dose et 0,5% pour la forte dose d’apixaban versus 1,7% pour les témoins placebo. Le taux de saignement majeur (major) a été de 0,2% pour la faible dose d’apixaban et 0,1% pour la posologie plus élevée versus 0,5% pour le placebo. Ces résultats illustrent donc l’absence d’augmentation des saignements majeurs malgré 12 mois de traitement anticoagulant à faible dose (2 x 2.5 mg/j). Les saignements non majeurs mais relevants (NMCR) ont été de 4,2% sous apixaban 5mg, 3,0% sous apixaban 2,5 mg et 2,3% dans le groupe placebo. L’anticoagulation prolongée avec apixaban se révèle donc efficace aux 2 dosages pour prévenir les récidives de TVP sans pour autant majorer le risque hémorragique (2). A faible dose (2,5 mg, 2x/j), le risque hémorragique ne diffère pas de celui associé à l’utilisation d’un placebo.
Interview du Professeur Giancarlo Agnelli: unmet clinical needs with NOACS : l’avis de l’expert à travers des questions – réponses, débat animé par le Professeur Philippe Hainaut.
« Au vu des résultats des études, on peut se demander pourquoi les habitudes de traitement de la MTEV mettent autant de temps à se modifier » fait d'emblée remarquer le Professeur Agnelli.
Pourquoi donne-t-on une HBPM au début du traitement pour certains NOACs et une dose de charge en monothérapie pour les autres ?
« Ce sont des choix faits lors du design des études. L’objectif principal était la prévention des récidives précoces mais par des approches différentes : une bi-thérapie ou une monothérapie avec une dose de charge »
En cas d’EP (non massive), faut-il privilégier une HBPM puis un NOAC ou peut-on avoir recours à un NOAC en monothérapie ?
« L’important est de classifier le risque de décès lié à l’EP (selon l’ESC 2014) (21). Pour le faible risque (21% des EP), autant utiliser un NOAC en monothérapie vu la simplicité d’utilisation. En cas de risque élevé (11%), le traitement initial sera classique (thrombolyse/héparine) jusqu’à stabilisation hémodynamique, avec ensuite un relai éventuel par un NOAC. Pour la catégorie à risque intermédiaire faible, il s’agit également d’une bonne indication pour un NOAC d’emblée en monothérapie. Enfin, pour la classe de risque intermédiaire élevé, il n’y a pas encore de données validées qui permettent de choisir la stratégie initiale. »
Quelle dose d’apixaban dans le traitement initial de l’EP chez patients fragiles ?
« Si le patient est éligible pour recevoir de l’apixaban, il faut s’en tenir aux doses validées dans les études à ce stade. En ce qui concerne l’insuffisance rénale, bien que le RCP (22) de l'apixaban permette son utilisation entre 15 et 29 ml/min, pour ma part, les patients ayant une clearance de la créatinine inférieure à 25-30 ml/min ne doivent pas recevoir de NOAC.»
Qui est candidat à une anticoagulation au long cours dans la MTEV?
« Il s’agit en général d’un second épisode de TVP idiopathique, d’un syndrome anti-phospholipides (SAPL) ou du contexte de cancer. Dans le cas d’un premier épisode TVP idiopathique, il n’y a pas de recommandation bien établie et l’indication se discutera au cas par cas. Avec les données des études comme AMPLIFY-EXT (2), nos habitudes vont probablement se modifier avec le risque éventuel de traiter plus voire trop de patients au long cours ».
Quelle est la place des NOACs dans la MTEV des patients avec un cancer ?
« Les données sont limitées. Dans les études, peu de patients (3-8%) avaient un cancer. Toutefois, en pratique clinique 20% des patients avec MTEV ont un cancer. Il faut donc plus de données pour cette population. Actuellement seules les HBPM sont recommandées pour le traitement de la MTEV dans un contexte néoplasique. Une méta-analyse montre toutefois que chez les 1132 patients avec un cancer inclus dans 6 études de validation des NOACs, il y avait une réduction de 37% de risque de récidive de MTEV. (13). Des études sont en cours pour valider les NOACs en oncologie. »
Les patients fragiles sont-ils bien représentés dans les études ?
« Si on prend les sous-groupes comme patient âgés et/ou avec une clearance de la créatinine de 30-50ml/min, ce sont ceux qui tirent le plus d’avantage à être traités par un NOAC (15-19) . »
Faut-il réduire les doses d’apixaban chez les patients dits fragiles ?
« Il n’y a pas eu de réduction de doses dans le design de l’étude AMPLIFY. L’objectif était de traiter efficacement et de protéger au mieux les patients d’une récidive de TVP ou EP (notamment fatale) ; c’est pourquoi il a été décidé de ne pas réduire les doses. Si on veut atteindre les résultats de l’étude, il faut utiliser les doses de l’étude. ».
Le profil de sécurité favorable de l’apixaban dans les études AMPLIFY s’explique-t-il par la dose, la prise bi-quotidienne ou les deux ?
« C’est probablement la combinaison de ces 2 caractéristiques de l’apixaban qui explique ce profil de sécurité. Ces résultats ne sont toutefois pas opposés aux résultats de sécurité des autres NOACs mais les renforcent. Deux prises par jour est peut-être moins pratique mais permet d’éviter un pic d’anticoagulation et de réduire le risque de saignements ».
Chez des patients à haut risque de récidive, au terme des 6 mois de traitement, faut-il réduire la dose d’apixaban à 2,5 mg/ 2x/j ou garder 5 mg 2x/j ?
« Dans la prévention secondaire, les données ont montré des résultats d’efficacité similaires avec 2,5 et 5 mg au long cours (2). On est face à une molécule qui offre un dosage lors de l’initiation (10mg 2x/j), un dosage pour le traitement pendant 6 mois (5mg 2x/j) puis un dosage pour le traitement au long cours (2,5mg 2x/j) (1,2). Cette courbe dans les doses suit celle du risque de récidive qui diminue avec le temps, mais il reste quelques patients à haut risque de récidive qui ne seront peut-être pas suffisamment protégés avec le dosage approuvé de 2,5 mg. Des études doivent être menées pour nous aider à mieux identifier cette population et voir si elle nécessite un dosage différent. »
Peut-on traiter une TVP centrale (associée ou non à un cathéter) et une TVP des membres supérieurs par un NOAC ?
« Nous n’avons pas encore de données avec les NOACs dans cette indication, une approche classique pour les TVP centrales reste de mise pour le moment. Par contre la physiopathologie de la TVP des membres supérieurs est similaire à celle des membres inférieurs et des centres utilisent déjà les NOACs dans cette situation. Mais les données sont encore peu nombreuses et des études à ce sujet sont en cours ».
Avons-nous besoin des antidotes ?
« Peu de situations les nécessitent en pratique. Avoir un antidote est un avantage mais l’usage sera très occasionnel en clinique et le risque d’utilisation abusive n’est pas négligeable ».
Quelle est la place du monitoring avec les NOACs ?
« Il n’y a pas de raison de « monitorer » les NOACs. Ils ont été conçus pour ne pas devoir le faire. Une mesure de la concentration circulante du NOAC peut toutefois s’avérer utile dans des situations bien particulières (saignement, urgence préopératoire) ».
Quelle est l’importance des registres VTE « real life » avec les NOACs ?
« Les patients des études sont-ils vraiment différents de la vraie vie ? Plus de données en pratique clinique est toujours intéressant mais elles ne doivent pas mettre en doute les résultats des études cliniques. Le registre Xalia (20) semble confirmer la sécurité du rivaroxaban ».
Correspondance
Dr. Catherine Lambert
Cliniques universitaires Saint-Luc
Service d'Hématologie adulte
avenue Hippocrate 10
B-1200 Bruxelles
catherine.lambert@uclouvain.be
Références
3. Agnelli G, Becattini C. Acute pulmonary embolism. N Engl J Med 2010; Jul 15;363(3):266-74.
4. Laroche JP, Juliard JM, Touzé E, Pernès JM, Drouet L. Nouveaux anticoagulants dans la prise en charge de la pathologie thromboembolique veineuse et du risque thromboembolique de la fibrillation atriale non valvulaire: devoir d’information. Sang Thrombose Vaisseaux 2012; 24 (6): 261-5.
22. Eliquis: EPAR – Product Information, EU. Bristol-Myers Squibb / Pfizer EEIG. 15/04/2016. Availablefrom: ww.ema.europa.eu