Introduction
Pour le deuxième symposium annuel de l’asbl RESUMES, organisé le 20 janvier 2024, pas moins de 150 prestataires de soins se sont réunis autour d’un thème commun, celui de l’obésité. L’enjeu de santé publique est de taille puisqu’il est attendu que le nombre de patients obèses dans la population devrait être de 1,5 milliard globalement en 2030.
La prévalence de l’obésité, maladie chronique et grave, ne cesse d’augmenter au cours des années, surtout dans les pays industrialisés. Il existe des prises en charge adaptées pour de nombreux facteurs de risque cardiovasculaires comme le tabac, l’hypertension. Pour l’obésité nous ne disposons pas encore de suffisamment de traitements efficaces à long terme. Une prise en charge pluridisciplinaire fait en tout cas l’unanimité, poussant au partage de connaissance sous le prisme de différentes disciplines. Les messages relevant des diverses interventions sont résumés ci-dessous.
Neurologie
Quel rôle du cerveau dans l’obésité ? Le cerveau est le maillon central de la régulation de l’homéostasie énergétique, menant à l’obésité en cas de dysfonction. Le développement et le maintien de l’obésité impliquent une perturbation des axes de communication entre le cerveau, le tractus digestif et le tissu adipeux, caractérisée par une dysrégulation du système homéostatique et du système de la récompense.
Cette régulation repose sur le fonctionnement de différentes structures et hormones, agissant à court (ghréline, cholécystokinine, GLP-1, peptide YY) et à long terme (leptine, insuline) (1). Le premier relais des informations est le noyau arqué, situé au niveau de l’hypothalamus. C’est un point de convergence et une zone privilégiée qui permet le passage des hormones périphériques, ouverture rendue possible par la plasticité des tanycytes et la présence de capillaires fenestrés (2). Ces facteurs agissent sur la production de mélanocortine qui se fixent sur des récepteurs MC4R qui contrôle directement la balance homéostatique. Ce signal permet alors une modulation en fonction de l’état de jeûne ou de satiété. Une perturbation de ces mécanismes va donc conduire à un déséquilibre énergétique menant à l’obésité.

En plus du noyau arqué de l’hypothalamus (faim homéostatique), il faut noter le rôle du circuit de la récompense, localisé dans le système mésolimbique et dans le cortex préfrontal/orbitofrontal. Ce circuit est en interconnexion avec d’autres structures corticales telles que l’amygdale et l’insula qui jouent un rôle dans le contrôle émotionnel de la prise alimentaire (faim hédonique).
Outre les mécanismes cérébraux complexes impliqués dans le développement de l’obésité, celle-ci est également à l’origine de complications du système nerveux. Les complications neurologiques de l’obésité sont surtout liées à l’obésité abdominale plutôt qu’à l’excès de poids en tant que tel (BMI). Parmi les complications fréquentes, on retrouve l’AVC ischémique, la neuropathie des petites fibres (conséquence du syndrome métabolique donnant des pieds douloureux brûlants ou glacés avec un examen clinique normal), le pseudotumor cerebri (hypertension intracrânienne idiopathique), l’atrophie corticale avec risque de démence ainsi que le syndrome des apnées obstructives du sommeil.
Heureusement, l’avancement dans la compréhension des mécanismes de régulation du poids ouvre la voie vers des thérapies pharmacologiques (ciblant par exemple le récepteur MC4R ou de la leptine) et des thérapies innovantes tel que la neuromodulation, permettant d’éviter ces nombreuses complications. Bien évidemment, la prise en charge de l’obésité ne s’arrête pas aux portes du cerveau et nécessite également une approche cognitivo-comportementale.
Endocrinologie
Parmi les traitements de l’obésité, outre la neuromodulation, la piste hormonale semble encourageante. Pour un patient avec un BMI de plus de 30 kg/m2 sans comorbidité, ou un BMI de plus de 27 kg/m2 avec comorbidité(s), ayant déjà appliqué des mesures hygiéno-diététiques durant plus d’un an, les analogues du GLP-1 sont une solution potentielle. Ces traitements sont satiétogènes et permettent, en diminuant la prise alimentaire, une perte de poids en moyenne de 15% (jusqu’à 25% pour un triple agoniste GLP-1/GIP/glucagon) (3). Les patients ainsi traités nécessitent malgré tout une prise en charge pluridisciplinaire car ces produits n’agissent pas sur la qualité de l’alimentation ni sur d’éventuels troubles alimentaires.
En pratique, ces traitements ne sont pas remboursés par la mutuelle et représentent une dépense de 100 à 250 euros par mois à la charge du patient. Ils se montrent efficaces chez environ deux tiers des patients et réduisent les complications associées à l’obésité telles que le diabète sucré ou le syndrome des apnées du sommeil. Par contre, sans changement en profondeur du comportement alimentaire, le risque de reprise est grand à l’arrêt du traitement. Les effets secondaires principaux sont les nausées et les troubles du transit, provoquant parfois l’arrêt précoce du traitement. Moins fréquemment, on peut observer l’apparition de lithiases biliaires ou de pancréatite aiguë.
Avant de traiter un patient en obésité par un analogue du GLP-1, certaines pathologies endocriniennes doivent être exclues ! En effet, beaucoup d’hormones, provenant du tube digestif, du pancréas, du foie et du tissu adipeux… influencent la prise de poids (4). C’est le cas par exemple du cortisol dont l’élévation est marquée en cas de stress et qui peut ainsi provoquer une prise de poids. L’hypercorticisme (syndrome de Cushing) en tant que tel est une pathologie rare mais essentielle à diagnostiquer compte tenu de l’importante morbi-mortalité associée. Le diagnostic peut se faire cliniquement, sur base d’un phénotype évocateur : obésité abdominale, amyotrophie des membres inférieurs, faciès lunaire, bosse dans la nuque, hypertension artérielle, ... La recherche se fait par dosage de la cortisolurie de 24h, en restant vigilant au pseudo-Cushing, résultant d’une obésité extrême et bien plus fréquent que le syndrome de Cushing lui-même.
Une dysfonction de la thyroïde est souvent suspectée par les patients pour expliquer une prise de poids. En effet, une TSH trop élevée peut faire évoquer une hypothyroïdie primaire qui doit être confirmée par un dosage de la T4 et des anticorps anti-TPO. Si la concentration de la T4 est normale, il ne faut pas trop vite traiter, l’augmentation isolée de TSH pouvant être la conséquence de l’obésité. Moyennant le traitement de l’hypothyroïdie, on peut s’attendre à une perte de 5% du poids.
Enfin, l’hypogonadisme lié à la ménopause peut s’accompagner d’une prise pondérale de l’ordre de 3 kg avec une augmentation du tour de taille. L’hormonothérapie ne prévient pas de la prise de poids ni des modifications corporelles car elles sont à mettre en rapport avec les taux de FSH et non ceux des oestrogènes. Chez l’homme, l’hypogonadisme peut être la conséquence de l’excès de poids (hypogonadisme fonctionnel). Il peut alors contribuer à la baisse de la libido, à une augmentation de la masse grasse et un risque de diabète. Cet hypogonadisme est réversible avec la perte de poids.
N’oublions donc pas que l’obésité elle-même peut provoquer des désordres hormonaux telle qu’une majoration de la TSH, un hypercorticisme ou un hypogonadisme. Ce n’est pas parce que la prise de sang est anormale qui faut se jeter sur la prescription, mais plutôt se demander si l’anomalie est la cause ou la conséquence de l’obésité.
Gériatrie
Chez la personne âgée, il est difficile d’aborder l’obésité lorsque l’on est habitué à parler de dénutrition en gériatrie ! Or l’obésité est également une forme de malnutrition. Mais quelles sont les spécificités de l’obésité en gériatrie ?
La particularité en gériatrie, c’est qu’on ne parle pas de surpoids. Il est donc normal d’observer un BMI entre 25 et 29,5 kg/m2 chez la personne âgée. L’obésité, selon la définition de l’OMS, concerne les personnes ayant un BMI > 30 kg/m2. Sa prévalence diminue avec l’âge, surtout après 80 ans. Cependant, le BMI est une mauvaise façon de détecter l’obésité chez la personne âgée. Avec les années, la masse maigre diminue tandis que la masse grasse augmente avec un pic vers 60-70 ans pour ensuite se redistribuer vers 70 ans. Il est important de distinguer un patient obèse depuis longtemps de celui qui le devient avec l’âge.
Cette diminution de la masse maigre et surtout de la masse musculaire, provoquant une diminution des performances physiques, s’appelle la sarcopénie. La sarcopénie peut commencer dès l’âge de 30 ans. Elle touche environ 50% des personnes âgées de plus de 80 ans. On peut lutter contre la sarcopénie grâce à une alimentation équilibrée et une activité physique régulière.
Ces deux notions, obésité et sarcopénie, permettent d’introduire le concept d’obésité sarcopénique, désignant ainsi des personnes en obésité présentant une perte musculaire. Chez ces patients, le BMI n’est pas un paramètre fiable pour détecter cette forme d’obésité, car il ne tient pas compte de la composition corporelle.
Notons que l’obésité en gériatrie est parfois considérée comme un facteur protecteur (« obesity paradox ») (5). En réponse à certains facteurs hormonaux et mécaniques, la personne en excès de poids augmente sa masse osseuse, diminuant ainsi les risques de fractures et d’ostéoporose. De plus, ces patients auraient un moindre risque de mortalité et se verraient davantage protégés face à une maladie aiguë.
Malgré ces effets protecteurs, l’obésité reste néanmoins un facteur de risque de fragilité et de déclin fonctionnel associé à une majoration du besoin d’aide dans les activités quotidiennes et de multiples complications. Parmi ces complications, on compte le syndrome métabolique, les neuropathies et artériopathies périphériques, le syndrome des apnées du sommeil causant parfois des troubles cognitifs, certains cancers, l’arthrose, l’incontinence urinaire et la démence.
Compte tenu de toutes ces particularités de l’obésité chez la personne âgée, quelle est la prise en charge à proposer ? Tout d’abord, il est nécessaire de garder en tête les objectifs thérapeutiques propres à la gériatrie : l’amélioration de la qualité de vie et des capacités physiques permettant d’accroître l’indépendance. Une fois ces objectifs déterminés, l’accompagnement dans cette perte de poids est primordial. En effet, maigrir en gériatrie implique une diminution de la masse grasse (75%) mais également de la masse maigre (25%). Or la réduction de masse maigre augmente la mortalité. On ne s’acharnera donc pas à faire maigrir une personne âgée au BMI < 30 kg/m2 ou à mettre une personne âgée au régime pour diminuer les complications d’une obésité survenue plus tôt. Si la perte de poids est indiquée, il faut accompagner le patient, offrir un apport en protéines suffisant (1g/kg/jour au minimum) et stimuler le maintien de la masse maigre par des exercices physiques contre résistance.
Pédiatrie
En Belgique, à l’autre extrême de l’âge, 19% des enfants sont en surpoids et 6% sont obèses (6). Tous ne deviendront pas obèses, mais cela nous rappelle que la prévention de l’obésité commence dès le plus jeune âge : un enfant allaité aura moins de chance de devenir obèse plus tard par exemple. Mais que faire en médecine générale ? En tant que soignant, il est important de réaliser une mesure systématique du poids et de la taille de l’enfant, peu importe sa corpulence ! En appliquant ces valeurs sur les courbes de croissance, on peut détecter un rebond d’adiposité précoce, facteur de risque d’obésité à l’âge adulte, ainsi que réaliser des projections jusqu’à l’âge de 18 ans.
Mais que faire si ces courbes sont anormales ? Dans la grande majorité des cas, il s’agit d’une obésité commune, liées à des prédispositions génétiques ainsi que des facteurs environnementaux. Dans 5% des cas, on observe une obésité rare, liée à une tumeur ou à son traitement, ou encore à un syndrome génétique (Prader-Willi, syndrome de ROHHAD). Ces obésités rares sont précoces, sévères et fulgurantes. Dans 3% des cas, l’obésité s’inscrit dans le cadre d’une endocrinopathie telle que l’hypothyroïdie ou la maladie de Cushing. Une endocrinopathie associe une prise de poids avec un ralentissement de la croissance staturale. Ces deux derniers cas nécessitent une prise en charge spécifique.
Face à une obésité commune, il est important de questionner l’enfant sur ses habitudes alimentaires, les conditions du repas, son activité physique, son sommeil. Un enfant qui mange devant la télévision aura un réflexe de satiété tardif et une tendance à moins bien mâcher la nourriture par exemple. La prise en charge passe systématiquement par une discussion diététique, en adressant les remarques de façon positive et en rappelant l’importance que toute la famille s’applique : on mange à table en famille, sans écrans, et on mange bien.
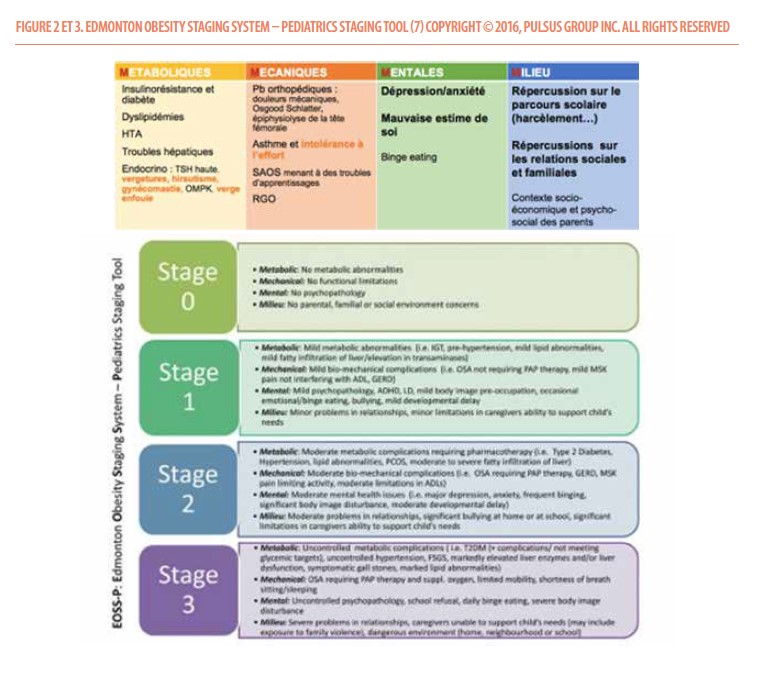
Par ailleurs, l’évaluation des conséquences et des comorbidités liées à l’obésité de l’enfant est primordiale. La classification EOSS (7) reprend ces complications d’un point de vue métabolique, mécanique, psychosocial/mental ainsi que environnemental/milieu. Sur base de cette classification, on distingue quatre stades selon la présence ou l’absence de certaines comorbidités. Le stade 0 correspond à l’absence de comorbidités par exemple, alors que le stade 3 correspond à la présence d’une complication sévère dans au moins une des catégories. Les deux premiers stades seront pris en charge par le médecin généraliste et un diététicien (10 séances remboursées sur 2 ans), alors que les deux derniers nécessitent une prise en charge pluridisciplinaire remboursée par l’INAMI.
Diététique
Mais en quoi consiste la prise en charge diététique de l’obésité ? Un suivi diététique ne se limite pas à la mise en place de régimes. En effet, ceux-ci ne fonctionnent pas à long terme et ont tendance à produire une reprise de poids. Le but n’est pas de manger moins mais de mieux manger. La perte de poids n’est donc pas le seul objectif : on travaille avant tout pour le bien-être et la qualité de vie du patient. Il faut conserver le plaisir de manger et éviter d’ajouter du stress sur l’alimentation. Il n’y a pas de mode alimentaire idéal pour perdre du poids mais des principes généraux existent (BASO 2020) (8) :
- diminuer la densité énergétique des aliments et des boissons en faveur d’aliments à haute densité nutritionnelle ;
- privilégier la consommation de céréales complètes, fruits, légumes, légumineuses, fruits à coques et graines … ;
- remplacer les glucides raffinés par des céréales complètes ;
- remplacer les acides gras saturés et trans par des acides gras insaturés (poissons, huiles, noix, avocats...) ;
- consommer quotidiennement des produits laitiers ou des produits alternatifs avec calcium (2x/jour).
- boire en quantité suffisante (2L par jour), éviter la consommation de boissons alcoolisées et sucrées ;
- manger régulièrement : il est normal d’avoir faim et de manger toutes les 3-4heures,
- utiliser des collations saines ; utilisation de techniques de cuisson saines (préservation de la qualité des aliments).
Concrètement, lors de la consultation diététique, il convient de rechercher la méthode la plus adéquate pour le patient afin de préserver un plaisir alimentaire, de déconstruire d’éventuelles croyances et restrictions cognitives ainsi que de le reconnecter à ses sensations alimentaires/gustatives. Par cet accompagnement, le but est de retrouver le poids d’équilibre du patient, c’est-à-dire le poids que l’on maintient quand on mange selon ses sensations alimentaires.
Psychiatrie
Les croyances et restrictions précédemment évoquées sont bien connues des psychiatres ! Elles font partie des raisons cognitives de l’échec des régimes, pratique que l’orateur ne conseille pas non plus.
Les raisons de l’échec des régimes sont multiples et bien évidemment spécifiques à chaque patient. Cependant, il est possible de dégager plusieurs grands concepts tels que la difficulté face à la multiplicité des modèles théoriques. En effet, les régimes sont multiples et contradictoires, n’offrant pas un cadre nutritionnel rassurant.
Par ailleurs, ces restrictions alimentaires sont souvent associées à la croyance du “tout ou rien”. Le patient essaye de respecter les règles à 100% et lorsque cela ne fonctionne pas, il y a une perte de contrôle. Plus il y a de règles à respecter, plus il y a de risque d’échec !
De plus, ces changements alimentaires s’associent d’un dénigrement du corps, le sujet n’écoute plus ses repères corporels et va même aller jusqu’à se dévaloriser face à des objectifs semblant irréalistes et inatteignables. Ce dénigrement du corps fait parfois écho à des traumatismes vécus par le passé, ayant poussé l’enfant à nier ses propres besoins (maltraitance, incompétence émotionnelle des parents). Un régime, vécu comme une contrainte, peut rappeler ces douleurs passées et provoquer une résistance.
Il est donc essentiel de considérer l’individu dans son ensemble et de ne pas catégoriser une personne en obésité comme une personne faible et sans caractère. L’âge d’apparition de l’obésité peut parfois suggérer un traumatisme ou des angoisses sous-jacentes qui valent la peine d’être explorés ! L’écoute du patient permettra de connaître son vécu, de mieux comprendre ce qui l’a mené vers une situation d’obésité pour ensuite l’orienter vers une prise en charge adaptée en gardant en tête que l’objectif perte de poids n’est peut-être pas l’objectif principal.
Alcoologie
Que ce soit chez le psychiatre ou chez l’alcoologue, les patients présentant un mésusage d’alcool sont à risque d’obésité étant donné le contenu calorique de ces boissons. En effet, 1g d’alcool équivaut à 7kcal contre 4kcal pour 1g de sucre, ce qui induit un stockage d’énergie sous forme de graisse. Paradoxalement, certains patients prenant du poids suite à la consommation d’alcool sont en réalité dans un état de malnutrition. L’ingestion de grandes quantités de boissons alcoolisées provoque une sensation de satiété mais n’apporte cependant aucun nutriment à notre organisme. Cela dérégule l’alimentation avec un risque de mauvaises habitudes alimentaires, ce qui peut à terme entraîner un amaigrissement chez les personnes ayant une consommation importante d’alcool.
Un deuxième lien entre l’obésité et l’alcool est le risque d’atteinte hépatique. Celle-ci se manifeste d’abord par de la stéatose, avec un risque d’évolution vers la fibrose et enfin la cirrhose. La maladie alcoolique du foie s’appelle alcohol-related liver disease (ALD) alors que l’atteinte hépatique liée au surpoids est appelée metabolic dysfunction associated steatotic liver disease (MASLD). L’obésité est corrélée à une augmentation de l’incidence de la stéato-hépatite non alcoolique (NASH ou MASLD/MetALD), multipliée par sept, avec les risques associés cardio-vasculaires et métaboliques tel que le diabète de type 2. L’association de la MASLD et de l'ALD est appelée MetALD.
Il est également impossible de parler d’alcool et d’obésité sans aborder le sujet de la chirurgie bariatrique, en particulier du bypass gastrique. Le risque d’alcoolo-dépendance est beaucoup plus rapide chez un patient ayant bénéficié d’un bypass que chez un patient avec un estomac non opéré (9). Cela s’explique par l’absorption plus rapide de l’alcool, vu l’absence de métabolisation dans l’estomac bypassé. Ceci génère une montée en flèche de l’alcoolémie. Il est classique de considérer qu’un verre d’alcool en vaut deux ou trois chez le patient bypassé (10). De plus, l’hyperphagie tout comme l’alcool entraînent la sécrétion de dopamine, neurotransmetteur largement impliqué dans les processus addictifs. Une règle que l’on pourrait retenir pour les patients bypassés, c’est de leur suggérer zéro alcool !
C’est pour ces raisons qu’il n’est pas recommandé d’effectuer un bypass chez les patients présentant initialement une consommation d’alcool problématique, au risque de provoquer une dépendance en post-opératoire. Pour détecter ces patients, le test PETH est une éventuelle solution. Cette mesure reflète la consommation d’alcool sur les 3 à 6 dernières semaines, mettant en évidence une consommation chronique ou l’abstinence du patient. Un score au-delà de 200 est signe de consommation d‘alcool problématique. Cette analyse du PETH peut être réalisée en période pré-opératoire pour ainsi éviter d’opérer les personnes à risque d’alcoolo-dépendance.
Gastro-entérologie
En dehors de la chirurgie bariatrique et des médicaments, il existe des pistes en gastro-entérologie pour traiter l’obésité. La plus répandue est la mise en place par voie endoscopique d’un ballon intra-gastrique (11). Ce traitement peut être proposé au patient souffrant d’obésité, mais doit être vu comme une aide à la perte de poids, un catalyseur à un changement dans le mode de vie, lequel est indispensable à la réussite du traitement !
Cette technique du ballon intra-gastrique permet d’éviter les carences alimentaires, contrairement à la chirurgie bariatrique. Son efficacité a été démontrée avec une perte moyenne de 16 kg en 6 mois, par l’association de différents mécanismes :
- satiété précoce à court terme par action sur l’hyperphagie ;
- satiété précoce à moyen et long terme par augmentation de la compliance gastrique, activation du nerf vague et du tractus solitaire ainsi que la régulation hormonale de l’appétit ;
- action sur les grignotages par ralentissement de la vidange gastrique.
Il existe plusieurs types de ballons sur le marché, qui se distinguent par remplissage (eau/air), le volume (400- 800ml), le revêtement (silicone ou polyuréthane) et la durée de pose (3 mois à 1 an). Avant la mise en place, l’établissement du profil psychologique du patient est nécessaire pour confirmer l’absence de comorbidité psychiatrique et de troubles du comportement alimentaire. Il est également important de s’intéresser au(x) traitement(s) du patient, ses comorbidités, ses antécédents et ses allergies. En effet, un patient ayant subi une chirurgie abdominale lourde, un patient sous traitement chronique majorant le risque de saignement ou encore un patient allergique au revêtement du ballon ne pourra pas bénéficier de ce procédé.
En favorisant la perte de poids, on diminue le risque de certaines affections gastro-entérologiques. L’obésité est un facteur de risque pour diverses affections œsophagiennes telles que le reflux gastro-œsophagien, principalement lié à de l’obésité abdominale, pouvant s’associer à une œsophagite érosive, ainsi que l’œsophage de Barrett et l’adénocarcinome de l’œsophage (12). Au niveau intestinal, on observe chez le patient obèse une majoration du risque de pathologie inflammatoire intestinale, avec une réponse sub-optimale aux traitements (13), ainsi que du cancer colorectal (14) et de ces récidives, liées à l’inflammation chronique et l’hyperinsulinisme.
Cardiologie
Quels sont ces risques cardiovasculaires associés à l’obésité ? Ce sont la génétique et l’environnement notamment alimentaire qui induisent une augmentation des adipocytes et donc l’obésité. Ces adipocytes dysfonctionnels vont entraîner par différents mécanismes des conséquences directes et indirectes sur les pathologies cardiovasculaires. Petit à petit apparaissent des comorbidités telles que l’hypertension, l’hypercholestérolémie, l’insulinorésistance, l’intolérance glucidique, un état pro thrombotique... Ces facteurs de risque sont ensuite responsables de maladies cardio-vasculaires à proprement parler comme l’insuffisance cardiaque, la fibrose myocardique, l’arythmie ou encore l’infarctus du myocarde, lesquelles impactent le pronostic vital et fonctionnel du patient. Cette augmentation de morbi-mortalité cardiovasculaire chez le patient en obésité est liée au BMI par différents mécanismes que nous allons développer ci -dessous.
Pour ce qui est de l’athérosclérose, dont l’obésité est un facteur de risque modifiable au même titre que le tabac, elle est liée à une dysfonction de l’endothélium, qui génère l’expression de molécules d’adhésion et la formation de cellules spumeuses. Le tissu adipeux, malade, produit toute une série de facteurs, notamment pro-inflammatoires (15), induisant une inflammation systémique au niveau des cellules endothéliales, hépatiques, musculaires et pancréatiques. Cette inflammation du tissu endothélial majore le risque de syndrome métabolique et de maladies cardiovasculaires.
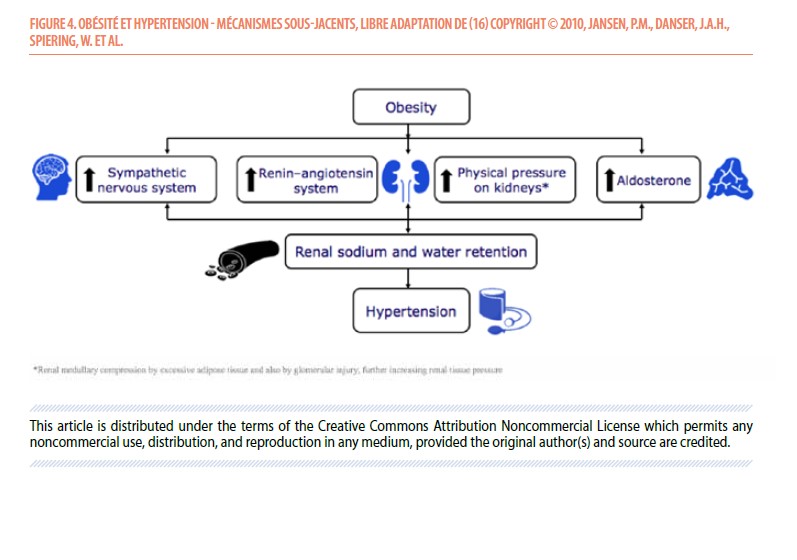
La prévalence d’hypertension artérielle augmente également avec le BMI (16) et ce par divers mécanismes : hausse de l’activation du système nerveux sympathique, élévation de la pression au niveau rénal, augmentation de l’activation du système rénine-angiotensine et majoration de la sécrétion d’aldostérone.
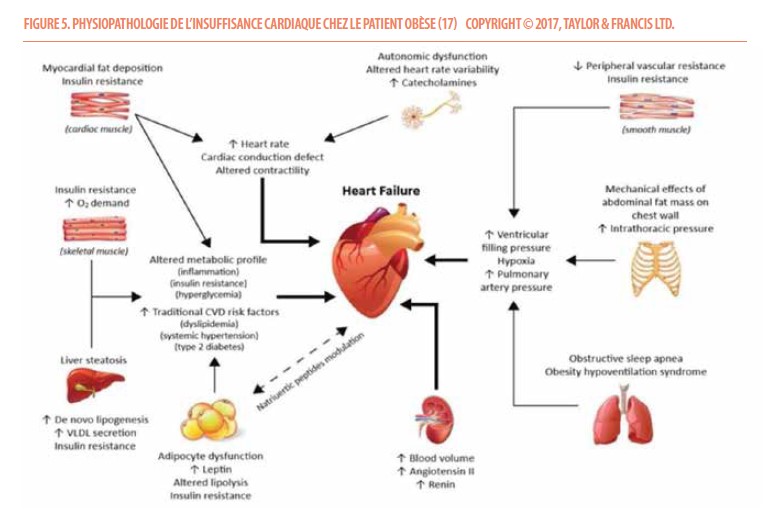
L’insuffisance cardiaque ne fait pas exception aux victimes de l’obésité, son incidence augmente au cours du temps chez le patient obèse (17). Les liens entre obésité et insuffisance cardiaque sont complexes, impliquant différents mécanismes et organes.
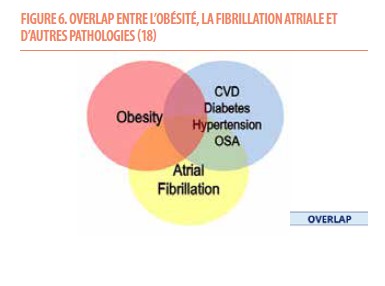
Enfin, il existe également une association entre l’obésité et la fibrillation auriculaire (18) ainsi que différentes pathologies liées au poids telles que les apnées du sommeil. Le risque d’arythmie chez ces patients s’explique par l’augmentation de la graisse péri-cardiaque, le « remodelling » atrial, l’apparition de fibrose, la conduction anormale et la mauvaise contractilité de l’oreillette. Il est dès lors bénéfique de proposer au patient en fibrillation auriculaire une perte de poids en plus de son traitement par ablation.
Prendre en charge et traiter l’obésité, pathologie complexe comprenant de nombreuses implications cardiovasculaires, est donc plus que nécessaire. Malheureusement, le manque de temps des soignants, les conditions défavorables de remboursement de la diététique et des médicaments et le caractère trop tardif des prises en charges ont pour conséquence que le problème de l’excès de poids n’est adressé qu’à un stade déjà avancé.
Uro-gynécologie
Les lombalgies chez les sujets en état d’obésité sont un motif fréquent de référencement chez le kinésithérapeute. Pendant les séances de kinésithérapie chez ces patients, les soignants constatent parfois la présence d’une douleur à l’effort située au niveau lombo-pelvien ainsi qu’une incontinence urinaire d’effort. C’est parfois difficile d’aborder ce sujet tabou lors d’une première séance de kinésithérapie mais c’est primordial !
En France, 14,2% de la population féminine souffre d’incontinence. On distingue parmi ces cas l’incontinence d’effort (50%), l’urgenturie ou hyperactivité vésicale (10-20%) et l’incontinence mixte (30%) L’obésité en est une des causes, surtout sur l’incontinence d’effort et l’urgenturie.
En effet, l’obésité est un facteur de risque majeur d’incontinence urinaire, par différents mécanismes (19) :
- hyperpression abdominale sur la vessie, surtout en cas d’obésité centrale ;
- exacerbation de l’activité vésicale par le système nerveux autonome stimulé par la leptine, hormone qui est davantage sécrétée en cas d’obésité ;
- troubles mictionnels caractérisés par une moindre sensibilité et contractilité vésicale chez les patients atteints de diabète sucré.

Cette pathologie nécessite une mise au point et prise en charge par un kinésithérapeute spécialisé, pierre angulaire du traitement conservateur en association avec la perte de poids. La première étape de la prise en charge consiste en un bilan de kinésithérapie qui permettra d’établir un traitement individualisé pour le patient, traitement qui sera le même en cas d’obésité ou non.
La première séance servira à définir le type d’incontinence dont souffre le patient, via l’anamnèse et l’examen clinique. A l’anamnèse, il est important d’aborder les antécédents médicaux-chirurgicaux, la prise de médicaments, la constipation, la sexualité, l’activité professionnelle, les sports pratiqués et tout autre élément jugé important par le patient. Le bilan clinique se réalise en décubitus dorsal et en position debout. S’agissant d’un examen endocavitaire par voie vaginale ou rectale, l’obtention du consentement éclairé du patient au préalable est indispensable. Le kinésithérapeute recherchera la présence de prolapsus, de désinsertions/avulsions musculaires caractérisées par une asymétrie musculaire (testing musculaire via l’échelle PERFECT) (20), et évaluera le tonus musculaire.
Le traitement général de l’incontinence (21) vise à éliminer les facteurs générateurs de pression sur le plancher pelvien, en corrigeant d’abord la posture en position debout et assise, sachant que la cyphose lombaire prolongée diminue le tonus du périnée. Les ajustements posturaux, la co-contraction des muscles transverses et la pré-contraction des muscles du plancher pelvien lors de l’effort sont nécessaires pour bien répartir la pression dans la cavité abdominale, sans quoi il y a un risque d’incontinence. On éduque également le patient sur les bonnes habitudes à avoir lors de la défécation telle que la bonne position à adopter aux toilettes et la bonne position du bassin. On travaille enfin le verrouillage périnéal avec des exercices d’anticipation automatique.
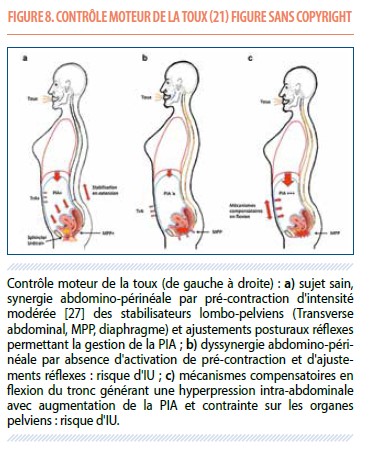
En cas d’incontinence d’urgence, on propose également la réalisation d’un calendrier mictionnel, de la thérapie manuelle, du renforcement musculaire, de la kiné biofeedback et parfois la stimulation électrique.
En cas de prolapsus, on recommande des exercices hypopressifs ainsi que l’utilisation d’un pessaire.
En pratique, le traitement par kinésithérapie se compose de 9 à 18 séances avec des exercices à effectuer à domicile. Les séances sont suffisamment espacées pour permettre au patient d’intégrer les exercices, favorisant l’automatisation après environ 6 semaines. Une reprise rapide mais adaptée des activités est recommandée. Un bilan est réalisé 6 mois après le traitement lors du suivi. Si aucune amélioration n’est constatée après 9 séances, il est conseillé de référer le patient chez un médecin.
Conclusion
Ce symposium RESUMES à propos de l’obésité éclaire une nouvelle fois une pathologie chronique sous l’angle de la multidisciplinarité. Tel que le démontre cet article, Il n’est pas possible aujourd’hui d’aborder et de prendre en charge les patients en obésité sans travailler en réseau avec des liens multidisciplinaires.
Références
- Luquet, S. (2008). Du nouveau dans la régulation de la prise alimentaire. M S-medecine Sciences, 24, 680-682.
- Dehouck, Bénédicte & Prevot, Vincent & Langlet, Fanny. (2014). Plasticity of the blood-hypothalamus barrier: a role in energy homeostasis.. Medecine sciences : M/S. 30. 627-630. 10.1051/medsci/20143006010.
- Rubino, D., Abrahamsson, N., Davies, M., et al. (2021). Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity: The STEP 4 Randomized Clinical Trial. JAMA, 325(14), 1414–1425. https://doi.org/10.1001/jama.2021.3224
- Theilade, S., Christensen, M.B., Vilsbøll, T., Knop, F.K., 2021. An overview of obesity mechanisms in humans: Endocrine regulation of food intake, eating behaviour and common determinants of body weight. Diabetes Obes Metab 23, 17–35.
- Dramé, M., & Godaert, L. (2023). The Obesity Paradox and Mortality in Older Adults: A Systematic Review. Nutrients, 15(7), 1780. https://doi.org/10.3390/nu15071780 S.
- Drieskens, R. Charafeddine, L. Gisle : Enquête de santé 2018 : Etat nutritionnel. Bruxelles, Belgique :Sciensano ; Numéro de rapport : D/2019/14.440/62. Disponible en ligne : www.enquetesante.be
- Hadjiyannakis, S., Buchholz, A., Chanoine, J. P. et al. (2016). The Edmonton Obesity Staging System for Pediatrics: A proposed clinical staging system for paediatric obesity. Paediatrics & child health, 21(1), 21–26. https://doi.org/10.1093/pch/21.1.21
- Belgian Association for the Study of Obesity (2020). Un guide pratique pour l’évaluation et le traitement du surpoids et de l’obésité. En ligne : https://belgium.easo.org/wp-content/uploads/2020/02/BASO_consensus_2020_...
- Ferrario, C., Pralong, F., P., Daeppen, J., Favre, L. (2016), Chirurgie bariatrique et risque accru de dépendance à l’alcool, Rev Med Suisse, 2, no. 511, 602–605.
- Pepino MY, Okunade AL, Eagon JC, Bartholow BD, Bucholz K, Klein S. Effect of Roux-en-Y Gastric Bypass Surgery: Converting 2 Alcoholic Drinks to 4. JAMA Surg. 2015;150(11):1096–1098. doi:10.1001/jamasurg.2015.188
- Yorke, E., Switzer, N. J., Reso, A., Shi, X., de Gara, C., Birch, D., Gill, R., & Karmali, S. (2016). Intragastric Balloon for Management of Severe Obesity: a Systematic Review. Obesity surgery, 26(9), 2248–2254. https://doi.org/10.1007/s11695-016-2307-9
- Richter, J. E., & Rubenstein, J. H. (2018). Presentation and Epidemiology of Gastroesophageal Reflux Disease. Gastroenterology, 154(2), 267–276. https://doi.org/10.1053/j.gastro.2017.07.045
- Singh, S., Dulai, P. S., Zarrinpar, A., et al. (2017). Obesity in IBD: epidemiology, pathogenesis, disease course and treatment outcomes. Nature reviews. Gastroenterology & hepatology, 14(2), 110–121. https://doi.org/10.1038/nrgastro.2016.181
- Mandic, M., Safizadeh, F., Niedermaier, T., et al. (2023). Association of Overweight, Obesity, and Recent Weight Loss With Colorectal Cancer Risk. JAMA network open, 6(4), e239556. https://doi.org/10.1001/jamanetworkopen.2023.9556
- Yao, L., Herlea-Pana, O., Heuser-Baker, J., Chen, Y., & Barlic-Dicen, J. (2014). Roles of the chemokine system in development of obesity, insulin resistance, and cardiovascular disease. Journal of immunology research, 2014, 181450. https://doi.org/10.1155/2014/181450
- Jansen, P.M., Danser, J.A.H., Spiering, W. et al. Drug Mechanisms to Help in Managing Resistant Hypertension in Obesity. Curr Hypertens Rep 12, 220–225 (2010). https://doi.org/10.1007/s11906-010-0123-5
- Powell-Wiley, T. M., Poirier, P., Burke, L. E., et al (2021). Obesity and Cardiovascular Disease: A Scientific Statement From the American Heart Association. Circulation, 143(21), e984–e1010. https://doi.org/10.1161/CIR.0000000000000973
- Magnani, J. W., Hylek, E. M., & Apovian, C. M. (2013). Obesity begets atrial fibrillation: a contemporary summary. Circulation, 128(4), 401–405. https://doi.org/10.1161/CIRCULATIONAHA.113.001840
- Lai, H. H., Helmuth, M. E., Smith, A. R., et al. (2019). Relationship Between Central Obesity, General Obesity, Overactive Bladder Syndrome and Urinary Incontinence Among Male and Female Patients Seeking Care for Their Lower Urinary Tract Symptoms. Urology, 123, 34–43. https://doi.org/10.1016/j.urology.2018.09.012
- da Silva, J. B., de Godoi Fernandes, J. G., Caracciolo, B. R., et al. (2021). Reliability of the PERFECT scheme assessed by unidigital and bidigital vaginal palpation. International urogynecology journal, 32(12), 3199–3207.https://doi.org/10.10 07/s00192-020-04629-2
- Benoit Steenstrup, Els Bakker, François-Xavier Nouhaud, et al. (2017) Grise,Le traitement rééducatif de l’incontinence urinaire : proposition de mise à jour de bonnes pratiques, Kinésithérapie, la Revue, Volume 17, Issue 191,Pages 3-13,ISSN 1779-0123, https://doi.org/10.1016/j.kine.2017.07.012
Affiliations
1. Médecine Générale, Projet Lama d’Ixelles, B-1050 Bruxelles
2. Médecine Générale, B-1150 Bruxelles
Conflits d’intérêts : aucun auteur ne déclare de conflit d’intérêt à propos de cet article.
Correspondance
Dre Audrey Bonnelance
Médecine Générale-ECG
Rue de l'Eglise, 64 bte 2
1150 Woluwé-Saint-Pierre
www.wolumed.be