Introduction
La ferritine est un marqueur reflétant les réserves corporelles en fer. Il s’agit d’une protéine de stockage du fer présente en particulier au niveau des hépatocytes et du système macrophagique. Sa concentration sérique est variable en fonction de l’âge, du sexe et de l’origine ethnique. La limite supérieure de la concentration de la ferritine est de l’ordre de 300-400 µg/l chez l’homme adulte et de 150-200 µg/l chez la femme. L’hyperferritinémie est souvent découverte fortuitement lors d’un bilan biologique de routine. Elle est retrouvée chez 13% des personnes dans une population donnée. Bien que la cause soit généralement non liée à l’hémochromatose, l’hyperferritinémie est un motif fréquent de consultation en hématologie. Toute hyperferritinémie n’est cependant pas synonyme de surcharge en fer. Il est donc important d’en identifier la cause et de déterminer s’il existe ou non un risque de surcharge en fer. Un élément-clé dans la démarche diagnostique initiale doit être le couplage du dosage de la ferritine à celui de la saturation de la transferrine.
Cet article revoit dans un premier temps les causes d’hyperferritinémie et propose ensuite un algorithme de prise en charge. Les mécanismes physiopathologiques n’ont volontairement pas été détaillés.
Étiologies de l’hyperferritinémie
Les principaux mécanismes induisant une majoration de la ferritine sont la lyse cellulaire, l’augmentation de la synthèse de ferritine par induction (alcool, inflammation…) ou une dérégulation génétique.
Quatre causes sont à l’origine de plus de 90% des hyperferritinémies, à savoir : le syndrome métabolique, l’alcoolisme, le syndrome inflammatoire et la lyse cellulaire. Ces causes ne s’accompagnent généralement pas d’une surcharge hépatique en fer. L’hémochromatose classique n’est donc pas la première cause d’hyperferritinémie mais doit toutefois être recherchée en cas de coefficient de saturation de la transferrine élevé.
Une anamnèse approfondie, un examen clinique complet et un bilan biologique de base permettent donc dans la grande majorité des cas d’en identifier l’origine. Si les causes susmentionnées sont écartées, d’autres causes plus rares d’hyperferritinémie doivent alors être évoquées et recherchées.
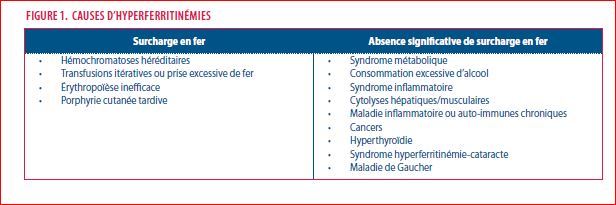
La figure 1 reprend les étiologies d’hyperferritinémie classifiées en fonction du risque ou non de surcharge.
Ferritine + surpoids
Le syndrome métabolique est probablement la première cause d’hyperferritinémie. Il est défini par la présence d’au-moins 3 des 5 critères suivants : tour de taille ≥ 88cm chez la femme et ≥ 102cm chez l’homme, triglycéridémie >150 mg/dl ou traitée, HDL-cholestérol < 40 mg/dl chez l’homme et < 50mg/dl chez la femme, tension artérielle ≥ 130/85mmHg ou traitée, glycémie à jeun > 100mg/dl ou traitée.
Biologiquement, l’élévation de la ferritine est modérée (inférieure à 1000µg/l) et la saturation de la transferrine est normale dans 65% des cas. Cette augmentation de la ferritine est proportionnelle au degré d’insulino-résistance et au nombre de critères présents du syndrome métabolique. Une surcharge hépatique modérée, d’origine bien souvent multifactorielle, complique environ 15% des syndromes métaboliques.
L’intérêt des saignées dans ce contexte est hautement controversé et elles ne sont recommandées. La préconisation de mesures hygiéno-diététiques est primordiale (diminution de la consommation de boissons alcoolisées, bonne hygiène de vie, éviction des suppléments par vitamine C ou en fer,…).
Ferritine + C2H5OH
L’augmentation de la ferritine est non proportionnelle à la quantité d’alcool ingérée. Les mécanismes impliqués dans cette hyperferritinémie sont d’une part, l’action directe de l’alcool sur la synthèse de la ferritine (qui augmente) et de l’hepcidine (qui diminue) et d’autre part, l’induction de lésions hépatiques par l’alcool.
Biologiquement, la saturation de la transferrine est bien souvent normale et dans 85% des cas, le taux de ferritine est inférieur à 1000µg/l. Ce taux de ferritine diminue de 50% dans les 15 jours de l’arrêt de toute boisson alcoolisée et se normalise plusieurs semaines après.
Ferritine + CRP
Toute inflammation aiguë ou chronique, de même que les épisodes infectieux peuvent entraîner une majoration de la concentration de la ferritine. Le mécanisme semble être cytokine-médié par stimulation de la synthèse de ferritine et d’hepcidine par les cytokines inflammatoires.
Biologiquement, la saturation de la transferrine est généralement abaissée et l’élévation de la ferritine est souvent modérée (aux alentours 500-700 µg/l). Toutefois, dans certaines pathologies inflammatoires telles que la maladie de Still ou en cas de syndrome d’activation macrophagique ou de chocs septiques (avec cytolyse associée), la ferritine peut s’élever jusqu’à 10 000 µg/l.
Ferritine + GOT/GPT
Toute cytolyse, principalement hépatique ou musculaire et dans une moindre mesure érythrocytaire ou médullaire, peut entraîner une élévation de la ferritine qui est corrélée au degré de lyse cellulaire.
Biologiquement, une élévation des transaminases est souvent associée. En cas d’hépatites aiguës ou chroniques, la ferritine peut atteindre des concentrations supérieures à 10.000/µg/l et la saturation de la transferrine est souvent élevée, d’autant plus qu’il existe une insuffisance hépato-cellulaire associée.
Ferritine + génétique
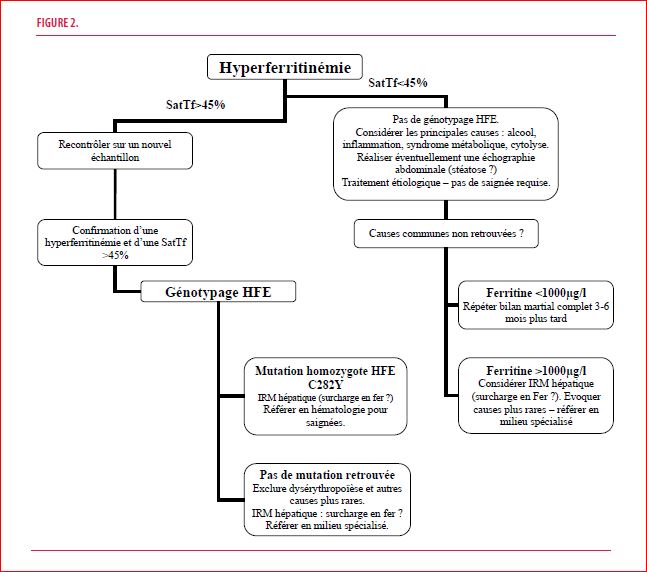
En cas d’hyperferritinémie associée à une élévation du coefficient de saturation de la transferrine (généralement ≥50% chez la femme et ≥60% chez l’homme), le diagnostic d’hémochromatose doit être exclu. La forme la plus fréquente est l’hémochromatose de type 1 (HFE-1).
HFE-1 : il s’agit d’une maladie autosomique récessive secondaire à une mutation C282Y à l’état homozygote du gène HFE. L’hémochromatose est la maladie génétique la plus fréquente, estimée à une personne sur 300 en Belgique. Les complications de type cirrhose ou diabète sont actuellement plutôt rares dans nos contrées en raison d’un diagnostic précoce. En l’absence de ces complications, l’espérance de vie des patients atteints d’hémochromatose est normale. Il est à noter que l’importance de la surcharge en fer est corrélée au coefficient de saturation de la transferrine. Le traitement consiste donc en la réalisation de saignées afin de maintenir une concentration de la ferritine inférieure à 50 µg/l. Par ailleurs, un style de vie approprié doit également être recommandé (alcool, hépatite, obésité).
En Belgique, il est possible de réaliser les saignées dans le cadre du don de sang quand le patient est en phase d’entretien (maximum 6 saignées/an), que cette hémochromatose n’ait pas entraîné de lésion organique et que les critères légaux classiques soient respectés.
La mutation H63D du gène HFE à l’état homozygote ou hétérozygote (H63D/C282Y) ne donne généralement pas de surcharge en fer significative. En cas de surcharge significative, d’autres causes doivent être recherchées (hépatopathie sous-jacente, alcool…).
D’autres mutations génétiques (plus rares) n’impliquant pas le gène HFE ont été également mises en évidence (hémochromatoses de type non HFE ou de type 2 à 4) :
* Coefficient de saturation de la transferrine majoré
- HFE-2 : mutation du gène de l’hémojuvéline ou de l’hepcidine - maladie de transmission autosomique récessive se manifestant avant l’âge de 30 ans et caractérisée principalement par une atteinte gonadotrope et cardiaque.
- HFE-3 : mutation du récepteur de la transferrine de type 2 – maladie de transmission autosomique récessive d’expression surtout hépatocytaire et se manifestant après l’âge de 30 ans.
* Coefficient de saturation de la transferrine normal ou majoré
- HFE-4 : mutation du gène de la ferroportine – maladie de transmission autosomique dominante entraînant une surcharge en fer au niveau hépatique et splénique. L’expression est souvent tardive.
* Coefficient de saturation de la transferrine normal
- Aceruloplasminémie : mutation dans le gène CP qui encode pour la céruloplasmine, entraînant une surcharge en fer diffuse qui s’accompagne de manifestations cliniques telles que problèmes rétiniens ou troubles neurologiques et anémie.Contrairement aux autres formes d’hémochromatoses héréditaires, les saignées sont contre-indiquées et un traitement chélateur de fer est indiqué.
Apports excessifs en fer
Ttransfusions (200mg de fer par poche de sang), vitamines contenant du fer et de la vitamine C (qui majore l’absorption du fer).
Autres étiologies (plus rares)
* Coefficient de saturation de la transferrine élevé
- Porphyrie cutanée tardive : forme de porphyrie la plus fréquente, caractérisée par une photosensibilité avec lésions cutanées bulleuses. Elle est acquise dans 80% des cas et familiale dans 20%. La surcharge hépatique en fer est souvent modérée et induite par la présence simultanée de plusieurs facteurs de risque (alcool, hépatopathie,…). Le traitement principal consiste à réaliser des saignées pour maintenir un taux de ferritine < 25µg/l.
- Dysérythropoïèse/érythropoïèse ineffective ou hémolyse entraînant une absorption intestinale accrue en fer par diminution de la synthèse d’hepcidine: thalassémies, sphérocytose, anémies sidéroblastiques, transfusions chroniques pour syndrome myélodysplasique ou autres pathologies hématologiques, …
* Coefficient de saturation de la transferrine normal
- Syndrome hyperferritinémie – cataracte : affection rare héréditaire autosomique dominante secondaire à une mutation du gène de la L-ferritine. Ce syndrome est caractérisé par la survenue précoce (dès l’enfance) d’une cataracte bilatérale.
- Hyperthyroïdie : l’hyperferritinémie est modérée dans ce contexte et se normalise progressivement après l’instauration du traitement de l’hyperthyroïdie.
- Maladie de Gaucher : maladie autosomique récessive de surcharge lysosomale secondaire à un déficit en glucocérébrosidase. D’autres anomalies biologiques ou cliniques telles qu’une anémie, une thrombopénie, des douleurs osseuses ou une hépatosplénomégalie peuvent être présentes. Il n’y a habituellement pas de risque de surcharge en fer mais celle-ci doit être recherchée en cas de splénectomie et un taux de ferritine supérieur à 1000µg/l. La concentration de la ferritine s’améliore après enzymothérapie substitutive.
- Cancers : souvent métastatiques. La majoration de la ferritine est liée à l’inflammation, la cytolyse, …
D’un point de vue pratico-pratique… que faire face à une hyperferritinémie ?
1. Anamnèse détaillée
- Consommation quotidienne d’alcool ?
- Antécédent transfusionnel ?
- Contexte évocateur en faveur d’une pathologie inflammatoire ou maligne sous-jacente ?
- Traitement au domicile : prise de vitamines, fer ?
- Antécédents médicaux ? Diabète de type 2, hypertension artérielle, obésité, …
- Antécédents familiaux de cataracte précoce, de diabète, de surcharge en fer, de cirrhose ou d’hépatocarcinome dans la famille ?
2. Examen clinique dont poids (BMI), tension artérielle, recherche d’une hépato-splénomégalie.
3. Bilan sanguin complet (de préférence à jeun): Hémogramme, réticulocytes, haptoglobine, enzymologie hépatique (GGT)/musculaire, fonction rénale, ionogramme, TSH, CRP, glycémie, bilan lipidique, bilan martial complet (fer, ferritine, saturation de la transferrine) et éventuellement les sérologies virales HCV/HBV si cytolyse hépatique. Il est indispensable que le bilan biologique martial soit complet : ferritine, fer sérique et saturation de la transferrine.
Conclusion
L’hyperferritinémie est bien trop souvent un motif de consultation en hématologie. Le diagnostic d’hémochromatose (dans sa forme la plus classique) n’est cependant pas la première cause à évoquer et ne devrait être évoqué et confirmé qu’en cas d’élévation de la saturation de la transferrine. Les causes les plus communes d’hyperferritinémie sont : le syndrome métabolique, la consommation d’alcool, l’inflammation et la cytolyse hépatique. Une saturation de la transferrine normale n’exclut cependant pas l’absence de surcharge en fer. Si l’étiologie de l’hyperferritinémie n’est pas évidente, si la ferritine se majore dans le temps ou encore, si la cause semble multifactorielle, il est indispensable de réaliser une IRM hépatique pour confirmer et quantifier un éventuel excès hépatique en fer.
Correspondance
Dr. Géraldine Verstraete
Grand Hôpital de Charleroi
Grand’Rue 3
B-6000 Charleroi
geraldine.verstraete@ghdc.be
Références
- Cullis J, Fitzsimons E, Griffiths W, Tsochatzis E, Wayne Thomas D. Investigation and management of a raised serum ferritin. Br J Haematol. 2018; 181: 331-340.
- Lorcerie B, Audia S, Samson M, Millière A, Falvo N, Leguy-Seguin V, et al. Démarche diagnostique devant une hyperferritinémie. La Revue de médecine interne. 2015 ; 36: 522-529.
- Saglini V, Lazzaro M, Keller F, Perren A. Dépistage de l’hémochromatose génétique. Rev Med Suisse. 2007 ; 3.
- Deugnier Y, Bardou-Jacquet E, Le Lan C, Brissot P. Hyperferritinémies non hémochromatosiques. Gastroentérologie Clinique et Biologique. 2009 ; 33:323-326.
- Deugnier Y, Bardou-Jacquet E, Lainé F. Dysmetabolic iron overload syndrome. Presse Med. 2017 ; 46:e306-e311.