Introduction
Les thrombopénies maternelles sont fréquentes durant la grossesse (5-10%). La valeur seuil est de 150.000 plaquettes/µL. Il faut souligner que les valeurs normales des plaquettes diminuent en fin de grossesse (1). L’intérêt du diagnostic différentiel se situe surtout lors de taux plaquettaire inférieur à 100.000/µL. On ne peut alors pas conclure d’emblée à une thrombopénie gestationnelle (1% des grossesses) (2,3).
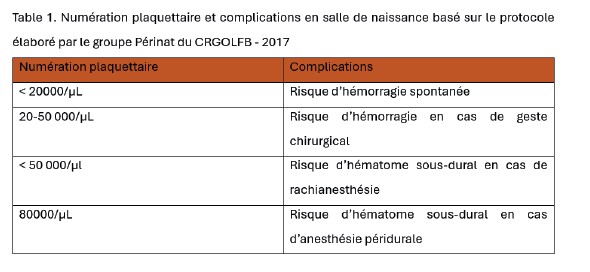
Il existe différents seuils plaquettaires hémostatiques en pratique clinique obstétricale ainsi que pour l’analgésie loco-régionale en salle de naissance. (3,4) (table 1). Ces seuils reposent principalement sur des avis d’experts.
La thrombopénie pendant la grossesse représente plusieurs défis majeurs pour l’hématologue et l’obstétricien. Il faut identifier quand elle est délétère pour la santé maternelle et fœtale ou à risque en période néonatale. Le suivi de grossesse puis l’obtention d’un taux de plaquettes suffisant pour l’accouchement seront également à discuter.
Bilan à réaliser
Il faut avant tout exclure une fausse thrombopénie, liée à la formation d’agrégats plaquettaire sur tube EDTA. Il est alors nécessaire de contrôler sur un tube citraté afin d’obtenir une quantification plaquettaire fiable. Une analyse microscopique sur frottis sanguin permet aussi d’obtenir une numération plaquettaire exacte, de rechercher la présence d’amas plaquettaires et d’exclure une pseudo-thrombopénie.
En première ligne, l’anamnèse permet d’orienter le diagnostic. Les antécédents personnels thrombotiques et obstétricaux ainsi que les antécédents familiaux (antécédent de maladie thrombo-embolique veineuse, retard de croissance, fausse couche, …) sont indispensables. Un score hémorragique, comme le score ISTH-BAT, et une anamnèse médicamenteuse et des toxiques (héparine de bas poids moléculaire, ranitidine, …) doivent être réalisés. Les symptômes associés (saignements prolongés, métrorragies, épistaxis, gingivorragies) ainsi que le timing d’apparition de la thrombopénie ou son existence antérieure à la grossesse, sont des données essentielles afin d’orienter l’examen clinique et les examens complémentaires. Un examen clinique complet et la prise des paramètres (hématomes, pétéchies, signes d’arthrite, adénomégalies ou hépatosplénomégalie, signes neurologiques associés) permettent à leur tour d’aiguiller le diagnostic.
Le diagnostic différentiel se fait sur base d’une prise de sang qui comprend un hémogramme complet vérifié sur un tube citraté et une analyse d’un frottis sanguin permettant d’exclure la formation d’agrégats plaquettaires. Une recherche de schizocytes et de réticulocytes, et le dosage de l’haptoglobine et des LDH suggérant une microangiopathie thrombotique sont également réalisés. L’activité de la protéase ADAMTS-13 sera réalisée en cas de point d’appel clinique ou biologique suspects (1-3). Le bilan sanguin comprendra également un bilan de coagulation, le dosage des immunoglobulines, des sérologies virales (HIV, EBV, hépatites, CMV) et l’évaluation de la fonction hépatique. Selon la situation clinique, des sérologies auto-immunes (incluant la recherche d’anticorps anti-phospholipides) seront effectuées.
Diagnostic différentiel
Les thrombopénies isolées
La thrombopénie gestationnelle
La thrombopénie gestationnelle est un diagnostic d’exclusion et représente 75% des thrombopénies durant grossesse. Elle se déclare le plus souvent au 2e ou 3e trimestre de grossesse et correspond à une thrombopénie modérée sans autre anomalie clinique ou biologique associée. Elle est due à l’hémodilution acquise pendant la grossesse et à la séquestration plaquettaire dans la rate et dans la circulation placentaire. Il n’y a pas d’augmentation du risque hémorragique pendant l’accouchement et ne requiert pas de traitement prénatal. Il s’agit d’un diagnostic d’exclusion et la thrombopénie évolue vers une résolution spontanée en post partum. Il n’y a pas de thrombocytopénie néonatale décrite. Le taux de récurrence est de 50% pour une grossesse suivante (1,2).
Le purpura thrombopénique immun (PTI)
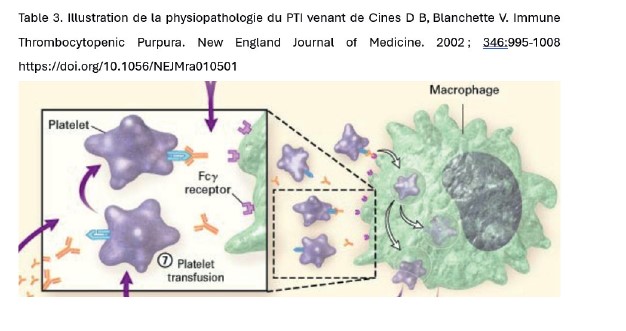
Le purpura thrombopénique immun correspond à 3% des thrombopénies de la grossesse mais est la cause la plus fréquente de plaquettes <100.000/µL au 1er et 2e trimestres de grossesse. Le PTI est une maladie auto-immune avec des auto-anticorps dirigés contre la glycoprotéine de surface IIIa des plaquettes (table 3). Cela accélère la clearance des plaquettes par les macrophages. C’est un diagnostic d’exclusion qui peut être évoqué notamment face à la présence d’une thrombopénie pré-gestationnelle (5).
En pré-conceptionnel, face à une patiente atteinte d’un PTI, il n’y a pas de contre-indications à une grossesse sauf si elle a présenté une hémorragie sévère récente, que le PTI n’est pas contrôlé avec des plaquettes <20.000/µL, qu’elle est réfractaire aux corticostéroïdes (CS) ou aux immunoglobulines intraveineuses ou qu’elle nécessite des traitements potentiellement tératogènes. Il faut rechercher une association avec un lupus ou un syndrome anti-phospholipides (SAPL) chez les patientes présentant un PTI car cela peut avoir des répercussions obstétricales (1).
Durant la grossesse, un suivi régulier des plaquettes est préconisé avec une fréquence rapprochée à partir de la 32-34e semaines d’aménorrhée jusqu’au terme. Il n’y a pas de recommandation quant à un suivi échographique prénatal particulier. Il n’est pas nécessaire de programmer une induction mais le taux plaquettaire recommandé pour l’accouchement est de 50.000/µL. Environ 50% des patientes auront besoin d’un traitement pendant la grossesse ou en vue de l’accouchement (3,5,6).
Le traitement de première ligne repose sur l’administration de CS (Methylprednisone) et/ou d’immunoglobulines intra-veineuses (IVIG). Il est important d’utiliser les doses les plus faibles possibles de corticoïdes pendant la grossesse. Rappelons également que l’utilisation de la dexaméthasone est contre-indiquée chez la femme enceinte. Le délai moyen de réponse est de 4 à 14 jours avec 40 à 70% d’efficacité jusqu’à 28 jours de traitement. Il sera donc rarement utilisé en première intention si l’accouchement est imminent. Il nécessite un suivi glycémique et tensionnel concomitant car il peut entraîner un diabète sucré, une prise de poids, de l’HTA, une rétention hydrosodée ou encore des troubles de l’humeur et du sommeil.
Les IVIG (400mg/kg/jour pendant 5 jours ou 1g/kg/jour pendant 1-2 jours) constituent une option intéressante quand l’accouchement est proche car le délai moyen de réponse est de 1 à 3 jours avec un taux d’efficacité semblable aux CS.
Il n’y a pas de consensus à propos du traitement de seconde ligne. La splénectomie par laparoscopie, bien qu’exceptionnelle, pendant le 2e trimestre offre une rémission dans 75% des cas. Le Rituximab peut également être utilisé mais il existe un passage transplacentaire avec possible immunosuppression fœtale. Enfin, l’utilisation de certains agonistes du récepteur à la thrombopoïétine est rapportée pendant la grossesse et en post-partum (1, 5 ,6 ,7). Il s’agit toutefois d’un usage « off-label » de ces molécules.
La voie d’accouchement sera discutée en fonction du taux plaquettaire de fin de grossesse mais reste dictée par la situation obstétricale. La voie basse est autorisée si le taux de plaquettes est supérieur à 20.000/µL, la césarienne s’il est supérieur à 50.000/µL. Il faut bien sûr prendre en compte le point de vue obstétrical et réaliser une transfusion de plaquettes si, exceptionnellement, l’objectif n’est pas atteint. La pose d’une péridurale est autorisée si la patiente a plus de 70.000-80.000 plaquettes/µL. Une prophylaxie par acide tranexamique a un intérêt afin de prévenir une hémorragie de la délivrance (1,4,5,6).
Contrairement à la thrombopénie gestationnelle, il n’y a pas de résolution spontanée en post-partum.
Au niveau néonatal, 1 à 5% des nouveau-nés risquent d’avoir des plaquettes inférieures à 20.000/µL dans les 3 premiers jours de vie. Il faut donc éviter les gestes invasifs durant l’accouchement (pose d’une électrode sur le scalp fœtal, instrumentation par ventouse ou forceps). Une prise de sang au cordon ainsi qu’un examen clinique complet doivent être réalisés à la naissance. Un bilan sanguin complémentaire est réalisé en présence de thrombopénie néonatale dans le sang de cordon. L’incidence d’hémorragie cérébrale à la naissance est <1% et le traitement maternel n’a pas montré d’effet sur la survenue des thrombopénies néonatales (6).
Les thrombopénies associées à une anémie hémolytique
Face à une thrombopénie et une anémie hémolytique, le diagnostic différentiel est crucial. En effet, celui-ci déterminera le moment de l’accouchement.
La prééclampsie (PEC) et le HELLP syndrome
La prééclampsie est une pathologie liée à une dysfonction placentaire, qui touche 5% des grossesses après 20 semaines d’aménorrhée. Elle associe hypertension artérielle (HTA) (≥140/90 mmHg) et protéinurie (≥ 0,3g/24h). Elle peut être accompagnée de certains critères biologiques ou cliniques qui la rendent « sévère » (8) (table 2).
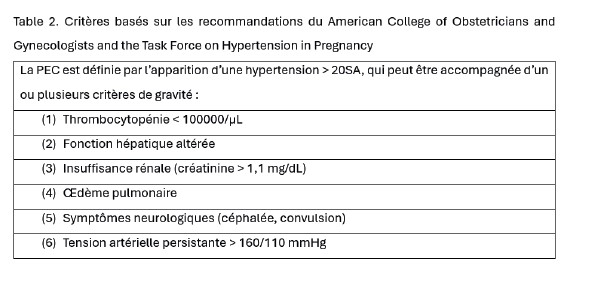
La PEC est associée à une thrombopénie <150.000/µL dans 50% des cas, <100.000/µL dans 7% des cas et <60.000/µL dans 3% des cas.
La pathogenèse de la thrombocytopénie dans la PEC reste incertaine. Les syncytiotrophoblastes des placentas pré-éclamptiques augmenteraient l’activation plaquettaire entrainant la thrombopénie et la formation de micro-thrombi et donc la libération de facteurs contribuant à l’ischémie vasculaire placentaire et systémique (9).
Le HELLP syndrome (Hemolysis, Elevated Liver enzymes, Low Platelets syndrome) est une complication de la PEC. 8 à 24% des PEC sévères développeront un HELLP syndrome. Il peut également être le tableau clinique inaugural comprenant entre autre une barre épigastrique, une HTA et des céphalées. Il n’y a pas de traitement hormis l’accouchement. La voie d’accouchement est choisie selon les conditions obstétricales. Les outcome néonataux dépendent de la prématurité induite et du possible retard de croissance associé lié à la mauvaise fonction placentaire. On observe une résolution spontanée des anomalies biologiques en post-partum. Si ce n’est pas le cas, il faut explorer le diagnostic différentiel des microangiopathies thrombotiques pouvant coexister avec une hypertension gravidique et ne pas conclure à tort à une PEC (1).
Les microangiopathies thrombotiques (table 4)
Le purpura thrombotique thrombocytopénique (PTT)
Le purpura thrombotique thrombocytopénique (PTT) est dû à une diminution importante de l’activité ADAMTS-13, protéase qui clive le facteur de von Willebrand (VWF). Cela résulte en la formation d’agrégats plaquettaires, de microthrombi et en l’apparition d’une anémie hémolytique mécanique associée à la thrombopénie. Le PTT peut être acquis suite à l’apparition d’auto-anticorps inhibant ADAMTS-13 ou, plus rarement, être héréditaire suite à une mutation de la protéase ADAMTS-13 (syndrome d’Upshaw-Schulman). La révélation de la maladie peut avoir lieu pendant la grossesse car elle est liée à augmentation constitutionnelle du VWF et une diminution physiologique de l’activité d’ADAMTS-13.
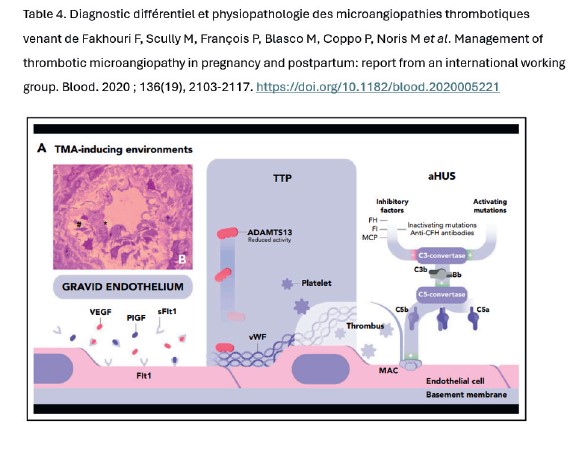
L’incidence est de 1-3/10.000 grossesses, la plupart au deuxième trimestre. On suspecte une microangiopathie thrombotique face à une anémie hémolytique, une thrombopénie et la présence de schizocytes. Le diagnostic du PTT se fait via un dosage de l’activité ADAMTS-13 qui sera <10%. La patiente peut présenter notamment des céphalées mais aussi de la confusion ou des convulsions. On peut également observer une défaillance multi-organique ou d’autres complications thrombotiques (1, 10).
Au niveau obstétrical, le placenta peut présenter de larges zones d’ischémie et entraîner un retard de croissance, la survenue d’une PEC ou même d’une mort fœtale in utero. Il est donc recommandé de réaliser un suivi échographique de la croissance et des dopplers fœtaux.
Le traitement consiste notamment en la réalisation de plasmaphérèses (avec restitution de plasma frais congelé) et en une corticothérapie si le PTT est acquis pour éliminer les auto-anticorps.
Il existerait un passage transplacentaire des anticorps anti-ADAMTS-13 mais aucune répercussion fœtale ni néonatale n’a été rapportée (1, 2, 9).
Il n’y a pas de donnée quant au timing et à la voie d’accouchement mais on peut raisonnablement penser que le suivi combiné entre l’hématologue et l’obstétricien permet de décider d’une éventuelle induction en fonction de la croissance et du bien-être fœtal et de la stabilité du PTT maternel.
Microangiopathie thrombotique médiée par le complément (SHU atypique)
La microangiopathie thrombotique médiée par le complément résulte d’un défaut congénital des gênes régulateurs du complément (C3, facteur H). Cela entraine une activation endothéliale et plaquettaire qui mène à la formation de thrombi, principalement dans la circulation rénale. L’incidence de cette pathologie est de 1/25.000 grossesses. Au niveau biologique, on retrouve donc une insuffisance rénale (créatinine > 2mg/dL) et une activité ADAMTS-13 > 10%.
Les risques obstétricaux semblent correspondre à ceux du PTT, même s’il n’y a pas de données concernant le suivi de grossesse et les outcomes néonataux au vu de la rareté de la pathologie.
Le traitement se fait par un anticorps monoclonal (Eculizumab), passant la barrière placentaire, dont l’usage est autorisé pendant la grossesse (1, 10, 11).
Microangiopathie secondaire aux complications obstétricales
On peut également voir se développer une microangiopathie due à l’activation du complément à la suite de certaines pathologies liées à la grossesse (PEC, HELLP syndrome) ou à des complications obstétricales comme l’hémorragie du post-partum. Il peut y avoir une insuffisance rénale aigue ainsi qu’une microangiopathie associant une anémie hémolytique et une thrombocytopénie sévère. Dans ce cas-là, il est essentiel de réaliser un diagnostic différentiel avec une CIVD et d’exclure une nécrose ischémique du cortex rénal où la dialyse est alors recommandée (10).
Autres causes de thrombopénie
Il existe de nombreuses autres causes de thrombopénie que l’on peut retrouver pendant la grossesse (constitutionnelle, infectieuse, médicamenteuse, maladie de von Willebrand de type II, hypersplénisme, déficience hépatique alcoolique, déficience en vitamine B12 ou en acide folique, origine néoplasique). Cependant, les trois pathologies décrites ci-dessous représentent des urgences obstétricales.
Stéatose hépatique gravidique aigüe
Il s’agit d’une insuffisance hépatique avec détérioration rapide qui concerne 1/7.000 à 1/15.000 grossesses, surtout au 3e trimestre (T3). Elle se manifeste par des nausées, des hypoglycémies, une anorexie, des douleurs épigastriques et des vomissements. Au niveau biologique, on retrouve une élévation importante des enzymes hépatiques et de la bilirubine, suivi de l’apparition d’une coagulopathie marquée par un déficit en fibrinogène.
L’accouchement doit avoir lieu dans un délai de 24h, par voie basse si les conditions obstétricales sont remplies. Le risque d’hémorragie du post-partum est très important. Une transfusion de plasma frais congelé est parfois nécessaire pour augmenter le fibrinogène et prévenir l’hémorragie (9).
Syndrome antiphospholipides catastrophique (CAPS)
Le SAPL nécessite un suivi prénatal rapproché au vu de l’augmentation du risque de PEC précoce et de retard de croissance intra-utérin. Il requiert un traitement préventif par héparine de bas poids moléculaire et aspirine pendant la grossesse. Dans moins de 1% des cas, celui-ci se complique d’un CAPS avec de multiples thromboses entraînant une défaillance multi-organique.
Il existe peu de données dans la littérature mais le traitement consiste potentiellement en une anticoagulation avec une corticothérapie, des plasmaphérèses et des immunoglobulines intra-veineuses. Cette situation clinique nécessite un accouchement immédiat. Il n’y a pas de données sur les outcome néonataux en cas de CAPS (12, 13).
Coagulation intravasculaire disséminée (CIVD)
La CIVD est un état pro-coagulant avec une activation non contrôlée de l’hémostase conduisant à l’apparition de multiples thrombi vasculaires et à une dysfonction multi-organique. Cet état est associé à une augmentation de la dégradation des facteurs de coagulation pouvant mener à des hémorragies non contrôlées. C’est une complication léthale pouvant survenir lors de diverses situations obstétricales (hémorragie du post-partum, infarctus placentaire, PEC, éclampsie, HELLP syndrome, sepsis, embolie amniotique, stéatose hépatique aigüe gravidique, mort fœtale in utero). Il est donc essentiel de diagnostiquer cette complication et de traiter la cause sous-jacente. Au niveau biologique, l’apparition d’une thrombopénie associée à une prolongation de temps de prothrombine (PT) et du temps de céphaline activée (TCA) et à une diminution du fibrinogène est évocateur. La répétition d’un dosage de ces différents facteurs et l’aggravation rapide de ceux-ci est pathognomonique d’une CIVD. Le traitement d’une CIVD nécessite une prise en charge multidisciplinaire entre obstétricien, anesthésiste, hématologue et intensiviste. Il comprend le traitement de la cause sous-jacente, le remplissage et l’utilisation de dérivés sanguins et de facteur de coagulation (14).
Conclusion
La thrombopénie pendant la grossesse laisse entrevoir un diagnostic différentiel varié. Il est important de ne pas la banaliser. En effet, elle peut cacher une pathologie ayant des répercussions sur le bien-être maternel et fœtal.
Une anamnèse bien construite, un examen clinique ainsi qu’un bilan biologique de base permettent d’exclure les pathologies graves qui nécessitent une prise en charge obstétricale immédiate comme la PEC sévère, le HELLP syndrome, la stéatose hépatique aigue gravidique, la CIVD ou encore le CAPS. Lorsque ces urgences obstétricales sont exclues, le bilan et le suivi de thrombopénie nécessite une réflexion conjointe entre hématologue et obstétricien. En effet, les pathologies comme le PTI, le PTT ou la microangiopathie thrombotique médiée par le complément sont des maladies hématologiques complexes pouvant impacter la grossesse ou la période néonatale.
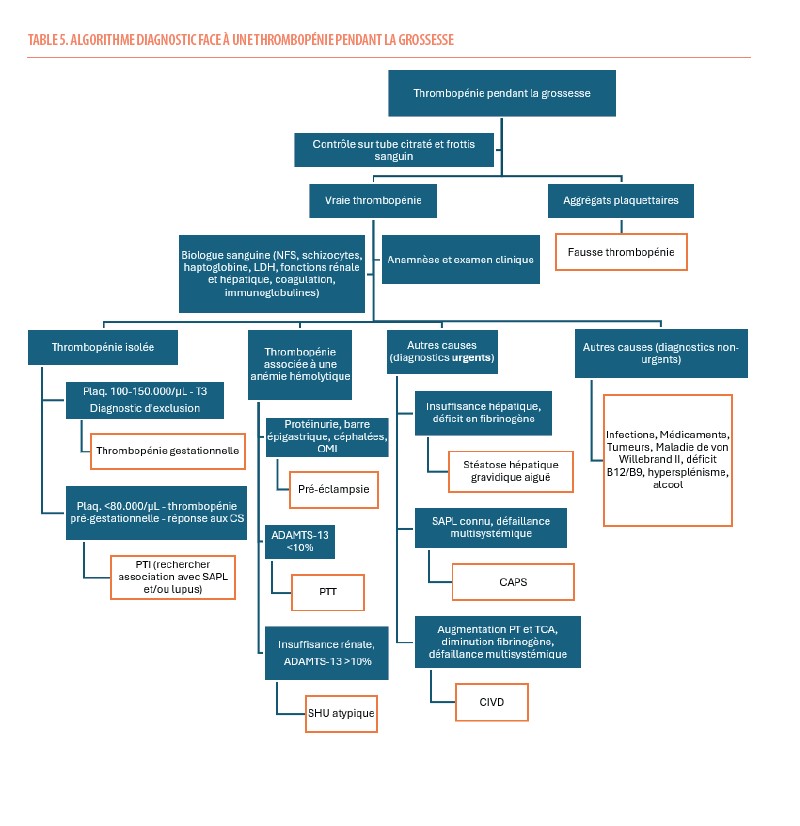
Sur base de cet article, nous avons développé un algorithme sur la mise au point à réaliser face à une thrombopénie pendant la grossesse (table 5).
Références
Pishko A M, Levine L D, Cines D. B. Thrombocytopenia in pregnancy: Diagnosis and approach to management. Blood Reviews. 2020; 40: 100638. https://doi.org/10.1016/j.blre.2019.100638
Park Y H. Diagnosis and management of thrombocytopenia in pregnancy. Blood Research. 2022; 57(S1): S79S85. https://doi.org/10.5045/br.2022.2022068
Gernsheimer T, James A H, Stasi R. How I treat thrombocytopenia in pregnancy. Blood. 2013; 121(1): 3847. https://doi.org/ 10.1182/blood-2012-08-448944
Bauer M E, Arendt K W, Beilin. The Society for Obstetric Anesthesia and Perinatology Interdisciplinary Consensus Statement on Neuraxial Procedures in Obstetric Patients With Thrombocytopenia. Anesthesia & Analgesia. 2021; 132(6): 15311544. https://doi.org/10.1213/ane.0000000000005355
Bussel J B, Hou M, Cines D B. Management of Primary Immune Thrombocytopenia in Pregnancy. New Engl J Med. 2023; 389(6): 540548. https://doi.org/10.1056/nejmra2214617
Eslick R, McLintock C. Managing ITP and thrombocytopenia in pregnancy. Platelets. 2019; 31(3): 300306. https://doi.org/10.1080/ 09537104.2019.1640870
Bussel J, Garcia C. Diagnosis of immune thrombocytopenia, including secondary forms, and selection of second-line treatment. Haematologica. 2022 ; 107(9): 2018–2036. https://doi.org/10.3324/haematol.2021.279513
Roberts J M, August P A, Bakris G, Barton J R, Bernstein I M, Druzin M, et al. Hypertension in Pregnancy. Obstetrics & Gynecology. 2013; 122(5): 11221131. https://doi.org/10.1097/01.aog.0000437382.03963.88
Cines D B, Levine L D. Thrombocytopenia in pregnancy. Blood. 2017 ; 130(21), 2271-2277. https://doi.org/10.1182/blood-2017-05-781971
Fakhouri F, Scully M, François P, Blasco M, Coppo P, Noris M et al. Management of thrombotic microangiopathy in pregnancy and postpartum : report from an international working group. Blood. 2020 ; 136(19), 2103-2117. https://doi.org/10.1182/blood.2020005221
Chinchilla K A, Vijayan M, Garcia B T, Jim B. Complement-Mediated Disorders in Pregnancy. Advances In Chronic Kidney Disease. 2020 ; 27(2), 155-164. https://doi.org/10.1053/j.ackd.2020.01.002
Carmi O, Berla M, Shoenfeld Y, Levy Y. Diagnosis and management of catastrophic antiphospholipid syndrome. Expert Review Of Hematology. 2017 ; 10(4), 365-374. https://doi.org/10.1080/17474086.2017.1300522
Silver, R. M. Catastrophic antiphospholipid syndrome and pregnancy. Seminars In Perinatology. 2018 ; 42(1), 26-32. https://doi.org/10.1053/j.semperi.2017.11.006
Erez O, Mastrolia S, Thachil J. Disseminated intravascular coagulation in pregnancy – insights in pathophysiology, diagnosis and management. Am J Obstet Gynecol. 2015. https://doi.org/10.1016/j.ajog.2015.03.054
Affiliations
1. MACCS Service d’Obstétrique, Cliniques Universitaires Saint-Luc
2. Cheffe de Clinique Service d’Obstétrique, Cliniques Universitaires Saint-Luc
3. Résident Service d’Obstétrique, Cliniques Universitaires Saint-Luc
Correspondance
Dre Julie Godefroi
Cliniques universitaires Saint-Luc
Service d’Obstétrique
Avenue Hippocrate 10
B-1200 Bruxelles
juliegodefroi@hotmail.com