Avec l’avènement des immunothérapies et thérapies cellulaires ciblées, on peut se poser la question de la place de la greffe de moelle à l’heure actuelle ; greffe de moelle qui reste malgré tout la première thérapie cellulaire à succès. Néanmoins, la greffe de moelle ou plus communément la greffe de cellules souches hématopoïétiques reste encore le traitement de choix pour des patients sélectionnés souffrant de pathologies hématologiques tels que la leucémie myéloïde aiguë, la myélodysplasie ou la myélofibrose. Le choix du donneur a toujours été basé initialement sur le typage des globules blancs ou typage HLA (Human Leucocyte Antigen). Une meilleure compatibilité HLA conduit à un meilleur succès de la greffe, essentiellement en protégeant de la maladie du greffon, à savoir la réaction immunitaire du greffon contre son hôte. Cette maladie du greffon se manifeste par des signes aussi divers qu’une éruption cutanée, une diarrhée, une hépatite pour sa forme aiguë, et un syndrome sec ou de l’asthme pour sa forme chronique. Dans ce contexte, un donneur familial compatible ou géno-identique reste le premier choix. Mais la probabilité d’identifier un tel donneur compatible entre frères et sœurs n’est que de 25%, ce qui est parfois difficile dans nos contrées où les familles sont de plus en plus restreintes. De plus, les pathologies hématologiques qui bénéficient d’une greffe de cellules souches hématopoïétiques surviennent à un âge avancé ce qui implique que les donneurs familiaux potentiels sont également âgés. Un donneur plus âgé est associé à un risque de mortalité plus important à la procédure de greffe dû à un taux plus élevé de maladie du greffon et une cellularité plus pauvre du greffon. Il est donc recommandé d’éviter un donneur de plus de 65-67 ans (1). Le rationnel pour éviter un donneur âgé est un répertoire immunitaire moins naïf qui a été plus exposé à des antigènes étrangers et par conséquent plus enclin à réagir avec le receveur (2,3). Si un donneur apparenté géno-identique n’est pas disponible, le second choix s’oriente vers un donneur non apparenté disponible via les registres internationaux, qui comptent à ce jour plus de 35 millions de donneurs. Pour un patient d’origine caucasienne, la probabilité d’identifier un donneur compatible ou phéno-identique est de 60-70%, mais cette probabilité se réduit fortement pour des certaines ethnicités ou des patients métissés. Sur les registres, les donneurs ont généralement un âge médian de 30 ans et sont préférentiellement des hommes. Rien de sexiste là-dedans, mais un donneur féminin pour un donneur masculin est associé à un risque plus élevé de maladie du greffon et la probabilité pour une femme jeune d’être enceinte ou de l’avoir été au moment du don peut également être un problème. Si un donneur familial géno-identique ou un donneur non apparenté phéno-identique ne peuvent être identifié, il faut se tourner vers un donneur dit alternatif. Les sangs de cordon peuvent être utiles pour les patients pédiatriques mais sont souvent plus problématiques pour les adultes à cause de la dose cellulaire faible et la reconstitution immunitaire plus lente. Depuis maintenant plus de 10 ans, on utilise de plus en plus de donneurs haplo-identiques, à savoir, un donneur familial à moitié compatible, n’ayant en commun qu’un seul haplotype. La probabilité entre frères et sœurs d’être haplo-identique est de 50%, mais nous sommes d’office haplo-identique avec nos parents ou nos enfants. À cela s’ajoute, la possibilité d’utiliser un donneur haplo-identique dit du troisième degré parmi les cousins et les oncles/tantes. Il est donc virtuellement possible de trouver un donneur haplo-identique pour tout patient pour autant qu’il ait un peu de famille. Le choix du meilleur donneur devient dans ce cas plus complexe. L’expansion de l’utilisation des donneurs haplo-identiques est secondaire à l’utilisation du cyclophosphamide hautes doses administré aux jours 3 et 4 après la greffe de cellules souches hématopoïétiques. Cela peut paraître étrange d’exposer des cellules souches hématopoïétiques fraichement collectées à de la chimiothérapie, mais cette technique permet de réduire le risque de maladie du greffon aiguë sévère ainsi que le taux de maladie du greffon chronique. Le mécanisme par lequel le cyclophosphamide protège de la maladie du greffon serait par l’ élimination des cellules immunitaires allo-réactives in vivo. En effet, dans cette technique, le greffon qui contient les cellules souches hématopoïétiques mais également des cellules immunitaires est infusé au patient sans aucune immunosuppression. Les cellules immunitaires du donneur réactives avec le receveur vont se mettre à multiplier, ce qui va les rendre sensibles à l’élimination par le cyclophosphamide administré après la greffe, laissant derrière elles, les cellules immunitaires du donneur tolérantes qui participeront à la reconstitution immunitaire du patient (Figure 1).
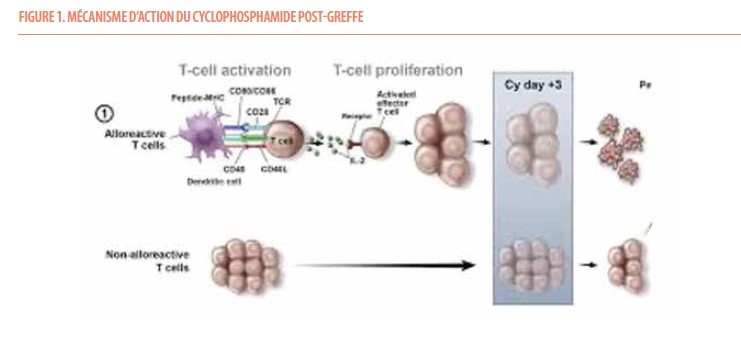
Des données récentes remettent en cause ce mécanisme et penchent plutôt pour un rôle central des cellules immunitaires régulatrices dans la protection contre la maladie du greffon (4). Quoiqu’il en soit, cette technique permet d’élargir le nombre de donneur disponible dans l’entourage immédiat du patient, d’autant plus que certaines données démontrent que la greffe haplo-identique avec cyclophosphamide post-greffe fait soit aussi bien (5) ou un peu moins bien que les greffes au départ des autres types de donneur (6). On se retrouve ainsi dans des situations où on a suffisamment de donneurs disponibles pour ne pas le choisir uniquement sur base de sa compatibilité mais on peut également évaluer les autres facteurs tels que l’âge, le sexe, le groupe sanguin ou le statut CMV. Pour un donneur moyen de 60 ans souffrant d’une pathologie hématologique néoplasique, on peut donc se retrouver à hésiter entre un donneur familial géno-identique du même âge, un donneur non apparenté phéno-identique généralement jeune ou un de ses enfants ou neveux haplo-identiques plus jeune. En sachant que les donneurs familiaux, qu’ils soient géno- ou haplo-identiques, sont plus facilement et plus rapidement disponible qu’un donneur non apparenté, ce qui est un facteur à prendre en considération devant des pathologie aiguë comme une leucémie aiguë où la procédure de greffe est urgente (7). Comparé à un donneur non apparenté phéno-identique jeune, Il semble qu’un donneur haplo-identique jeune donne un risque de mortalité plus élevé (8). Et si on décide de rester en intra-familial, certaines données de la littérature objectivent des résultats similaires qu’on utilise un donneur haplo-identique ou géno-identique (9,10), mais d’autres publications continuent à défendre la meilleure efficacité d’un donneur apparenté géno-identique, même au-delà de son âge (11,12). On ne peut donc formellement répondre à la question de quel donneur serait le mieux pour un patient de 60 ans entre son frère de 62 ans ou son fils de 25 ans. Les données actuelles ne nous permettent donc pas d’exclure un donneur sur la simple base de l’âge, et si un frère de 62 ans est éligible au don de cellules souches hématopoïétiques, il doit être inclus dans les choix des donneurs potentiels. Si on ne peut répondre facilement à la question du meilleur donneur de cellules souches hématopoïétiques en 2023, nous avons accès, grâce à l’utilisation du cyclophosphamide post-greffe, à un choix plus vaste de donneurs qui nous permet de peser les avantages et les inconvénients de chaque donneur potentiel en terme de compatibilité HLA, d’âge, de genre, de groupe sanguin ou du statut CMV.
Affiliations
1. Cliniques universitaires Saint-Luc, Hématologie, B-1200 Bruxelles
Correspondance
Dr Xavier Poiré
Cliniques universitaires Saint-Luc
Service d’Hématologie
Avenue Hippocrate 10
B-1200 Bruxelles
Références
- Alousi AM, Le-Rademacher J, Saliba RM, et al. Who is the better donor for older hematopoietic transplant recipients: an older-aged sibling or a young, matched unrelated volunteer? Blood. 121:2567-73, 2013
- Kollman C, Spellman SR, Zhang MJ, et al. The effect of donor characteristics on survival after unrelated donor transplantation for hematologic malignancy. Blood. 127:260-7, 2016
- Kroger N, Zabelina T, de Wreede L, et al. Allogeneic stem cell transplantation for older advanced MDS patients: improved survival with young unrelated donor in comparison with HLA-identical siblings. Leukemia. 27:604-9, 2013
- Nunes NS, Kanakry CG. Mechanisms of Graft-versus-Host Disease Prevention by Post-transplantation Cyclophosphamide: An Evolving Understanding. Front Immunol. 10:2668, 2019
- Wu Y, Lai X, Shi J, et al. Effect of donor characteristics on T cell-replete haploidentical stem cell transplantation over the last 10 years at a single institution. Br J Haematol. 196:1225-1238, 2022
- Piemontese S, Ciceri F, Labopin M, et al. A comparison between allogeneic stem cell transplantation from unmanipulated haploidentical and unrelated donors in acute leukemia. J Hematol Oncol. 10:24, 2017
- Visram A, Aziz J, Bryant A, et al. Effect of Donor Age and Donor Relatedness on Time to Allogeneic Hematopoietic Cell Transplantation in Acute Leukemia. Biol Blood Marrow Transplant. 24:2466-2470, 2018
- Mehta RS, Ramdial J, Marin D, et al. Impact of Donor Age in Haploidentical-Post-Transplantation Cyclophosphamide versus Matched Unrelated Donor Post-Transplantation Cyclophosphamide Hematopoietic Stem Cell Transplantation in Patients with Acute Myeloid Leukemia. Transplant Cell Ther. 29:377 e1-377 e7, 2023
- Devillier R, Legrand F, Rey J, et al. HLA-Matched Sibling versus Unrelated versus Haploidentical Related Donor Allogeneic Hematopoietic Stem Cell Transplantation for Patients Aged Over 60 Years with Acute Myeloid Leukemia: A Single-Center Donor Comparison. Biol Blood Marrow Transplant. 24:1449-1454, 2018
- Huang J, Huang F, Fan Z, et al. Haploidentical related donor vs matched sibling donor allogeneic hematopoietic stem cell transplantation for acute myeloid leukemia and myelodysplastic syndrome aged over 50 years: A single-center retrospective study. Cancer Med. 9:6244-6255, 2020
- Perales MA, Tomlinson B, Zhang MJ, et al. Alternative donor transplantation for acute myeloid leukemia in patients aged >/=50 years: young HLA-matched unrelated or haploidentical donor? Haematologica. 105:407-413, 2020
- Salvatore D, Labopin M, Ruggeri A, et al. Outcomes of hematopoietic stem cell transplantation from unmanipulated haploidentical versus matched sibling donor in patients with acute myeloid leukemia in first complete remission with intermediate or high-risk cytogenetics: a study from the Acute Leukemia Working Party of the European Society for Blood and Marrow Transplantation. Haematologica. 103:1317-1328, 2018