Introduction
Qui parmi nous monterait dans un avion s’il existe une (mal)chance sur 2000 que celui-ci s’écrase ?
Dans son rapport d’activité de 2023, l’Association Internationale du Transport Aérien (IATA) a calculé qu’un accident ne survenait qu’une fois tous les 1.260.000 vols, soit 0.8 par million (1), ce qui rend le risque « acceptable ». Il en va autrement en médecine transfusionnelle…
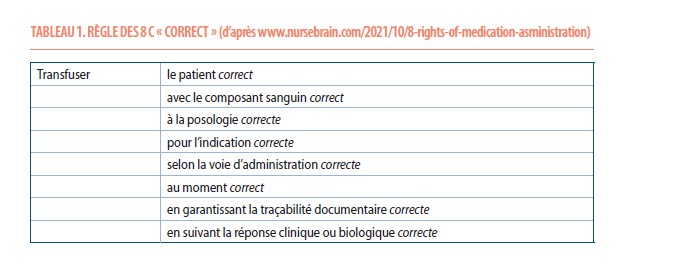
La transfusion est une chaîne complexe faisant intervenir de nombreux professionnels différents. La plupart des incidents transfusionnels résultent d’erreurs multiples (2). Chaque étape du processus doit donc être accomplie de manière scrupuleuse pour garantir la sécurité du patient : la solidité globale de la chaîne transfusionnelle dépend de son maillon le plus faible. À l’instar de ce qui existe pour l’administration des médicaments, le flux de la transfusion doit donc respecter la règle des 8 C, « correct » (Tableau 1).
Tout ce processus est surveillé par l’hémovigilance dont les rôles sont multiples : suivre et analyser les événements indésirables, cibler les unités de soins où la pratique transfusionnelle mérite d’être améliorée, conscientiser sur les risques de la transfusion, avertir rapidement en cas de nouvelles complications, stimuler la recherche, avec pour objectif final d’améliorer la sécurité transfusionnelle.
Pendant des décennies, l’attention a été portée de façon prépondérante sur la menace de transmission de maladies infectieuses (3). Dans nos pays occidentaux, ces risques sont désormais maîtrisés et leur incidence est bien inférieure au niveau de risque acceptable évoqué précédemment (4). Les erreurs dans l’application des procédures de base ont été identifiées comme étant la cause la plus courante d’incidents transfusionnels (plus de 60% des déclarations dans le système d’hémovigilance britannique SHOT) (4), en particulier les erreurs d’identitovigilance. Le risque majeur se produit donc désormais au lit du malade : se tromper de patient lors de la transfusion, ou plus insidieusement, lors du prélèvement de l’échantillon sanguin destiné aux analyses pré-transfusionnelles. Le prélèvement de sang étant l’acte invasif le plus courant pour le personnel infirmier (5), son exécution se serait-elle banalisée ?
Il est navrant de constater que la population pédiatrique (6) et surtout les tout petits, bien que moins souvent transfusés, sont plus à risque que les adultes de recevoir du sang « incorrect ». En effet, on constate que dans les unités de néonatalogie, là où les enfants ne peuvent pas confirmer leur identité, où ils peuvent se ressembler et peuvent ne pas porter de bracelet d’identification, les erreurs d’identitovigilance se perpétuent : 5 à 10% des événements indésirables des rapports SHOT concernent des enfants (4). Ceci est d’autant plus désolant que l’espérance de vie de ces petits patients est encore longue.
WBIT : Définition
WBIT, acronyme anglais largement utilisé même chez nos confrères français, signifie « Wrong Blood in Tube » et pourrait se traduire par la discordance entre l’Identité figurant sur le tube et celle du patient. En effet, il recouvre trois situations problématiques différentes (7) : 1° le sang dans le tube a été prélevé au bon patient mais le tube est identifié au nom de quelqu’un d’autre, 2° le tube est étiqueté au nom du bon patient, mais le sang a été prélevé à quelqu’un d’autre, 3° il existe une discordance d’identité de patient entre ce qui figure sur la prescription et celle qui est reprise sur l’étiquette du tube. Certains limitent la notion de WBIT aux échantillons pour lesquels le groupe sanguin est discordant par rapport à un groupe historique connu pour le patient (2).
Incidence des WBIT (tableau 2)
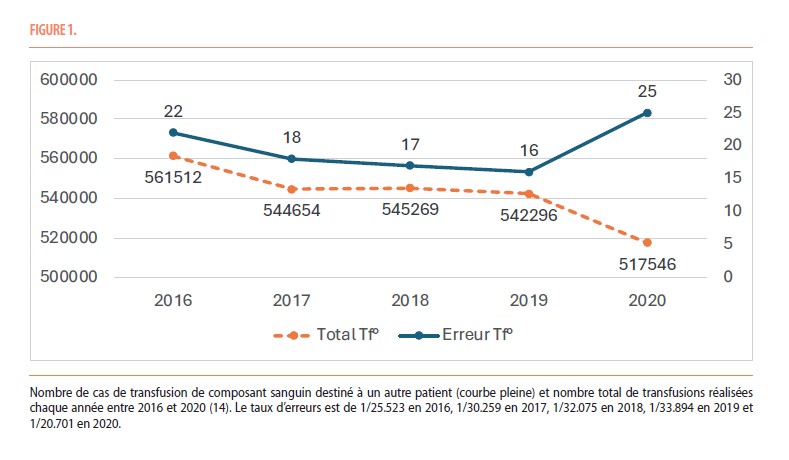
Le WBIT est l’erreur de procédure la plus fréquente dans les rapports d’hémovigilance (7,8) : le groupe d’experts internationaux BEST (Biomedical Excellence for Safer Transfusion) a publié, en 2021, une incidence annuelle de WBIT (dans sa définition complète, cf. supra) comprise entre 4,3 et 5,8 pour 10.000 échantillons (9), soit entre 1/1724 et 1/2326, l’incidence en pédiatrie se situant dans les valeurs hautes de cet écart (2). On peut donc estimer globalement que le risque moyen de WBIT est de 1/2000 (10). Seize ans d’hémovigilance au Royaume-Uni montrent que, malgré d’importants efforts déployés en matière de formation et d’évaluation de compétences, et la publication de diverses recommandations (4), ces erreurs dans le processus transfusionnel n’ont pas diminué au cours du temps. Le nombre annuel de cas de WBIT rapportés au système d’hémovigilance SHOT a augmenté de 734 en 2021 à 890 en 2022 (11), parallèlement à l’augmentation du nombre de transfusions. Par contre, une étude canadienne rapporte une augmentation absolue de l’incidence de WBIT entre 2005 et 2020, malgré de nombreuses formations, audits, évaluation des compétences du personnel de nursing et l’implémentation progressive du contrôle électronique du bracelet depuis 2017 (12). Les auteurs ne peuvent cependant exclure un effet de meilleur rapportage. Une étude multicentrique réalisée aux USA rapporte également une augmentation de cette incidence (1/2323 en 2017 par rapport à 1/2631 en 2007) malgré l’utilisation de contrôle d’identité par code-barres (13). En Belgique, comme dans les autres pays, le problème d’identitovigilance reste donc majeur et toujours d’actualité. Les WBIT ne sont pas rapportés à l’AFMPS parce qu’ils sont gérés directement par le système qualité des laboratoires. Il est donc difficile d’obtenir un état des lieux en Belgique. Cependant, les épisodes de transfusion de composant sanguin destiné à un autre patient sont également le reflet d’erreurs d’identitovigilance. Ceux-ci sont rapportés au système national d’hémovigilance : stable entre 2016 et 2019, la fréquence d’erreurs de transfusion est en augmentation en 2020 (22 pour 517.546 composants sanguins administrés, soit 1/20.701) (Figure 1), (14) !

Les erreurs liées à l’étiquetage des tubes sont trois fois plus fréquentes que les erreurs lors du prélèvement (15). Dans une méta-analyse récente, portant sur des échantillons tout venant, non limités au contexte pré-transfusionnel, les erreurs d’étiquetage étaient responsables du rejet par le laboratoire d’un prélèvement sur 714 (16).
Certaines unités de soins semblent plus à risques que d’autres. Un étude internationale réalisée dans 39 services de transfusion répartis dans 9 pays a rapporté que le taux de WBIT était 1,7 fois plus élevé dans les services d’urgence par rapport aux unités de soins classiques, en particulier lorsqu’il est fait usage de prélèvement de type « rainbow draw » (prélèvement de tubes a priori, « pour le cas où », lors de la mise en place d’une voie d’accès veineux, avant la demande de sang, voire avant une identification correcte du patient) (17). On note également un risque accru dans les blocs d’accouchement lorsque les tubes sont préparés à l’avance, avant la naissance du bébé (15).
Dans l’ensemble des services, les risques sont accrus en période de garde, lorsqu’il y a moins de personnel disponible (15).
Dans certains cas, ces WBIT peuvent être considérés comme des « near misses » (« quasi-accidents » ou « échappées belles » selon nos confrères canadiens). Malheureusement parfois, ils aboutissent à une transfusion incorrecte du patient ; on estime à plus de 330/1 le ratio entre « near misses » et accidents transfusionnels (18).

Causes des WBIT (Figure 2)
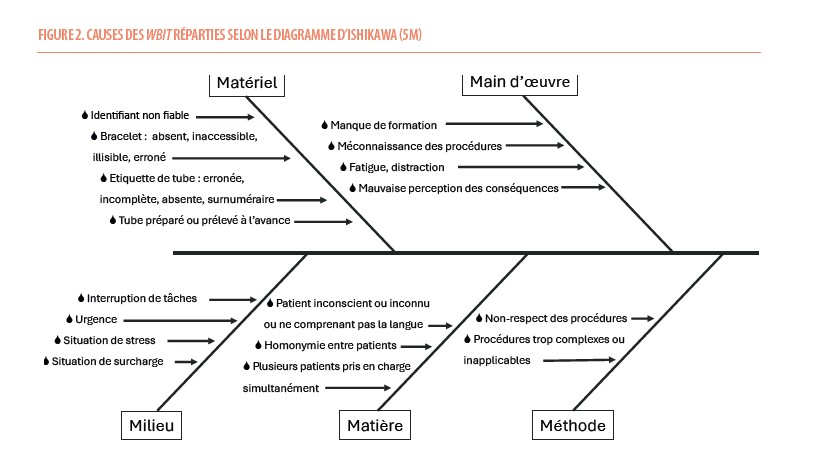
Les causes de WBIT sont multiples et peuvent survenir à toutes les étapes de la chaîne, depuis l’inscription du patient jusqu’à la pose de la transfusion. Elles sont le plus souvent liées à un manquement en matière d’identitovigilance et, dans un nombre important de cas, la cause immédiate est un non-respect des procédures (7,9,11). La volonté du soignant n’est certainement pas de nuire aux patients, mais il perçoit mal la gravité potentielle en cas de violation du protocole (7). On peut également incriminer le manque de formation et donc de connaissances desdites procédures (9,24) et la surcharge de travail. Finalement, certains soignants ont la conviction de pouvoir contourner la procédure, justifiée par une urgence (24), l’acte de prélever du sang étant banalisé, comme déjà évoqué (7).
Les causes directes des WBIT sont reprises ici :
1) Identification incorrecte du patient lors de son inscription à l’hôpital (6,25), ce risque a été évalué à 1/3329 dans l’étude de Ferrera-Tourenc (23).
2) Pas d’identification positive1 du patient lors du prélèvement d’un échantillon et/ou lors de la transfusion proprement dite (2,11,26) : il s’agit d’une cause majeure et récurrente. Il faut qu’une solution alternative existe pour les patients inconscients, ceux qui ne parlent pas ou ne comprennent pas la langue utilisée, ou les patients inconnus (2). Parmi les causes racines de mauvaise identification des patients, on peut évoquer outre les facteurs humains, le fait que le patient ne se trouve pas là où il est censé être, les homonymies, le mélange entre le sang de la maman et le sang de cordon au bloc d’accouchement, ou les prélèvements chez des jumeaux, l’utilisation d’un autre identifiant non fiable comme le numéro de lit (27), et la certitude du personnel de prélever le bon patient, …
3) Problèmes de bracelet d’identification (2) : le bracelet d’identification, posé à l’admission ou changé en cours d’hospitalisation, peut également être erroné. La vérification de l’identité par le soignant avant l’acte de prélèvement ou de transfusion, avec des questions ouvertes, portant sur au moins deux éléments de l’identité, permet de limiter ces risques en mettant en évidence la discordance entre les données figurant sur le bracelet et l’identité réelle du patient. Dans certains contextes, le bracelet peut être absent (ex : en ambulatoire), le bracelet peut être ou illisible (27), non accessible (lors d’une intervention chirurgicale) (7) ou placé près du patient mais non accroché à son bras.
4) Problème d’étiquetage des tubes : il s’agit également d’une cause majeure et récurrente d’erreur. Plusieurs facteurs de risques ont été identifiés parmi lesquels on peut citer le fait d’étiqueter les tubes à l’avance ou à distance du patient (17), l’étiquetage et le prélèvement réalisés par deux personnes différentes, le prélèvement chez plusieurs patients puis étiquetage final à distance du lieu de prélèvement, et des conditions locales de stress (15). Dans l’étude BEST (9), la présence d’une étiquette ou d’un tube surnuméraire lors du prélèvement était une cause majeure de WBIT.
5) Manque de personnel, interruptions de tâches : si la littérature démontre que les interruptions dans les tâches « de compétences » (à l’opposé du travail « cognitif ») produisent davantage d’erreurs (28), la situation est moins claire dans un contexte hospitalier (29, 30). En effet, la complexité des tâches et les interactions entre professionnels mènent à de nombreuses interruptions. Néanmoins, le principe de minimisation du risque impose d’éviter les interruptions, raison pour laquelle les prélèvements devraient être réalisés par deux professionnels différents, à deux moments différents. Dans un contexte de pénurie, la disponibilité de deux professionnels peut néanmoins être difficile à assurer. Des stratégies existent, notamment procéder à une première détermination du groupe sanguin avant l’entrée du patient, comme nous le verrons plus loin.
6) Facteurs humains : fatigue, stress, distraction sont des sources d’erreurs bien démontrées.

1 L’identification positive d’un patient consiste à lui demander de décliner lui-même son, son prénom et sa date de naissance ou à défaut, à contrôler ces données sur un bracelet d’identification attaché au patient.
Conséquences des WBIT
Les WBIT peuvent être détectées rapidement et ne pas avoir d’impact majeur pour le patient, mais peuvent aussi être très graves. Les conséquences des WBIT peuvent survenir à court mais également à long terme. En outre, l’erreur ne se limite pas aux échantillons prélevés pour les tests pré-transfusionnels, mais concerne tous les tubes prélevés en même temps et donc d’autres paramètres biologiques, ce qui peut aboutir à des erreurs de diagnostic et/ou une prise en charge inappropriée du patient (2,7). Seules les conséquences en matière de transfusion seront reprises ici.
Near miss
Le WBIT peut être repéré directement au laboratoire parce que le résultat du groupe sanguin n’est pas concordant avec les résultats obtenus au moyen d’échantillons antérieurs du patient. Lorsqu’une telle erreur est détectée, l’échantillon est éliminé au laboratoire et un nouveau prélèvement est demandé, ce qui entraîne une redondance d’examens (31). L’impact est alors généralement limité pour le patient, mais peut cependant engendrer un retard dans la prise en charge thérapeutique (2).
Il ne faut pas non plus perdre de vue que l’erreur peut potentiellement concerner plusieurs patients (7).
Transfusion de sang incompatible
Si le WBIT n’est pas repéré, l’erreur peut aboutir à une transfusion de sang incompatible (32). Cette dernière peut également être due à une erreur lors de l’administration de la transfusion elle-même sans qu’il y ait eu de WBIT au préalable. Il est surprenant de noter que la fréquence et la variété des erreurs lors de l’administration de composants sanguins sont beaucoup plus grandes que lors de l’administration de médicaments (33).
L’incidence de transfusion de concentrés de globules rouges ABO incompatibles était estimée à 1/263.157 au Royaume-Uni en 2015 (2) et elle demeure constante depuis lors (32). Elle a été calculée à 1/167. 000 pour la période 2016 à 2020 en Belgique (14). Le risque de décès lié à une transfusion ABO incompatible a été estimé entre1/600.000 et 1/800.000 dans l’Etat de New-York (24) : le risque zéro n’existe donc pas (34). Dans le rapport SHOT 2022, 890 WBIT ont été enregistrés parmi lesquels, 320 (soit 46,4%) auraient mené à la transfusion d’un composant sanguin ABO incompatible s’ils n’avaient pas été détectés (11). Il est important de souligner que lorsque le groupe sanguin a été déterminé à deux reprises, il est considéré comme validé et lorsque le laboratoire a fait le choix de la RAI (Recherche d’Anticorps Irréguliers) comme test pré-transfusionnel, le groupe sanguin ABO n’est plus contrôlé par un test de compatibilité directe entre la poche et le plasma du patient. L’incompatibilité peut également porter sur un autre système de groupe sanguin : en effet, actuellement 45 systèmes de groupes sanguins ont été définis et plus de 350 antigènes érythrocytaires ont été décrits. L’incompatibilité peut alors être liée soit à une erreur de phénotype, soit à la non détection d’un anticorps chez le receveur (2,31). De plus, une incompatibilité ABO peut également concerner la transfusion de plasma ou de composants sanguins riches en plasma.
Erreur dans la détermination du phénotype étendu
Pour prévenir les risques d’immunisation chez les patients particulièrement exposés par des transfusions multiples, comme les patients drépanocytaires (2), il est nécessaire de réaliser un phénotypage étendu et de respecter la compatibilité pour d’autres systèmes que ABO et RH. Une erreur de phénotypage liée à un WBIT peut aboutir à une allo-immunisation.
Dans le cadre des allogreffes de cellules souches hématopoïétiques, il est indispensable de connaître le phénotype étendu à d’autres systèmes ABO et Rh du receveur et de son donneur : une erreur de phénotypage peut aboutir à l’établissement de règles erronées pour les transfusions en post-greffe, ainsi que des erreurs d’interprétation dans le suivi de la prise de greffe érythrocytaire.
Erreur dans la prophylaxie anti-RhD chez les parturientes
En cas d’erreur lors du prélèvement du sang de la maman et/ou du sang du cordon, il y a un risque que la maman ne bénéficie pas de la prophylaxie anti-RhD qui serait nécessaire. Dans le rapport SHOT 2022 (11), 45 cas ont été rapportés de femmes RhD négatif qui ont erronément été typées RhD positif. Parmi celles-ci, 9 (20% !) ont donné naissance à un enfant RhD positif et n’ont donc pas bénéficié de la protection immunologique, ce qui peut avoir des conséquences délétères pour les grossesses ultérieures.
Erreur dans la transmission des données au réseau santé
Avec leur accord, les données médicales des patients sont désormais disponibles via le réseau santé dans l’ensemble des institutions hospitalières en Belgique. Ceci concerne également le groupe sanguin et les anticorps anti-érythrocytaires irréguliers. Ces renseignements s’avèrent très utiles dans certaines situations urgentes ou complexes sur le plan immuno-hématologique. Des erreurs d’informations liées à des WBIT vont donc avoir des conséquences non seulement dans l’institution concernée, mais potentiellement, dans d’autres hôpitaux en Belgique. C’est une des raisons pour lesquelles il est recommandé qu’un contrôle du groupe ABO RhD soit effectué avant toute transfusion.
Gestion des non-conformités
De façon globale, ces WBIT entraînent une perte de temps substantielle et des efforts parfois conséquents doivent être déployés pour investiguer l’origine des erreurs et résoudre les problèmes en toute sécurité (2). Ils peuvent également engendrer une perte de confiance des patients et du personnel dans le système de sécurité de la santé.

Prévention des WBIT
L’échantillon de sang est le seul lien entre le receveur et le composant sanguin qui lui est éventuellement destiné. Compte tenu de l’incidence des WBIT et de leurs conséquences pour les patients, chaque institution hospitalière doit mettre en place un plan d’action pour prévenir les effets indésirables pour les patients. Diverses mesures efficaces ont été proposées, mais aucune d’entre elles n’a montré une efficacité absolue (35). C’est la raison pour laquelle il faut les additionner pour parvenir à un risque, si non négligeable, au moins acceptable. Comme décrit dans le modèle COM-B (Capability Opportunity Motivation Behaviour) (36), le changement de comportement est mutuellement influencé par trois grands facteurs : (1) la capabilité, c’est-à-dire les capacités physiques et psychologiques du personnel à s’engager dans le changement, (2) la motivation, qui regroupe les processus mentaux qui dirigent et dynamisent notre comportement, et (3) l’opportunité, c’est-à-dire les facteurs qui sous-tendent la nécessité de changement.
Voici donc quelques mesures qui ont fait preuve d’efficacité :
Double détermination de groupe sanguin sur des échantillons prélevés à des moments différents
En Belgique, lorsque le groupe sanguin a été réalisé à deux reprises dans le même laboratoire, on considère qu’il est validé. En pratique, cela signifie que pour les transfusions de globules rouges, on réalisera, le plus souvent, une RAI assortie du contrôle des antigènes A, B et RhD chez le patient lors de chaque épisode transfusionnel (23) ou, dans un nombre restreint de laboratoires, un test de compatibilité. Mais pour les transfusions ultérieures de plasma et de plaquettes, le groupe ABO RhD ne sera plus contrôlé dans l’hôpital concerné. Théoriquement, si l’incidence de WBIT est évaluée à 1/2000 échantillons, réaliser deux déterminations de groupe sanguin sur des échantillons prélevés de façon indépendante, c’est-à-dire à des moments différents, et si possible, par des personnes différentes, fait statistiquement chuter cette incidence à 1/4.000.000 (1/2000 x 1/2000). Goodnough et al. (37) en 2009, avaient réalisé le même calcul, mais en partant d’un risque de 1/630 au départ et ils concluaient à un risque résiduel de 1/396.000. Cette double détermination permet, selon eux, de neutraliser les effets liés à l’erreur humaine. C’est pour cela qu’elle est devenue une mesure obligatoire dans l’ensemble des systèmes d’hémovigilance internationaux (38).
Idéalement, les deux tubes devraient être prélevés à des jours différents (par exemple, dans un contexte chirurgical, le premier échantillon pourrait être prélevé lors de la consultation d’anesthésie pré-opératoire)2. Mais ceci n’est pas toujours possible et dans certains cas, en particulier en urgence, les deux déterminations de groupe sanguin sont réalisées le même jour.
Pour éviter la tentation de prélever les deux tubes en même temps - ce que rapportent aujourd’hui encore des audits de suivi, malgré les recommandations, les procédures et les rappels - puis de les envoyer au laboratoire de manière différée, certains recommandent que le prélèvement pour la deuxième détermination de groupe sanguin soit réalisé en utilisant des tubes avec des capuchons de couleurs différentes qui ne sont disponibles qu’à la banque de sang et envoyés dans l’unité de soins uniquement lorsque le premier tube est arrivé au laboratoire (12,39). Cette solution n’est pas facile à mettre en place et le bénéfice de son implémentation devra être évaluée en fonction des contraintes logistiques locales.
2 Certains comités de transfusion préconisent d’ailleurs de réaliser un premier groupe sanguin pour tout patient hospitalisé dont le groupe sanguin est inconnu.
Procédure robuste d’identitovigilance
À l’admission, l’utilisation de la carte d’identité avec photo permet de limiter les risques d’erreur d’identitovigilance. Ensuite, lors de l’hospitalisation, la procédure est basée sur la présence d’un bracelet d’identification au bras du patient, dont les renseignements doivent être contrôlés par celui-ci (٤٠). Une procédure spécifique est rédigée lorsque le bracelet du patient est susceptible d’être ôté durant l’hospitalisation (par exemple, lors d’une intervention chirurgicale). On peut, par exemple, proposer que les patients qui sont admis au bloc opératoire soient porteurs de deux bracelets (identiques !).
La procédure d’identitovigilance doit être claire, régulièrement mise à jour et appliquée partout. Elle est censée prévoir les situations complexes comme l’identification des nouveau-nés et petits enfants, des patients « inconnus » en salle d’urgence, des patients qui ne comprennent pas la langue utilisée, ou des patients inconscients en salle d’opération. Elle ne doit pas concerner uniquement les échantillons pré-transfusionnels car les mêmes précautions doivent être appliquées pour tous les échantillons d’un patient quelle que soit leur destination. Il est implicite que le contrôle de l’identité soit réalisé au chevet du patient.
Le système britannique d’hémovigilance conseille que le contrôle d’identité d’un patient soit réalisé par deux personnes différentes pour les actes critiques, comme la transfusion (7). Idéalement, le patient est identifié par des questions ouvertes portant sur deux facteurs (nom-prénom et date de naissance par exemple) (41). Les échantillons, quant à eux, doivent être identifiés au minimum par le nom, le prénom, la date de naissance du patient, ainsi que par un numéro d’identification unique (2). Le système hollandais recommande fortement l’ajout d’un code-barres ou d’une puce d’identification par radiofréquence (RFID) en plus de l’identité « lisible » du patient : en effet, le code-barres offre 15 à 20 fois plus de sécurité qu’un processus de contrôle humain (2).
Appartient au laboratoire la responsabilité d’appliquer une tolérance zéro vis-à-vis des tubes mal ou non étiquetés (42) : le taux de rejet des tubes incorrects est, par ailleurs, un indicateur de performance pertinent.
Procédure stricte pour le prélèvement des échantillons de sang et pour l’acte transfusionnel proprement dit
On sait que l’introduction d’une checklist avant une intervention chirurgicale a clairement amélioré la sécurité du patient. Les systèmes internationaux d’hémovigilance recommandent l’utilisation d’une checklist dans le processus transfusionnel (4).
Rapportage des non-conformités, analyse et feedback aux équipes
Pour chaque WBIT, il est important d’analyser les causes racines avec le personnel impliqué dans l’erreur (43) dans un esprit exempt de coercition ou de répression. Cette analyse permet d’ouvrir les yeux, d’optimiser les processus et de conduire à des changements comportementaux qui contribuent à diminuer les erreurs et améliorer le flux à long terme (٤٤). Différents outils sont disponibles (Pareto, Ishikawa, DMAIC (Define-Measure-Analyze-Improve-Control) , 5 pourquoi ,…)
Formation du personnel et suivi des compétences
“Education should do more than provide instruction” (7) : la formation du personnel ne se limite pas à une simple transmission de procédures. Elle doit comporter un volet sur la nature de l’erreur, les limites des performances humaines, leurs conséquences potentielles (27), et mener à une véritable appropriation avec pour objectif, la sécurité du patient. Il existe de nombreuses publications sur le sujet, qui, toutes, rapportent une diminution du nombre de near misses après formation du personnel (45, 46, 47). De plus, la présence dans l’institution d’une personne référente en transfusion et hémovigilance est un atout indéniable (27).
La formation peut être accompagnée d’outils visuels, comme des dépliants ou des affiches reprenant des messages clés en matière de sécurité transfusionnelle (48) tels que :
- « Ne prélevez pas les deux échantillons en même temps (en les envoyant éventuellement à des moments différents) parce que, si vous vous êtes trompé de patient, vous dupliquez l’erreur. »
- « Si vous avez prélevé le mauvais patient ou si vous vous êtes trompé en étiquetant les tubes, les résultats des deux déterminations de groupe sanguin seront identiques mais FAUX, et le patient pourrait recevoir une transfusion ABO incompatible susceptible d’avoir des conséquences très graves voire mener à son décès. »
- « Les deux prélèvements pour groupage sanguin doivent être réalisés à des moments différents, et idéalement par deux personnes différentes, avec deux demandes d’analyses totalement séparées à envoyer au laboratoire. »
Audits de suivi
Les audits réguliers permettent d’identifier les faiblesses du système ou la non-compliance aux procédures. Ils sont d’autant plus efficaces qu’ils sont suivis d’un retour et d’une discussion avec l’équipe, d’un plan d’actions correctives et préventives (5) avec mise en place d’indicateurs de performance (40). Ils sont programmés à l’avance et répétés dans le temps, ce qui permet de vérifier que les mesures mises en place se perpétuent dans le temps.
Outils informatiques– code-barres
L’utilisation d’outils informatiques pour assurer un contrôle électronique semble le moyen le plus efficace tout au long de la chaîne transfusionnelle, quand il est accompagné d’un contrôle du groupe sanguin avant transfusion, soit sur un échantillon de sang ou sur un document validé par le laboratoire. Une expérience dans un hôpital tertiaire à Taiwan a rapporté l’utilisation de contrôle électronique a permis de faire passer le taux d’erreur de 1/3333 (2008-2010) à 1/100.000 (2017) (49), soit une diminution de 30 fois. Une étude aux USA a décrit une diminution du taux de WBIT d’un facteur 10 et une réduction du nombre d’échantillons mal étiquetés de 47% (50) lorsque le contrôle électronique était accompagné d’une vérification par deux personnes indépendantes.
Mais on sait qu’aucun système n’a permis d’éradiquer toutes les erreurs et il est fortement conseillé d’assortir le contrôle électronique d’un contrôle visuel comme mesure de sécurité supplémentaire (9). En effet, le contrôle électronique n’est sûr que sous certaines conditions (7) :
- Que le contrôle de l’identité du patient se fasse par scannage du bracelet attaché au bras du patient et qu’il n’y ait qu’un seul bracelet disponible pour le patient
- Que le programme informatique soit sûr et intuitif pour l’utilisateur
- Que l’impression d’étiquettes et que l’étiquetage des tubes soient réalisés au chevet du patient
- Que le support informatique soit adapté, disponible et efficace afin d’éviter les contournements (12).
Il est évident que, dans un souci de sécurité, une procédure de secours utilisant des documents papiers doit être disponible en cas de panne de l’outil informatique.
Utilisation d’une barrière mécanique (38)
Ce système a été développé il y a une dizaine d’années. Il consistait à mettre la poche de sang dans un système fermé qui ne pouvait s’ouvrir que par l’utilisation d’un code unique basé sur l’identité du patient et le numéro de la poche (24). Il avait pour objectif de garantir que le patient chez qui on a prélevé un échantillon pré-transfusionnel est le même que celui qui va être transfusé. Il n’a pas connu un déploiement très étendu et n’est plus utilisé actuellement.
Implication du patient – Patient partenaire
De plus en plus, le patient est considéré comme un acteur de son trajet de soins (51). C’est d’ailleurs une exigence des référentiels d’accréditation des hôpitaux, comme le système ACI (Accréditation Canada International, critère 22.2). En matière de transfusion, le patient pourrait intervenir à différents niveaux (52) :
- En s’informant sur la pertinence d’une transfusion, du type de composant et du nombre de poches nécessaires selon sa situation clinique ;
- En interrogeant sur les risques et les bénéfices de la transfusion avant de donner son consentement ;
- En exigeant d’avoir toujours un bracelet d’identification ;
- En vérifiant les données qui figurent sur son bracelet d’identification, sur les tubes qui lui ont été prélevés ;
- En interrogeant sur ce qui peut se passer durant la transfusion et en vérifiant que ses paramètres sont bien contrôlés avant, pendant et après la transfusion ;
- En rapportant les événements indésirables qu’il a subis ;
- …

Que faire quand deux déterminations de groupe sanguin ne sont pas disponibles ?
Avant tout, vérifier qu’il n’est pas possible d’obtenir un 2e échantillon (8) :
- En situation d’urgence : tenter de prélever un ٢e tube juste avant d’entamer la transfusion (sinon il y a un risque de contamination de l’échantillon par le sang transfusé) ;
- Envisager la possibilité de prélever le 2e échantillon dès que le patient est endormi en salle d’opération à condition que la RAI soit négative ;
- De façon générale et pour la pédiatrie en particulier, rappeler la possibilité de travailler sur un 2e tube de faible volume (éventuellement rempli par du sang capillaire) puisqu’il n’est pas nécessaire de refaire une RAI sur le 2e échantillon (38).
L’accès à une base de données nationale permet de comparer le résultat d’un premier groupe sanguin à celui obtenu dans un autre laboratoire « officiel » (ne pas valider les résultats transmis par téléphone ou figurant dans un rapport d’hospitalisation) (53, 54). Malheureusement, une telle base de données n’est pas encore disponible en Belgique.
En situation d’extrême urgence, il est toujours possible de délivrer du sang O (RhD négatif ou positif selon la situation clinique, l’âge et le sexe du patient) en attendant une détermination fiable.
Conclusions
Il n’est plus à démontrer que l’identification du patient est un véritable enjeu de la gestion des risques hospitaliers (31) et constitue une étape-clé de la sécurité transfusionnelle (11). Dans un hôpital, elle implique bon nombre d’acteurs : le personnel d’admission en hospitalisation, le personnel infirmier et médical, les coursiers et le personnel de la banque de sang (38). Les expériences rapportées nous apprennent qu’une attention particulière doit être portée en pédiatrie, au bloc d’accouchement, pour les patients endormis ou dans le coma, et en situation d’urgence (38).
La sécurité transfusionnelle concerne l’ensemble du processus de transfusion dans l’hôpital et pas seulement le contenu ou l’intégrité de la poche (27). Elle est basée sur la double détermination du groupe sanguin ABO RhD, - les 2 systèmes de groupe les plus importants en matière de transfusion -, réalisées sur 2 échantillons prélevés de manière totalement indépendante. Tout doit être mis en place pour éviter, autant que faire se peut, la précipitation. Dans ce sens, une détermination de groupe peut être réalisée quelques jours avant une intervention chirurgicale, ou la veille. Des procédures strictes doivent être rédigées et régulièrement contrôlées pour éviter le prélèvement des deux échantillons simultanément. Aucune raison ne peut justifier une telle pratique, source d’erreurs transfusionnelles potentiellement graves. Ceci doit être considéré comme une faute professionnelle.
Éliminer les WBIT représente un véritable défi auquel sont confrontés tous les laboratoires (12). La plupart des erreurs sont liées à une mauvaise pratique : il est clair que des facteurs humains (y compris l’environnement de travail, la formation, la communication, …) favorisent l’occurence de ces incidents. Avant d’imposer, en vue de les améliorer, une modification des pratiques, il ne faut donc pas sous-estimer la résistance humaine au changement (33). C’est regrettable, mais le nombre d’années d’expérience non seulement n’abolit pas le risque de mauvaise identification si on est distrait ou interrompu, mais dans certains cas, entraîne une banalisation des gestes « courants » comme le prélèvement d’échantillons de sang. La formation et la sensibilisation aux facteurs humains devrait permettre de mieux conscientiser les personnes par rapport à la vulnérabilité humaine vis-à-vis de l’erreur, particulièrement dans le monde médical où les facteurs de risques sont nombreux (2,11) et souvent conséquents.
La sécurité et la fiabilité ne sont pas des paramètres statiques mais dynamiques. Puisque les déviations se perpétuent dans un système complexe, leur détection, leur analyse et leur correction doivent être réalisées en continu (18). Les « near misses » offrent la possibilité de détection précoce des faiblesses du processus et l’opportunité de les corriger. La gestion de la qualité dans l’hôpital a aussi pour mission de soutenir et fournir les ressources nécessaires pour que la sécurité transfusionnelle soit optimisée.
In fine, l’implication du patient en tant que partenaire motivé dans la sécurité de son parcours hospitalier doit également être encouragée (52, 40).
Références
- IATA. Annual Review 2024. https://www.iata.org/ iata-annual-review-2024.pdf (consulté le 1er juillet 2024).
- Bolton-Maggs PHB, Wood EM, Wiersum-Osselton JC. Wrong blood in tube – potential for serious outcomes: can it be prevented. Br J Haematol. 2015; 168:3-13.
- Garraud O, Tissot JD, Osselaer JC, Folléa G, Vernant JP, Lefrère JJ. Transfusion safety from the viewpoint of a musical quintet. Blood Transfus. 2015; 13:687.
- Bolton-Maggs PHB. Transfusion and Hemovigilance in Pediatrics. Pediatr Clin N Am. 2013; 60:1527-1540.
- Haroun A, Al-Ruzzieh MA, Hussien N, Masa-ad A, Hassoneh R, Abu Alrub, Ayaad O. Using failure mode and effects analysis in improving nursing blood sampling at an international specialized cancer center. Asian Pac J Cancer Prev. 2021; 22:1247-1254.
- Varey A, Tinegate H, Robertson J, Watson D, Iqbal A. Factors predisposing to wrong blood in tube incidents: a year-s experience in the North East of England. Transfus Med. 2013; 23:321-325.
- Australian Red Cross Lifeblood. Wrong blood in tube (WBIT) – what can we do to reduce errors ? Blood Matters 2023. https://www.health.vic.gov.au/patient-care/blood-matters-program.
- Chavez-Ortiz JL, Griffin I, Kazakova SV, Stewart PB, Kracalik I, Basavaraju SV. Transfusion-related errors and associated adverse reactions and blood product wastage as reported to the National Healthcare Safety Network Hemovigilance Module, 2014-2022. Transfusion. 2024; 64:627-637.
- Dunbar NM, Kaufman RM, WBIT Study Investigators. The Biomedical Excellence for Safer Transfusion (BEST) Collaborative. Factors associated with wrong blood in tube errors: an international case series – The BEST collaborative study. Transfusion. 2022; 62:44-50.
- Dzik WH, Murphy MF, Andreu G, Heddle N, Hogman C, Kelomaki R, et al. & the Biomedical Excellence for Safer Transfusion (BEST) Working Party of the International Society for Blood Transfusion. An international study of the performance of sample collection from patients. Vox Sang. 2003; 85:40-47.
- Bolton-Maggs P, Molloy A, Carter-Graham S. Near miss – Wrong Blood in Tube. Annual SHOT report 2022. Chapter 12a: 125-130.
- Obaidallah N, Downie H, Colavecchia C, Callum J, Lin Y. Implemntation of a blood bank generated tube for second blood group determination: Challenges, yield, and cost. Transfusion. 2022: 62:784-790.
- Novis DA, Lindholm PF, Ramsey G, Alcorn KW, Souers RJ, Blond B. Blood Bank specimen mislabelling. A College of American Pathologists Q-Probes. Study of 41 333 blood bank speimens in 30 institutions. Arch Pathol Lab Med. 2017; 141:255-259.
- AFMPS. Rapport annuel d’hémovigilance 2020. https://www.afmps.be/Rapport_annuel_hemovigilance_2020 (consulté le 1er juillet 2024).
- Haslina Mohd N, Joibe KF, Hasan MN. Prevalence of near-miss events of transfusion practice and its associated factors amongst house officers in a teaching hospital. Oman Med J. 2021; 36:e249. Doi 10.5001/omj2021.55.
- Getawa S, Aynalem M, Melku M, Adane T. Blood specimen rejection rate in clinical laboratory: a systematic review and meta-analysis. Pract Lab Med. 2023: 33:e00303. 1-10.
- Dunbar NM, Delaney M, Murphy MF, Pagano MB, Saifee NH, Seheult J, et al., the WBIT Study Investigators on behalf of the Biomedical Excellence for Safer Transfusion (BEST) Collaborative. Emergency departments are higher-risk locations for wrong blood in tube errors. Transfusion. 2021; 61:2601-2610.
- Kaplan HS. Getting the right blood to the right patient: the contribution of near-miss event reporting and barrier analysis. Transfus Clin Biol. 2005; 12:380-384.
- Murphy MF, Steran BE, Dzik WH. Current performance of patient sample collection in the UK. Transfus Med. 2004; 14:113-121.
- Chiaroni J, Legrand D, Dettori I, Ferrera V. Analysis of ABO discrepancies occurring in 35 French hospitals. Immunohematology. 2004; 44:860-864.
- Gonzalez-Porras JR, Graciani LF, Alvarez M, Pinto J, Gonde MP, Nieto MJ, Corral M. Tubes for pretransfusion testing should be collected by blood bank staff and hand labelled until the implementation of new technology for improved sample labelling. Results of a prospective study. Vox Sang. 2008; 95:52-56.
- Grimm E, Friedberg RC, Wilkinson DS, AuBuchon JP, Souers RJ, Lehman CM. Blood bank safety practices: mislabeled samples and wrong blood in tube – a Q-Probes analysis of 122 clinical laboratories. Arch Pathol Lab Med. 2010; 134:1108-1115.
- Ferrera-Tourenc V, Lassale B, Chiaroni J, Dettori I. Unrelable patient identification warrants ABO typing at admission to check existing records before transfusion. Transfus Clin Biol. 2015; 22:66-70.
- Clifford SP, Mick PB, Derhake BM. A case of transfusion error in trauma patient with subsequent root cause analysis leading to institutional change. J Investig Med High Iimpact Case Reports. 2016; 1-4.
- Cohen R, Ning S, Tak Sheng Yan M, Callum J. Transfusion safety: the nature and outcomes of errors in patient registration. Transfus Med Rev. 2019; 33:78-83.
- Fukami T, Uemura M, Terai M, Umemura T, Maeda M, Ichikawa M, et al. Intervention efficacy for eliminating patient misidentification using step-by-step problem-solving procedures to improve patient safety. Nagoya J Med Sci. 2020; 82:315-321.
- Murphy MF, Stanworth SJ, Yazer M. Transfusion practice and safety: current status and possibilities for improvement. Vox Sang. 2011; 100:46-59.
- Cheol Lee B, Duffy VG. The effects of task interruption on human performance: a study of the systematic classification of human behavior and interruption frequency. Human Factors and Ergonomics in Manufacturing & Service Industries. 2015; 25: 137-152.
- Grundgeiger T, Sanderson P. Interruptions in healthcare: theoretical views. Int J Med Informatics. 2009; 78:293-307.
- Rivera-Rodriguez AJ, Karsh BT. Interruptions and distractions in healthcare: review and reappraisal. BMJ Quality & Safety. 2010; 19:304-312.
- Flourié F, Duboeuf S, Oriol P, Benamara A, Rigal E, Garraud O. Identitovigilance et son impact sur les résultats d’immuno-hématologie érythrocytaire assurant la sécurité transfusionnelle. Ann Biol Clin. 2008 ; 66 : 597-600.
- Carter-Graham S, Swarbrick N, Tuckley V, Hughes C, Poles S, Narayan S. Incorrect Blood Component Transfused (IBCT). Annual SHOT report 2022. Chapter 9: 71-90.
- Frietsch T, Thomas D, Schöler M, Fleiter B, Schipplick M, Spannagl M, et al. Administration safety of blood products – Lessons learned from a national registry for transfusion and hemotherapy practice. Transfu Med Hemother. 2017; 44:240-254.
- Storch EK, Rogerson B, Eder AF. Trend in ABO-incompatible RBC transfusion-related fatalities reported to the FDA, 2000-2019. Transfusion. 2020; 60:2867-2875.
- Cottrell S, Watson D, Eyre TA, Brunskill SJ, Dorée C, Murphy MF. Interventions to reduce wrong blood in tube errors in transfusion: a systematic review. Transfus Med Rev. 2013; 27:197-205.
- Michie S, van Stralen MM, West R. The behaviour change wheel : A new method for characterising and designing behaviour change interventions. Implem Sci. 2011; 6:42. Doi:10.1186/1748-5908-6-42.
- Goodnough LT, Viele M, Fontaine MJ, Jurado C, Stone N, Quach P, et al. Implementation of a two-specimen requirement for verification of ABO/Rh for blood transfusions. Transfusion. 2009; 49:1321-1328.
- Gálvez J, Hsu G, Dubow S, Obermeier L, Blai P, Friedman D, Sesok-Pizzini D. How do I… incorporate a two-sample blood type verification in a pediatric hospital. Transfusion. 2020; 60:2787-2792.
- Glisch C, Jawa Z, Brener A, Carpenter E, Gottschall J, Treml A, Scott Karafin M. Evaluation of a two-sample process for prevention of ABO mistransfusions in a high volume academic hospital. BMJ Open Quality. 2018; 7:e000270. 1-5.
- De Rezende HA, Melleiro MM, Tochika Shimoda G. Interventions to reduce patient identification errors in the hospital setting: a systematic review protocol. JBI Database System Rev Implement Rep. 2019; 17:37-42.
- OMS. Solutions pour la Sécurité des Patients | volume 1, solution 2 | Mai 2007 https://cdn.who.int/media/docs/default-source/patient-safety/psf/patient...
- van Dongen-Lases EC, Corned MP, Grankvist K, Ibarz M, Kristensen GBB, Lippi G, Nybo M, Simundic AM, on behalf of the Working Group for Preanalytical Phase (WG-PRE), European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). Patient identification and tube labelling – a call for harmonisation. Clin Chem Lab Med. 2016; 54:1141-1145.
- Makroo RN, Bhatia A. Delta check for blood groups: a step ahead in blood safety. As J Transfus Sci. 2017; 11:18-21.
- Srinivasaragavan D, Ramalingam K, Ramani P. Root Cause Analysis: unraveling common laboratory challenges. Cureus. 2024; 16:e53393. DOI 10.7759/cureus.53393.
- Sahmoud S, Ashry EM, El Kalioby M, Kamel N. Knowledge improvement of blood transfusion safety among pediatricians : post-educational intervention. Transfus Med Rev. 2021; 35:135-139.
- Najafpour Z, Hasoumi M, Behzadi F, Mohamadi E, Jafary M, Saeedi M. Preventing blood transfusion failures: FMEA, an effective assessment method BMC Health Serv Res. 2017; 17:453. 1-9.
- Strauss R, Downie H, Wilson A, Mounchili A, Berry B, Cserti-Gazdewich C, Callum J. Sample collection and sample handling errors submitted to the transfusion error surveillance system, 2006 to 2015. Transfusion. 2018; 58:1697-1707.
- Thomas W, Davies J, Asamoah A, Scott-Molloy C, Sansom V, Kerr J. Two samples for blood transfusion: single centre experience. Transfus Med. 2014; 24:209-212.
- Chou SS, Chen YJ, Shen YT, Yen HF, Kuo SC. Implementation and effectiveness of a Bar-Code-based transfusion management system for transfusion safety in a tertiary hospital: retrospective quality improvement study. JMIR Med Inform. 2019; 7:e14192. 1-12.
- Passwater M, Huggins YM, Delvo Favre ED, Mukhtar F, Pelletier JPR. Adding automation and independent dual verification to reduce wrong blood in tube (WBIT) events. Am J Clin Pathol. 2022; 158:212-215.
- Pomey MP, Flora L, Karazivan P, Dumez V, Lebel P, Vanier MC, Débarges B, Clavel N, Jouet E. « Le “Montreal model” : enjeux du partenariat relationnel entre patients et professionnels de la santé », Santé Publique, 2015/HS (S1), 41-50. DOI : 10.3917/spub.150.0041. https://www.cairn.info/revue-sante-publique-2015-HS-page-41.htm
- Davis RE, Vincent CA, Murphy MF. Blood transfusion safety: the potential role of the patient. Transfus Med Rev. 2011; 25: 12-23.
- MacIvor D, Triulzi DJ, Yazer MH. Enhanced detection of blood bank sample collection errors with a centralized patient database. Transfusion. 2009; 49:40-43.
- Delaney M, Dinwiddie S, Nester TN, AuBuchon JA. The immunohematologic and patient safety benefits of a centralized transfusion database. Transfusion. 2013; 53:771-776.
Affiliations
1. Banque de sang, Cliniques universitaires Saint-Luc, B-1200 Bruxelles, Belgique
2. Direction qualité, Cliniques universitaires Saint-Luc, B-1200 Bruxelles, Belgique
3. Département des Banques de Matériel Corporel Humain, Cliniques universitaires Saint-Luc, B-1200 Bruxelles, Belgique
Correspondance
Pre Véronique Deneys
Cliniques universitaires Saint-Luc
Banque de sang
Avenue Hippocrate 10
B – 1200 Bruxelles
veronique.deneys@saintluc.uclouvain.be