Itroduction
Selon le Centers for Disease Control and Prevention, on dénombre chaque année aux USA 48 millions d’épisodes de gastro-entérite, 128 000 hospitalisations et 3 000 décès (en particulier chez les enfants de moins de 5 ans) [1].
La plupart de ces gastro-entérites sont d’origine virale. Les rotavirus sont responsables de plus de 50% des cas, surtout chez le nourrisson, tandis que les norovirus, souvent liés à une contamination alimentaire, surviennent à tout âge et sont source d’épidémies en collectivité. Dans une proportion bien moindre, on retrouve les adénovirus 40 et 41, les astrovirus et les sapovirus [2]. Parmi les étiologies bactériennes, Salmonella spp., Shigella spp. et Escherichia coli producteur de Shiga-toxines (STEC), Campylobacter spp. et Yersinia enterocolitica sont les pathogènes les plus fréquents [3]. Giardia intestinalis, Cryptosporidium spp. et Entamoeba histolytica sont les causes majeures des infections parasitaires [4] mais restent peu fréquents dans les pays industrialisés.
En bactériologie, la prescription d’une analyse de selles est justifiée devant une atteinte sévère, des signes de diarrhée inflammatoire ou dans certains contextes particuliers (immunodépression, voyage, syndrome cholériforme, hyperéosinophilie, …). Seuls des renseignements cliniques pertinents permettent d’orienter la recherche vers des pathogènes particuliers. Actuellement, l’absence de ces renseignements cliniques fait de la coproculture l’une des analyses les moins efficientes de la bactériologie : des études ont montré un rendement diagnostique de 1.5% à 5.6% et un coût par culture positive très élevé [5].
L’utilisation des méthodes moléculaires pour la détection des entéro-pathogènes a montré une sensibilité supérieure aux méthodes conventionnelles [6-7], une réduction du temps de rendu des résultats (8) ainsi qu’une réduction globale au niveau des coûts de soins de santé [9].
Objectifs
Au laboratoire de microbiologie de la Clinique Saint-Pierre Ottignies, nous avons évalué le système BD MAX™ pour la recherche moléculaire des entéro-pathogènes (bactéries, parasites et virus) par comparaison aux méthodes conventionnelles utilisées afin de déterminer la place d’un tel automate en routine, tout en mettant en évidence ses avantages mais également ses inconvénients.
Matériels et méthodes
Echantillons
L’étude a été réalisée rétrospectivement sur une collection de selles molles ou liquides (n = 77) de patients adultes et pédiatriques issues de la routine, accompagnées d’une prescription de recherche de pathogènes gastro-intestinaux (coproculture, recherche virale ou parasitaire). Les techniques conventionnelles ont été réalisées au moment de la réception de l’échantillon, puis les échantillons ont été conservés à - 80°C dans un récipient stérile sans conservateur pour que les panels PCR puissent être réalisés ultérieurement et en même temps. La totalité des échantillons n’a pas été testée avec tous les panels mais une sélection a à chaque fois été réalisée pour challenger le panel de la manière la plus intéressante en fonction des résultats antérieurs obtenus par les techniques conventionnelles.
Techniques conventionnelles
Les échantillons ont été cultivés sur des milieux de culture sélectifs pour la détection de Salmonella spp. (gélose XLD/ OSCM II, Thermo Fisher Scientific, USA; bouillon Rappaport Vassiliadis, E&O Laboratories, Ecosse; milieu BPLS Vert Brillant modifié, Thermo Fisher Scientific, USA), Shigella spp. (gélose XLD/ OSCM II, Thermo Fisher Scientific, USA), Yersinia spp. et Aeromonas spp. (gélose CIN, BD Diagnostics, USA) et Campylobacter spp. (gélose Karmali, Thermo Fisher Scientific, USA). Les cultures ont été incubées à 35°C pendant 48h pour la détection de Salmonella spp. et Shigella spp., à 29°C pendant 48h pour Yersinia spp. et à 42°C pendant 48h en microaérophilie pour Campylobacter spp. L’identification des colonies suspectes a été réalisée par Matrix-Assisted Laser Desorption/Ionization Time Of Flight Mass Spectrometry (MALDI-TOF MS, Bruker Daltonics, Allemagne) et confirmée pour Shigella spp. par tests biochimiques (carte ID VITEK®2, bioMérieux, France).
La recherche virale a été effectuée par immunochro-matographie selon les recommandations du fabricant pour la détection simultanée du Rotavirus et Adénovirus (Combi-Strip, CORIS BioConcept, Belgique). En cas de positivité du test pour l’Adénovirus, une recherche de l’Adénovirus 40/41 a été réalisée (40/41 Adeno-Strip, CORIS BioConcept, Belgique). Le Norovirus a été recherché par PCR sur le système GeneXpert® Dx (Xpert® Norovirus, Cepheid, USA).
La recherche de parasites a été effectuée par examen microscopique après concentration (DiaMondiaL Paraprep, Diagnostic Mondial Laboratories, Autriche) et par immunochromatographie pour la détection de Giardia intestinalis et Cryptosporidium spp. (GIARDIA/CRYPTOSPORIDIUM QUIK CHEK™, TechLab, USA).
Diagnostic moléculaire par BD MAX™
Le système BD MAX™ (BD Diagnostics, USA) est un appareil de diagnostic in vitro automatisé de PCR en temps réel proposant 4 panels pour la recherche d’entéro-pathogènes :
- « Extended Enteric Bacterial Panel » (EEBP) utilisé conjointement au “Enteric Bacterial Panel” (EBP) et détectant 8 cibles : Salmonella spp., Shigella spp./E. coli entéro-invasif (EIEC), Campylobacter spp. (C. jejuni et C. coli), gènes de Shiga-toxines (stx1 et stx2), Yersinia enterocolitica, E. coli entéro-toxinogène (ETEC), Vibrio (V. parahaemolyticus, V. cholerae et V. vulnificus) et Plesiomonas shigelloides.
- « Enteric Parasite Panel » (EPP) détectant 3 cibles : Giardia intestinalis, Cryptosporidium spp. (C. parvum et C. hominis) et Entamoeba histolytica.
- « Enteric Viral Panel » (EVP) détectant 5 cibles : Norovirus (GI et GII), Rotavirus A, Adénovirus F40/41, Sapovirus (génogroupes I, II, IV, V) et Astrovirus humain.
Pour chaque échantillon, 10 μL de selles ont été prélevés via une oëse calibrée et déchargés en faisant tournoyer cette dernière dans un BD MAX™ Sample Buffer Tube (SBT). Pour EPP, le SBT a ensuite subi une lyse thermique sur le BD Pre-warm Heater. Les SBT sont ensuite chargés sur le rack (pouvant contenir jusque 12 échantillons) ainsi que les barrettes réactives contenant les différents consommables nécessaires. L’automate réalise la lyse et l’extraction pour transférer ensuite l’échantillon extrait dans une (pour EPP) ou deux (pour EEBP et EVP) des 24 chambres de la cassette PCR. L’appareil peut accueillir deux racks indépendants (pour un maximum de 24 échantillons traités simultanément) et deux cassettes PCR (48 chambres d’amplification).
En cas de résultat invalide, un nouveau test a été réalisé sur le BD MAX™ à partir de l’échantillon de départ.
Interprétation des résultats et gestion des discordances.
Les résultats de 34 EEBP, 30 EPP et 18 EVP ont été comparés aux résultats obtenus par les méthodes conventionnelles utilisées dans notre laboratoire. En cas de discordance, une autre méthode moléculaire a été réalisée : DiagCORE® Gastrointestinal Panel v2 sur l’appareil QIAstat-Dx® (QIAGEN, Hilden, Allemagne). Le résultat final retenu a été celui confirmé par au moins deux techniques.
Résultats et discussion
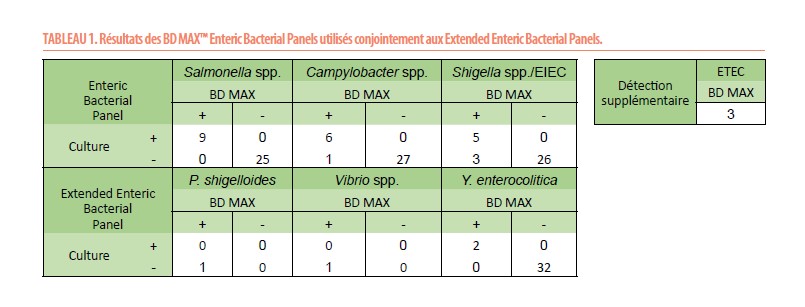
Extended Enteric Bacterial Panel (Tableau 1)
Tous les pathogènes cultivés en routine ont été détectés par le BD MAX™. Dans 5 panels sur 34 (15%), nous avons observé une détection supplémentaire de Campylobacter spp. (n=1), Shigella spp./EIEC (n=3), Vibrio spp. (n=1), Plesiomonas shigelloides (n=1) et ETEC (n=3). Ces échantillons ont été analysés par le QIAstat-Dx® et le résultat final retenu a été celui confirmé par au moins deux techniques.
Après traitement des discordances, on obtient un taux de concordance de 100% (tous les pathogènes retrouvés par le BD MAX™ ont été confirmés par le QIAstat-Dx®). Aucun résultat invalide ne fut observé.
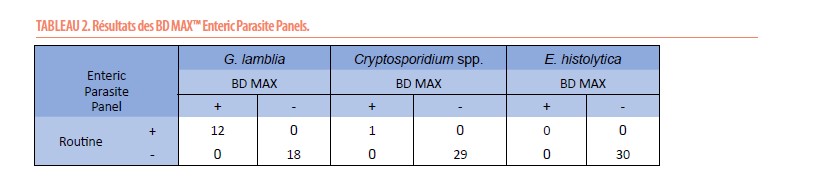
Enteric Parasite Panel (Tableau 2)
Sur les 30 échantillons, nous avons observé une concordance de 100% avec les résultats de la routine (microscopie et/ou test immunochromatographique) sans détection supplémentaire de parasites. 3 résultats invalides ont été observés (10%) pour lesquels un rerun a été effectué et a permis d’obtenir un résultat final.
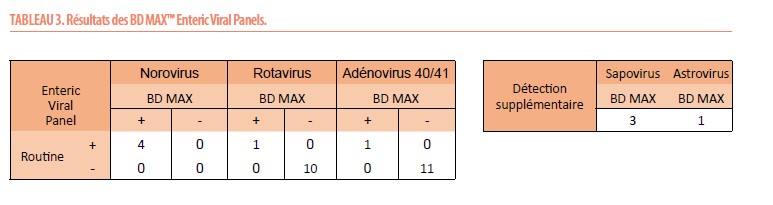
Enteric Viral Panel (Tableau 3)
Tous les virus détectés en routine ont bien été identifiés par le BD MAX™. Une détection supplémentaire de Sapovirus (n=3) et d’Astrovirus (n=1) a été confirmée par le QIAstat. 1 seule discordance a été observée entre les 2 méthodes moléculaires (échantillon négatif en routine, Sapovirus et Astrovirus détectés par BD MAX™, et Astrovirus seul détecté par QIAstat-Dx®. Aucun résultat invalide ne fut observé.
Aspects pratiques
1.5 ETP technologue sont nécessaires par jour dans notre laboratoire pour effectuer les analyses microbiologiques sur les selles avec les méthodes conventionnelles. 0.5 ETP technologue par jour a été suffisant pour réaliser les panels PCR.
Les méthodes conventionnelles permettent un temps de rendu des résultats de 48 à 96h pour la culture bactérienne, 1h pour les tests antigéniques viraux et 24h pour la recherche parasitaire. L’utilisation des panels PCR permettrait un temps de rendu des résultats de 12h pour un travail par batch et de 2h pour un travail au test par test. Cinq milieux de culture, 3 tests antigéniques et 1 test PCR sont utilisés en routine et nécessitent une gestion des stocks conséquente. 3 panels PCR peuvent remplacer ces méthodes conventionnelles avec une traçabilité complète pour chaque échantillon clinique des lots de réactifs, leur date de péremption ainsi que l’utilisateur de l’appareil.
La facilité d’utilisation de l’appareil BD MAX™ (moyenne du temps de manipulations = 4 minutes/échantillon) permet également de diminuer le temps de formation nécessaire au technologue.
Cependant, les techniques conventionnelles de culture bactérienne et de recherche microscopique de parasites ne peuvent être complètement abandonnées car elles permettent, si nécessaire, la confirmation de résultats positifs, la réalisation d’un antibiogramme et une recherche plus étendue.
Une connexion bidirectionnelle avec le LIS est possible, permettant ainsi un gain de temps pour l’encodage des résultats, une absence d’erreur de retranscription des résultats et une traçabilité complète des réactifs.
En 2019, notre laboratoire a effectué 577 recherches virales, 4462 coprocultures et 4304 recherches de parasites intestinaux. Le coût des réactifs nécessaires (hors prix de l’automate et des maintenances) pour la réalisation de ces analyses par les panels entériques sur le BD MAX™ aurait été 3 fois supérieur au coût des réactifs des méthodes conventionnelles.
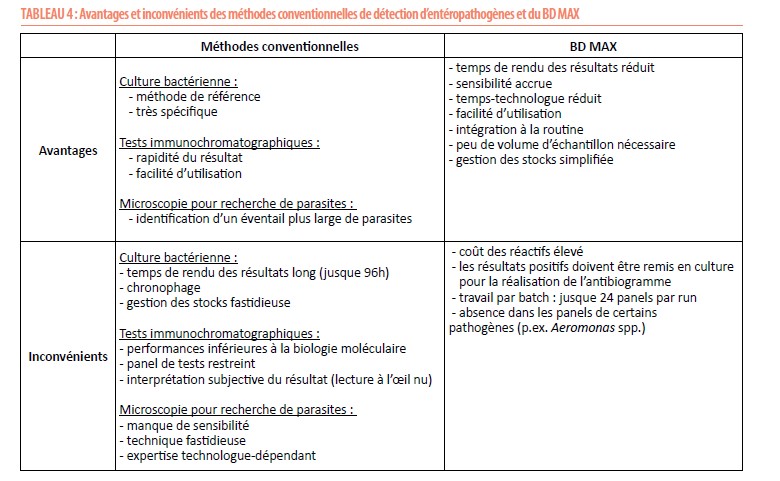
Le tableau 4 résume les avantages et les inconvénients des méthodes conventionnelles et du BD MAX™.
Limites de l’étude
La première limite de cette étude est son aspect rétrospectif : toutes les méthodes conventionnelles ont été réalisées à la réception de l’échantillon alors que les panels PCR ont été réalisés après un certain temps de congélation.
Une autre limite importante est la confirmation des résultats discordants : un autre panel multiplex a été utilisé ne présentant pas tout-à-fait les mêmes cibles au lieu de vérifier la présence de chaque cible par une PCR monoplex.
Conclusion
L’objectif principal d’une coproculture est d’isoler un nombre limité d’espèces bactériennes réputées pathogènes. La stratégie actuelle est donc de réaliser une coproculture standard en recherchant les agents les plus fréquents. Au niveau bactérien, on recherchera essentiellement Salmonella spp., Shigella spp., Campylobacter spp. et Yersinia spp. Au niveau viral, le Norovirus, le Rotavirus, l’Adénovirus 40/41 et plus rarement le Sapovirus et l’Astrovirus. En ce qui concerne les parasites, les deux pathogènes les plus fréquents sont Giardia intestinalis et Cryptosporidium spp. (Entamoeba histolytica étant beaucoup plus rarement retrouvé dans nos régions). Les 4 panels entériques BD MAX™ sont de ce point de vue parfaitement adaptés à une utilisation en routine.
Les techniques moléculaires sont une alternative très intéressante de plusieurs points de vue. Tout d’abord parce qu’elles sont plus sensibles [6, 7, 9-11] : malgré un petit échantillonnage, tous les pathogènes retrouvés par les méthodes conventionnelles ont bien été détectés par le BD MAX™ et très peu de résultats invalides ont été enregistrés (0% pour EEBP, 0% pour EVP et 10% pour EPP). Au total, 15 entéropathogènes (19%) ont été retrouvés en plus (dont 9 bactéries (26%) pour EEBP et 4 virus (22%) pour EVP). Les performances des panels entériques du BD MAX™ ont déjà été largement décrites dans la littérature [12 à 17].
Cependant, une sensibilité augmentée mène à une détection de charge bactérienne plus faible ainsi qu’à la détection de plusieurs pathogènes dans un même échantillon. Devant ces co-infections et des valeurs de Cycle threshold (Ct) élevées, on ne doit pas perdre de vue l’éventualité d’un portage asymptomatique (p. ex. Salmonella spp.) [18].
Un autre aspect important est le temps de rendu des résultats, qui peut aller jusqu’à 96 heures avec les cultures conventionnelles, et qui se voit drastiquement diminué avec les techniques moléculaires, ce qui permet une meilleure prise en charge du patient, une prescription antibiotique plus raisonnée et une meilleure gestion de prévention de transmission d’infection.
Le panel parasitaire présente, quant à lui, un avantage plus limité par rapport aux techniques immunochromatographiques (présentant une bonne sensibilité [11], plus rapides et moins coûteuses) au vu de la rareté de l’isolement de E. histolytica dans la pratique quotidienne.
Contrairement au panel parasitaire, le panel viral est plus intéressant car il permet de détecter, en plus du Rotavirus et de l’Adénovirus, le Norovirus pour lequel la technique immunochromatographique ne présente pas de bonnes performances et pour la recherche duquel une méthode de biologie moléculaire est nécessaire [19, 20].
En conclusion, bien que l’approche moléculaire présente quelques inconvénients et nécessite un investissement financier important pour le laboratoire, les panels entériques du BD MAX™ semblent pouvoir occuper une place intéressante dans un laboratoire de microbiologie de routine pour diminuer le temps de rendu des résultats, faciliter le flux analytique (travail par batch) et permettre une meilleure prise en charge des patients.
Recommandations pratiques
- Techniques moléculaires : alternative intéressante mais interprétation des résultats pouvant être compliquée.
- Temps de rendu des résultats diminué mais nécessité de continuer les cultures classiques en vue de la réalisation d’un antibiogramme.
- Flux analytique facilité.
- Coût non négligeable.
Affiliations
1. Laboratoire de microbiologie, Clinique Saint-Pierre, Avenue Reine Fabiola n°9, 1340 Ottignies, Belgique
2. auteur correspondant : ekaterina.melnik@jolimont.be – 065/38.57.65
Correspondance
Dr Ekaterina Melnik
Clinique Saint-Pierre
Laboratoire de microbiologie
Avenue Reine Fabiola 9
B-1340 Ottignies
ekaterina.melnik@jolimont.be 065/38.57.65
Conflits d’intérêts : aucun.
Références
- Centers for Disease Control and Prevention. 2020. Foodborne germs and illnesses. En ligne https://www.cdc.gov/foodsafety/foodborne-germs.html
- Centre Hospitalier Universitaire de Dijon. 2019. Rapport annuel d’activité Centre National de Référence virus des gastro-entérites. En ligne http://www.cnr-ve.org/wp-content/uploads/documents/RAPPORT%20ACTIVITES%2...
- Société française de microbiologie. Gastro-entérites. In : REMIC : Société française de Microbiologie Ed ; 2018 : p.221-227.
- Société française de microbiologie. Infections parasitaires du système digestif. In : REMIC : Société française de Microbiologie Ed ; 2018 : p.229-233.
- Lee JY, Cho SY, Hae Hwang HS, Ryu JY, Lee J, Song ID, Kim BJ, Kim JW, Chang SK, Choi CH. Diagnostic yield of stool culture and predictive factors for positive culture in patients with diarrheal illness. Medicine (Baltimore).2017; 96 (30): e7641. DOI: 10.1097/MD.0000000000007641
- Yoo J, Park J, Lee HK, Yu JK, Lee GD, Park KG, Oak HC, Park YJ. Comparative evaluation of Seegene Allplex Gastrointestinal, Luminex xTAG Gastrointestinal Pathogen Panel, and BD MAX Enteric Assays for detection of gastrointestinal pathogens in clinical stool specimens. Arch Pathol Lab Med.2019; 143 (8) : 999-1005. DOI : 10.5858/arpa.2018-0002-OA
- Bruijnesteijn van Coppenraet LES, Dullaert-de Boer M, Ruijs GJHM, van der Reijden WA, van der Zanden AGM, Weel JFL, Schuurs TA. Case-control comparison of bacterial and protozoan microorganisms associated with gastroenteritis: application of molecular detection. Clin Microbiol Infect.2015; 21 (6): 592.e9-19. DOI: 10.1016/j.cmi.2015.02.007.
- Mortensen JE, Ventrola C, Hanna S, Walter A. Comparison of time-motion analysis of conventional stool culture and the BD MAX Enteric Bacterial Panel (EBP). BMC Clin Pathol.2015; 15:9. DOI: 10.1186/s12907-015-0010-8.
- Beal SG, Tremblay EE, Toffel S, Velez L, Rand KH. A gastrointestinal PCR panel improves clinical management and lowers health care costs. J Clin Microbiol.2018; 56:e01457-17. DOI: 10.1128/JCM.01457-17.
- Kim J, Kim HS, Kim H-S, Kim J-S, Song W, Lee KM, Lee S, Park KU, Lee W, Hong YJ. Evaluation of an immunochromatographic assay for the rapid and simultaneous detection of rotavirus and adenovirus in stool samples. Ann Lab Med.2014; 34 (3): 216-222. DOI: 10.3343/alm.2014.34.3.216
- Elsafi SH, Al-Maqati TN, Hussein MI, Adam AA, Abu Hassan MM, Al Zahrani EM. Comparison of microscopy, rapid immunoassay, and molecular techniques for the detection of Giardia lamblia and Cryptosporidium parvum. Parasitol res.2013; 112 (4): 1641-1646. DOI: 10.1007/s00436-013-3319-1.
- Stokes W, Simner PJ, Mortensen J, Oethinger M, Stellrecht K, Lockamy E, Lay T, Bouchy P, Pillai DR. Multicenter Clinical Validation of the Molecular BD Max Enteric Viral Panel for Detection of Enteric Pathogens. J Clin Microbiol.2019; 57:e00306-19. DOI: 10.1128/JCM.00306-19.
- Anderson NW, Buchan BW, Ledeboer NA. Comparison of the BD MAX Enteric Bacterial Panel to Routine Culture Methods for Detection of Campylobacter, Enterohemorrhagic Escherichia coli (O157), Salmonella, and Shigella Isolates in Preserved Stool Specimens. J Clin Microbiol.2014; 52: 1222-1224. DOI: 10.1128/JCM.03099-13.
- Harrington SM, Buchan BW, Doern C, Fader R, Ferraro MJ, Pillai DR, Rychert J, Doyle L, Lainesse A, Karchmer T, Mortensen JE. Multicenter Evaluation of the BD Max Enteric Bacterial Panel PCR Assay for Rapid Detection of Salmonella spp., Shigella spp., Campylobacter spp. (C. jejuni and C. coli), and Shiga Toxin 1 and 2 Genes. J Clin Microbiol.2015; 53: 1639-1647. DOI: 10.1128/JCM.03480-14.
- Simner PJ, Oethinger M, Stellrecht KA, Pillai DR, Yogev R, Leblond H, Mortensen JMultisite Evaluation of the BD Max Extended Enteric Bacterial Panel for Detection of Yersinia enterocolitica, Enterotoxinogenic Escherichia coli, Vibrio, and Plesiomonas shigelloides from Stool Specimens. J Clin Microbiol.2017; 55: 3258-3266. DOI: 10.1128/JCM.00911-17.
- Molling P, Nilsson P, Ennefors T, Ogren J, Floren K, Thulin Hedberg S, Sundqvist M. Evaluation of the BD Max Enteric Parasite Panel for Clinical Diagnostics. J Clin Microbiol. 2016; 54: 443-444. DOI: 10.1128/JCM.02100-15.
- Madison-Antenucci S, Relich RF, Doyle L, Espina N, Fuller D, Karchmer T, Lainesse A, Mortensen JE, Pancholi P, Veros W, Harrington SM. Multicenter Evaluation of BD Max Enteric Parasite Real-Time PCR Assay for Detection of Giardia duodenalis, Cryptosporidium hominis, Cryptosporidium parvum, and Entamoeba histolytica. J Clin Microbiol.2016; 54: 2681-2688. DOI: 10.1128/JCM.00765-16.
- Yalamanchili H, Dandachi D, Okhuysen P. Use and interpretation of enteropathogen multiplex nucleic acid amplification tests in patients with suspected infectious diarrhea. Gastroenterol Hepatol. 2018; 14 (11): 646-652.
- Ambert-Balay K, Pothier P. Evaluation of 4 Immunochromatographic Tests for Rapid Detection of Norovirus in Faecal Samples. J Clin Virol. 2012; 56 (3): 194-198. DOI: 10.1016/j.jcv.2012.11.001.
- Henningsson A, Nilsson Bowers A, Nordgren J, Quttineh M, Matussek A, Haglund S. Rapid diagnosis of acute norovirus-associated gastroenteritis: evaluation of the Xpert Norovirus assay and its implementation as a 24/7 service in three hospitals in Jonkoping County, Sweden. Eur J Clin Microbiol Infect Dis.2017; 36 (10): 1867-1871. DOI: 10.1007/s10096-017-3005-9.