Introduction
La myosite ossifiante correspond à une formation osseuse hétérotopique au sein du muscle strié squelettique, mais également au sein des tendons, des ligaments, fascias et aponévroses. Le muscle lisse, myocardique, le diaphragme et les sphincters ne sont pas concernés par ce processus (1). Il en existe deux formes : la forme génétique et la forme acquise.
La forme acquise, également appelée myosite ossifiante circonscrite, est la forme la plus commune, qui correspond à 75% des cas de myosite ossifiante. Typiquement, un élément traumatique déclencheur est identifié, mais peut être absent dans 40% des cas (1). L’atteinte peut avoir lieu à tout âge, mais en moyenne, il s’agirait de patients jeunes et actifs, entre 20 et 30 ans. Les localisations préférentielles concernent les ceintures pelviennes et scapulaires, le plus souvent au sein des loges antérieures, particulièrement exposées aux chocs directs (1, 2, 3). Les mécanismes physiopathologiques de cette formation ne sont pas complètement compris à ce jour. Néanmoins, plusieurs études démontrent que le muscle strié squelettique traumatisé induirait une cascade inflammatoire avec un environnement riche en cytokines : BMP (bone morphogenic protein) et TGF (transforming growth factor) ; cet environnement amènerait les cellules endothéliales vasculaires du muscle strié squelettique à subir une transition mésenchymateuse, qui est à la base de la formation osseuse hétérotopique (4). Par la suite, la myosite ossifiante circonscrite évolue de manière parallèle sur le plan histologique, clinique et radiographique.
Vignette clinique
Il s’agit d’une patiente âgée de 17 ans, qui s’est présentée aux urgences pour une douleur au niveau de la face interne de la cuisse droite, évoluant depuis trois semaines et en aggravation depuis une semaine, sans notion de traumatisme initial. La douleur était évaluée à 7 sur 10 par la patiente selon l’échelle analogique visuelle, avec une intensité qui semblait majorée durant la nuit, irradiant parfois dans tout le membre inférieur droit sans topographie précise. Cette douleur semblait être légèrement soulagée par la position assise et la prise d’antalgiques de pallier 1. Il existait une impotence fonctionnelle de la hanche droite avec une limitation à la marche et des amplitudes articulaires diminuées. La patiente évoquait également une douleur lombaire basse, beaucoup moins importante que la douleur au niveau de la cuisse. Elle était apyrétique aux urgences. Il n’y avait pas d’autres plaintes ni anomalies à l’examen clinique.
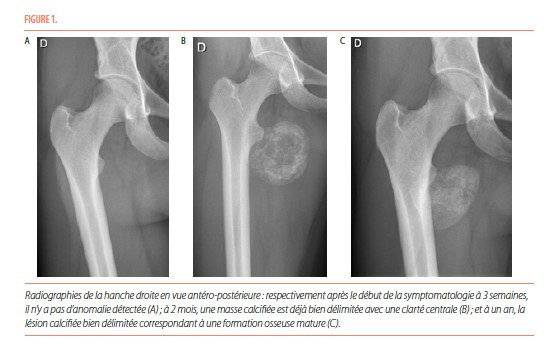
Des radiographies de colonne lombaire, bassin et hanche droite étaient normales (Figure 1).
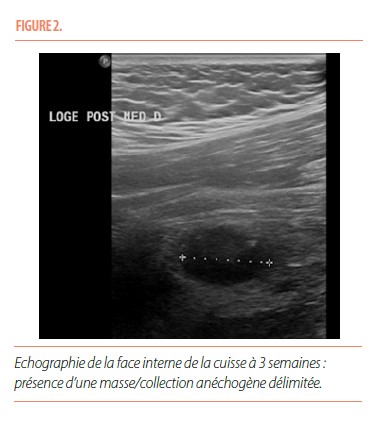
Une échographie de la face interne de la cuisse démontrait la présence d’une collection anéchogène bien délimitée, d’environ 20 mm de grand axe, en profondeur de la loge des adducteurs et au contact de la diaphyse fémorale (Figure 2).
La biologie sanguine montrait un syndrome inflammatoire avec une augmentation de la CRP (C-reactive protein) à 28mg/dL (nl <5.0mg/dL), de la VS (vitesse de sédimentation) à 67mm/h (nl < 20mm/h), une leucocytose à 14 100/mm3 (nl 5,50 – 9,30 10 e3/mm3), sans autre anomalie.
Plus tard, une IRM de la région lombo-sacrée, prescrite en raison du caractère irradiant des douleurs, avait permis d’exclure une atteinte inflammatoire rachidienne et tout autre type de conflit radiculaire.
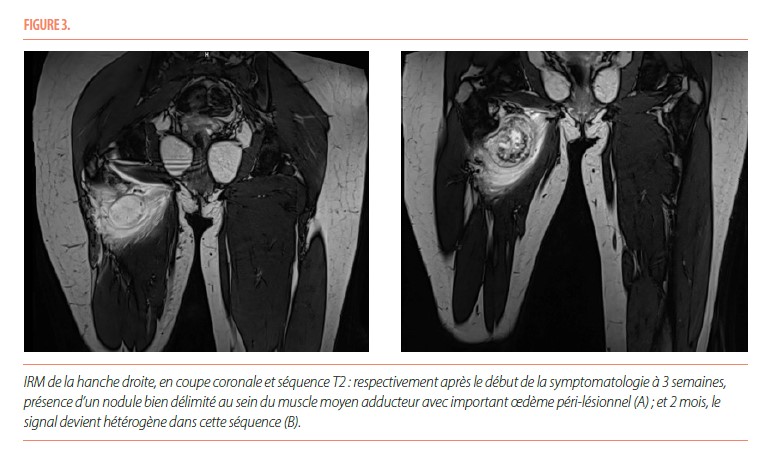
L’IRM de la hanche mettait en évidence un nodule en hypersignal T2, avec un important œdème en périphérie directe de ce nodule (Figure 3).
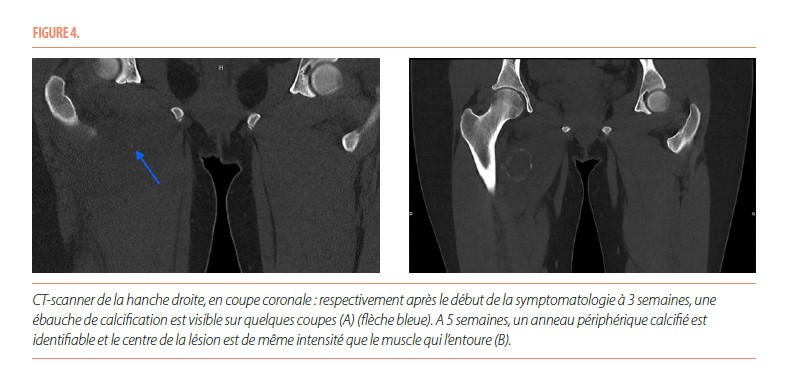
Le CT-scanner réalisé au même moment mettait en évidence une ébauche de calcification au pourtour de la masse décrite dans les autres modes d’imagerie (Figure 4). Cela a permis d’évoquer le diagnostic de myosite ossifiante circonscrite en phase aiguë. Deux semaines plus tard, un nouveau CT-scanner mettait clairement en évidence un anneau périphérique calcifié et a permis de donner la confirmation du diagnostic (Figure 4). La patiente a été hospitalisée plusieurs jours pour gestion de la douleur. Ensuite, un suivi pluridisciplinaire (pédiatrie, orthopédie, médecine physique, radiologie) s’est organisé.
Diagnostic
La myosite ossifiante circonscrite présente trois stades d’évolution, dont les caractéristiques cliniques et liées à l’imagerie diffèrent (Tableau 1) (1,2).
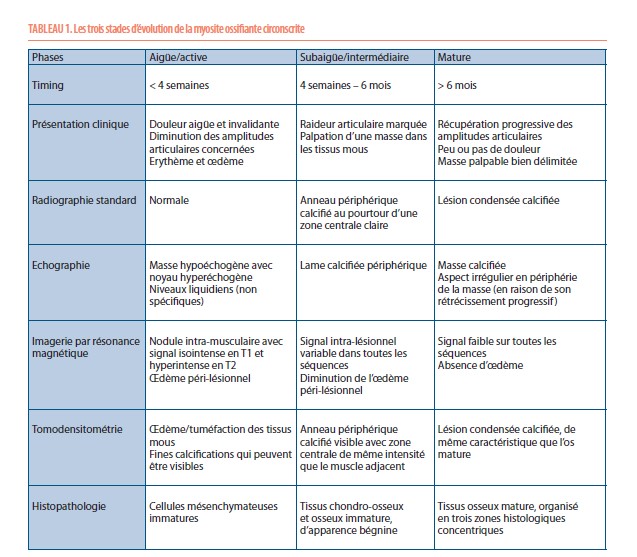
Il y a tout d’abord une phase aiguë, marquée par d’importantes douleurs. Il peut exister un érythème et un œdème au pourtour de la zone douloureuse, avec parfois un contexte fébrile associé. Cette phase évolue sur quatre semaines. Les radiographies initiales ne sont pas contributives pour élaborer un diagnostic et sont normales la plupart du temps. L’échographie, aspécifique, met en évidence une masse hypoéchogène développée au sein des tissus mous avec un centre hyperéchogène et peut également montrer des niveaux liquidiens compatibles avec un hématome. L’IRM souligne la présence d’un nodule intramusculaire, avec un œdème inflammatoire en périphérie ; ce nodule apparait isointense en T1 et hyperintense en T2. L’IRM n’est pas spécifique mais permet de délimiter l’extension de la lésion en apportant des informations anatomiques précises sur sa localisation (5). La tomodensitométrie démontre une tuméfaction des tissus mous, avec une fine lame calcifiée qui peut être présente de manière précoce. C’est ce dernier examen qui a la meilleure valeur diagnostique en phase aigüe.
La phase subaiguë ou intermédiaire s’étend de la quatrième semaine au sixième mois après l’apparition des premiers symptômes. Lors de cette phase, les douleurs diminuent progressivement. Les radiographies mettent en évidence une masse qui commence à se délimiter par une fine couche calcifiée, tout comme à l’échographie. L’IRM fait ressortir des zones d’intensités variables et non spécifiques qui organisent la formation osseuse, avec une diminution de l’œdème péri-lésionnel. La tomodensitométrie montre la présence d’une zone centrale, isointense par rapport aux muscles avoisinants, entourée d’un anneau périphérique calcifié.
La troisième phase dite phase d’état, débute au sixième mois après l’apparition des premiers symptômes. Cliniquement, les patients n’ont que peu ou plus de douleurs. Les radiographies délimitent clairement à ce stade une lésion condensée calcifiée, dont le grand axe est généralement parallèle à l’os adjacent, en suivant le trajet musculaire. L’échographie met en évidence une masse bien calcifiée, avec un pourtour qui peut être irrégulier dû au rétrécissement de la lésion. À l’IRM, toutes les séquences sont isointenses et il n’y a plus d’œdème péri-lésionnel. La tomodensitométrie met en évidence la lésion avec les caractéristiques d’un os mature.
Ces trois stades d’évolution sont également marqués par une histopathologie différente (Tableau 1), avec d’abord une métaplasie mésenchymateuse (phase aigüe), puis une différenciation progressive chondro-osseuse (phase subaigüe), jusqu’à atteindre le stade de maturité osseuse (phase mature). La lésion mature atteint en général 3 à 6 cm et présente, de manière microscopique, trois zones concentriques distinctes. La zone centrale se compose de tissu mésenchymateux contenant des fibroblastes mitotiques avec foyers de nécrose et d’hémorragie, la zone intermédiaire est constituée de tissu fibroblastique et osseux immature, et enfin la zone périphérique contient du tissu osseux lamellaire mature. L’ossification se fait vers une réduction de taille de façon centripète (2, 6, 7, 8).
Sur le plan biologique, il n’y a actuellement aucun marqueur diagnostique, mais plusieurs associations ont été décrites (2, 9). La phosphatase alcaline sérique (SAP) reste initialement normale mais devient extrêmement élevée après 3 semaines d’évolution, en parallèle de la formation osseuse. La CRP (C-reactive protein) et la vitesse de sédimentation érythrocytaire sont élevées dès la phase aigüe.
Le calcium sérique a tendance à diminuer pour une courte période puis retourner à la normale lors du pic de SAP. La CPK (créatine phosphokinase) sera également majorée, et sera le seul marqueur prédictif de l’évolution et de la sévérité de la myosite ossifiante (10). L’ensemble de ces anomalies biologiques retournent à la normale aux alentours de la 18ème semaine d’évolution (2, 9).
La scintigraphie osseuse en trois temps serait plus intéressante qu’une tomodensitométrie standard pour différencier la myosite ossifiante d’autres conditions inflammatoires, selon certains auteurs (1, 2). Cependant l’intérêt dans le suivi et le choix du timing chirurgical optimal n’est pas fiable car la captation du traceur peut rester élevée de manière chronique dans les formes post traumatiques (1, 2).
Le diagnostic différentiel dans les phases aigüe et subaigüe inclut principalement l’abcès musculaire (qui peut présenter des caractéristiques identiques à l’IRM au stade initial), le sarcome des tissus mous (et en particulier s’il présente des calcifications comme le sarcome synovial), et l’ostéosarcome. La douleur a tendance à diminuer au cours de l’évolution de la myosite ossifiante, à la différence des affections tumorales.
Le recours à la biopsie doit être évité. Une anamnèse, un examen clinique et un bilan par imagerie, en suivant toutes les phases de l’évolution, doivent être suffisants à l’élaboration du diagnostic. Si néanmoins un doute persiste, la biopsie guidée par CT est la modalité idéale pour récolter un échantillon convenable. En effet, la zone centrale de la myosite ossifiante étant non différenciée, sa distinction avec un sarcome la rend impossible et il est donc essentiel d’obtenir un prélèvement représentatif du phénomène de zones (2, 5, 8, 11).
En ce qui concerne le cas clinique présenté ; les différents stades d’évolution ont pu être documentés par radiographie, TDM et IRM (Figure 1, 3 et 4). Un diagnostic a pu être établi en phase aiguë grâce à la présence d’une ébauche de calcification sur le CT-scanner réalisé à trois semaines. Cela a permis d’éviter la biopsie chez cette patiente.
Traitement et pronostic
Le traitement initial est similaire à celui d’un muscle contus, à savoir le contrôle du développement de l’hématome et le maintien de la fonction. Une courte période d’immobilisation, combinée à du repos, un glaçage, une compression et une surélévation du membre, est admise (2, 12). Le traitement médicamenteux inclut les AINS tel l’indométacine et les bisphosphonates comme le pamidronate (13) ou l’alendronate (14). La kinésithérapie a pour but de maintenir les amplitudes articulaires et de prévenir la raideur ; il en existe plusieurs protocoles, qui ne doivent pas être trop agressifs dans les premiers stades sous peine d’exacerber la symptomatologie et la sévérité de la lésion (2, 3, 6).
Le traitement chirurgical est réservé aux lésions symptomatiques qui ne répondent pas au traitement conservateur. Le but sera d’améliorer la fonction et de limiter la douleur. Il est admis que le timing opératoire doit être retardé au minimum de 6 à 18 mois après le début de la symptomatologie. De cette manière, la lésion aura atteint la maturité. Il est en effet accepté que la chirurgie ne stoppera pas l’évolution normale du processus et qu’une chirurgie prématurée amènerait ainsi un risque de récurrence élevé (2, 15).
Concernant le cas clinique présenté ; le traitement conservateur, incluant anti-inflammatoires et kinésithérapie, n’a pas permis de réduire la symptomatologie algique, invalidante lors de la marche mais aussi lors de la station assise. L’ablation chirurgicale après plus d’un an d’évolution a finalement été décidée. L’examen anatomopathologique de la lésion est compatible avec une myosite ossifiante.
Recommandations pratiques
Le cas clinique exposé illustre le mode de présentation assez typique d’une myosite ossifiante circonscrite, qui peut être rencontrée dans la pratique courante. Dans sa phase aiguë, il s’agit d’un challenge diagnostique car les premières manifestations cliniques peuvent évoquer d’autres diagnostics plus péjoratifs. La connaissance des critères d’imagerie, en fonction des différents stades d’évolution, a permis d’établir un diagnostic et de mettre en place un suivi adapté. Le recours à la biopsie dans ce contexte a pu être évité.
affiliations
1. Clinique CHC MontLégia, Service de chirurgie orthopédique, B-4000 Liège
Correspondance
Dr. Pauline Despontin
Clinique CHC MontLégia
Service de chirurgie orthopédique
Boulevard Patience et Beaujonc 2
B-4000, Liège, Belgique
pauline.despontin@student.uclouvain.be
Références
- Tyler P, Saifuddin A. The imaging of myositis ossificans. Semin Musculoskelet Radiol. 2010 ; 14 (2) : 201-216.
- Walczack BE, Johnson CN, Howe BM. Review myositis ossificans. J Am Acad Orthop Surg. 2015 ; 23 : 612-622.
- Sferopoulos NK, Kotakidou R, Petropoulos AS. Myositis ossificans in children : a review. Eur J Orthop Surg Traumatol. 2017 ; 27 : 491-502.
- Medici D, Olsen BR. The role of endothelial-mesenchymal transition in heterotopic ossification. J Bone Miner Res. 2012 ; 27 (8) : 1619-1622.
- Wang H, Nie P, Li Y, Hou F, Dong C, Huang Y, HaoD. MRI Findings of Early Myositis Ossificans without Calcifications or Ossification. Biomed Res Int. 2018 : 4186324.
- Taam I, Boussouni K, Redouane B, Amil T, Saouab R. La myosite ossifiante circonscrite, une localisation inhabituelle – à propos d’un cas et revue de la littérature. Pan Afr Med J. 2016 ; 24 : 71.
- Kaplan FS, Glaser DL, Hebela N, Shore EM. Heterotopic ossification. J Am Acad Orthop Surg. 2004 ; 12 (2) : 116-125.
- Ackerman LV. Extra-osseous localized non-neoplastic bone and cartilage formation (so-called myositis ossificans) : Clinical and pathological confusion with malignant neoplasms. J Bone Joint Surg Am. 1958 ; 40 (2) : 279-298.
- Beiner JM, Jokl P. Muscle contusion injury and myositis ossificans traumatica. Clin Orthop Relat Res. 2002 ; (suppl403) : S110-S119.
- Singh RS, Craig MC, Katholi CR, Jackson AB, Mountz JM. The predictive value of creatine phosphokinase and alkaline phosphatase in identification of heterotopic ossification in patients after spinal chord injury. Arch Phys Med Rehabil. 2003 ; 84 (11) : 1584-1588.
- Goldman AB. Myositis ossificans circumscripta : a benign lesion with a malignant differential diagnosis. AJR Am J Roentgenol. 1976 ; 126 (1) : 32-40.
- Järvinen JA, Järvinen TL, Kääriäinen M, Kalimo H, Järvinen M. Muscles injuries : Biology and treatment. Am J Sports Med. 2005 ; 33 (5) : 745-764.
- Mani-babu S, Wolman R, Keen R. Quadriceps traumatic myositis ossificans in football player : management with intravenous pamidronate. Clin J Sport Med. 2014 ; 24 : 56-58.
- Ben Hamida KS, Hajri R, Kedadi H, Bouhaouala H, Salah MH, Mestiri A, Zakraoui L. et al. Myositis ossificans circumscripta of the knee improved by alendronate. Joint Bone Spine. 2004 ; 71 (2) : 144-146.
- Garland DE. A clinical perspective on common forms of acquired heterotopic ossification. Clin Orthop Relat Res. 1991 ; (263) : 13-29.