Définitions
Composants sanguins (anciennement appelés produits sanguins labiles ou instables, ou dérivés sanguins) : ce terme regroupe tous les composants issus du don de sang total ou d’aphérèse, dont la conservation est limitée dans le temps et selon des conditions de température très strictes. Leur distribution et transfusion aux patients répondent à des exigences en matière de compatibilité de groupes sanguins. Ils regroupent les concentrés érythrocytaires, les concentrés plaquettaires, le plasma frais congelé et les concentrés granulocytaires. Ils sont distribués sous la responsabilité du Directeur de la banque de sang. Ils se distinguent des médicaments dérivés du plasma (anciennement appelés produits sanguins stables) qui ont une conservation prolongée dans le temps, sont obtenus à partir de pools de centaines de litres de plasma et sont distribués sous la responsabilité du pharmacien hospitalier. Ils se distinguent aussi des cellules souches hématopoïétiques et des concentrés de lymphocytes ou de monocytes qui sont considérés comme du matériel corporel humain.
Groupes sanguins : ensemble d’antigènes présents à la surface des globules rouges (mais parfois aussi d’autres cellules) susceptibles d’enclencher des réactions d’immunisation.
Actuellement, on a décrit 45 groupes sanguins différents (dont les plus connus sont le premier, le système ABO, et le quatrième, le système RH) sous le contrôle de 50 gènes différents, et rassemblant plus de 360 antigènes différents (1).
Logiciels : EPIC : logiciel de gestion intégrée du dossier patient o Beaker : fonctionnalité d’EPIC utilisée pour les analyses de laboratoire Cursus 3 : logiciel de gestion de la banque de sang
Introduction : rôles et missions d’une banque de sang hospitalière*
* Les textes repris en italique dans ce chapitre sont extraits des textes légaux.
La banque de sang aux Cliniques universitaires Saint-Luc
La banque de sang des Cliniques universitaires Saint-Luc assure la distribution d’environ 20.000 composants sanguins par an. Pour cela, elle dispose en permanence d’un stock d’environ 650 composants sanguins, tous confondus. Sur les presque 3 millions de patients ayant un dossier médical aux Cliniques universitaires Saint-Luc, la banque de sang dispose d’un historique transfusionnel complet pour 346.000 d’entre eux, dépassant ainsi le million de résultats.
Une fonction hospitalière indispensable pour l’agrément d’un hôpital
La banque de sang hospitalière est une fonction hospitalière au sens de l’article 76bis de la loi sur les hôpitaux, coordonnée le 7 août 1987.
Par banque de sang hospitalière, on entend la fonction de l’hôpital général qui stocke et distribue du sang et des dérivés sanguins destinés exclusivement à être utilisés dans les services de l’hôpital, y compris lors de transfusions sanguines dans un cadre hospitalier, et qui peut effectuer des tests de compatibilité (2).
Pour être agréée, elle doit répondre à différentes normes concernant le stockage et la distribution des composants sanguins.
Les tests de compatibilité du sang et des dérivés sanguins que la banque de sang hospitalière peut effectuer n’ont pas lieu dans la banque de sang hospitalière elle-même, mais dans le cadre des activités de biologie clinique de l’hôpital. A cet effet, les normes fixées pour ces activités de biologie clinique doivent être respectées (3).
En somme, le service de transfusion d’un hôpital joue un double rôle de laboratoire d’analyses biologiques et de banque de sang ; le fonctionnement de cette dernière est proche de celui d’une pharmacie, avec un nombre de produits certes beaucoup plus limités, mais dont les responsabilités sont assorties d’exigences en matière de compatibilité sanguine.
Un rôle incontournable en matière d’hémovigilance et d’identitovigilance
La banque de sang doit enregistrer les incidents indésirables graves qui pourraient affecter la qualité ou la sécurité des composants sanguins. Elle travaille ainsi en étroite collaboration avec le Département Qualité de l’hôpital.
La banque de sang hospitalière dispose de procédures permettant, d’une part, d’enregistrer les cas présumés de réaction indésirable grave survenant chez les patients au cours d’une transfusion ou après celle-ci et imputables à la qualité ou à la sécurité du sang ou des dérivés sanguins et, d’autre part, de notifier ces cas dans les meilleurs délais à l’établissement de transfusion sanguine d’approvisionnement ou au centre d’approvisionnement, ainsi qu’au Centre d’hémovigilance mis en place au SPF Santé publique, Sécurité de la Chaîne alimentaire et Environnement, direction générale Médicaments, section Vigilance. Le comité de transfusion de l’hôpital est associé à l’élaboration de cette procédure (3).
La banque de sang hospitalière dispose d’une procédure permettant de vérifier si chaque unité de sang ou de dérivé du sang a été administrée au patient auquel elle était destinée ou, à défaut, quelle a été sa destination ultérieure.
Des obligations de traçabilité tout au long de la chaîne
La banque de sang hospitalière garantit la traçabilité du sang et des composants sanguins.
Cette traçabilité implique que la banque de sang hospitalière met en place un système permettant d’identifier et d’enregistrer sans la moindre équivoque chaque unité de sang ou dérivé de sang que la banque de sang hospitalière de l’établissement de transfusion sanguine d’approvisionnement ou le centre d’approvisionnement reçoit et, par là même, de tracer le cheminement de chaque unité de sang ou dérivé du sang du donneur à sa destination finale et inversement.
Dans ce contexte, la destination finale peut consister en une transfusion, une élimination ou une restitution à l’établissement de transfusion sanguine d’approvisionnement ou au centre d’approvisionnement.
Pour garantir la traçabilité, la banque de sang hospitalière conserve les informations mentionnées dans l’annexe 2 pendant au moins 30 ans et au maximum 40 ans sous une forme électronique.
La banque de sang hospitalière élabore, en concertation avec le comité de transfusion, une procédure précise, rapide et vérifiable permettant de soustraire à la distribution le sang et les dérivés sanguins que l’on peut relier à une notification.
La nécessité d’informatisation ou comment résoudre une équation à double inconnue
Pour remplir toutes ces missions, il est aisé de comprendre qu’une informatisation robuste de la banque de sang et du laboratoire d’immunologie érythrocytaire est indispensable.
Cette informatisation doit couvrir tant les analyses pré-transfusionnelles réalisées chez les patients que la traçabilité complète de tous les composants sanguins qu’ils soient transfusés ou non.
Jusqu’en décembre 2023, la banque de sang des Cliniques universitaires Saint-Luc gérait la transfusion avec un logiciel arrivant peu à peu en fin de vie (implémentation en 2008). Ce logiciel était peu sécurisé (règles minimales de sélection de poches, pas de blocage incontournable en cas d’incompatibilité d’un composant avec le receveur potentiel, perte de traçabilité des utilisateurs…) et non interfaçable avec EPIC. Ceci nécessitait de réencoder toutes les demandes d’analyses et toutes les prescriptions de composants sanguins.
Il était donc temps d’en changer. La décision a été prise en 2017.
Le logiciel EPIC n’ayant pas développé de module pour gérer la transfusion, il a fallu se tourner vers une solution alternative qui devait être interfacée avec le logiciel EPIC.
Après plusieurs essais infructueux, en février 2023, le choix s’est finalement porté vers le logiciel Cursus 3 (Guyot-Walser Informatique, GPI France). Ce logiciel, présent dans plus de 300 hôpitaux en France, assure la traçabilité de la fonction « banque de sang » mais ne gère pas les analyses de laboratoire. En effet, en France, la gestion immuno-hématologique et la sélection des composants sanguins adaptée à chaque patient se font en dehors des hôpitaux. Il a fallu donc paramétrer toutes les analyses immuno-hématologiques dans Beaker, partie du logiciel EPIC qui équipe les laboratoires des Cliniques universitaires Saint-Luc.
En outre, l’organisation de la distribution du sang en France étant différente de celle de la Belgique, il a fallu paramétrer toutes les règles de compatibilité et de distribution (assumées en France par l’Etablissement Français du Sang, équivalent de nos établissements de transfusion sanguine) en tenant compte des spécificités de certains patients pris en charge aux Cliniques universitaires Saint-Luc (patients greffés, transfusés chroniques, petits prématurés…).
Le service de transfusion a donc été confronté à relever le double défi de résoudre une équation à double inconnue : les résultats des analyses du laboratoire d’immunologie érythrocytaire seront enregistrés dans Beaker, la gestion des composants sanguins quant à elle sera enregistrée dans Cursus 3. Cursus 3 sera interfacé avec le logiciel du dossier patient informatisé EPIC.
La mise en commun entre le logiciel Cursus 3 et le logiciel EPIC est une première mondiale. Ceci a engendré de nombreuses contraintes, a nécessité la mise en place de nombreuses interfaces, et l’acceptation de plusieurs compromis.
Logigrammes de flux – interfaces avec Epic/Beaker
Afin de faire communiquer les deux logiciels (Cursus 3 et EPIC), il était primordial de créer deux flux principaux avec chacun leurs différentes interfaces informatiques.
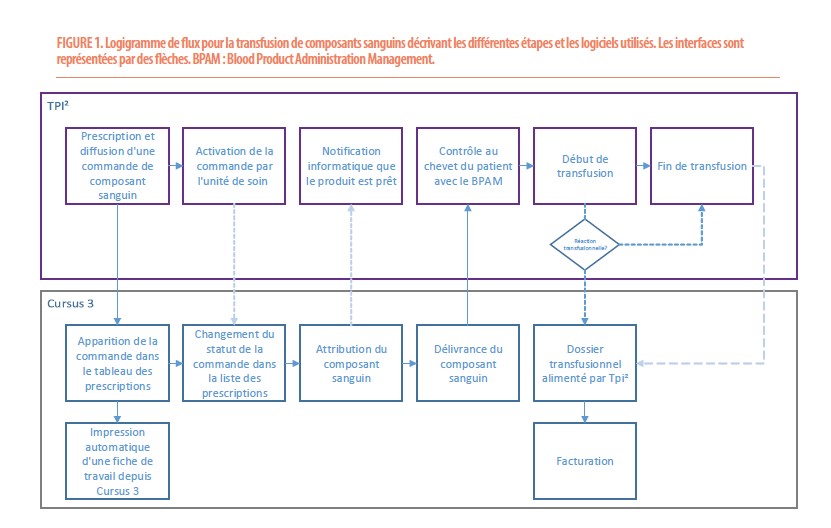
Flux transfusionnel de composants sanguins (Figure 1)
Ce flux commence par la prescription d’une transfusion de composant sanguin par un médecin pour un patient de l’institution dans le logiciel EPIC. Cette prescription est automatiquement transmise dans le logiciel Cursus 3 afin d’alerter la banque de sang d’une nouvelle commande. Une fiche de travail papier s’imprime et est utilisée par les technologues pour s’assurer de la bonne communication. Cette première information permet à la banque de sang d’assurer une bonne gestion de ses stocks et d’anticiper la commande de composants particuliers à l’établissement de transfusion sanguine.
Dès que le patient est dans les bonnes conditions pour recevoir une transfusion, le médecin transfuseur ou l’infirmière diffuse l’ordre de transfusion dans EPIC. Cette action va automatiquement changer le statut de la commande dans Cursus 3.
Le technologue en charge du poste d’allocation choisit le composant le plus adéquat pour le patient en fonction de différents facteurs (âge, sexe, pathologies, antécédents transfusionnels…). Cette étape cruciale réalisée dans Cursus 3 lie informatiquement un composant particulier à un patient donné.
À la fin de cette étape, un message est transmis par Cursus3 afin d’alerter le personnel infirmier que la poche est prête et qu’il peut venir la chercher physiquement à la banque de sang avec une étiquette du patient.
À la banque de sang, le technologue délivre le composant sanguin en scannant dans Cursus 3 le code-barre du code produit et le badge de la personne responsable du transport. Cette étape assure une traçabilité parfaite entre la banque de sang et le service.
Au chevet du patient, l’infirmière ou le médecin transfuseur scanne les informations du composant sanguin (code produit et numéro de don) et le bracelet du patient. Cette étape est capitale : elle permet une dernière vérification et s’assure de la compatibilité informatique (dont la compatibilité ABO) entre la poche scannée et le patient. Cette ultime vérification, réalisée au lit du malade, assure une sécurité maximale et évite de transfuser erronément une poche à un mauvais patient. Si les informations de la poche ne correspondent pas aux informations transmises par Cursus 3, le soignant est bloqué et ne peut commencer la transfusion.
Par contre, si tout est correct, alors il peut poursuivre les étapes et commencer la transfusion. Le moment correspondant au début de transfusion est communiqué à Cursus 3, ce qui va enclencher la facturation du composant sanguin.
Lorsque la transfusion est terminée, l’heure de fin est elle aussi communiquée dans le dossier transfusionnel Cursus 3 du patient, ainsi que la présence éventuelle d’une réaction transfusionnelle.
Si toutes les étapes du processus sont respectées, le flux est sécurisé par une traçabilité informatique complète. Cette automatisation permet d’éviter au maximum les coups de téléphone vers la banque de sang et donc de diminuer les interruptions de tâche du technologue responsable de la délivrance.
Le flux décrit ci-dessus est le flux général appliqué au sein des Cliniques universitaires Saint-Luc. Des procédures particulières existent pour les commandes vers le bloc opératoire ou en cas d’hémorragie avec menace vitale immédiate.
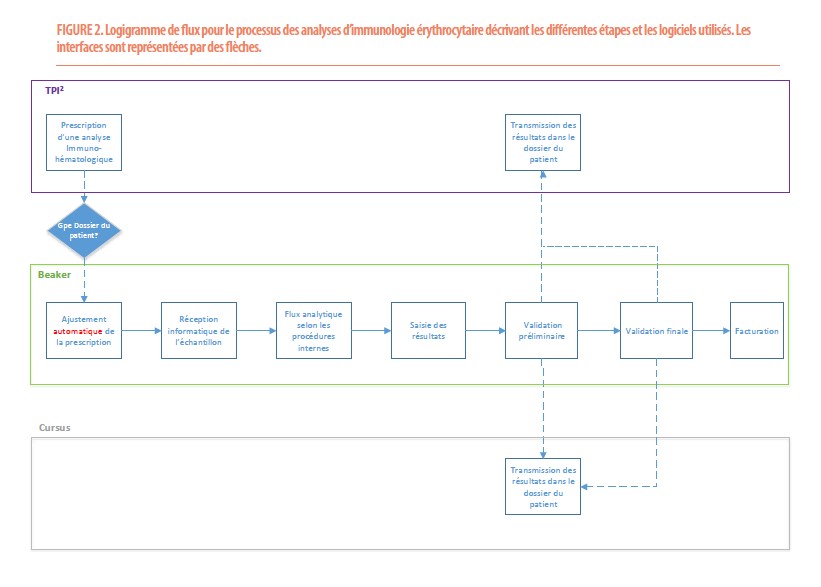
Flux transfusionnel des analyses d’immunologie érythrocytaire (Figure 2)
Pour la fonction laboratoire de la banque de sang, un flux spécifique pour les analyses d’immunohématologie a dû être créé. Les analyses principales réalisées au sein du laboratoire sont :
- Détermination de groupe sanguin
- Recherche d’anticorps irréguliers (RAI)
-Panel d’identification d’anticorps anti-érythrocytaires
- Test de compatibilité
- Test de coombs direct
- Elution
-Recherche et titrage d’agglutinines froides
-Test de cryohémolyse
- Titrage des anticorps anti-A/Anti-B naturels et/ou immuns
La prescription d’analyses est réalisée dans EPIC par un médecin. Les échantillons prélevés sont envoyés à la banque de sang et réceptionnés informatiquement. En fonction du contenu de la prescription, le technologue réalise les analyses, introduit le résultat dans Beaker et le valide. Cette validation préliminaire envoie le résultat dans le dossier du patient EPIC et dans le dossier transfusionnel Cursus 3. Après une dernière vérification, un biologiste réalise la validation biologique du résultat qui induit la facturation du test.
Concernant la détermination du groupe sanguin, le médecin doit prescrire simplement « groupe sanguin ». En fonction du nombre de déterminations de groupe sanguin connues dans le dossier du patient (aucune, une ou au moins deux), Beaker va déclencher le test approprié (première détermination, deuxième détermination ou contrôle de groupe sanguin). Cette intelligence permet d’éviter les erreurs de prescription, les prélèvements excédentaires et permet d’optimiser au mieux le flux analytique.
Arbres décisionnels et cas particuliers
Principes généraux
Afin de garantir la sécurité transfusionnelle et d’offrir un choix de composant sanguin optimal pour l’ensemble des patients de l’institution, différentes règles automatiques ou manuelles ont été paramétrées dans Cursus 3. Les règles automatiques sont déterminées selon l’âge et le sexe du patient, ainsi que selon la présence éventuelle d’un anticorps anti-érythrocytaire. Les règles manuelles sont ajoutées par l’utilisateur et restent d’application tant qu’elles ne sont pas enlevées manuellement.
Cursus 3 a aussi créé différents profils d’utilisateur paramétrables (administrateur, biologiste, assistant, technologue) qui ont chacun leurs différents droits propres.
Les différentes règles transfusionnelles existent sous deux formes différentes :
- Les protocoles transfusionnels rendent les conditions de délivrance « contraignantes » et induisent un contrôle supplémentaire au moment de la sélection d’une poche pour un patient tant au moment de la réservation qu’au moment de l’allocation. Leur activation est réservée aux assistants et biologistes ;
- Les consignes transfusionnelles donnent des informations complémentaires importantes liées à la délivrance d’un composant sanguin sans restriction lors de l’allocation. Elles peuvent être ajoutées et modifiées par tous les utilisateurs.
Toute règle possède un niveau de sécurité compris entre 1 à 5 ; elle peut être outrepassée par des actions particulières selon le profil de l’utilisateur.
Règles de compatibilité ABO cadenassées, y compris si < 2 déterminations
Les règles de compatibilité ABO sont basées sur le fait que tout individu possède dans son sérum/plasma des anticorps (anti-A/anti-B) dirigés contre les antigènes (A et/ou B) qu’il ne possède pas (= anticorps « réguliers »). Comme ces anticorps peuvent activer la cascade du complément, ils sont toujours dangereux provoquant des accidents de haute gravité (choc, collapsus vasculaire compliqué d’insuffisance rénale aiguë et de coagulation intravasculaire disséminée) parfois mortels ! Puisqu’ils sont naturels et réguliers, ce risque est immédiat, dès la première transfusion, et constant. Les incompatibilités immunologiques de type ABO sont parfaitement évitables par le respect des bonnes pratiques transfusionnelles. Elles sont le plus souvent la conséquence d’une erreur d’administration ou d’une suite d’erreurs le long de la chaîne transfusionnelle (erreur d’attribution, mauvaise identification du patient, non-respect des procédures transfusionnelles…). Afin de prévenir l’erreur ABO, les processus conduisant à l’attribution d’un groupe sanguin et à la délivrance d’une poche à un patient font l’objet de multiples contrôles. Leur transgression n’est pas tolérée. Actuellement, le risque relatif d’erreur ABO est estimé à 0.7 pour 100.000 composants sanguins transfusés (4).
Un des principes fondamentaux est qu’avant toute transfusion de composants sanguins, tout patient doit faire l’objet de deux déterminations des groupes sanguins ABO RH. Cela nécessite deux prélèvements effectués à des moments réellement différents de préférence par deux personnes différentes afin d’éviter toute erreur pré-analytique de prélèvement. Grâce à Beaker, la banque de sang a accès aux informations concernant le prélèvement (date, heure, préleveur) et peut donc s’assurer du respect de cette règle incontournable. En cas de doute sur le respect de ces règles, un nouveau prélèvement sera demandé.
Le logiciel informatique d’une banque de sang joue un rôle central dans la prévention de l’erreur ABO. Au sein du logiciel Cursus 3, des règles de distribution strictes et automatiques ont été mises en place afin d’ajouter un contrôle supplémentaire. Toute allocation d’un composant sanguin ABO incompatible avec le groupe sanguin ABO connu du patient est directement bloquée sans possibilité de contournement. De plus, si le patient n’a pas deux déterminations dans son dossier, Cursus 3 ne tolère qu’une distribution de concentré érythrocytaire de groupe O et du plasma AB. Dès que le groupe sanguin est définitivement connu, les règles ABO classiques seront automatiquement d’application pour les différents composants sanguins.
Respect de la compatibilité RH et KEL pour les femmes < 45 ans, hommes < 20 ans
Chez les femmes de moins de 45 ans et chez les hommes de moins de 20 ans, il est souhaitable de respecter la compatibilité des groupes sanguins RH et KEL pour les concentrés érythrocytaires, afin de limiter le risque d’immunisation et, par voie de conséquence, celui d’accident hémolytique ou de maladie hémolytique néonatale. En effet, théoriquement, toute transfusion est à risque d’une allo-immunisation anti-érythrocytaire post-transfusionnelle due à une différence antigénique incompatible entre le donneur et le receveur. Ces allo-anticorps n’auront pas tous les mêmes conséquences en termes de gravité ou d’avenir transfusionnel.
Au sein de Cursus 3, des règles d’allocation automatiques permettent de sélectionner uniquement des concentrés érythrocytaires RH KEL compatibles chez les femmes de moins de 45 ans et chez les hommes de moins de 20 ans sauf moyennant l’accord du superviseur médical de la banque de sang.
Protocoles pour un patient immunisé
Les patients qui présentent un auto- ou un allo-anticorps anti-érythrocytaire sont plus à risque de développer des allo-anticorps dirigés contre d’autres spécificités. Il est donc recommandé de respecter le phénotype RH KEL chez ces patients.
De plus, lors de l’identification de ces anticorps, le technologue doit caractériser ces anticorps dans Beaker. Les données vont aussi être transférées dans Cursus 3, ce qui engendre le respect de règles de sélection particulières pour la transfusion de concentrés érythrocytaires.
Par exemple, pour un allo-anticorps chaud, il faut sélectionner un concentré érythrocytaire phéno compatible, qui ne porte pas l’antigène contre lequel l’anticorps est dirigé, avec un test de compatibilité négatif, et ce durant toute la vie du patient.
Ces différentes règles ont pour but d’éviter les hémolyses immunologiques post-transfusionnelles pour les anticorps dangereux en transfusion, mais sont moins contraignantes pour les anticorps non dangereux afin de permettre une allocation plus rapide mais tout aussi sécurisée pour ces patients.
Protocoles pour les greffes de CSH
30 à 40% des allogreffes de cellules souches hématopoïétiques (CSH) sont réalisées en situation ABO incompatible (5). En période post-greffe, en attendant qu’il acquière le groupe sanguin du donneur, le receveur est dans un état de chimérisme mixte. Il n’a donc plus de véritable groupe sanguin et son groupe va devenir « CSH ». Le superviseur/l’assistant va ensuite encoder les protocoles transfusionnels dans Cursus 3 en tenant compte du groupe sanguin ABO RH KEL du donneur et du receveur pour les concentrés érythrocytaires et les plasmas frais congelés.
Quand le receveur aura acquis le groupe du donneur de manière définitive, le superviseur/l’assistant enlèvera manuellement ces protocoles. Il a été décidé de ne pas rendre ces opérations automatiques afin de limiter les risques d’une transfusion incompatible chez ces patients particuliers, notamment en cas de rechute.
De plus, en post-greffe, les concentrés érythrocytaires devront être irradiés (cf. infra).
Protocoles d’irradiation
L’irradiation du sang par rayon gamma est la méthode la plus couramment utilisée en Europe pour prévenir la réaction du greffon contre l’hôte associée à la transfusion (TA-GvHD). La TA-GvHD survient lorsqu’un composant sanguin cellulaire contenant des cellules T provenant d’un donneur immunocompétent est transfusé à un receveur (hôte) immuno-incompétent. Les cellules transfusées du donneur réagissent contre les tissus du receveur et provoquent des lésions de la peau, du foie, du tractus gastro-intestinal et également la moelle osseuse de l’hôte. Cette attaque entraîne souvent une insuffisance médullaire fatale pour le patient (6).
Les indications d’irradiation variant en fonction des recommandations des pays, mais les indications principales sont les allogreffes de cellules souches, les autogreffes de cellules souches, les nouveau-nés avec un poids inférieur à 1500 grammes, les lymphomes de Hodgkin, les dons intra-familiaux… En fonction du contexte clinique du patient, un protocole d’irradiation sera ajouté afin d’empêcher la transfusion de concentré érythrocytaire non irradié pour ces patients.
Cependant, l’irradiation des concentrés érythrocytaires doit être réalisée dans les 14 jours qui suivent le prélèvement en raison des lésions cellulaires qu’elle entraîne (relargage de potassium par exemple) et la durée de leur stockage doit être réduite à 28 jours. Le Logiciel Cursus 3 permet aussi de vérifier cette règle en empêchant la transfusion de CED trop vieux et adapte la nouvelle date de péremption. Cette vérification permet d’augmenter la sécurité pour les patients et de simplifier la gestion du sang irradié au quotidien pour les technologues de la banque de sang.
Protocoles pour les bébés âgés de moins de 4 mois et utilisation de sang maternel
Le système immunitaire étant encore immature, les bébés de moins de 4 mois sont des receveurs particulièrement vulnérables. En outre, leur espérance de vie étant très longue, toutes les précautions doivent être prises afin d’assurer l’innocuité la plus grande possible de toute transfusion (7), notamment pour les concentrés érythrocytaires. Vu l’immaturité immunologique des nouveau-nés, leur groupe sanguin n’est jamais considéré comme définitif. Ces receveurs sont transfusés avec des concentrés érythrocytaires de groupe sanguin O RhD négatif sauf si la maman possède des anticorps qui nécessitent l’utilisation d’un autre groupe sanguin ou si à la fois la maman et l’enfant sont RhD positif.
Le logiciel Cursus 3 n’autorise donc que la transfusion de CED de groupe O et du plasma de groupe AB grâce à un protocole automatique qui prend en compte l’âge du patient.
Il arrive qu’un allo-anticorps anti-érythrocytaire d’origine maternelle soit présent dans le sang du bébé. Les tests pré-transfusionnels obligatoires avant toute transfusion de CED comme la RAI/test de compatibilité peuvent donc être réalisés sur l’échantillon de la maman. Un type de matrice « sang maternel » a donc été créé dans Beaker afin de pouvoir réaliser les différentes analyses sur le sang de la maman. Cela permet d’éviter de prélever les nouveau-nés de façon répétée et d’empêcher au maximum les anémies iatrogènes.
Au niveau du logiciel Cursus 3, un lien mère-enfant peut être créé informatiquement afin que les données immuno-hématologiques connues de la maman soient utilisées pour l’allocation de concentré érythrocytaire pour son bébé. Ce lien amène un niveau de sécurité supplémentaire.
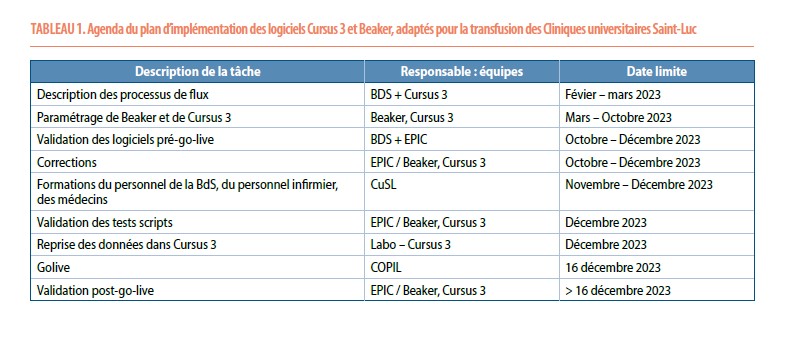
Chronogramme d’implémentation
Pour implémenter ces deux nouveaux logiciels, l’agenda suivant a été suivi (Tableau 1)
Services impactés
Les services suivants ont été impactés à des degrés divers.
Services internes médicaux et paramédicaux
A priori, tous les services de l’hôpital sont impactés par ces changements puisque la banque de sang est une fonction hospitalière qui travaille de manière transversale pour tous les patients d’une institution hospitalière.
Tant les médecins que le personnel infirmier sont concernés.
Et plus particulièrement :
- La banque de sang : apprentissage de deux nouveaux logiciels (EPIC/Beaker et Cursus 3)
- Les superviseurs en transfusion :
o validation biologique de tous les résultats,
o introduction des règles et protocoles transfusionnels
o autorisation via des mots de passe…
- Le service d’anesthésiologie :
o nouveau processus de prescription
o et de transfusion (cf. annexes : document de formation pour les anesthésistes)
- La néonatalogie et la pédiatrie :
o prescription des composants sanguins en poches et non plus en ml (concentrés érythrocytaires) ou en unités (concentrés plaquettaires)
o possibilité de prescrire des analyses sur la matrice « sang maternel »
- Le personnel infirmier :
o nouveau processus de diffusion de la transfusion
o nouveau processus pour l’acte transfusionnel proprement dit (cf. annexes : document de formation pour les infirmiers)
o utilisation du BPAM (Blood Product Administration Management)
La pharmacie : puisque la banque de sang sert de dépôt pour la pharmacie (Octaplas®, et stock d’urgence de facteurs de coagulation et divers), le processus de transmission des données pour la facturation a dû être revu.
Services internes non médicaux
- Service de l’administration des patients : interfaces créées entre le logiciel Cursus et le logiciel Oazis
o Pour la mise à jour des données des patients
o Pour la facturation des composants sanguins
Services externes
- Service du Sang de la Croix-Rouge (notre fournisseur de composants sanguins)
o Transmission des données des composants sanguins livrés par le Service du Sang dans le logiciel Cursus 3
o Enregistrement des données d’irradiation (convention entre le Service du Sang et la Banque de sang des CuSL)
o Enregistrement des distributions à d’autres institutions hospitalières (convention entre le Service du Sang et la Banque de sang des CuSL)
Gestion du risque
Expérience
Pour appréhender le risque d’implémenter un nouveau logiciel de banque de sang, nous n’avions que l’expérience antérieure datant de 2008. Certains membres de l’équipe avaient une expérience similaire dans une autre institution hospitalière.
Un dossier de validation pré-golive a été constitué et bien documenté.
Le contrôle des étapes clés de la validation a été programmé dans le post-go-live immédiat.
Communication et formation
Tous les services impactés ont été prévenus et de nombreuses séances de formation adaptées aux différents métiers ont été organisées dans les semaines qui ont précédé le golive. Des supports didactiques (« tip-sheets ») ont été rédigés et mis à disposition du personnel.
Décision du golive
La décision du golive a été prise en équipe avec des représentants des différents logiciels concernés (Cursus 3 et EPIC), un représentant de la direction médicale, la directrice du Département Médical d’Information et les cadres de la direction de la banque de sang.
Avantages de la nouvelle solution
Sécurité transfusionnelle maximale pour le patient
Les différents logigrammes décisionnels mis en place tant au niveau de Beaker que de Cursus 3 garantissent une sécurité maximale dans la sélection finale du composant sanguin à administrer (le bon produit pour le patient), tant au niveau du type de composant que des règles de compatibilité immunologique. Les cas particuliers liés aux spécificités de la patientèle prise en charge aux Cliniques universitaires Saint-Luc ont été couverts. Les situations exceptionnelles d’hémorragie avec menace vitale immédiate font l’objet d’une procédure particulière, manuelle, avec régularisation ultérieure (« Patient first »).
Traçabilité stricte et hémovigilance assurée
Le système mis en place couvre tout le processus transfusionnel intra-hospitalier, depuis la réception des composants sanguins par la banque de sang, jusqu’à la finalisation des transfusions au chevet du malade. La sécurisation des données est assurée par le transfert informatique de toutes les données.
L’identitovigilance lors de la mise en route d’une transfusion est sécurisée par le scan du bracelet du patient permettant une dernière vérification à partir des données envoyées par la banque de sang (contrôle du bon produit au bon patient) : en cas de discordance, un signal « stop » est activé pour le personnel soignant.
Les symptômes liés aux réactions transfusionnelles éventuellement développées par le patient sont également transmis informatiquement au logiciel Cursus 3, ce qui permet de documenter les événements d’hémovigilance.
Les composants sanguins qui n’ont pas été transfusés font également l’objet d’une traçabilité stricte (péremption, rejet).
Gestion administrative renforcée
L’envoi d’un message notifiant le début d’une transfusion enclenche automatiquement la facturation du composant sanguin, en temps réel.
Le logiciel Cursus 3 fournit un outil indispensable pour la réalisation régulière d’un inventaire physique du stock de composants sanguins (réconciliation avec les données informatiques).
Outils statistiques disponibles
Le logiciel Cursus 3 est doté d’outils statistiques robustes tant pour le suivi journalier, que pour la préparation de rapports annuels.
Il fournit une base de données indispensable pour l’implémentation et la surveillance du Patient Blood Management (Gestion personnalisée du sang du patient).
Conclusions : une « première mondiale »…
L’informatisation de la banque de sang et du laboratoire d’immunologie érythrocytaire a représenté un défi important puisqu’elle a nécessité la paramétrisation de deux logiciels, équation à double inconnue.
En effet, le logiciel Beaker (EPIC) n’avait pas été développé pour informatiser le laboratoire de transfusion. Ceci a nécessité le développement de règles pour que le bon test soit utilisé dans la bonne situation, en particulier le choix du type de détermination de groupe sanguin et les tests réflexes indispensables en cas de présence d’anticorps.
Quant au logiciel Cursus 3, il n’avait encore jamais été interfacé avec le logiciel EPIC auparavant. En outre, il a été modifié pour répondre aux besoins des banques de sang hospitalières belges.
Tout était donc à construire. Ceci a nécessité la mise en place de nombreuses interfaces et a engendré beaucoup de contraintes. Des compromis ont dû être choisis. Cependant, l’exigence première a toujours été la sécurité du patient. Mais tant le bien-être du personnel utilisateur que les outils de traçabilité ont également guidé les choix réalisés.
Cette expérience pourra servir de guide pour d’autres institutions hospitalières.
Cette réussite n’aurait pas abouti sans une formidable collaboration entre les équipes de la Banque de Sang, de DGW Informatique, du Département d’Information Médicale, du Département Information et Systèmes, des médecins et des infirmiers des Cliniques universitaires Saint-Luc. Que chacun trouve ici tous les remerciements qu’il mérite.
Références
- International Society of Blood Transfusion. Red Cell Blood Group Allele Tables, mises à jour en juillet 2023. https://www.isbtweb.org/isbt-working-parties/rcibgt.html
- Arrêté Royal du 17 février 2005 rendant certaines dispositions de la loi sur les hôpitaux, coordonnée le 7 août 1987, applicables à la fonction de banque de sang hospitalière.
- Arrêté Royal du 17 février 2005 fixant les normes auxquelles une banque de sang hospitalière doit répondre pour être agréée.
- AFMPS. Hémovigilance en Belgique. Rapport annuel 2019. https://www/afmps.be/sites/default/files/Rapport_annuel_hemovigilance_20...
- Malfuson JV, Hicheri Y, Bonin P, Rodet M, Boccaccio C, Pautas C, et al. Incompatibilité ABO et greffe allogénique de cellules souches hématopoïétiques à l’ère des conditionnements non myéloablatifs, Transfus Clin Biol. 2007; 14 :327-333.
- National Academies of Sciences, Engineering, and Medicine. 2022. Radioactive Sources: Applications and Alternative Technologies: French Version. Washington, DC: The National Academies Press. https://doi.org/10.17226/26454
- Conseil Supérieur de la Santé. Bonnes pratiques de transfusion à l’usage des hôpitaux. Avis 8381. Janvier 2010
Affiliations
1. Banque de sang, Département des Banques de Matériel Corporel Humain
2. Département Information et Systèmes
3. Beaker, EPIC, Département d’Information Médicale
4. Cheffe du Département des Banques de Matériel Corporel Humain
Correspondance
Pre Véronique Denyes, MD PhD
Cliniques universitaires Saint-Luc
Banque de Sang
Département des Banques de Matériel Corporel Humain
Avenue Hippocrate 10, B-1200 Bruxelles
veronique.deneys@saintluc.uclouvain.be