2024, la stimulation deviendra-t-elle 100% sans sonde ?
Les premières implantations de pacemakers ont été réalisées il y a des décennies. L’évolution de la technologie utilisée pour corriger les bradycardies est passée par des étapes majeures rappelées dans l’encadré ci-contre.
Parmi ces évolutions, le développement du leadless (pacemaker sans sonde) est un processus quasi naturel qui marque un véritable tournant et dont les avantages sont indéniables. L’idée d’une implantation d’un pacemaker sans sonde remonte bien avant les premières études des années 2000. En effet dès les années 1970, un dénommé J. William Spickler avait de façon très ingénieuse mis au point une capsule implantable dans le ventricule capable de stimuler un cœur (étude sur des chiens, à 12 semaines) sans être reliée à aucun fil métallique ni à un boîtier sous-cutané (1). Un précurseur en avance sur son temps mais tombé dans l’oubli pendant 3 décennies avant que ne soit ressorti des cartons cette idée géniale. Il faudra attendre les années 2000 pour voir la finalisation du projet industriel leadless. La plupart des médecins connaît le nom de MICRA™, le 1er pacemaker VVI leadless de Medtronic™. Cette petite capsule est actuellement la seule à être implantée de façon courante, bien que la firme concurrente Abbott™ fut la première firme à implanter le NANOSTIM™ en 2012. Mais la firme revient dans la compétition avec son nouvel appareil (AVEIR-VVI/DR™), point discuté plus loin (2). Le MICRA™ est un appareil dont le projet de développement date de 2006, et la première implantation remonte à 2013. Cela fait déjà 10 ans d’expérience clinique. On a du recul clinique avec plus de 150.000 implantations réalisées dans le monde à l’heure actuelle (3). Si on regarde les données à la fois d’efficacité et de sécurité, on est satisfait des progrès effectués qui correspondent à ce qui avait été annoncé à l’époque. Les succès d’implantation sont proches de 100% (fixation par des petites ancres), les paramètres électriques sont globalement excellents, et sur le versant de la sécurité, on observe des taux de complications peropératoires aux alentours de 3.5%.

La complication la plus grave avec cet appareil est la perforation cardiaque, en particulier si l’implant qui est très rigide est fixé à l’apex du ventricule droit. C’est une complication qu’on arrive à minimiser en visant de préférence quand cela est techniquement possible le septum interventriculaire comme site d’implantation. L’expérience joue donc, mais cela reste potentiellement dangereux. Une fois l’appareil implanté, il ne se passe quasi jamais rien. Exceptionnellement on a observé des déplacements de l’appareil (0.1%), ou une infection (0.2%) (4).
La volonté de développer du « tout leadless » a du sens. Elle se nourrit d’un constat affligeant pour le pace traditionnel. En effet, les systèmes (pacemakers, défibrillateurs) disposant des sondes intracardiaques peuvent entraîner chez le patient des complications sérieuses comme des déplacements de sonde, des perforations cardiaques, des infections. C’est une réalité rude et froide, qui a été démontrée depuis des années. Le risque infectieux peut être réduit, mais jamais totalement contrôlé. Ceci représente réellement le tendon d’Achille des pacemakers et défibrillateurs intracardiaques. En 2022, un important registre d’extraction (ESC-EHRA ELECTRa) (5) réalisé dans plus de 70 centres de centres de cardiologie (3.555 patients adressés pour extraction) l’a reconfirmé. On a globalement une mortalité qui est multipliée par 5 si la cause de l’extraction est une infection du boîtier mais si cette infection est systémique avec atteinte des sondes, la mortalité est multipliée par 9. C’est un vrai problème. Grosso-modo, si un patient infecte son boitier et ses sondes, qu’il a une endocardite, ou des foyers ailleurs, il a une certaine probabilité de mourir. Une partie de la solution est évidemment d’éviter d’implanter des sondes par abord veineux dans le cœur, ce qu’offre le leadless. Les indications sont principalement réservées à des patients dont la situation clinique est “grave”: lorsqu’il n’y a pas/plus d’accès veineux, si un appareil implanté a présenté ou présente une infection même active, si le patient est en insuffisance rénale terminale ou en dialyse, enfin s’il est à haut risque ou présente de fortes comorbidités. Ces situations rendent parfois très difficile l’implantation d’un stimulateur conventionnel. Le leadless est donc une solution de contournement, mais qui a un prix : il est 2 fois plus cher (>7000 Euros), mais la longévité actuelle est quasi équivalente. Les modèles animaux indiquent que l’on peut placer au maximum 2 à 3 capsules dans le ventricule droit sans atteinte à sa fonction. Toutefois, les capsules ne peuvent se toucher au risque de créer des artéfacts qui interfèrent avec le fonctionnement de l’appareil. L’enjeu reste de taille donc.

Quel est le futur de 2024 ? Le développement d’appareils doubles chambres, tels des « DDD ». La resynchronisation A-V existe déjà avec le MICRA-AV™ de Medtronic. Cet appareil est indiqué chez les patients en bloc auriculo-ventriculaire de haut degré, et complet. Il s’agit d’un mode simulant le VDD (pas de stimulation atriale possible, seule la détection est permise) mais en utilisant une seule capsule implantée dans le ventricule. En termes d’implantation, il s’agit donc de la même procédure que pour celle du Micra-VVI™. La longévité de la batterie semble similaire au VVI. Comment fonctionne-t-il puisqu’il ne peut détecter le signal électrique atrial ? L’appareil utilise de façon ingénieuse l’accéléromètre du boitier pour permettre la détection de l’activité atriale (contraction atriale - remplissage ventriculaire actif, produisant un signal acoustique appelé « A4 »). La détection atriale est donc mécanique et non réellement électrique comme on le verrait dans un pacemaker double chambre. Les indications sont donc différentes du MICRA-VR, puisqu’ici 100% des patients implantés sont en sinusal et ont un bloc auriculo-ventriculaire de haut grade ou complet. Dans les études de faisabilité MARVEL 1 de 2018, puis MARVEL 2, la synchronisation A-V (bonne détection de l’oreillette et resynchronisation de la stimulation ventriculaire) était assurée respectivement dans 87% et 89.2%, pas mal mais loin des 100% (6). Les auteurs confirmaient toutefois que cette resynchro améliorait le débit cardiaque, ce qui était un but recherché. En pratique, chez certains patients cela ne marche pas aussi bien, surtout s’ils sont bradycardes, ou trop tachycardes. Des difficultés de resynchronisation sont également observés en cas d’extrasystoles, particulièrement ventriculaires.
Face à une désynchronisation, on devrait s’attendre à un « syndrome du pacemaker » comme on le constate chez les patients en sinusal stimulés uniquement par un pace VVI. Ce syndrome est la conséquence de la contraction de l’oreillette sur valve fermée. Ce fameux syndrome redouté provoque un reflux de sang e.a. vers les jugulaires et une baisse du débit du cœur surtout à l’effort. Généralement le patient le ressent fortement. Mais heureusement, ce n’est quasi pas observé avec le MICRA-AV™. On a donc des risques de désynchronisation AV mai sans trop ni de gênes, ni de conséquences hémodynamiques, c’est donc acceptable comme solution technologique.
Peut-on toutefois prédire les patients qui ne présenteront pas de bonne détection de l’oreillette ? La formule suivante : un taux bas de sensing atrial prédira une mauvaise synchronisation. On peut le prédire grâce à deux paramètres : d’abord par le ratio E/A au niveau mitral (simplement mesuré par l’échographie), et la variabilité sinusale. Ces deux facteurs sont prédictifs de mauvaise synchronisation. Une faible variabilité sinusale, et un ratio E/A<1 ne sont pas des contre-indications mais seront plutôt à éviter.
Le premier « vrai » leadless-AV (2 capsules) sera probablement l’AVEIR-DR™ de la firme Abbott. Leur entrée dans le monde du leadless a été fracassante. La firme qui s’appelait précédemment St-Jude livra en 2012 leur appareil (NANOSTIM™) qui historiquement fut le premier stimulateur à être proposé pour une application humaine. Sa longévité était extraordinaire jusqu’à 15 ans. Toutefois, après un peu plus de 1400 implants, la commercialisation de l’appareil avait été interrompue prématurément suite aux risques élevés de tamponnades rapportés lors des implantations, et des problèmes de batterie (7). Avec l’AVEIR-DR™, Abbott offre pour la première fois un vrai double chambre DDDR (voir figures 1, 2).
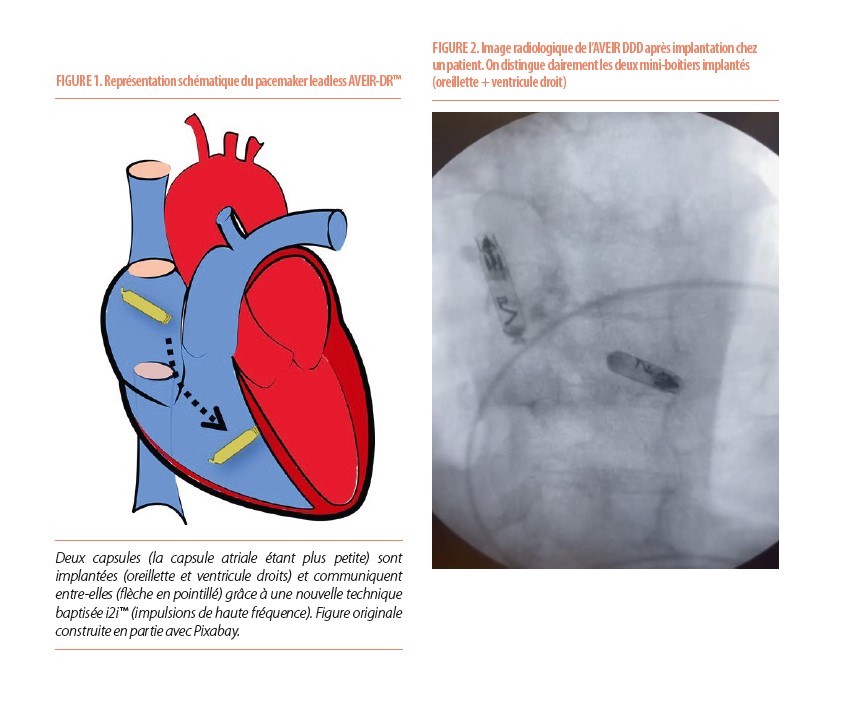
La technique est donc différente, plus technique car elle nécessite l’implantation de 2 capsules : une capsule dans le ventricule (2.4 grammes, longueur 38 mm) et une dans l’oreillette (2.1 grammes, longueur 32.2 mm). La resynchronisation AV est assuré par un nouveau mode de communication électrique (i2i™) entre les 2 systèmes (voir Figure 1). Les premières données publiées en 2023 démontrent des taux de synchronisation AV excellents, proches de 95%, en particulier si la capsule atriale est implantée à l’ostium de l’auricule droit (8). Ce site améliore considérablement les taux de communications avec le ventricule droit et réduit les risques de délogement. Dans l’étude publiée en 2023, l’implantation était un succès dans plus de 98%, avec une durée moyenne de procédure de 86,3±36,5 minutes et un temps de fluoroscopie de 18,3±10,7 minutes. Une tamponnade a été observée rarement, chez 0,7% des patients, ce qui est comparable aux études sur les stimulateurs cardiaques conventionnels (9).
En conclusion
Les pacemakers « leadless » imaginés il y a quelques décennies font maintenant partie du quotidien. Toutefois la technologie progresse, et on peut dans un avenir très proche proposer de vrais doubles chambres. Les avantages de ces systèmes sont indéniables : facilité d’implantation, quasi aucun risque de déplacement de l’appareil, pas d’infection, et surtout absence de nécessité d’utiliser des sondes de stimulations. Le système « tout en un » comme fabriqué aujourd’hui doit peut-être encore murir et probablement subir quelques améliorations techniques pour devenir un système utilisable au quotidien. Il sera indispensable de le confronter dans des études randomisées à la technologie conventionnelle endoveineuse, chose dont on ne dispose pas actuellement.
Références
- Totally self-contained intracardiac pacemaker. J. Electrocadiology, 3 (3-4) ; 325-331.
- Annonce commerciale résumant le produit. Lien : https://www.cardiovascular.abbott/us/en/hcp/products/cardiac-rhythm-mana...
- Données de Stéphane Combes, clinique Pasteur, Toulouse.
- El-Chami MF et al. Updated performance of the Micra transcatheter pacemaker in the real-world setting: A comparison to the investigational study and a transvenous historical control. Heart Rhythm. 2018 Dec;15(12):1800-1807.
- Diemberger I. et al. Transvenous Lead Extraction in Patients with Cardiac Implantable Device: The Impact of Systemic and Local Infection on Clinical Outcomes—An ESC-EHRA ELECTRa (European Lead Extraction Controlled) Registry Substudy.Biology 2022, 11, 615.
- Steinwender C, Khelae SK, Garweg C, et al. Atrioventricular Synchronous Pacing Using a Leadless Ventricular Pacemaker: Results From the MARVEL 2 Study. JACC Clin Electrophysiol. 2020 Jan;6(1):94-106.
- Sperzel J, Hamm C, Hain A. Nanostim-leadless pacemaker. Herzschrittmacherther Elektrophysiol. 2018 Dec;29(4):327-333
- Knops, Reinoud E., et al. “A Dual-Chamber Leadless Pacemaker.” New England Journal of Medicine (2023). DOI: 10.1056/NEJMoa2300080
- Vamos M, Erath JW, Benz AP, et al. Incidence of cardiac perforation with conventional and with leadless pacemaker systems: a systematic review and meta-analysis. J Cardiovasc Electrophysiol 2017;28:336-346.
La stimulation de la branche gauche, nouvelle alternative à la CRT
Corriger la dysfonction ventriculaire gauche, en particulier associée à de l’asynchronisme reste en rythmologie un grand sujet d’actualité. Le bloc de branche gauche (BBG) spontané (prévalence de 0.2-1% dans la population générale) est observé dans 30% des cas de cardiopathie dilatée, mais peut être induit par la stimulation apicale du ventricule droit (VD). Un BBG « naturel » ou électriquement induit par la stimulation produit un asynchronisme dans la contraction ventriculaire (paroi latérale du VG désynchronisée du reste de la contraction des ventricules). Ceci peut expliquer des altérations de fonction, mais aussi causer une forme particulière de cardiomyopathie, en particulier si la stimulation apicale du VD est fréquente. Une telle situation délétère se rencontrerait selon une analyse très récente dans 12% des cas de stimulations du VD (1). À l’inverse, une stimulation cardiaque dite plus physiologique, proche de la dépolarisation normale des ventricules (QRS fins) permettrait d’éviter l’apparition ou l’aggravation d’une dysfonction ventriculaire gauche. Un des points d’attention lors de la stimulation artificielle est donc de conserver un mode d’entraînement qui vise à favoriser une dynamique contractile ventriculaire synchrone. Il existe plusieurs techniques qui permettent d’y parvenir. Une des façons de faire est d’opter pour le placement de la sonde à proximité du système de conduction septal (typiquement à l’entrée ou au milieu du septum) ou des sites proches du VG. Sans aller du côté gauche du ventricule, les études ont montré que des sites de stimulation septale sont associés à une amélioration de la contractilité, à une durée plus courte des QRS, dont l’axe est par ailleurs normalisé. Une autre est la resynchronisation cardiaque (aussi nommée CRT pour Cardiac Resynchonization Therapy). Cette technique bien rodée nécessite d’ajouter à la stimulation ventriculaire droite une sonde qui permettra d’activer par l’intermédiaire du sinus coronaire la paroi (latérale) épicardique du ventricule gauche. La stimulation triple chambre, historiquement la première à être développée s’accompagne aujourd’hui d’une expérience scientifique solide qui repose sur de nombreuses études randomisées. Les qualités d’une bonne CRT se démontrent par des bénéfices cliniques majeurs en termes d’hospitalisation pour insuffisance cardiaque, de ralentissement de la progression de la dysfonction du ventricule gauche (parfois avec normalisation de la fraction d’éjection), amélioration de la classe NYHA, de la qualité de vie, de la VO2max, et de décès. Toutefois, tous les patients ne sont pas répondeurs, et techniquement il n’est pas toujours possible de placer une sonde correctement dans le sinus coronaire. La sonde peut se déloger, ou stimuler le nerf phrénique et causer des contractions involontaires et désagréables du diaphragme.

Depuis peu, des modes de stimulation alternatifs permettent d’obtenir des résultats encourageants similaires à la CRT. Ces techniques se basent sur la stimulation directe du faisceau de His, ou de la branche gauche (SBG). Par ailleurs, la technique d’implantation lors de la SBG est très similaire à celle d’une implantation d’un pacemaker classique. Les boîtiers sont similaires. Pour permettre à l’opérateur de fixer la sonde dans le septum, il utilise une longue gaine préformée. Cette gaine spéciale possède une double courbe, amenant la sonde de stimulation sur le côté septal du ventricule droit, et lui permettant ensuite d’être bien perpendiculaire au septum afin d’y être vissée. La manœuvre est surveillée grâce à l’ECG. Lors du passage à gauche, différents critères qu’il n’est pas utile de détailler ici permettent de savoir si la capture du QRS est spécifique de la branche gauche ou plutôt non sélective et septale (voir figure 3). Cette technique innovante doit encore faire ses preuves. Malheureusement, les données disponibles pour les systèmes alternatifs de la simulation du His ou de la branche gauche manquent.
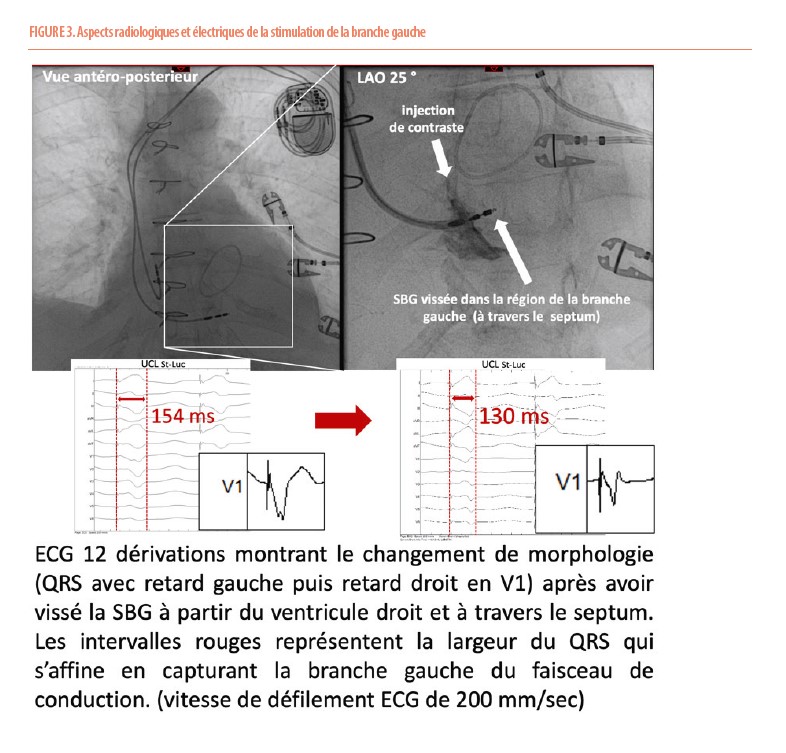
Il reste en effet encore de nombreuses questions non résolues à propos de ces nouvelles formes de stimulation : est-elle aussi physiologique et performante que la CRT ? Quels sont les patients qui en tireront le plus de bénéfice ? Quid des patients implantés pour BAV complet mais avec une FEVG normale ? Quel est le risque d’apparition/progression de la FA lors de la SBG ? La même question se pose pour le risque d’arythmies ventriculaires, sachant que le septum où est vissé la sonde reste une zone rythmologiquement sensible. Par ailleurs, des questions de sécurité demeurent. Une sonde défectueuse ou infectée peut-elle être extraite en toute sécurité ? Des essais randomisés devraient répondre à ces diverses questions légitimes. La SBG est promue à un bel avenir et pourrait peut-être définitivement supplanter la CRT.

En conclusion
La SBG semble offrir une stimulation physiologique, en évitant certaines difficultés de la CRT, comme l’usage de la troisième sonde, et la nécessité trouver le sinus coronaire dans lequel sera introduit la sonde. Dans l’attente de résultats d’études randomisées, la CRT gardera toutefois une place de premier choix lorsqu’un patient doit subir une resynchronisation cardiaque.
Références
- Somma V, Ha FJ, Palmer S, et al. Pacing-induced cardiomyopathy: a systematic review and meta-analysis of definition, prevalence, risk factors, and management. Heart Rhythm 2023;20:282–290.
L’électroporation, technique révolutionnaire de l’ablation
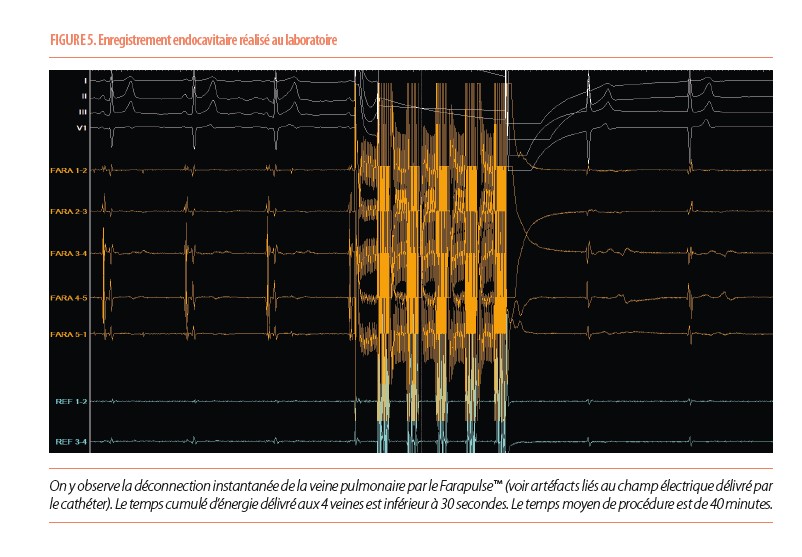
Lors des « hot sessions » du congrès de la Société Européenne de Cardiologie de 2023, a été présenté en primeur les résultats d’une étude technique qui s’appelle ADVENT. L’étude est parue ensuite en détail dans le New-England en novembre (1). C’est une étude concernant une nouvelle énergie pour l’ablation, dénommée électroporation. Les résultats étaient très attendus car c’est la première étude d’électroporation à être randomisée, étape indispensable à l’évaluation objective de la technique et à la reconnaissance par la FDA aux USA. L’essai thérapeutique complète des données obtenues un peu plus tôt dans l’étude PULSED-AF (2) qui avait précédemment montré que l’ablation de la FA en électroporation (utilisant le système PulseSelect™ de Medtronic) avait une efficacité similaire aux techniques conventionnelles. Mais cette étude n’était pas randomisée, et n’avait pas de groupe contrôle. Pourquoi de l’électroporation ? Pour rappel, l’ablation des arythmies notamment de la fibrillation atriale se fait habituellement avec des énergies thermiques qui sont soit la radiofréquence (chaleur) soit la cryoablation (froid). L’électroporation est une innovation qui permet une isolation non thermique des veines pulmonaires, au moyen d’un traitement délivré par champ électrique pulsé (environ 2kV), qui directement appliqué au niveau des cellules des veines pulmonaires entraîne une ouverture complète des pores membranaires qui secondairement causent la mort cellulaire (3), voir également le lien vidéo : https://www.nejm.org/doi/full/10.1056/NEJMoa2307291. Le courant délivré serait spécifique des cellules ciblées, et garantirait de ne toucher que les ostia des veines pulmonaires sans atteinte de l’œsophage, de nerfs, pour autant que les énergies recommandées soient respectées. Si cela se confirme, il s’agirait d’une avancée spectaculaire en terme de sécurité de l’ablation. Lors de l’usage d’énergies conventionnelles, les risques de dommages collatéraux, dont la fistule œsophagienne tant redoutée existent. Un des premiers systèmes avoir été utilisé est le FARAPULSE™ de Boston Scientific (voir figure 4).D’autres sont développés par des firmes concurrentes comme Medtronic™, Biosense Webster™.

C’est donc une nouvelle façon d’entrevoir l’ablation. La technique utilise un introducteur spécial orientable (FARADRIVE™) qui permet d’acheminer le cathéter d’ablation (FARAWAVE™) au niveau du cœur et des veines pulmonaires. Une fois sur place, un choc électrique de très courte durée est délivré (voir figure 5). La déconnection est quasi instantanée.
Bien entendu, il était important d’avoir donc une comparaison entre cette énergie et les énergies conventionnelles. L’étude randomisée ADVENT qui comportait 607 patients (≤75 ans) a été menée dans des centres aux USA où les opérateurs avaient une très grosse expérience avec les techniques déjà en place comme la cryoablation, ou la radiofréquence mais qui étaient novices quant à l’usage de l’électroporation. Lorsqu’un patient présentait de la fibrillation atriale paroxystique, réfractaire au traitement médical, il pouvait être randomisé pour recevoir le traitement par énergie conventionnelle (choix entre la cryoablation ou la radiofréquence), soit l’électroporation. C’était une étude de non infériorité, avec une analyse des critères de succès et de sécurité. Elle était non inférieure en termes d’efficacité (isolation des veines satisfaisante) comparé aux techniques habituelles (succès dans >90% des cas). Les résultats à 1 an restaient également comparables chez des sujets par ailleurs jeunes (âge moyen de 62 ans). En termes de sécurité, compte tenu des aspects « tissu spécifique » de l’électroporation, on pouvait s’attendre à plus d’efficacité. Les auteurs ont analysé particulièrement 3 complications qui auraient pû être moins fréquentes avec l’électroporation comme les sténoses de veines pulmonaires, les fistules atrio-oesophagiennes et les paralysies phréniques. Là encore, il y avait une « non infériorité », avec des complications graves rares mais tout à fait comparables entre les techniques, hormis pour les rétrécissements des veines pulmonaires (sans atteindre le niveau de réelle sténose). Pour cette dernière, une petite supériorité de l’électroporation a quand même pu être démontrée. Bien que certains détails de la procédure ne soient pas publiés, les études précédentes comme Manifest-PF (4) ont montré que l’électroporation est plus rapide que la radiofréquence, mais avec des temps de scopie plus longs (durée moyenne de l’intervention de 65’, durée moyenne d’irradiation de 13’). Que peut-on finalement conclure : la technique en est à ses débuts, et commence à faire ses preuves. Même si la seule étude randomisée dont on dispose est globalement neutre, elle laisse chez les observateurs un sentiment de satisfaction car on a l’impression que la sécurité pourrait devenir supérieure, au moins sur les cas de rétrécissements des veines pulmonaires. Il n’y a pas eu dans l’essai de fistules atrioœsophagiennes rapportées (dans aucun des deux groupes), mais pourtant il peut y en avoir car cela a été démontré lors des précédentes études portant sur la radiofréquence en particulier. Les prochaines étapes seront l’analyse de l’électroporation dans des indications plus larges comme les fibrillations atriales persistantes.
En conclusion
Les avantages de l’électroporation sont nombreux : le premier est une procédure qui est rapide même si elle nécessite plus de scopie. Le 2e avantage est le respect des tissus environnants, en particulier de l’œsophage. Ceci s’explique par une fréquence électrique utilisée qui est propre aux cellules cardiaques et n’impacte pas le fonctionnement des cellules qui compose les organes environnants.
Références
- V. Reddy, E Gerstenfeld, A Natale et al. Pulsed field or cpnventional thermal ablation for paroxysmal atrial fibrillation. N Engl J Med 2023 ; 389 : 1660-1671.
- A. Verma, D. Haines, L. Boersma et al. Pulsed field ablation for the treatment of atrial fibrilation, Pulsed AF pivotal trial. Circulation. 2023;147:1422–1432.
- Batista Napotnik T, Polajžer T, Miklavčič D. Cell death due to electroporation — a review. Bioelectrochemistry 2021;141:107871
- E. Ekanem, V Reddy, B Shcmidt et al. Multi national survey on the methods, efficacy, and safety on the post-approval clinical use of pulsed field ablation. Europace 2022 ; 24(8) : 1256-66.
Affiliations
Service de Cardiologie, Unité de Rythmologie, Cliniques universitaires Saint-Luc, B-1200 Bruxelles
Correspondance
Pr Christophe Scavée
Cliniques universitaires Saint-Luc
Service de Cardiologie
Avenue Hippocrate10
B-1200 Bruxelles
Christophe.scavee@uclouvain.be