Introduction
Les malformations vasculaires résultant d’anomalie dans le développement du système vasculaire et lymphatique, sont classées en fonction du type de vaisseau atteint en malformation à flux lent (veineux, capillaire, lymphatique) ou à flux rapide (malformations artérioveineuses). Présentes à la naissance, elles s’étendent avec le temps et dégradent progressivement la qualité de vie, induisant divers symptômes tels que douleur (continue ou en crise), déformation, limitation fonctionnelle, saignements ou infection à répétition. Les options thérapeutiques comprennent la résection chirurgicale et la sclérothérapie, mais ces procédures sont rarement curatives ou parfois irréalisables chez les patients présentant des lésions étendues et infiltrantes (1).
Malformations vasculaires au niveau moléculaire
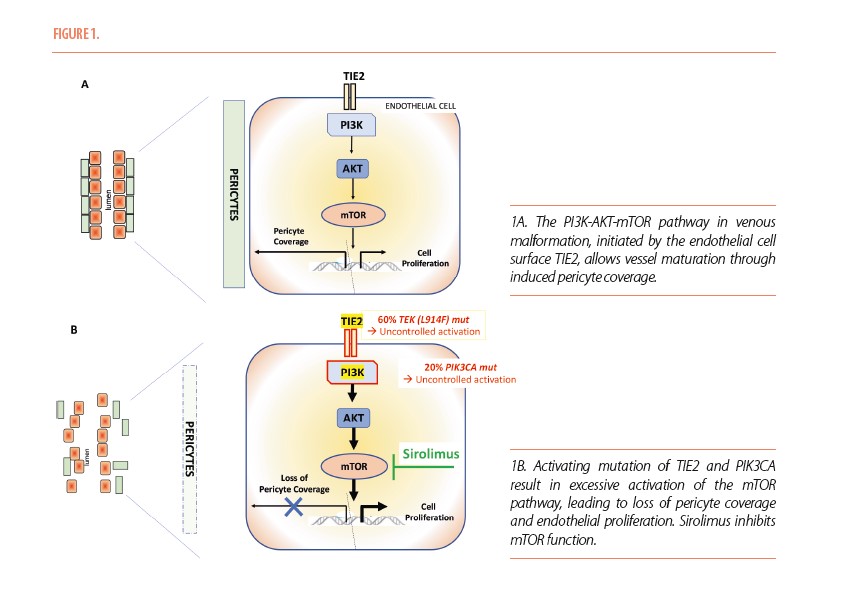
L’équilibre vasculaire est régi par le récepteur TIE2 situé à la surface endothéliale, initiant l’activation de la cascade PI3K-AKT-mTOR. Une mutation activatrice de TIE2 est retrouvée dans 60% des malformations veineuses (MVs) ; une mutation PIK3CA, encodant PI3K, est retrouvée dans 20% des MVs et 80% des malformations lymphatiques (MLs). Ces mutations, le plus souvent somatiques, entraînent une prolifération anarchique des cellules endothéliales et un détachement des péricytes via une activation excessive de AKT et mTOR (Figure 1A et B). Un inhibiteur mTOR, le sirolimus (ou rapamycine) a montré une efficacité prometteuse dans le traitement des malformations vasculaires à flux lent (2-3).
Confirmation de l’efficacité du sirolimus dans l’étude VASE
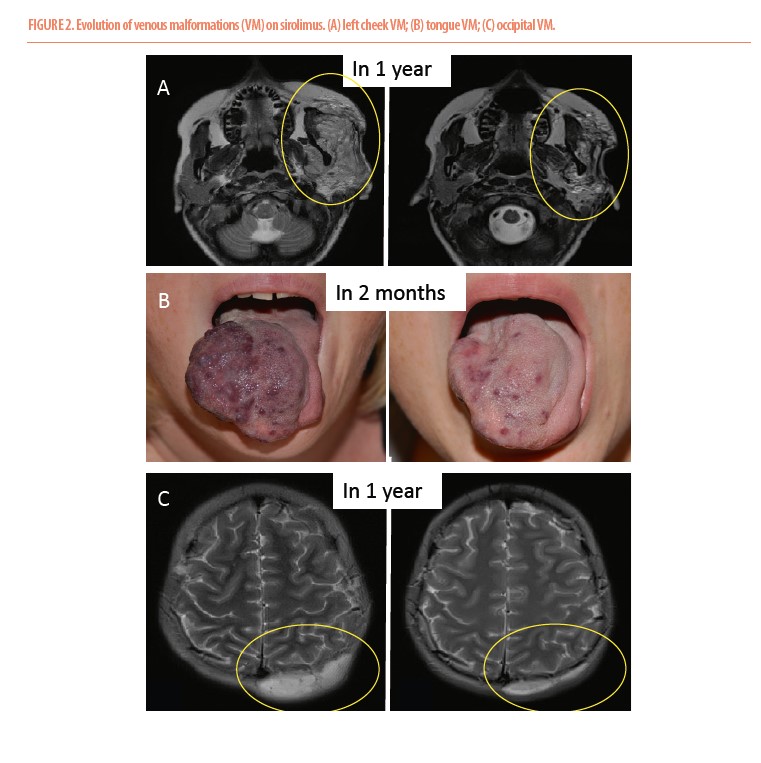
Nous avons débuté en 2016 une étude prospective multicentrique de phase III évaluant l’efficacité et la sécurité du sirolimus chez des patients atteints de malformations vasculaires à flux lent complexes et réfractaires aux traitements standards (EudraCT 2015-001703-32). En novembre 2023, nous avons publié dans le JCI insight les résultats concernant les 132 premiers patients (31 enfants et 101 adultes) (4). Le sirolimus a démontré une efficacité chez 85% de ces patients, permettant une amélioration significative de la douleur, de la limitation fonctionnelle, des suintements, des infections et/ou des saignements (Figure 2). Au-delà de cette efficacité globale, s’ajoutent :
- 70 % des patients ont signalé une amélioration des symptômes dès le premier mois de traitement. Dans les premiers mois, cependant, 20 % des patients peuvent décrire une détérioration transitoire de leurs symptômes, soulignant l’importance d’éviter un arrêt prématuré de la sirolimus.
- Le sirolimus a permis la réalisation d’une chirurgie ou d’une sclérothérapie chez 20 % des patients initialement jugés inéligibles à de telles traitements.
- Le sirolimus était administré pour une durée de 2 ans mais pouvait être repris en cas de résurgence des symptômes ; seulement un tiers des patients ont repris la sirolimus.
- Une mutation PIK3CA semble être associée à une réponse plus rapide au sirolimus.
Sécurité du sirolimus
Tant cette étude VASE que les autres études de phase II ont montré que le sirolimus était bien toléré, aussi bien chez les adultes que chez les enfants. Les effets secondaires les plus fréquents comprennent fatigue, mucite, diarrhée, maux de tête et éruption cutanée ; ils sont en général légers, de courte durée et facilement gérables. Aucun phénomène lié à une immunosuppression n’a été observé, en particulier aucun cas d’infection par Pneumocystis Carinii n’a été rapporté (en l’absence de prophylaxie). De plus, nous observons les premiers cas de grossesse survenant dans le cadre de cette étude, suggérant le peu d’impact du sirolimus sur la fertilité (2-4).
Premier cas de traitement in utero par sirolimus
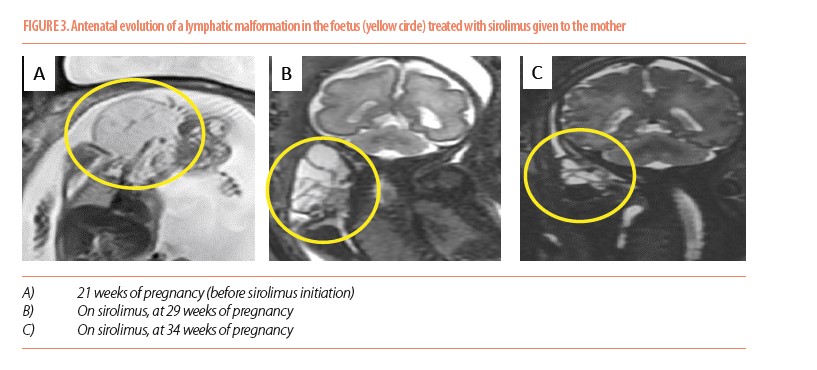
Nous avons récemment publié dans le Nature Cardiovascular Research un traitement in utero d’une malformation lymphatique fœtale par du sirolimus per os administré à la mère très tôt dans la grossesse, de la 22e semaine à la 39e semaine. La décision de commencer le sirolimus a été motivée par la compression des voies respiratoires par la malformation. Le sirolimus a permis une diminution rapide du volume de la malformation dans les trois semaines suivant le début du traitement (Figure 3). Il est important de noter qu’aucun retard de croissance intra-utérin n’a été observé, et que l’accouchement s’est déroulé sans complication. Après la naissance, le sirolimus a dû être rapidement réintroduit en raison d’une croissance rapide de la malformation lymphatique. L’enfant a bénéficié d’une résection chirurgicale subtotale de sa malformation lymphatique cervicale à l’âge de 15 mois. Maintenant âgée de 6 ans, elle a présenté un développement normal et ne requiert pas de traitement particulier. Cette expérience ouvre la voie à l’optimisation de la prise en charge des malformations vasculaires aux tout premiers stades de la progression naturelle de la maladie (5).
En conclusion
À travers l’essai VASE, le sirolimus devient le nouveau traitement standard des malformations vasculaires à flux lent, réduisant les symptômes et améliorant la qualité de vie. Le sirolimus ouvre la voie à d’autres options thérapeutiques qui étaient initialement considérées comme irréalisables. De plus, étant bien toléré, il peut facilement être administrés à des enfants, sans crainte d’effet immunosuppresseur.
Références
- Queisser A, et al. Genetic basis and therapies for vascular anomalies. Circ Res. 2021;129(1):155–173.
- Boscolo E, et al. Rapamycin improves TIE2-mutated venous malformation in murine model and human subjects. J Clin Invest. 2015;125(9):3491–3504.
- Hammer J, et al. Sirolimus is efficacious in treatment for extensive and/or complex slow-flow vascular malformations: a monocentric prospective phase II study. Orphanet J Rare Dis. 2018;13(1):191.
- Seront E, et al. Preliminary results of the European multicentric phase III trial regarding sirolimus in slow-flow vascular malformations. JCI Insight. 23;8(21):e173095
- Seront, E., Biard, J.M., Van Damme, A. et al. A case report of sirolimus use in early fetal management of lymphatic malformation. Nat Cardiovasc Res. 2, 595–599 (2023).
Affiliations
1. Institut Roi Albert II, Department of Medical Oncology, Cliniques universitaires St Luc, University of Louvain, Brussels, Belgium; VASCERN VASCA European Reference Centre
2. Institut Roi Albert II, Department of Pediatric Hematology & Oncology, Cliniques universitaires St Luc, University of Louvain, Brussels, Belgium
3. Division of Plastic Surgery, Cliniques universitaires St Luc, University of Louvain, Brussels, Belgium
4. Human Molecular Genetics, de Duve Institute, University of Louvain, Brussels, Belgium
Correspondance
Dr Emmanuel Seront
Centre de malformations vasculaires congénitales
Cliniques universitaires Saint-Luc
Avenue Hippocrate 10
B-1200 Bruxelles