La leucémie lymphoïde chronique : incidence, diagnostic et bilan initial
La leucémie lymphoïde chronique, ou LLC, est une hémopathie maligne caractérisée par l’accumulation de lymphocytes B matures clonaux dans le sang, la moelle, et les organes lymphoïdes (ganglions, rate).
En 2023, l’incidence aux Etats-Unis était estimée à 18740 nouveaux cas par an, et près de 4500 décès (1,2). Il s’agit d’une maladie touchant préférentiellement les personnes âgées, avec un âge médian de 72 ans au diagnostic. On retrouve une prédominance masculine ainsi que dans la population caucasienne (3).
Le diagnostic de LLC repose sur la mise en évidence dans le sang périphérique d’une population B clonale, avec au minimum 5000 cellules clonales/µl, depuis au moins 3 mois. Morphologiquement, les cellules sont de petites tailles, rondes, avec un bord étroit de cytoplasme autour d’un noyau dense avec de la chromatine en motte. Des ombres de Gumprecht sont fréquemment visualisées.
Lorsque l’atteinte est uniquement ganglionnaire, avec un taux de cellules clonales circulantes <5000/µl, il s’agit plutôt d’un lymphome lymphocytique, ou SLL. Quand une population clonale de phénotype LLC est décrite dans le sang, avec un nombre de lymphocytes clonaux inférieur à 5000/µl, sans symptômes et/ou masses ganglionnaires, on parle plutôt de MBL pour monoclonal B lymphocytosis. Le MBL est un statut pré-LLC, avec un risque de progression de l’ordre de 1% par an, et requiert une surveillance biologique annuelle.
La clonalité B kappa ou lambda des chaînes légères des immunoglobulines des lymphocytes doit être confirmée par une technique de cytométrie en flux. Les cellules de LLC expriment le CD5 (un antigène T), associé à des marqueurs B, notamment CD19, CD20 et CD23 (4). Pour le laborantin, il existe des scores associés à l’immunophénotypage, qui permettent de différentier la LLC d’autre syndromes lymphoprolifératifs B (ERIC and ESCCA, ou anciennement le score de Catovsky).
Le bilan initial comprend, outre une anamnèse détaillée et l’examen clinique, un examen sanguin avec immunophénotypage, une électrophorèse des protéines, un dosage de la beta2-microglobuline, une recherche d’hémolyse, les sérologies virales (hépatites et HIV). Un scanner ou un PET-scanner ne sont indiqués qu’en cas de suspicion de forte masse tumorale et/ou de transformation en lymphome agressif. L’examen médullaire n’est pas nécessaire en l’absence de cytopénies. Une caractérisation génétique de la LLC est également réalisée sur le sang périphérique (par FISH, caryotype et séquençage NGS).
La stadification des patients repose sur l’examen clinique et certaines analyses biologiques, via le système de Rai et/ou de Binet. A cela s’associent d’autres paramètres pronostiques, notamment le statut mutationnel des chaînes lourdes de la région variable des immunoglobulines (IgHV) et des anomalies génétiques de pronostic défavorables (concernant le gène TP53 ou ATM, ainsi que le caryotype lorsqu’il est complexe).
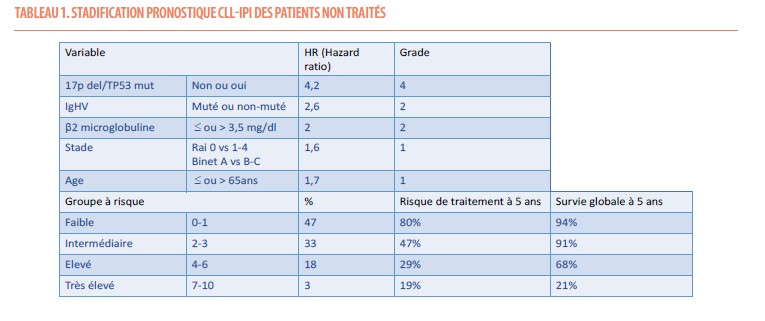
Les paramètres de la stadification pronostique CLL-IPI pour les patients non traités sont repris dans le tableau 1 (2).
La LLC est souvent diagnostiquée suite à la découverte fortuite d’une population sanguine B clonale. Lorsqu’elle devient symptomatique, les présentations cliniques sont variables, caractérisées par des masses ganglionnaires et/ou une splénomégalie douloureuse, des cytopénies centrales ou de causes immunes ou encore des symptômes constitutionnels. Les indications de traitement restent inchangées, elles sont reprises dans le tableau 2 (2).

Traiter un patient atteint de leucémie lymphoïde chronique en 2024
Le panel des traitements disponibles a énormément évolué ces dernières années, en Belgique notamment. La chimiothérapie qui était le gold standard il y a quelques années encore, a presque totalement laissé sa place à des thérapies ciblées et immunothérapies. Chaque traitement offre des modalités de prises différentes, et expose le patient à des risques d’effets secondaires différents. Le choix du traitement repose sur certains paramètres liés au patient (comme son âge, ses comorbidités) mais également sur les caractéristiques de la maladie (statut mutationnel IgVH, présence de mutations de mauvais pronostic à risque de chimiorésistance telles que la del 17p et/ou les mutations du gène TP53). Certaines molécules sont données en monothérapie, d’autres en association, selon le design des différentes études à l’origine de leurs approbations. Il en est de même pour les durées de prises, qui peuvent être sur le long cours (par exemple avec les BTKi en monothérapie) ou pour une durée de prise définie (par exemple avec le Venetoclax en association avec les anti-CD20, ou encore la chimiothérapie).
L’année 2024 offre de belles perspectives pour les patients belges suite à l’obtention de plusieurs nouveaux remboursements : celui du Zanubrutinib, de l’association Obinutuzumab-Venetoclax et de l’association Ibrutinib-Venetoclax en première ligne de traitement. Les mécanismes d’actions de ces molécules sont schématisés dans la figure 1.

Les modalités de traitements possibles et remboursés en Belgique sont reprises dans les figures 2 et 3 (31).

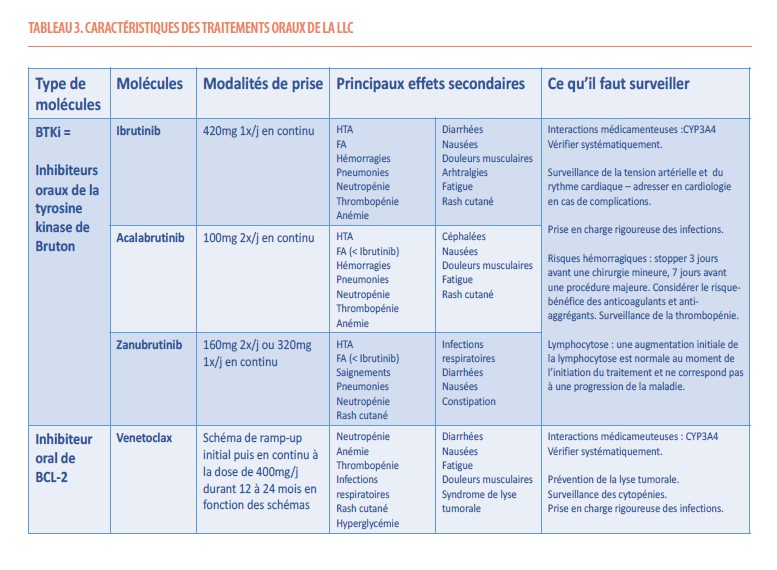
Les caractéristiques des thérapies orales sont reprises dans le tableau 3.
Que retenir par ailleurs ?
Le Rituximab et le Gazyvaro sont des anticorps monoclonaux qui ciblent le CD20 exprimés par la cellule de LLC. Ils peuvent être responsables de syndrome de lyse tumorale et de réactions infusionnelles à la première perfusion. De par la lymphopénie qu’ils induisent, ils sont également associés à un risque majoré d’infections.
Les BTKi sont des inhibiteurs irréversibles du récepteur B. En monothérapie, ils sont donnés en continu jusqu’à intolérance et/ou progression. Les molécules disponibles se distinguent notamment par leur spécificité pour le récepteur BTK et leurs différents effets « off target ».
Il existe des mutations de résistances connues pour les BTKi et le Venetoclax, celles-ci peuvent être recherchées sur le sang du patient en cas de signes d’échappement.
Les schémas de chimiothérapie encore utilisés dans certaines situations sont le FCR (pour Fludarabine-Cyclophosphamide et Rituximab), le BR (pour Bendamustine-Rituximab) et le Leukeran, généralement associé avec le Gazyvaro.
Traitements de support de la LLC

Perspectives pour l’avenir
De nombreux challenges persistent encore pour l’avenir. Quelle est la meilleure séquence pour ces différents traitements ? Actuellement, les décisions thérapeutiques se font au cas par cas en fonction des caractéristiques et/ou préférences du patient, du clinicien et de la maladie. Certaines études comparatives entre les différents schémas sont en cours, et pourront peut-être nous permettre de mieux affiner nos décisions thérapeutiques.
Il reste également la question des patients doubles réfractaires aux BTKi et au Venetoclax, de la meilleure prise en charge des LLC transformées en lymphomes agressifs (ou syndrome de Richter) dont le pronostic reste très défavorable. D’autres molécules sont en cours d’investigations et offrent de réelles perspectives pour le futur proche. Il s’agit notamment des traitements par CAR-T cells, des anticorps bispécifiques, des anti-BCL2 de nouvelles générations, ou encore des inhibiteurs réversibles de BTK.
Affiliations
1. Département d’Hématologie adulte, Cliniques universitaires Saint-Luc, B-1200 Bruxelles, Belgique.
Correspondance
Dr Sarah Bailly
Cliniques universitaires Saint-Luc
Département d’hématologie adulte
Avenue Hippocrate 10
B-1200 Bruxelles
Sarah.bailly@saintluc.uclouvain.be
Références
1. Chronic Lymphocytic Leukemia—Cancer Stat Facts. Available online: https://seer.cancer.gov/statfacts/html/clyl.html (accessed on 9 October 2022).
2. Hallek, M.; Al-Sawaf, O. Chronic Lymphocytic Leukemia: 2022 Update on Diagnostic and Therapeutic Procedures. Am. J. Hematol. 2021 ; 96, 1679–1705. [Google Scholar] [CrossRef] [PubMed]
3. Tambaro, F.P.; Wierda, W.G. Tumour Lysis Syndrome in Patients with Chronic Lymphocytic Leukaemia Treated with BCL-2 Inhibitors: Risk Factors, Prophylaxis, and Treatment Recommendations. Lancet Haematol. 2020 ; 7, e168–e176.[Google Scholar] [CrossRef] [PubMed]
4. Burger, J.A.; Barr, P.M.; Robak, T.; Owen, C.; Ghia, P.; Tedeschi, A.; Bairey, O.; Hillmen, P.; Coutre, S.E.; Devereux, S.; et al. Long-Term Efficacy and Safety of First-Line Ibrutinib Treatment for Patients with CLL/SLL: 5 Years of Follow-up from the Phase 3 RESONATE-2 Study. Leukemia. 2019 ; 34, 787–798. [Google Scholar] [CrossRef] [PubMed] [Green Version]
5. Wang, E.; Mi, X.; Thompson, M.C.; Montoya, S.; Notti, R.Q.; Afaghani, J.; Durham, B.H.; Penson, A.; Witkowski, M.T.; Lu, S.X.; et al. Mechanisms of Resistance to Noncovalent Bruton’s Tyrosine Kinase Inhibitors. N. Engl. J. Med. 2022; 386, 735–743. [Google Scholar] [CrossRef] [PubMed]
6. NCCN Clinical Practice Guidelines in Oncology Version 1. 2024. Available online: https://www.nccn.org/guidelines/guidelinesetail? category=1&id=1478.
7. Montserrat, E.; Marques-Pereira, J.P.; Rozman, C.; Ballesta, A.M.; Aguilar, J.L.; Elena, M. Serum Beta-2 Microglobulin in Chronic Lymphocytic Leukaemia. Clin. Lab. Haematol. 1982 ; 4, 323–325. [Google Scholar] [CrossRef]
8. Hallek, M.; Wanders, L.; Ostwald, M.; Busch, R.; Senekowitsch, R.; Stern, S.; Schick, H.-D.; Kuhn-Hallek, I.; Emmerich, B. Serum β2-Microglobulin and Serum Thymidine Kinase Are Independent Predictors of Progression-Free Survival in Chronic Lymphocytic Leukemia and Immunocytoma. Leuk. Lymphoma. 1996; 22, 439–447. [Google Scholar] [CrossRef]
9. Autore, F.; Strati, P.; Innocenti, I.; Corrente, F.; Trentin, L.; Cortelezzi, A.; Visco, C.; Coscia, M.; Cuneo, A.; Gozzetti, A.; et al. Elevated Lactate Dehydrogenase Has Prognostic Relevance in Treatment-Naïve Patients Affected by Chronic Lymphocytic Leukemia with Trisomy 12. Cancers. 2019 ; 11, 896. [Google Scholar] [CrossRef] [Green Version]
10. Barr, P.M.; Owen, C.; Robak, T.; Tedeschi, A.; Bairey, O.; Burger, J.A.; Hillmen, P.; Coutre, S.E.; Dearden, C.; Grosicki, S.; et al. Up to 8-Year Follow-up from RESONATE-2: First-Line Ibrutinib Treatment for Patients with Chronic Lymphocytic Leukemia. Blood Adv. 2022; 6, 3440–3450. [Google Scholar][CrossRef]
11. Hallek, M.; Cheson, B.D.; Catovsky, D.; Caligaris-Cappio, F.; Dighiero, G.; Döhner, H.; Hillmen, P.; Keating, M.; Montserrat, E.; Chiorazzi, N.; et al. IwCLL Guidelines for Diagnosis, Indications for Treatment, Response Assessment, and Supportive Management of CLL. Blood. 2018; 131, 2745–2760. [Google Scholar] [CrossRef] [Green Version]
12. Early Intervention in Asymptomatic Chronic Lymphocytic Leukemia—Hematology & Oncology. Available online: https:// www.hematologyandoncology.net/archives/february-2021/ early-intervention-in-asymptomatic-chronic-lymphocyticleukemia/(accessed on 5 November 2022).
13. Eichhorst, B.; Robak, T.; Montserrat, E.; Ghia, P.; Niemann, C.U.; Kater, A.P.; Gregor, M.; Cymbalista, F.; Buske, C.; Hillmen, P.; et al. Chronic Lymphocytic Leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol. 2021; 32, 23–33. [Google Scholar] [CrossRef]
14. Desikan, S.P.; Venugopal, S.; Ferrajoli, A. BTK inhibitor selection for chronic lymphocytic leukemia: Which drug for which patient? Expert Rev. Hematol. 2022; 15, 403–409. [Google Scholar] [CrossRef] [PubMed]
15. Hus, I.; Puła, B.; Robak, T. PI3K inhibitors for the treatment of chronic lymphocytic leukemia: Current status and future perspectives. Cancers. 2022; 14, 1571. [Google Scholar] [CrossRef] [PubMed]
16. Ahn, I.E.; Tian, X.; Wiestner, A. Ibrutinib for chronic lymphocytic leukemia with tp53 alterations. N. Engl. J. Med. 2020; 383, 498–500. [Google Scholar] [CrossRef
17. Fakhri, B.; Andreadis, C. The role of acalabrutinib in adults with chronic lymphocytic leukemia. Ther. Adv. Hematol. 2021; 12, 204062072199055. [Google Scholar] [CrossRef] [PubMed]
18. Delgado, J.; Josephson, F.; Camarero, J.; Garcia-Ochoa, B.; Lopez-Anglada, L.; Prieto-Fernandez, C.; Hennik, P.B.; Papadouli, I.; Gisselbrecht, C.; Enzmann, H.; et al. Ema Review of acalabrutinib for the treatment of adult patients with chronic lymphocytic leukemia. Oncologist. 2021; 26, 242–249. [Google Scholar][CrossRef]
19. Lewis, K.L.; Cheah, C.Y. Non-Covalent BTK Inhibitors-the New BTKids on the Block for B-Cell Malignancies. J. Pers.Med. 2021; 11, 764. [Google Scholar] [CrossRef]
20. Brown, J.R.; Eichhorst, B.; Hillmen, P.; Jurczak, W.; Kaźmierczak, M.; Lamanna, N.; O’Brien, S.M.; Tam, C.S.; Qiu, L.; Zhou, K.; et al. Zanubrutinib or Ibrutinib in relapsed or refractory chronic lymphocytic leukemia. N. Engl. J. Med. 2023; 388, 319–332.[Google Scholar] [CrossRef]
21. Al-Sawaf, O.; Zhang, C.; Tandon, M.; Sinha, A.; Fink, A.-M.; Robrecht, S.; Samoylova, O.; Liberati, A.M.; Pinilla-Ibarz, J.; Opat, S.; et al. Venetoclax plus obinutuzumab versus Chlorambucil Plus obinutuzumab for previously untreated chronic Lymphocytic Leukaemia (cll14): Follow-up results from a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020; 21, 1188–1200. [Google Scholar] [CrossRef]
22. `Tam, C.S.; Allan, J.N.; Siddiqi, T.; Kipps, T.J.; Jacobs, R.; Opat, S.; Barr, P.M.; Tedeschi, A.; Trentin, L.; Bannerji, R.; et al. Fixed-Duration Ibrutinib plus Venetoclax for First-Line Treatment of CLL: Primary Analysis of the CAPTIVATE FD Cohort. Blood. 2022, 139, 3278–3289. [Google Scholar] [CrossRef]
23. Kater, A.P.; Owen, C.; Moreno, C.; Follows, G.; Munir, T.; Levin, M.-D.; Benjamini, O.; Janssens, A.; Osterborg, A.; Robak, T.; et al. Fixed-duration ibrutinib-venetoclax in patients with chronic lymphocytic leukemia and Comorbidities. NEJM Evid. 2022 ; 1. [Google Scholar] [CrossRef]
24. Waggoner, M.; Katsetos, J.; Thomas, E.; Galinsky, I.; Fox, H. Practical management of the Venetoclax-treated patient in chronic lymphocytic leukemia and acute myeloid leukemia. J. Adv. Pract. Oncol. 2022; 13, 400–415. [Google Scholar] [CrossRef] [PubMed]
25. Kay, N.E.; Hampel, P.J.; Van Dyke, D.L.; Parikh, S.A. CLL Update 2022: A Continuing Evolution in Care. Blood Rev. 2022; 54, 100930. [Google Scholar] [CrossRef] [PubMed]
26. Gribben, J.G. Practical Management of Tumour Lysis Syndrome in Venetoclax-Treated Patients with Chronic Lymphocytic Leukaemia. Br. J. Haematol. 2019; 188, 844–851. [GoogleScholar] [CrossRef] [PubMed]
27. Burger, J.A. Integrating new therapies for chronic lymphocytic leukemia. Cancer J. 2021; 27, 275–285. [Google Scholar] [CrossRef] [PubMed]
28. Michot, J.-M.; Ribrag, V. Pirtobrutinib Shows Evidence to Inaugurate a Third Generation of BTK Inhibitors. Lancet. 2021; 397, 855–857. [Google Scholar] [CrossRef]
29. Reiff, S.D.; Muhowski, E.M.; Guinn, D.; Lehman, A.; Fabian, C.A.; Cheney, C.; Mantel, R.; Smith, L.; Johnson, A.J.; Young, W.B.; et al. Noncovalent Inhibition of C481S Bruton Tyrosine Kinase by GDC-0853: A New Treatment Strategy for Ibrutinib-Resistant CLL. Blood. 2018; 132, 1039–1049. [Google Scholar] [CrossRef] [Green Version]
30. NEJM Journal Watch: Summaries of and Commentary on Original Medical and Scientific Articles from Key Medical Journals. Available online: https://www.jwatch.org/na53334/2021/05/20/third-generation-bruton-tyrosi...,
31. Janssens A, et al. BHS guidelines for the treatment of chronic lymphocytic leukaemia anno 2023. Belg J Hematol.