Introduction
Les syndromes myélodysplasiques (SMD), appelés maintenant néoplasmes myélodysplasiques selon la nouvelle classification OMS 2022 (1), regroupent un ensemble très hétérogène de désordres myéloïdes caractérisés par une hématopoïèse clonale inefficace responsable de cytopénies et un risque accru de transformation en leucémie myéloïde aiguë (LMA).
Les SMD affectent généralement les adultes âgés, puisque 80 % d’entre eux ont plus de 60 ans.
Le diagnostic repose sur la mise en évidence à la morphologie, de signes de dysplasie au niveau de la moelle. Les informations additionnelles obtenues par la cytogénétique et les tests moléculaires permettent d’affiner le pronostic et d’orienter le traitement (2).
Le risque de progression est défini sur base de différents facteurs dont l’existence de cytopénies, le pourcentage de blastes dans la moelle osseuse et les événements oncogéniques somatiques. Deux tiers des patients présentent, au diagnostic, une maladie de faible risque. Chez ces derniers, le but du traitement est d’améliorer les cytopénies, principalement l’anémie. Chez les patients à haut risque, même si la greffe de cellules souches hématopoïétiques (GCSH) reste la seule option curative, les agents hypométhylants (AHM) représentent la norme de soins mais ne sont malheureusement pas curatifs.
Classification
En 2022, et l’OMS et l’International consensus classification (ICC) ont chacun publié une mise à jour de la classification des SMD (1,3). Même s’il existe des différences entre ces ٢ classifications, les ٢ systèmes ont le mérite d’avoir incorporé les données génétiques, en particulier les mutations de SF3B1, les mutations bi-alléliques de TP53 et la délétion 5q. L’OMS ajoute aussi 2 nouvelles entités basées sur la morphologie, les SMD hypoplasiques dont une des caractéristiques est d’être associés à des taux élevés de réponse au traitement immunosuppresseur, et les SMD avec fibrose de pronostic défavorable, deux entités qui ne sont pas reprises dans l’ICC 2022. L’ICC 2022 introduit quant à elle une nouvelle entité, les SMD/LMA, définis par la présence de 10-19% de blastes dans le sang périphérique et/ou la moelle, en l’absence d’anomalies génétiques spécifiques de LMA. Cette situation permet d’élargir les possibilités d’inclusion des patients dans les essais cliniques afin de les faire bénéficier de nouvelles thérapies approuvées pour les LMA (Figure 1).
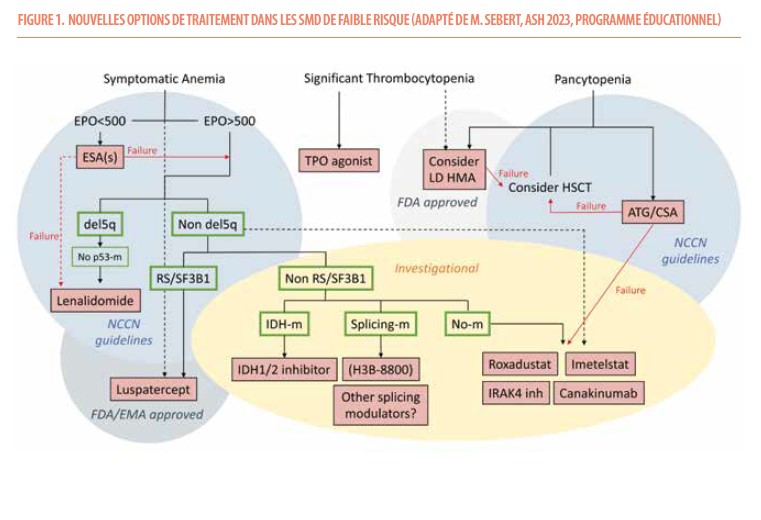
Stratification du risque
Différents scores permettent d’évaluer le risque évolutif des patients atteints de SMD. Le score le plus utilisé est l’International prognostic scoring system révisé ou IPSS-R. Cependant, récemment, les données moléculaires ont aussi été implémentées dans un nouveau score, l’International prognostic scoring system moléculaire ou IPSS-M qui permet de mieux définir le risque pronostique en termes de survie et de transformation en LMA, bien que son application en pratique clinique et particulièrement dans les études cliniques, reste à définir.
SMD de faible risque (SMD-FR)
Dans les SMD-FR, définis par un score IPSS-R ≤3,5 ou IPSS-M modéré faible, faible et très faible, l’objectif du traitement est de réduire les cytopénies, principalement l’anémie, présente chez près de 90% des patients. L’anémie a un impact profond sur leur qualité de vie, elle est souvent associée à une dégradation de la fonction cardio-pulmonaire et un déclin cognitif. L’approche thérapeutique est essentiellement supportive, se limitant principalement aux transfusions ou aux agents stimulant l’érythropoïèse (ASE), plus récemment, le luspatercept et dans certains cas, le lénalidomide.
La prise en charge de l’anémie repose d’abord sur la transfusion de globules rouges (GR). La dépendance à la transfusion de GR (DT) induit une surcharge en fer, diminue la qualité de vie et la survie. L’érythropoiétine (EPO) et ses dérivés constituent la première étape de la prise en charge chez les patients DT, avec des taux de réponse globale de l’ordre de 30 à 45% pour une durée médiane de réponse de 18 à 24 mois (4). Ces molécules sont plus efficaces chez les patients ayant un taux d’EPO sérique ≤500 U/L, une charge transfusionnelle limitée et dans les sous-types de SMD avec sidéroblastes en couronne (RS, ring sideroblasts).
Ces dernières années, de nombreux efforts ont été déployés pour améliorer le taux de réponse de ces patients que ce soit en première ligne ou en rechute.
Cibler la voie métabolique impliquant TGF BETA
Le luspatercept (LUS) est le premier représentant d’une nouvelle classe thérapeutique. Il agit comme un piège pour certains ligands de la famille des facteurs TGF- β (transforming growth factor beta), en inhibant la voie Smad 2/3 et en favorisant les derniers stades de l’érythropoïèse (5).
Dans l’essai MEDALIST de phase 3, des patients atteints de MDS-DT, réfractaires/intolérants ou inéligibles aux ASE, ont été randomisés entre LUS et placebo (6). Au total, 153 patients ont reçu LUS à la dose initiale de 1 mg/kg par voie sous-cutanée tous les 21 jours, tandis que 71 patients ont reçu un placebo. L’objectif primaire, à savoir l’indépendance vis-à-vis des transfusions de GR (IT) pendant au moins 8 semaines, a été atteint chez 45 % des patients du groupe LUS contre 16 % des patients du groupe placebo, un effet qui a perduré au-delà de 16 semaines chez 28 % des patients du groupe LUS contre 7 % seulement des patients du groupe placebo (7). Outre une bonne tolérance, aucun signe de progression de la maladie n’a été observée sous ce traitement.
Plus récemment, l’essai COMMANDS de phase 3 a comparé LUS à EPO en première ligne chez des patients atteints de SMD-FR, non porteurs de la délétion 5q, non exposés à l’EPO (8). L’objectif primaire de l’étude, l’IT pendant au moins 12 semaines avec une augmentation moyenne simultanée de l’hémoglobine d’au moins 1,5 g/dl, a été atteint chez 60% des patients du groupe LUS contre 35% du groupe EPO, avec une durée de réponse significativement plus longue pour LUS (127 semaines) comparé à EPO (90 semaines). A noter que pour les patients porteurs d’un SMD sans RS, aucune différence de réponse n’a été observée entre LUS et EPO. Le traitement des patients DT par LUS présente donc un avantage, au moins chez ceux porteurs de RS. Le médicament s’accompagne cependant certains effets secondaires tels qu’asthénie, nausées, dyspnée, hypertension et céphalées. A noter également que les patients présentant des mutations ASXL1, TET2, SF3B1 sont plus susceptibles d’obtenir une réponse avec LUS qu’avec EPO (9).
D’autres nouvelles molécules ciblant la voie du TGF-β sont à l’étude. Le KER-050, en inhibant la signalisation d’un sous-ensemble de protéines de la famille TGF-β, augmente non seulement les taux de GR mais aussi de plaquettes. Les résultats d’une analyse préliminaire portant sur les 59 patients sont informatifs puisque 40% des patients atteignent l’objectif principal d’IT pour au moins 8 semaines, alors que 50% d’entre eux voient leur hémogramme s’améliorer, y compris en cas de transfusions itératives (10).
Cibler les mutations somatiques : inhibiteurs de l’isocitrate déshydrogénase et du spliceosome
Les mutations ciblant IDH1 ou IDH2 (isocitrate déshydrogénases 1 et 2) sont détectées chez environ 10 % des patients atteints de SMD. Il s’agit de mutations avec ‘gain de fonction’ qui altèrent la différenciation des cellules hématopoïétiques. Bien que les inhibiteurs d’IDH1/2, ivosidenib et enasidenib, soient actuellement largement développés dans les SMD-HR, certains essais cliniques évaluent également leur efficacité dans les SMD-FR (11,12). En outre, l’enasidenib permet d’augmenter la différenciation érythroïde des progéniteurs de cellules souches hématopoïétiques (PCSH) (13), et dans ce cadre, fait actuellement l’objet d’études dans les SMD-FR sans mutation d’IDH2.
D’autres thérapies ciblées concernent les inhibiteurs du spliceosome. Parmi eux, H3B8800 est une petite molécule qui module le splicing (épissage) (14). Dans une étude de phase 1 menée chez des patients porteurs de mutations du splicing, aucune réponse franche n’a été obtenue sous réserve de quelques patients ayant acquis une IT (15). Compte tenu de la fréquence élevée des mutations du splicing dans les SMD, d’autres inhibiteurs sont à l’étude.
Cibler l’activité des télomérases
Les SMD sont caractérisés par une augmentation de l’activité des télomérases, ce qui favorise l’expansion des cellules tumorales clonales. L’imetelstat, premier agent de sa catégorie, est un inhibiteur compétitif de l’activité enzymatique des télomérases. Il induit l’apoptose des PCSH malignes tout en épargnant leurs homologues normaux, ce qui permet le rétablissement de l’érythropoïèse.
Dans l’étude IMerge de phase 2 qui concerne 57 patients atteints de SMD-FR DT (61% de SMD-RS), l’imetelstat a permis d’atteindre une IT prolongée d’au moins 8 semaines chez 42% des patients, pour une durée médiane de 65 semaines (16). La myélosuppression est l’effet secondaire principal observé avec cette drogue.
Dans l’étude IMerge de phase 3, l’imetelstat a été comparé à un placebo chez des patients atteints de SMD-FR DT après échec de l’EPO (17). L’objectif principal, à savoir l’IT pendant au moins 8 semaines, a été atteint dans 40% des cas chez les patients sous imetelstat contre 15 % chez ceux sous placebo, pour une durée de réponse significativement plus longue (52 contre 13 semaines), un avantage observé dans tous les sous-groupes, y compris chez les patients porteurs de SMD sans RS. En termes de sécurité, des taux similaires de saignements et d’infections de grade ≥3 ont été observés avec l’imetelstat et le placebo.
Cibler la voie du facteur inductible à l’hypoxie (HIF)
Cette voie métabolique est impliquée dans la régulation de l’hématopoïèse. Le roxadustat (ROX) imite la réponse naturelle de l’organisme aux conditions d’hypoxie en inhibant la prolyl hydroxylase HIF, ce qui permet la transcription et l’expression des gènes nécessaires à l’érythropoïèse. Ce médicament augmente l’hémoglobine et l’EPO chez les patients souffrant d’insuffisance rénale chronique (18,19). L’essai MATTERHORN de phase 3, comparant ROX à un placebo chez des patients atteints de SMD-FR sans del(5q), peu transfusés, mais en échec d’un traitement par EPO, n’a pas atteint son objectif principal d’IT d’au moins 8 semaines (20).
Cibler les voies de signalisation de l’inflammation
Des données récentes évoquent le fait que l’inflammation puisse conduire à une prolifération sélective de cellules souches aberrantes dans les SMD, tout en inhibant l’hématopoïèse saine, aggravant les cytopénies (21). Plusieurs agents ciblant les voies immunitaires/inflammatoires sont ainsi à l’étude. L’une de ces voies concerne IRAK4, impliqué dans l’hyperactivation de NFκB. L’inhibition d’un des isoformes d’IRAK4 entrave la prolifération des cellules leucémiques (22). Les inhibiteurs d’IRAK4 tels que l’emavusertib sont en cours d’évaluation dans les SMD-FR (23).
Un autre agent interférant avec la signalisation immunitaire est le canakinumab, un anticorps monoclonal dirigé contre l’interleukine IL-1b qui joue un rôle majeur dans l’inflammation. Ce médicament est déjà autorisé par la FDA dans les maladies inflammatoires et oncologiques induites par l’IL-1b. Une étude de phase 2 est actuellement en cours (24).
Les différentes options thérapeutiques (y compris investigationnelles) en cas de SMD-FR sont reprises dans la Figure 1.
SMD de haut risque (SMD-HR)
Chez les patients atteints de MDS-HR, les options thérapeutiques n’ont quasi pas évolué depuis près de 15 ans, les azanucléosides restant le standard de traitement pour la majorité des patients.
Azacitidine, un standard indéboulonnable… !
L’azacitidine (AZA) est le seul médicament qui a permis d’améliorer la survie des patients atteints de SMD-HR par rapport aux traitements classiques (24,5 contre 15,0 mois) dans un vaste essai randomisé publié en 2009 (25). Malheureusement, les données de vie réelle sont moins optimistes, avec une survie médiane allant de 14 à 19 mois (26). Invariablement, tous les patients progressent et, en cas d’échec aux agents hypométhylants (AHM), leur pronostic est particulièrement mauvais.
En outre, toutes les combinaisons testées avec les AHM à ce jour n’ont pas permis de démontrer un quelconque avantage en termes de survie. Parmi elles, le lénalidomide, un immunomodulateur, le vorinostat et le pracinostat, des inhibiteurs des histones désacétylases (HDAC), le volasertib, un inhibiteur de polo-like kinase, l’elthrombopag et le romiplostim, des agonistes de la thrombopoiétine, et le durvalumab, un inhibiteur de PD-L1 (programmed death-ligand 1).
Plus récemment, trois essais de phase 3 n’ont pas atteint leurs objectifs de recherche. L’association AZA-eprenetapopt (APR-246) (27), une petite molécule qui réactive p53, n’a pas atteint son objectif principal de réponse complète. La combinaison AZA-pevonedistat, un inhibiteur sélectif de l’enzyme activatrice NEDD8, n’a pas permis d’améliorer la survie sans évènement ni la survie globale (28). Enfin, un essai de phase 3 associant le magrolimab et agents hypométhylants a été interrompu pour futilité. Cette molécule est portant intéressante, il s’agit d’un anticorps ciblant le CD47 surexprimé sur les cellules cancéreuses, anticorps qui supprime le signal «ne me mange pas» envoyé par les cellules cancéreuses aux cellules immunitaires (29).
Le venetoclax, l’inhibiteur sélectif de BCL¬2 qui a révolutionné la prise en charge des patients âgés atteints de LMA, est actuellement évalué dans les SMD-HR (30). Dans l’étude de phase 1b, l’association AZA-venetoclax induit un taux de réponse globale de 80%, avec un taux de réponse complète de 40% (16% pour les patients présentant des mutations TP53), avec une survie globale particulièrement favorable pour les patients atteignant la réponse complète (31). Ces données soutiennent l’étude VERONA de phase 3 actuellement en cours, comparant AZA ± venetoclax, avec comme objectif principal, la survie globale.
Le sabatolimab est une nouvelle immunothérapie ciblant TIM-3, une molécule exprimée à la surface des cellules immunitaires mais également, de manière aberrante, à la surface des cellules souches leucémiques (CSL) où il favorise l’auto-renouvellement autocrine de ces cellules et donc la prolifération, alors qu’il n’est pas exprimé à la surface des CSH normales. En se liant à TIM-3, le sabatolimab inhibe la boucle autocrine des CSL, supprime la prolifération et permet l’activation des macrophages qui conduisent à la phagocytose.
L’association AZA ± sabatolimab a fait l’objet d’une étude de phase 2 chez des patients SMD-HR en première ligne thérapeutique, avec la réponse complète et la survie sans progression comme objectifs primaires, objectifs qui n’ont pas été atteints. Un essai randomisé de phase 3 est néanmoins en cours.
La surexpression de RARA (retinoic acid receptor alpha) est une autre cible actionnable avec le tamibarotène, un agoniste sélectif et puissant visant cette cible présente dans près de 50% des SMD-HR. La sensibilité au médicament a été démontrée dans des modèles précliniques de LMA avec RARA élevé, mais pas avec RARA faible. L’association AZA-tamibarotène, évaluée dans une étude de phase 2, s’est montrée efficace, mais uniquement chez les patients RARA positifs, avec des taux de réponse complète de 50%, obtenues dans un délai de 1.2 mois, et un taux de IT de l’ordre de 72%. Ces résultats soutiennent la poursuite de l’évaluation du tamibarotène dans l’essai de phase 3 SELECT-MDS1 actuellement en cours.
Anticorps bispécifiques pour les SMD-HR
Les CSL ont une forte expression de CD123 si on les compare par aux CSH normales. De ce fait, le CD123 représente une cible thérapeutique de choix dans les néoplasies myéloïdes, y compris les SMD. Le vibécotamab est un anticorps bispécifique CD3xCD123 qui a montré une activité clinique dans les LMA récurrentes/réfractaires, en particulier dans les cas présentant un faible taux de blastes. Chez des patients atteints de SMD/leucémie myélomonocytaire chronique (LMMC) après échec d’un AHM, le vibécotamab permet d’observer des taux de réponse de 64%, mais seulement 25% en cas de LMA présentant une maladie résiduelle positive. Le vibécotamab est actif chez les patients antérieurement exposés au venetoclax et/ou ayant déjà subi une greffe de CSH (35). L’absence de myélosuppression significative justifie l’association de cet anticorps bispécifique avec d’autres agents dans la LMA, les SMD et la LMMC.
Conclusions
L’hétérogénéité génétique et biologique des SMD représente un défi important pour le développement de nouvelles thérapies.
Dans le cas des SMD-FR, de nouveaux traitements sont disponibles pour améliorer les cytopénies, en particulier l’anémie, et plusieurs essais prometteurs ciblant le clone ou l’inflammation sont en cours. Dans le cas du SMD-HR, nous attendons toujours la première percée thérapeutique. Trois essais de phase 3 sont en cours et portent sur l’association d’un agent hypométhylant avec le venetoclax, le sabatolimab ou le tamibarotene. Une évaluation plus poussée des mécanismes de synergie ou de résistance pouvant survenir en présence de thérapies combinées est impératif. Parallèlement, l’immunothérapie avec les anticorps bispécifiques offre de nouvelles perspectives. De nombreux défis restent à relever. Un meilleur accès aux tests génomiques et le développement d’outils plus performants permettant d’allier la biologie de la maladie et le traitement seront nécessaires dans un avenir proche pour améliorer la prise en charge des patients atteints de SMD.
Correspondance
Pre Marie-Christiane Vekemans
Cliniques universitaires Saint-Luc
Service d’Hématologie
Avenue Hippocrate 10
B-1200 Bruxelles
Références
- Khoury JD, Solary E, Abla O, et al. The 5th edition of the World Health Organization Classification of hematolymphoid tumors: myeloid and histiocytic/dendritic neoplasms. Leukemia. 2022; 365(7): 1703-1719.
- Bernard E, Tuechler H, Greenberg PL, et al. Molecular international prognostic scoring system for myelodysplastic syndromes. NEJM Evid. 2022; 1(7).
- Arber DA, Orazi A, Hasserjian RP, et al. International consensus Classification, of Myeloid Neoplasms and acute leukemias: integrating morphologic, clinical, and genomic data. Blood. 2022; 140(11) : 1200-1228.
- Fenaux P, Santini V, Spiriti MAA, et al. A phase 3 randomized, placebo-controlled study assessing the efficacy and safety of epoietin-alpha in anemic patients with low-risk MDS. Leukemia. 2018; 32(12): 2648-2658.
- Verma A, Suragani RN, Aluri S, et al. Biological basis for efficacy of activin receptor ligand traps in myelodysplastic syndromes. J Clin Invest. 2020; 130(2): 582-589.
- Fenaux P, Platzbecker U, Mufti GJ, et al. Luspatercept in patients with lower-risk myelodysplastic syndromes. NEJM. 2020; 382(2): 140-151.
- Zeidan A, Platzbecker U, Garcia-Manero G, et al; Longer-term benefit of luspatercept in transfusion-dependent lower-risk myelodysplastic syndromes with ring sideroblasts. Blood. 2022; 140(20): 2170-2174.
- Platzbecker U, Della Porta MG, Santini V, et al. Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agents naïve, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): interim analysis of a phase 3, open-label, randomized controlled trial. Lancet. 2023; 402(10399): 373-385.
- Garcia-Manero G, Platzbecker U, Santini V, et al. Efficacy and safety of luspatercept versus epoetin alfa in erythropoiesis-stimulating agents, naïve patients with transfusion-dependent (TD) lower-risk myelodysplastic syndromes (LR-MDS): full analysis of the COMMANDS trial. ASH. 2023, #193.
- Diez-Campelo M, Ross DM, Giagounidis A, et al. Durable clinical benefit with Ker-050 treatment: findings from an ongoing phase 2 study in participants with lower-risk MDS. ASH. 2023, #199.
- Sebert M, Cluzeau T, Rauzy O, et al. Ivosidenib monotherapy is effective in patients with IDH1 mutated myelodysplastic syndromes (MDS): the Idiome phase 2 study of the GFM group. Blood. 2021; 138(suppl 1): 62.
- Ades L, Dimicoli-Salazar S, Sebert M, et al. Enasidenib (ENA) is effective in patients with IDH2 mutated myelodysplastic syndromes (MDS): the Ideal phase 2 study of the GFM group. Blood. 2021; 138(suppl 1): 63.
- Dutta R, Zhang TY, Köhnke T, et al. Enasidenib drives human erythroid differentiation independently of isocitrate dehydrogenase 2. J Clin Invest. 2020; 130(4): 1843-1849.
- Seiler M, Yoshimi A, Darman R, et al. H3B-8800, an oral available small-molecule splicing modulator, induces lethality in spliceosome-mutant cancers. Nat Med. 2018; 24(4): 497-504.
- Steensma DP, Wermke M, Klimek VM, et al. Phase I first-in-human dose escalation study of the oral SF3B1 modulator H3B-8800 in myeloid neoplasms. Leukemia. 2021; 35(12): 3542-3550.
- Steensma DP, Fenaux P, Can Eygen K, et al. Imetelstat achieves meaningful and durable transfusion independence in high transfusion-burden patients with lower-risk myelodysplastic syndromes in a phase 2 study. J Clin Oncol. 2021; 39(1): 48-56.
- Komrokji RS, Santinin V, Fenaux P, et al. Efficacy of imetelstat in achieving red blood cell transfusion independence (RBC-TI) across different risk subgroups in patients with lower-risk myelodysplastic syndromes (LR-MDS) relapsed/refractory to erythropoiesis-stimulating agents (ESAs) in IMerge phase 3 study. ASH. 2023, #194.
- Chen N, Hao C, Peng X, et al. Roxadustat for anemia in patients with kidney disease not receiving dialysis. NEJM. 2019; 381(11): 1001-1010.
- Chen N, Hao C, LIU BC, et al. Roxadustat treatment for anemia in patients undergoing long-term dialysis. NEJM. 2019; 381(11): 1011-1022.
- Mittelman M, Henry DH, Glaspy J, et al. Efficacy and safety of Roxadustat for treatment of anemia in patients with lower-risk myelodysplastic syndromes (LR-MDS) with low red blood cell (RBC) transfusion burden: results of the phase III Matterhorn study. ASH. 2023, #195
- Caiado F, Pietras EM, Manz MG. Inflammation as a regulator of hematopoietic stem cell function in disease, aging, and clonal selection. J Exp Med. 2021; 218(7): e20201541.
- Smith MA, Choudhary GS, Pellagatti A, et al. U2AF1 mutations induce oncogenic IRAK4 isoforms and activates innate immune pathways in myeloid malignancies. Nat Cell Biol. 2019; 21(5): 640-650.
- Garcia-Manero G, Silvermann LR, Yan L. Phase 1b trial of IRAK 1/4 inhibition for low-risk myelodysplastic syndromes refractory/resistant to prior therapies: a trial in progress. ASH. 2023, #3247.
- Rodriguez-Sevilla JJ, Adema V, Chien KS, et al. A phase 2 study of canakinumab in patients with lower-risk myelodysplastic syndromes or chronic myelomonocytic leukemia; ASH. 2023, #1866.
- Fenaux P, Mufti GJ, Hellstrom-Lindberg E, et al. Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomized, open-label, phase III study. Lancet Oncol. 2009; 10(3): 223-32.
- Zeidan A, Salimi T, Epstein RS. Real-world use and outcomes of hypomethylating agent therapy in higher-risk myelodysplastic syndromes: why are we not achieving the promise of clinical trials? Future Oncol. 2021; 17(36): 5163-5175.
- Sallman DA, DeZern A, Garcia-Manero G, et al. Eprenetapopt (APR-246) and azacitidine in TP53-mutant myelodysplastic syndromes. J Clin Oncol. 2021; 39(14): 1584-1594.
- Ades L, Girshova L, Doronin VA, et al. Pevonedistat plus azacitidine vs azacitidine alone in higher-risk MDS/chronic myelomonocytic leukemia or low-blast-percentage AML. Blood Adv. 2022; 6(17): 5132-5145.
- Sallmann DA, Al Malki MM, Asch AS, et al. Magrolimab in combination with azacitidine in patients with higher-risk myelodysplastic syndromes: final results of a phase 1b study, J Clin Oncol. 2023; 41(15): 2815-2826.
- Komrokji RS, Singh AM, Ali NA, et al. Assessing the role of venetoclax in combination with hypomethylating agents in higher risk myelodysplastic syndrome. Blood Cancer J. 2022; 12(11): 148.
- Garcia J, Platzbecker U, Odenike O, et al. Efficacy and safety of venetoclax in combination with azacitidine for the treatment of patients with treatment-naïve, higher-risk myelodysplastic syndromes. ASH. 2023, #319.
- Brunner AM, Esteve J, Porkka K, et al. Phase 1b study of sabatolimab (MBG453), a novel immunotherapy targeting TIM-3 antibody, in combination with decitabine or azacitidine in high- or very high-risk myelodysplastic syndromes. Am J Hematol. 2023 nov 22. doi:10.1002/ajh.27161.
- Zeidan A, Ando K, Rauzy O, et al. Sabatolimab plus hypomethylating agents in previously untreated patients with higher-risk myelodysplastic syndromes (STIMULUS-MDS1) : a randomized, double-blind, placebo-controlled, phase 2 trial. Lancet Haematol. 2024; 11(1): e38-e50.
- de Botton S, Cluzeau T, Vigil C, et al. Targeting RARA overexpression with tamibarotene, a potent and selective RARa agonist, is a novel approach in AML. Blood Adv. 2023; 7(9): 1858-1870.
- Nguyen N, Ravandi F, Wang SA, et al. A phase II study of vibecotamab, a CD3-CD123 bispecific T-cell engaging antibody for MDS and CMML after hypomethylating failure and MRD positive AML. ASH. 2023, #322.