Introduction
Le myélome multiple (MM) est un cancer hématologique caractérisé par la prolifération clonale de plasmocytes dans la moelle osseuse, habituellement associé à des taux élevés d’immunoglobulines monoclonales dans le sang et/ou l’urine. Il représente 1% de tous les cancers, 10% des cancers hématologiques. Plus de 1100 personnes sont diagnostiquées avec un MM chaque année en Belgique. L’âge moyen au diagnostic est 70 ans. Bien que les causes de l’affection ne soient pas établies, on sait que le MM est toujours précédé d’un état asymptomatique appelé gammapathie monoclonale de signification indéterminée (ou MGUS selon l’acronyme anglais)(Landgren, Blood 2009), associé à un risque de progression d’environ 1 % par an, que l‘incidence du MM augmente avec l’âge, et est 2-3x plus fréquent dans la race noire (1-5). Les facteurs cytogénétiques ont aussi un rôle pronostique dans le MM qui est défini comme étant à ‘haut risque’ sur base de la présence de certaines anomalies parmi lesquelles figurent la délétion chromosomique del(17p), les translocations t(4;14), t(14;16) et t(14;20) et les anomalies du chromosome 1. Le MM est dit ‘symptomatique’ en présence d’un ‘quatuor’ de symptômes connus sous l’acronyme ‘CRAB’ qui fait référence à la présence d’une hypercalcémie, d’une insuffisance rénale, d’une anémie ou d’une atteinte osseuse, la présence d’un de ces éléments imposant la mise en traitement.
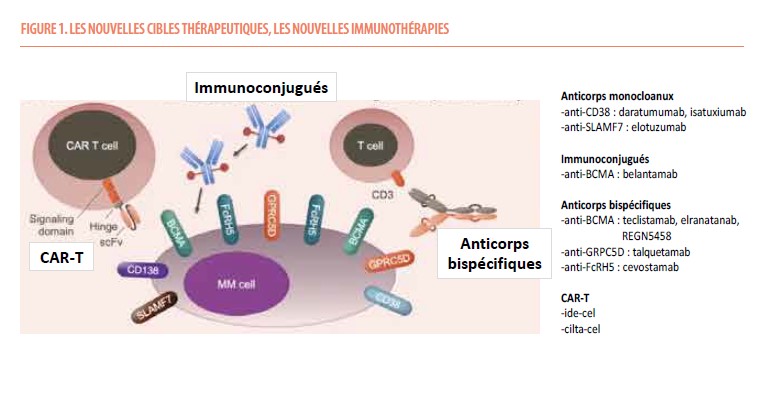
Sur les 20 dernières années, la prise en charge du MM a été le cadre d’une révolution sans précédent. Alors que durant des décennies, le traitement était limité à l’usage des agents alkylants et des corticostéroïdes, les avancées plus récentes reposent sur l’introduction de l’autogreffe (ASCT) d’une part, et l’introduction de nouvelles classes de molécules telles que les inhibiteurs du protéasome (bortezomib et carfilzomib) et les immunomodulateurs (lénalidomide et pomalidomide). Un nouveau tournant est survenu en 2015 avec l’introduction de deux anticorps monoclonaux, le daratumumab et l’elotuzumab. Le daratumumab en particulier, a marqué le traitement du MM et fait maintenant partie des schémas thérapeutiques que ce soit chez les patients nouvellement diagnostiqués ou ceux en rechute. Ces dernières années voient s’étendre cet arsenal thérapeutique avec l’introduction d’autres immunothérapies que ce soit l’isatuximab, un autre anticorps, ou d’autres formes d’immunothérapie, les immunoconjugués, les anticorps bispécifiques et les CAR-T.
Cette revue couvre certains aspects fondamentaux de l’immunothérapie du MM, en soulignant les avancées réalisées dans ce domaine au cours de la dernière décennie.
Anticorps monoclonaux anti-CD38
Le CD38 est une glycoprotéine transmembranaire exprimée à la surface des plasmocytes normaux mais surtout des plasmocytes néoplasiques. Son rôle principal découle de son activité enzymatique impliquée dans la régulation du calcium intracellulaire. En ciblant CD38, les anticorps monoclonaux anti-CD38 combinent la cytotoxicité cellulaire dépendante des anticorps, mais impliquent aussi la phagocytose, le complément, induisant l’apoptose. Le daratumumab est un anticorps monoclonal IgG1κ considéré maintenant comme un acteur majeur dans la prise en charge des patients atteints de MM. Combiné au lénalidomide (dara-VRD)-bortézomib-dexaméthasone, le daratumumab représente un standard de traitement incontournable pour les patients nouvellement diagnostiqués (MMND), indépendamment de leur statut d’éligibilité à la greffe (6-7). Parallèlement, les trithérapies associant le daratumumab et la dexamethasone au lénalidomide ou au bortézomib sont devenus des standards de traitement pour les MM en rechute ou réfractaire (MMRR) (8).
Les effets secondaires principaux du daratumumab portent sur des réactions à la perfusion, associant éruptions cutanées, céphalées, toux, congestion nasale et dyspnée, nausées et vomissements, observées chez jusqu’à 50 % des patients recevant le médicament, mais habituellement limitées à la première injection, et prévenues par l’administration préalable d’un glucocorticoïde, anti-histaminique et/ou d’un inhibiteur des leucotriènes (par exemple, montelukast). Le daratumumab peut interférer avec le typage sanguin en se liant au CD38 présent sur les globules rouges, générant un test de Coombs indirect positif, problème qui peut être contourné en effectuant un typage sanguin avant sa première administration. L’utilisation du daratumumab favorise les infections principalement en raison de son effet immunosuppresseur sur la moelle osseuse et de la survenue d’une hypogammaglobulinémie, ce qui justifie l’utilisation d’antimicrobiens prophylactiques tels que le cotrimoxazole pour prévenir les infections opportunistes à Pneumocystis jiroveci, et dans les cas d’infections pulmonaires récurrentes, une substitution par immunoglobulines.
L’isatuximab est un autre anticorps monoclonal chimérique IgG1κ humanisé anti-CD38, introduit plus récemment. Son mode d’action est similaire à celui du daratumumab, bien qu’il se lie à un épitope distinct de celui qui lie le daratumumab. L’isatuximab est approuvé en association avec le pomalidomide et la dexaméthasone chez les patients en rechute après au moins deux traitements antérieurs comprenant un inhibiteur du protéasome et le lénalidomide, sur base de l’essai de phase 3 ICARIA. Cette combinaison améliore la survie sans progression (SSP) des patients de manière significative (11,5 mois vs. 6,5 mois)(9). L’isatuximab est aussi approuvé en association avec le carfilzomib pour les patients en rechute après 1-3 traitements antérieurs, selon l’essai de phase 3 IKEMA (10) mais n’est malheureusement, malgré ces résultats impressionnants, pas remboursé en Belgique actuellement.
Les effets secondaires rapportés avec l’isatuximab sont sensiblement similaires à ceux décrits avec le daratumumab.
Anticorps monoclonaux anti-SLAMF7
La famille des molécules d’activation lymphocytaire de signalisation (SLAMF) comporte un groupe de glycoprotéines transmembranaires quasi exclusivement exprimés à la surface des plasmocytes qu’ils soient normaux ou pathologiques mais aussi sur les cellules NK. L’un des membres de cette famille, SLAMF7 (ou CS1), représente une autre cible importante dans la recherche de nouveaux agents immunologiques ayant une activité anti-myélomateuse.
L’elotuzumab (Elo) est un anticorps monoclonal IgG1κ humanisé anti-SLAMF7, qui contrairement aux anticorps anti-CD38, n’a pas d’activité en monothérapie. Il est approuvé en association avec le lénalidomide et la dexaméthasone (Rd) sur base des résultats de l’essai ELOQUENT-2 chez les patients atteints de MMRR, après 1-3 lignes thérapeutiques antérieures. Dans cet essai, 646 patients ont été randomisés pour recevoir la combinaison Rd avec/sans Elo, la combinaison Elo-Rd permettant d’observer une réduction de 30 % du risque de décès ou de progression (11). Un autre essai, ELOQUENT-3, a inclus des patients atteints de MMRR exposés à au moins deux thérapies antérieures et réfractaires à la fois au lénalidomide et à un inhibiteur du protéasome, et a montré l’avantage d’associer l’Elo au pomalidomide sans mettre en évidence de problème accru de sécurité (12). Cette dernière combinaison n’est pas remboursée en Belgique.
Autres cibles, autres effets secondaires
La véritable avancée de ces dernières années réside dans l’introduction d’autres formes d’immunothérapie, en particulier celles impliquant les cellules T. Ces nouvelles thérapies génèrent de nouveaux concepts. D’une part, ces traitements utilisent de nouvelles cibles telles que BCMA (B cell maturation antigen ou antigène de maturation des cellules B), GRPC5D (G protein coupled receptor 5D ou récepteur couplé à la protéine G, classe C, groupe 5, membre D) ou FcRH5 (Fc receptor-like protein 5 ou protéine type-récepteur FC). Le plus étudié est BCMA, une glycoprotéine transmembranaire de 184 acides aminés appartenant à la famille des facteurs TNF, quasi exclusivement exprimée sur cellules plasmocytaires, et surexprimée sur les cellules myélomateuses.
D’autre part, ces thérapies nous confrontent à de nouveaux effets secondaires que ceux habituellement rencontrés avec la chimiothérapie conventionnelle, les inhibiteurs du protéasome, les immunomodulateurs ou les anticorps monoclonaux simples. Il s’agit par exemple des syndromes de relarguage des cytokines (CRS) ou troubles neurologiques tels les ICANs (immune effector cell-associated neurotoxicity syndrome, syndrome de neurotoxicité associée aux cellules effectrices immunitaires). Néanmoins, ces molécules représentent un véritable espoir pour les patients réfractaires aux 3 classes thérapeutiques, qui sans accès à ces composés ne peuvent espérer une SPP médiane de plus de 6 mois et une survie médiane de plus d’un an (13).
Immunoconjugués
Les immunoconjugués sont apparus au cours de la dernière décennie. Ils jouent un rôle important dans la thérapie de nombreux cancers, tels que les cancers du sein et du col de l’utérus, les leucémies aiguës, la maladie de Hodgkin et d’autres types de lymphomes. Ces composés combinent un anticorps lié de manière covalente à une toxine ou à un isotope.
Dans le MM, le représentant de cette classe thérapeutique est le belantamab mafodotin, un anticorps humanisé ciblant BCMA, approuvé en 2020 sur base de l’étude DREAMM-2, une étude concernant 196 patients exposés à 4 lignes de traitement antérieures et réfractaires aux 3 classes thérapeutiques. Chez ces patients, le belantamab permet d’observer des taux de réponse globale de l’ordre de 34% pour une SSP médiane de 4,9 mois (14). Cependant, dans l’essai de confirmation requis par la FDA (DREAMM-3), le belantamab utilisé en monothérapie et comparé à la combinaison pomalidomide-dexaméthasone, n’a pas permis de démontrer de bénéfice en terme de SSP, menant au retrait de son autorisation (15). Néanmoins, plusieurs essais ultérieurs mettent en évidence le bénéfice d’utiliser le belantamab en association avec d’autres molécules, comme le bortezomib avec résultats plus qu’encourageants (16).
Parmi les effets secondaires du belantamab, outre une possible atteinte des lignées sanguines, le plus marquant consiste en des modifications de l’épithélium cornéen, habituellement réversibles, qui peuvent entraîner une perte de vision, des ulcères cornéens, une vision floue et une sécheresse oculaire, mal contrôlés par les corticostéroïdes locaux mais qui peuvent être améliorés par une réduction de dose (17).
Anticorps bispécifiques
Les anticorps bispécifiques ont la particularité de cibler 2 épitopes à la fois, d’une part, un épitope à la surface des cellules tumorales, et d’autre part, un épitope à la surface des cellules effectrices (lymphocytes), le plus souvent CD3. Bien que le concept comporte une multitude de variantes, la stratégie de base est donc de mettre en contact les lymphocytes T cytotoxiques et les cellules tumorales entraînant la lyse de ces dernières. La destruction cellulaire est attribuée aux effets combinés de deux protéines, la perforine qui génère des pores transmembranaires dans les cellules tumorales, et le granzyme B qui traverse les canaux ainsi formés pour activer l’apoptose.
Les anticorps bispécifiques offrent certains avantages théoriques en contournant certains processus normalement associés aux réponses immunitaires, tels que les molécules de costimulation, les cellules présentatrices d’antigènes ou l’interaction entre les antigènes et les complexes majeurs d’histocompatibilité. En outre, la modification de l’affinité relative de chaque bras de l’anticorps pour sa cible spécifique permet d’ajuster les propriétés thérapeutiques de chaque construction afin d’optimiser les paramètres biopharmaceutiques et l’activité, en rendant par exemple ces produits « prêts à l’emploi ». Cette technologie a été appliquée avec succès pour la première fois en cancérologie avec l’approbation en 2014 du blinatumomab, bispécifique ciblant CD19, incontournable dans le traitement de la leucémie lymphoblastique aiguë B.
Dans le MM, le premier représentant de cette clase est le teclistamab, un anticorps bispécifique anti-BCMA remboursé en Belgique depuis fin 2023 pour le traitement des patients en rechute après 3 lignes de traitement et exposés aux 3 classes thérapeutiques, sur base de l’étude d’enregistrement MajesTEC-1. Dans cet essai portant sur 165 patients largement prétraités (moyenne de 5 lignes antérieures), le teclistamab permet d’observer des taux de réponse globale de l’ordre de 63%, de réponses complètes de l’ordre de 40%, avec une SPP médiane de 11 mois, ce qui le compare de façon très favorable aux traitements conventionnels disponibles (18).
Sur base de ces résultats positifs, le teclistamab fait maintenant l’objet d’études en association, par exemple avec le nirogacestat, un inhibiteur de la gamma-secrétase qui permet de prolonger son effet (MajesTEC-2, phase 1b), mais aussi avec le daratumumab (MajesTEC-3, phase 3) ou en première ligne chez les patients inéligibles à l’autogreffe, en association avec dara-R, en comparaison au dara-Rd (MajesTEC-7).
Les effets secondaires concernent la survenue de CRS, habituellement limités à des grades 1-2, des cytopénies et des infections (45% de grade 3-4), y compris des réactivations CMV et des infections fongiques. Ces infections sont liées à la déplétion T et l’hypogammaglobulinémie profonde induits par le traitement, justifiant un suivi attentif et la prescription d’une substitution mensuelle par immunoglobulines.
L’elranatanab est un autre anticorps bispécifique ciblant BCMA, approuvé en 2023, sur base de l’essai de phase 3 MagnetisMM-3, avec des taux de réponse globale de l’ordre de 61,0 %, réponse complète de l’ordre de 35 % dans une cohorte de 123 sujets MMRR après un suivi médian de 14,7 mois (19). Ce produit est maintenant en cours d’investigation en première ligne chez les patients non-éligibles à la greffe (MagnetisMM-6) ou en maintenance après autogreffe en comparaison au lénalidomide.
Les effets indésirables sont globalement similaires à ceux rencontrés avec le teclistamab. L’administration bihebdomadaire de l’elranatanab permet de réduire le nombre total d’effets indésirables de grade 3-4 sans compromettre l’efficacité (19).
Des antigènes de surface autre que BCMA servent également de cibles pour les anticorps bispécifiques dans le cadre du MM. L’un de ces antigènes est GPRC5D, récepteur exprimé principalement à la surface des cellules myélomateuses, mais aussi sur les tissus kératinisés, ce qui explique une partie de sa toxicité.
Le talquetamab est un anticorps bispécifique anti-GPRC5D évalué en monothérapie chez 288 patients en rechute dans l’essai MonumenTAL-1. À la dose hebdomadaire de 405 µg/kg, son efficacité est comparable à celle observée avec les anticorps anti-BCMA. Les réponses semblent néanmoins plus durables en allongeant les intervalles entre les administrations (20). La tolérance est similaire à celle observée avec d’autres anticorps bispécifiques, à la différente près de la survenue de toxicités cutanées, dystrophies unguéales et dysgueusie s’expliquant par la distribution du récepteur au niveau des tissus kératinisés, et des taux d’infections moindres comparé aux bispécifiques anti-BCMA (7% d’infections de grade 3-4 dans l’essai MonumenTAL-1, contre 44,8 % dans l’essai MajesTEC-1).
Forimtamig est un autre bispécifique ciblant GPRC5D actuellement en investigation.
Une autre cible non-BCMA est le FcRH5, exprimé de manière préférentielle sur tous les plasmocytes malins, récepteur ciblé par le cevostamab qui fait actuellement l’objet de six essais cliniques dans le cadre du MM en rechute.
Seul le teclistamab est remboursé à ce stade en Belgique.
CAR-T cells
La dernière décennie a vu émerger la thérapie par CAR-T (chimeric antigenic receptor T ou récepteur antigénique chimérique T), une stratégie d’immunothérapie qui vise à combattre les cellules tumorales en s’appuyant sur le propre système immunitaire du patient. Les cellules CAR-T sont des lymphocytes T modifiés génétiquement dans le but de reconnaître puis d’éliminer les cellules tumorales. Les lymphocytes du patient sont prélevés par aphérèse, puis modifiés génétiquement en laboratoire pour leur permettre d’exprimer à leur surface une ‘antenne’ qui pourra reconnaitre une cible à la surface des cellules malignes, avant d’être multipliés puis réinjectés au patient. Ce traitement s’administre en une seule injection ce qui le différencie de toute autre forme de traitement, quelle qu’elle soit.
Cette technique fait déjà partie de l’arsenal thérapeutique permettant de traiter des lymphomes réfractaires et certaines leucémies de l’enfant.
Dans le myélome, c’est BCMA qui est principalement utilisé comme cible. Les 2 CAR-T les plus prometteurs et pour lesquels nous disposons de données à l’heure actuelle sont l’idecaptagene vicleucel (ide-cel) et le ciltacaptagene autoleucel (cilta-cel).
L’efficacité de l’ide-cel a été évaluée pour la première fois dans l’essai KarMMa-1, avec des taux de réponse globale de l’ordre de 81%, réponses complètes de l’ordre de 39%, chez 140 patients atteints de MMRR, exposés aux 3 classes thérapeutiques. La SSP médiane est de 12,1 mois. Les effets secondaires portent sur la survenue de CRS et ICANS, mais de grade limité (21).
Sur base de ces résultats, a été initié un essai de phase 3, KarMMa-3, essai visant à comparer l’ide-cel aux schémas standard en usage dans ce groupe de patients réfractaires (dara-Vd, dara-Pd, ixazomib-Rd, Elo-Pd, Kd). L’usage de l’ide-cel améliore de manière impressionnante la SSP (13,3 contre 4,4 mois)(22).
L’efficacité du cilta-cel a été évaluée chez 113 patients atteints de MMRR multi-traités, avec des taux de réponse globale de 98 %, réponse complète de plus de 80%, une SSP médiane de 35 mois et une durée médiane de réponse de 34 mois (23). Comme l’ide-cel, le cilta-cel se révèle nettement supérieur en terme d’efficacité par rapport aux standards de traitement chez les patients réfractaires au lénalidomide, avec une SSP à 12 mois de 76 % pour cilta-cel contre 49 % pour les traitements standards (24).
Forts de ces données encourageantes, de nombreux essais sont en cours afin de positionner les CAR-T dans les phases moins avancées de la maladie. Dans l’essai CARTITUDE-4, cilta-cel est comparé à dara-Pd ou dara-Vd chez des patients en rechute ayant reçu 1 à 3 lignes antérieures de traitement. Un autre essai très attendu est CARTITUDE-6 qui évalue l’efficacité du cilta-cel par rapport à l’autogreffe chez les patients en première ligne thérapeutique éligibles à la greffe, après traitement d’induction par dara-VRD.
Bien qu’il n’y ait pas de comparaison directe entre cilta-cel et ide-cel, les données d’efficacité du cilta-cel semblent supérieures à celles de l’ide-cel, dont les taux de réponse sont plus conformes aux résultats actuellement disponibles avec les anticorps bispécifiques ciblant BCMA.
Comme pour les bispécifiques, d’autres produits cellulaires CAR-T visant d’autres cibles sont en cours d’évaluation, avec des degrés d’efficacité préliminaire variables (25).
Nous n’avons pas accès aux CAR-T actuellement en Belgique, en dehors d’études cliniques.
Conclusion
Le traitement du myélome a progressé de manière incroyable au cours des 2 dernières décennies. Même si le mot guérison n’est pas encore d’actualité, les traitement actuels permettent d’obtenir un contrôle profond et prolongé de la maladie tout en maintenant une qualité de vie très correcte, grâce à des médicaments au meilleur profil de tolérance.
Depuis près de 10 ans, l’apport des anticorps monoclonaux anti-CD38 a révolutionné le pronostic de l’affection, et ce quel que soit l’âge ou le type de traitement considéré, en première ligne ou en rechute. Les années 2020 voient apparaitre les immunothérapies innovantes utilisant des anticorps bispécifiques ou les thérapies cellulaires de type CAR-T, des traitements prometteurs qui offrent des perspectives de diversification des cibles sur les cellules tumorales et de nombreuses modalités de combinaison ou de séquençage thérapeutique.
Correspondance
Pre Marie-Christiane Vekemans
Cliniques universitaires Saint-Luc
Service d’Hématologie
Avenue Hippocrate 10
B-1200 Bruxelles
Références
- Kyle RA, Therneau TM, Rajkumar SV, et al. A long-term study of prognosis of monoclonal gammopathy of undetermined sig- nificance. N Engl J Med. 2002; 346: 564–9.
- Kyle RA, Larson DR, Therneau TM, et al. Long-Term Follow-up of Monoclonal Gammopathy of Undetermined Significance. N Engl J Med. 2018; 378: 241–9.
- Landgren O, Kyle RA, Pfeiffer RM, et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently pre- cedes multiple myeloma: a prospective study. Blood. 2009; 113: 5412–7.
- Landgren O, Graubard BI, Katzmann JA, et al. Racial disparities in the prevalence of monoclonal gammopathies: a population-based study of 12 482 persons from the national health and nutritional examination survey. Leukemi.a 2014; 28: 1537– 42.
- Landgren O, Graubard BI, Kumar S, et al. Prevalence of myeloma precursor state monoclonal gammopathy of undetermined significance (MGUS) in 12,309 individuals 10 to 49 years old: a population-based study from the National Health and Nutritional Examination Survey. Blood Cancer J. 2017; 7: e618.
- Voorhees PM, Sborov DW, Laubach J, Kaufman JL, Reeves B, Rodriguez C, et al. Addition of daratumumab to lenalidomide, bortezomib, and dexamethasone for transplant-eligible patients with newly diagnosed multiple myeloma (GRIFFIN): final analysis of an open-label, randomized, phase 2 trial. Lancet Haematol. 2023; 10(10): e825-e837.
- Sonneveld P, Dimopoulos MA, Boccadoro M, et al. Phase 3 randomized study of daratumumab (dara) + bortezomib, lenalidomide, and dexamethasone (VRd) versus VRd alone in patients (pts) with newly diagnosed multiple myeloma (NDMM) who are eligible for autologous stem cell transplantation (ASCT): primary results of the Perseus trial. NEJM. 2024; 390 :301-313.
- Facon T, Kumar S, Plesner T, et al. Daratumumab plus lenalidomide and dexamethasone for untreated multiple myeloma. NEJM. 2019; 380(2): 2104-2115.
- Attal M, Richardson PG, Rajkumar Sv et al. Isatuximab plus pomalidomide and low-dose dexamethasone versus pomalidomide and low-dose dexamethasone in patients with relapsed and refractory multiple myeloma (ICARIA-MM): A randomised, multicentre, open-label, phase 3 study. Lancet. 2019; 394: 2096–2107.
- Moreau P, Dimopoulos MA, Mikhael J, et al. Isatuximab, carfilzomib, and dexamethasone in relapsed multiple myeloma (IKEMA): a multicentre, open-label, randomised phase 3 trial. Lancet. 2021; 397(10292): 2361-2371.
- Lonial S, Dimopoulos MA, Palumbo A, et al. therapy for relapsed or refractory multiple myeloma. NE JM. 2015; 373: 621–631.
- Dimopoulos MA, Lonial S, White D, et al. Elotuzumab, lenalidomide, and dexamethasone in RRMM: Final overall survival re- sults from the phase 3 randomized ELOQUENT-2 study. Blood Cancer J. 2020; 10: 91.
- Mateos MV, Weizel K, De Stefano V, et al. LocoMMotion: a prospective, non-interventional, multinational study of real-life current standard of care in patients with relapsed/refractory multiple myeloma. Leukemia. 2022; 36(5): 1371-1376.
- Lonial S, Lee HC, Badros A et al. Belantamab mafodotin for relapsed or refractory multiple myeloma (DREAMM-2): A two- arm, randomised, open-label, phase 2 study. Lancet Oncol. 2019; 21: 207–221.
- Weisel K, Hopkins TG, Fecteau D, et al. DREAMM-3: A phase 3, open-label, randomized study to evaluate the efficacy and safety of belantamab mafodotin (GSK2857916) monotherapy compared with pomalidomide plus low-dose dexamethasone (pom/dex) in participants with relapsed/refractory multiple myeloma (RRMM). Blood. 2019; 134 (Suppl. 1): 1900.
- Rifkin R, Boyd K, Grosicki S, et al. DREAMM-7: A phase III study of the efficacy and safety of belantamab mafodotin with bortezomib and dexamethasone in patients with relapsed/refractory multiple myeloma. Br Haematol. 2021; 193: 172–173.
- Eaton JS, Miller PE, Mannis MJ, et al. Ocular adverse events associated with antibody-drug conjugates in human clinical trials. J Ocul Pharmacol Ther. 2015; 31: 589–604.
- Moreau P, Garfall A, van de Donk N, et al. Teclistamab in Re- lapsed or Refractory Multiple Myeloma. N Engl J Med. 2022; 387(6):495-505.
- Lesokhin A, Tomasson M, Arnulf B, et al. Elranatamab in relapsed or refractory multiple myeloma: phase 2 MagnetisMM-3 trial results. Nat Med. 2023; 29(9): 2259-2267.
- Chari A, Minnema M, Berdeja J, et al. Talquetamab, a T-Cell-Re- directing GPRC5D Bispecific Antibody for Multiple Myeloma. N Engl J Med. 2022 Dec 15;387(24):2232-2244
- Munshi N, Anderson L, Shah N, et al. Idecabtagene Vicleucel in Relapsed and Refractory Multiple Myeloma. N Engl J Med. 2021 Feb 25;384(8):705-716.
- Rodriguez-Otero P, Ailawahdi S, Arnulf B, et al. Ide-cel or Standard Regimens in Relapsed and Refractory Multiple Myeloma. N Engl J Med. 2023 Mar 16;388(11):1002-1014.
- Martin T, Usmani S, Berdeja J, et al. Ciltacabtagene Autoleucel, an Anti-B-cell Maturation Antigen Chimeric Antigen Recep- tor T-Cell Therapy, for Relapsed/Refractory Multiple My loma: CARTITUDE-1 2-Year Follow-Up. J. Clin Oncol. 2023 Feb 20;41(6):1265-1274.
- San Miguel J, Dhakal B, Yong K, et al. Cilta-cel or Standard Care in Lenalidomide-Refractory Multiple Myeloma. N Engl J Med. 2023 Jul 27;389(4):335-347
- Mailankody S, Devlin S, Landa J, et al. GPRC5D-Targeted CAR T Cells for Myeloma. N Engl J Med. 2022 Sep 29;387(13):1196-1206.