Introduction
Les cancers pédiatriques sont généralement définis comme les pathologies tumorales diagnostiquées entre la naissance et l’âge de 16 ans, bien que la limite d’âge supérieure varie selon les registres de 15 à 18 ans. Représentant moins de 1% des cas de cancers, ce sont des maladies rares. Leur fréquence estimée était de 397000/an dans le monde en 2015, ou de 16,4/100 000 personne-année (0-14 ans) (GloboCan de l’organisation mondiale de la santé (OMS)) (1). Ces chiffres sont cependant sous-estimés, notamment pour cause de sous-diagnostic dans les zones plus défavorisées. Pour la Belgique, les diagnostics de nouveaux cas représentent environ 340 cas/an (0-14 ans) (2), avec des taux d’incidence similaires à ceux des autres pays à hauts niveaux de revenus.
Les cancers pédiatriques comptent plus de 60 entités différentes. En nombre absolu et tous âges confondus, les tumeurs malignes hématologiques sont les plus fréquentes (39% chez les 0-14ans, dont 27% de leucémies et 12% de lymphomes), suivies des tumeurs du système nerveux central (SNC) (27%) (Figure 1). La distribution des sous-types tumoraux varie grandement selon l’âge. Les tumeurs embryonnaires non-SNC sont les néoplasies les plus fréquentes chez les enfants de moins d’un an, puis leur incidence diminue rapidement. En particulier, les rétinoblastomes représentent 11% des tumeurs de l’enfant de moins d’un an, alors qu’ils sont quasi inexistants au-delà de l’âge de cinq ans. Les autres tumeurs fréquentes dans le jeune âge sont les leucémies et les tumeurs du SNC. Chez les adolescents (15-19 ans), les lymphomes sont les pathologies les plus communes (25 %), suivis des carcinomes et mélanomes (24 %), des tumeurs du SNC (17 %), des leucémies (11 %) et des tumeurs germinales (11 %) (2).

Prédispositions et causes environnementales des cancers de l’enfant
Une part non négligeable de tumeurs pédiatriques, estimée à l’heure actuelle au minimum à 14%, serait due à des prédispositions génétiques, syndromiques ou non (3). Les syndromes de Down, de Wiedeman-Beckwith, de Noonan, les neurofibromatoses ou l’ataxie télangiectasie comptent parmi les syndromes de prédisposition les plus connus et s’accompagnent de phénotypes évidents, mais une part non négligeable de prédispositions génétiques proviendrait de la transmission de mutations autosomiques récessives ou à pénétrance variable, ou de polymorphismes parentaux, telles les mutations SMARCB1/SMARCA4 dans les tumeurs rhabdoïdes ou RRAS dans les sarcomes, ou bien encore de l’acquisition de novo de mutations à risque. Ainsi, certains types de cancer, une présentation initiale atypique, des localisations multiples d’emblée, ou des tumeurs variées chez un même individu, de même qu’une toxicité excessive aux traitements doivent faire envisager la recherche d’un syndrome de prédisposition, plus encore que l’histoire familiale. Par ailleurs, d’autre facteurs, tels que l’ethnicité des patients, semblent favoriser certaines susceptibilités tumorales, avec, par exemple, un risque accru de LLA B dans les populations hispanophones aux Etats-Unis (4).
Les infections virales à EBV ou HBV sont incriminées parmi les facteurs environnementaux pouvant influencer l’apparition de cancers pédiatriques, respectivement dans les lymphomes de Burkitt (5) ou les carcinomes hépatocellulaires, particulièrement en zone d’endémie. De même, les hautes doses de radiation ionisantes, la radio- ou la chimiothérapie sont des facteurs de risques prouvés de néoplasies secondaires.
Le rôle des infections dans la petite enfance, ainsi que la précocité de la mise en collectivité, semblent par contre apparaître comme des facteurs protecteurs de leucémie aiguë lymphoblastique (LLA) B pédiatrique, du moins pour celles de meilleur pronostic. Par exemple, des précurseurs avec la translocation ETV6::RUNX1 seraient présents dès la vie embryonnaire chez environ 5% des nouveaux nés (6) et leur expansion, ainsi que l’acquisition d’événements génétiques secondaires, facilitées par des infections plus tardives dans la petite enfance (7).
Parmi les facteurs de risque environnementaux suspectés en pédiatrie, se trouvent des carcinogènes de classe 1 dans la classification du CIRC (Centre International de Recherche sur le Cancer) tels que l’exposition solaire ou aux UV, au radon, au tabagisme passif ou à la pollution de l’air, mais également aux pesticides ou aux champs électromagnétiques générés par des courants électriques (carcinogènes de classe 2 dans la classification du CIRC) (8-10). À noter que la faible taille des cohortes et la limitation des études prospectives rendent plus difficile l’identification des facteurs de risque en pédiatrie, d’autant plus que les méthodes diagnostiques et classifications tumorales ne sont pas toujours standardisés. Enfin, les facteurs environnementaux n’ont pas la même influence selon les organes à risque. Ainsi, les radiations ionisantes à forte dose n’ont-elles été reconnues réellement pathogènes que dans les néoplasies thyroïdiennes (11).
Biologie des cancers pédiatriques
Bien que leur large spectre empêche toute généralisation, les tumeurs pédiatriques présentent certaines caractéristiques biologiques uniques. Ainsi, même lorsqu’elles sont histologiquement comparables à leurs homologues de l’adulte, les tumeurs pédiatriques ont souvent des comportements cliniques, une étiologie et une biologie tumorale différents. Si les cancers de l'adulte sont essentiellement épithéliaux et résultent principalement du vieillissement et/ou de l'exposition à des agents mutagènes, les cancers pédiatriques dérivent principalement de lignées embryonnaires dans lesquelles apparaissent des anomalies développementales et un blocage maturatif. Ces événements génétiques, souvent sous la forme de translocations, aboutissent à des fusions oncogéniques et sont accompagnés d’un faible taux de mutations additionnelles (12).
Amorcée initialement avec les tumeurs du SNC, la classification de l’Organisation Mondiale de la Santé (OMS) 2022 des tumeurs pédiatriques a introduit une nouvelle taxonomie hybride, avec sous-classifications moléculaires, ouvrant la voie à des approches thérapeutiques personnalisées. Se dégagent ainsi trois grandes catégories tumorales : celles diagnostiquées grâce à des critères morphologiques (approche histogénétique), celles diagnostiquées sur la seule base de caractéristiques moléculaires, et celles identifiées par la combinaison des deux caractéristiques précédentes (13).
Caractéristiques de la prise en charge des cancers pédiatriques en Belgique
Les centres d’hémato-oncologie pédiatrique (CHOP)
Depuis 2014, un arrêté royal (AR) fixe les critères auxquels doit répondre un programme de soins d’hémato-oncologie pédiatrique pour être approuvé : il doit couvrir le diagnostic, le traitement multidisciplinaire, la réadaptation, le suivi des effets tardifs et les soins palliatifs pour tous les patients de moins de 16 ans (14).
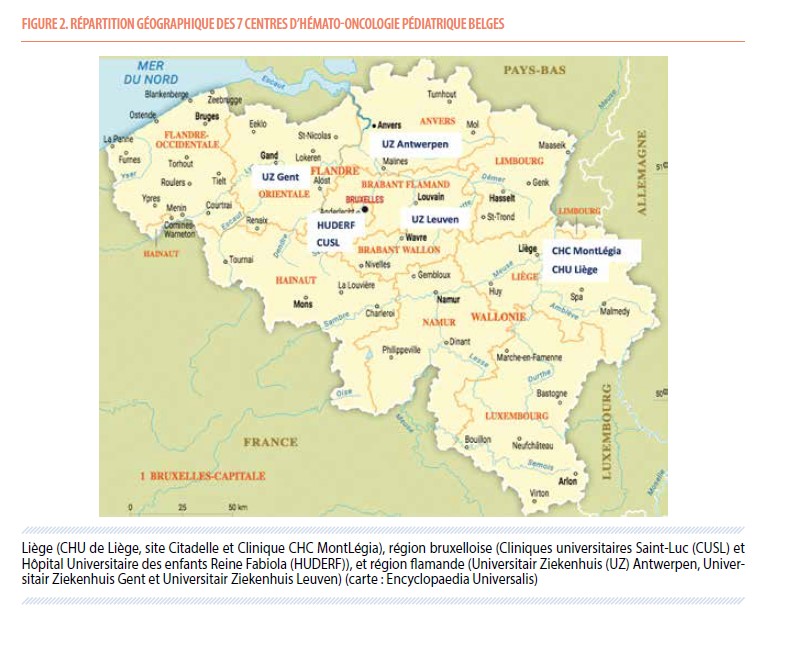
La prise en charge des cancers pédiatriques est effectuée dans sept CHOP (Figure 2) : deux en Wallonie, le CHU de Liège, site Citadelle et la Clinique CHC MontLégia, deux en région bruxelloise, les Cliniques universitaires Saint-Luc (CUSL) et l’Hôpital Universitaire des enfants Reine Fabiola, et trois en région flamande, l’Universitair Ziekenhuis Antwerpen, l’Universitair Ziekenhuis Gent et l’Universitair Ziekenhuis Leuven. Ces centres, ainsi que tous les professionnels de santé impliqués dans la prise en charge des enfants, sont regroupés au sein de la Belgian Society for Pediatric Hematology and Oncology (BSPHO), elle-même affiliée à la SIOPe (société internationale des cancers de l’enfant, Europe). Les objectifs de la BSPHO sont d’améliorer la coopération médicale et scientifique entre ses différents centres, mais également d’améliorer l’accès aux essais cliniques.
Dans chaque centre, la prise en charge des enfants est confiée à des équipes médicales pluridisciplinaires mêlant des pédiatres hémato-oncologues ayant chacun·es leurs domaines de sous-spécialités et leurs collaborateur·rices radiologues, radiothérapeuthes, chirurgien·nes, anesthésistes, et spécialistes d’organe. Les équipes paramédicales sont formées d’infirmier·ères et puériculteur·rices, de kinésithérapeuthes, psychologues et neuro-psychologues, logopèdes, diététicien·nes ou encore assistant·es sociaux·ales et éducateur·rices. Pour ne pas perdre le lien précieux à l’école, les enfants bénéficient d’une scolarité à l’hôpital, qui peut prendre en charge la classe en hospitalisation et/ou à domicile mais fait également relais avec les écoles d’origine. De nombreux bénévol·es gravitent autour des patient·es et de leur famille pour leur apporter confort et distraction.
La prise en charge oncologique des patients pédiatriques est standardisée en Belgique par l’inclusion systématique des patients, dès que l’option se présente, dans des protocoles d’étude clinique internationaux, ou dans des études de phases précoces. Ces protocoles, élaborés par des spécialistes internationaux et sociétés savantes, ou l’industrie, sont coordonnés par la BSPHO et des investigateurs principaux (PI) nationaux, ainsi que des PI dans les centres de référence. Il s’agit, au moment de mettre cet article sous presse, de 48 protocoles ouverts au niveau national, 12 en phase de lancement et 47 actuellement fermés au recrutement ou recommandations thérapeutiques. Pour le traitement des pathologies pour lesquelles aucun protocole de traitement n’est ouvert, la prise en charge se base sur des recommandations internationales. Une fois par semaine, les cas les plus compliqués ou posant problème sont discutés virtuellement au “national tumour board” organisé par la BSPHO.
Concernant certaines prises en charges hyper-spécialisées, des collaborations existent entre les différents centres. Les CUSL sont, à titre d’exemple, centre de référence pour la prise en charge des rétinoblastomes, pour les tumeurs hépatiques ou pour la chirurgie des sarcomes, tandis que les traitements par CAR-T cells pour la pédiatrie ne sont réalisés qu’à l’UZ Gent. De même, il existe un unique centre belge de protonthérapie, PARTICLE (‘Particle Therapy Interuniversity Centre Leuven’), issu d’un projet interuniversitaire porté par les CUSL, l’UCLouvain, l’UZ Leuven et la KU Leuven, et co-supporté par l’UZ Gent, le CHU-UCL-Namur, l’UZ Brussel et l’UZA. A savoir que les patients pédiatriques représentent plus de la moitié (60%) des cas pour lesquels une telle technique est indiquée.
Enfin, les spécialistes d’hémato-oncologie pédiatrique dédient une part non-négligeable de leur activité, de 20 à 50%, à l’hématologie bénigne (pathologies de l’hémoglobine, cytopénies...), aux déficits immunitaires ou aux troubles de l’hémostase, mais également aux malformations vasculaires, pour ne citer qu’eux.
Le développement des unités « adolescents et jeunes adultes »
La population des adolescents et jeunes adultes (AJA), est la tranche d’âge qui définit la période durant laquelle les enfants ne sont plus tout à fait des enfants, ni tout à fait des adultes. Si la définition d’AJA varie, l’adolescence est généralement limitée aux 15-19 ans, tandis que la limite d’âge supérieure du «jeune adulte» reste discutée, rapportée entre 24, 35, et 39 ans. Dans les pays à hauts niveaux de revenu, le cancer chez les 15-39 ans représentait en 2018 6,8 % de tous les cancers et était la principale cause de décès par maladie, avec des taux de survie dépassant cependant 80 % à 5 ans (15). Probablement sous-estimée, l’incidence annuelle du cancer dans cette population était ainsi de 42.2/100 000, avec 156 431 cas en Europe et 1 231 007 dans le monde, et de 23,3/100 000 personne-année pour les 15-19 ans. Pour la Belgique, on dénombre en moyenne 180 nouveaux diagnostics par an chez les 15-19 ans.
Depuis la fin des années 1990, de nombreuses études ont mis en évidence que les AJA n’avaient pas bénéficié d’améliorations pronostiques similaires aux enfants et aux adultes plus âgés, principalement en raison d’une participation limitée aux essais cliniques. Les raisons pour lesquelles les AJA sont moins susceptibles de s’y inscrire comprennent (16) :
- la rareté des essais pour les types de cancer courants dans cette population;
- le lieu de prise en charge (hôpitaux pour adultes versus centres pédiatriques);
- les critères d’éligibilité restrictifs en terme d’âge rendant de nombreux AJA mineurs inéligibles à des essais cliniques menés par l’industrie en population adulte;
- le manque de sensibilisation des médecins traitant aux essais disponibles;
- la conception d’essais ne tenant pas compte de leurs modes spécifiques de vie, d’éducation et d’emploi.
De nombreux autres facteurs contribuent au moins bon pronostic des patients AJA, notamment les types particuliers de tumeurs rencontrées dans cette population, mais aussi des différences dans les biologies de l’hôte et des tumeurs, un diagnostic souvent plus tardif, la faible observance thérapeutique, ainsi que des problèmes psychosociaux et économiques spécifiques, et il a été démontré que ni le modèle classique de soins pédiatriques, ni celui des adultes, ne répondent à leurs besoins complexes.
En 2015, l’ESMO et la SIOPE ont établi un groupe de travail commun pour améliorer les soins des AJA atteints de cancer en Europe. Les récentes recommandations de ce groupe soulignent l’importance d’une collaboration étroite entre les équipes pédiatriques et adultes et d’une prise en charge axée sur le patient et le cancer (plutôt que sur l’âge), sans modèle organisationnel prédéfini (17).
En Belgique, d’après l’AR de 2014 et même si dans la pratique, cette limite peut varier jusqu’à l’âge de 18 ans, les jeunes âgés de 16 ans et plus chez qui un cancer est diagnostiqué sont orientés vers les services d’hémato-oncologie pour adultes. En 2024, une nouvelle convention de l’INAMI/RIZIV a été instaurée pour constituer des équipes de soins dédiés aux AJA dans les centres d’hémato-oncologie pédiatrique belges.
La clinique des effets secondaires à long terme
Les taux de survie pour les cancers pédiatriques ont considérablement augmenté au cours des 20 dernières années et continuent à s’améliorer, avec un taux de survie à 15 ans, tous cancers confondus, de 83 % pour les enfants de moins de 15 ans au diagnostic et de 86 % pour les adolescents. On estime ainsi qu’à l’heure actuelle, en population générale, 1/300 jeune adulte est survivant d’un cancer pédiatrique (18). Cette population présente des taux plus élevés de maladies chroniques, de problèmes de santé mentale et de décès prématurés, une fertilité réduite et des taux d’emploi et de mariage plus faibles que les témoins ou les frères et sœurs appariés selon l’âge. Certains effets tardifs, notamment les néoplasies secondaires, la nécessité d’un enseignement spécialisé ou les troubles de la croissance, sont beaucoup plus fréquents chez les enfants diagnostiqués à un plus jeune âge (19).
Pour sensibiliser les patients, leur entourage et/ou leurs médecins traitant à ces complications, et en améliorer le suivi et le pronostic, des consultations de suivi au long cours ont vu le jour dans les CHOP. Elles consistent en des consultations spécialisées, pluridisciplinaires et le cas échéant de transition pour les patients ayant atteint l’âge adulte. Les CUSL, un des centres pionniers dans ce domaine en Belgique, ont démarré une telle consultation multidisciplinaire en 2016.
Le futur de l’oncologie pédiatrique
De nombreux défis restent à relever en oncologie pédiatrique, dont l’accès aux nouvelles techniques diagnostiques (moléculaires, biopsies liquides, IA en imagerie…) et aux thérapies les plus récentes qui pâtît le plus souvent de quelques années de retard en comparaison des adultes. Ceci est dû notamment à la rareté des entités néoplasiques distinctes qui rendent difficile l’obtention de cohortes pédiatriques satisfaisantes, mais aussi au manque d’intérêt pour l’industrie d’un tel marché de niche. Récemment, des accélérations dans les processus d’accréditation des thérapies innovantes ont cependant été permises, grâce, par exemple, à l’ITCC Consortium en Europe (Innovative Therapies for Children with Cancer) (20).
Toutes les initiatives pour l’amélioration des soins en oncologie pédiatrique sont portées par les sociétés savantes, mais aussi par un tissu dense d’associations de professionnels, de patients et de parents, qui ont un rôle important dans le développement des politiques de santé et financent aussi bien la recherche, que le bien-être des et le soutien aux patients et aux familles.
Conclusion
En Europe, les sept principaux objectifs pour le futur de l’oncologie pédiatrique sont résumés dans le plan stratégique 2021-2026 de la SIOPe.
Concernant la Belgique, les objectifs pour le futur de l’oncologie pédiatrique ont été définis en 2023 par le « Belgian ‘Europe’s beating cancer plan’ (EBCP) mirror group children, adolescents and young adults (CAYAs) with cancer ». Ces objectifs visent à faire reconnaître plus clairement dans le modèle de soins les particularités de l’oncologie pédiatrique, ainsi qu’à apporter aux AJA la démarche intégrée qui fait la particularité de l’oncologie pédiatrique. Si les connaissances sur les tumeurs pédiatriques progressent rapidement, cela s’accompagne également d’une nécessité croissante de spécialisation des acteurs de terrain et d’une centralisation des soins pour ces pathologies rares.
Take-home messages
- L’hémato-oncologie pédiatrique vise à la prise en charge de maladies rares.
- Les facteurs de prédisposition et la biologie des cancers pédiatriques ne sont pas superposables à ceux de l’adulte.
- Les taux de survie dépassent les 80 %.
- La prise en charge des cancers pédiatriques est multidisciplinaire.
- Les adolescents et jeunes adultes (AJA) de 16 à 35 ans n’ont pas la même qualité de soins que les enfants.
- Le futur de l’hémato-oncologie passe par un meilleur accès aux nouvelles méthodes diagnostiques et aux thérapies innovantes.
Affiliations
1. Service d’hémato-oncologie pédiatrique, Cliniques universitaires Saint-Luc, Université catholique de Louvain, B-1200 Bruxelles
Conflits d’intérêt : les auteurs ne déclarent pas de conflits d’intérêts.
Correspondance
Dr. Gabriel Levy
Cliniques universitaires Saint-Luc
Service d’Hémato-oncologie pédiatrique
Avenue Hippocrate 10
B-1200 Bruxelles, Belgique
gabriel.levy@saintluc.uclouvain.be
Références
- Steliarova-Foucher E, Fidler MM, Colombet M, et al. Changing geographical patterns and trends in cancer incidence in children and adolescents in Europe, 1991-2010 (Automated Childhood Cancer Information System): a population-based study. Lancet Oncol. 2018;19(9):1159–69.
- Belgian Cancer Registry. Cancer in children and adolescents in Belgium 2004-2020. 2023;
- Gröbner SN, Worst BC, Weischenfeldt J, et al. The landscape of genomic alterations across childhood cancers. Nature. 2018;555(7696):321–7.
- Qian M, Xu H, Perez-Andreu V, et al. Novel susceptibility variants at the ERG locus for childhood acute lymphoblastic leukemia in Hispanics. Blood. 2019;133(7):724–9.
- Velavan TP. Epstein-Barr virus, malaria and endemic Burkitt lymphoma. EBioMedicine. 2019;39:13–4.
- Schäfer D, Olsen M, Lähnemann D, et al. Five percent of healthy newborns have an ETV6-RUNX1 fusion as revealed by DNA-based GIPFEL screening. Blood. 2018;131(7):821–6.
- Hauer J, Fischer U, Auer F, Borkhardt A. Regional BCG vaccination policy in former East- and West Germany may impact on both severity of SARS-CoV-2 and incidence of childhood leukemia. Leukemia. 2020;34(8):2217–9.
- Demoury C, Marquant F, Ielsch G, et al. Residential Exposure to Natural Background Radiation and Risk of Childhood Acute Leukemia in France, 1990-2009. Environ Health Perspect. 2017;125(4):714–20.
- Filippini T, Hatch EE, Rothman KJ, et al. Association between Outdoor Air Pollution and Childhood Leukemia: A Systematic Review and Dose-Response Meta-Analysis. Environ Health Perspect. 2019;127(4):46002.
- Bailey HD, Infante-Rivard C, Metayer C, et al. Home pesticide exposures and risk of childhood leukemia: Findings from the childhood leukemia international consortium. Int J Cancer. 2015;137(11):2644–63.
- Bard D, Verger P, Hubert P. Chernobyl, 10 years after: health consequences. Epidemiol Rev. 1997;19(2):187–204.
- Coorens THH, Behjati S. Tracing and Targeting the Origins of Childhood Cancer. Annu Rev Cancer Biol. 2022;6(1):35–47.
- Pfister SM, Reyes-Múgica M, Chan JKC, et al. A Summary of the Inaugural WHO Classification of Pediatric Tumors: Transitioning from the Optical into the Molecular Era. Cancer Discov. 2022;12(2):331–55.
- service public federal sante publique securite de la chaine alimentaire et environnement. Arrêté Royal du 02/04/2014 arrete royal fixant les normes auxquelles un programme de soins pour enfants doit repondre pour etre agree [Internet]. etaamb.openjustice.be. 2014 [cited 2023 Oct 9];Available from: https://etaamb.openjustice.be/fr/arrete-royal-du-02-avril-2014_n20140241...
- Trama A, Stark D, Bozovic-Spasojevic I, et al. Cancer burden in adolescents and young adults in Europe. ESMO Open. [Internet] 2023 [cited 2023 Oct 9];8(1). Available from: https://www.esmoopen.com/article/S2059-7029(22)00378-7/fulltext
- Bleyer A, Tai E, Siegel S. Role of clinical trials in survival progress of American adolescents and young adults with cancer-and lack thereof. Pediatr Blood Cancer. 2018;65(8):e27074.
- Ferrari A, Stark D, Peccatori FA, et al. Adolescents and young adults (AYA) with cancer: a position paper from the AYA Working Group of the European Society for Medical Oncology (ESMO) and the European Society for Paediatric Oncology (SIOPE). ESMO Open. [Internet] 2021 [cited 2023 Oct 2];6(2). Available from: https://www.esmoopen.com/article/S2059-7029(21)00053-3/fulltext
- Bhakta N, Force LM, Allemani C, et al. Childhood cancer burden: a review of global estimates. Lancet Oncol. 2019;20(1):e42–53.
- Robison LL, Green DM, Hudson M, et al. Long-term outcomes of adult survivors of childhood cancer. Cancer. 2005;104(11 Suppl):2557–64.
- Vassal G, Rojas T de, Pearson ADJ. Impact of the EU Paediatric Medicine Regulation on new anti-cancer medicines for the treatment of children and adolescents. Lancet Child Adolesc Health. 2023;7(3):214–22.