Introduction
Les arthrites sont des maladies inflammatoires chroniques fréquentes dont le chef de file est la polyarthrite rhumatoïde (1). Les arthrites variantes de la polyarthrite rhumatoïde appartiennent au groupe des spondyloarthropathies (arthrite psoriasique…) et aux rhumatismes inflammatoires systémiques (lupus, sclérodermie...). L’arthrite chronique peut toucher près de 250000 patients en Belgique et peut survenir à tout âge, y compris chez les enfants sous forme d’arthrite juvénile. La PR s’observe avec un sex-ratio de 3 femmes pour 1 homme, préférentiellement après la grossesse ou la ménopause. Elle atteint en priorité les articulations mais peut être à l’origine d’une atteinte pulmonaire, oculaire, de nodules rhumatoïdes et d’un risque cardio-vasculaire augmenté (1,3,4). L’atteinte typique de la PR associe des douleurs et des gonflements articulaires bilatéraux et symétriques, d’apparition récente, avec une raideur matinale et des résurgences algiques nocturnes (1,3,4). Son étiologie reste inconnue et repose sur différents facteurs génétiques, environnementaux et immunitaires. La prise en charge et les traitements sont assez similaires pour les autres formes d’arthrite inflammatoire périphérique telles que l’arthrite psoriasique ou les spondyloarthropathies.
Le diagnostic précoce
La reconnaissance de toute arthrite inflammatoire débutante est cruciale. L’anamnèse et l’examen clinique sont les piliers essentiels afin de distinguer les différentes formes d’arthrites inflammatoires des atteintes métaboliques liées aux dépôts dans les articulations ou des atteintes mécaniques liées à l’usure du cartilage.
L’évaluation clinique minutieuse est essentielle à la recherche des signes de synovite principalement localisée au niveau des mains et des pieds. Il est recommandé de faire un compte articulaire en notant les articulations douloureuses et gonflées. L’examen systémique est indispensable car l’arthrite peut s’accompagner de manifestations extra articulaires et il permet d’affiner le diagnostic différentiel.
Un syndrome inflammatoire biologique est présent dans 90% des cas d’arthrite. La PR est une maladie auto-immunitaire caractérisée souvent par la production de 2 auto-anticorps, le facteur rhumatoïde et les anticorps anti-peptides citrullinés (ACPA). Les ACPA ont une spécificité de 98% pour une sensibilité de 50-60% et leur détection est dès lors très utile dès le début des symptômes articulaires inflammatoires. Le facteur rhumatoïde n’est quant à lui pas très spécifique (sensibilité 70-80% et spécificité 65-85%).
Le bilan de base radiologique peut être enrichi par la réalisation d’une échographie articulaire qui permet de détecter de manière précoce les synovites, ténosynovites et érosions ou d’une IRM qui pourra mettre en évidence toutes ces lésions précoces et l’œdème osseux (zone de développement potentiel d’érosions) (1). Ces examens sont en effet plus sensibles pour détecter l’arthrite débutante mais leur interprétation devra être prudente car les synovites a minima peuvent être influencées par des facteurs mécaniques, métaboliques et l’âge.
À noter que, actuellement, l’intérêt des biopsies synoviales dans le diagnostic des PR reste du domaine de la recherche et de protocoles scientifiques mais pourrait devenir un élément capital et indispensable à l’avenir.
Le diagnostic repose sur tous ces éléments cliniques et paracliniques. Il est validé par des critères internationaux de classification de la polyarthrite. Les critères de l’American College of Rheumatology de 1987 ont été remplacés en 2010 par des critères américains et européens incluant la présence des ACPA et sont dès lors plus sensibles. Il est cependant essentiel avant d’utiliser ces critères d’exclure toute autre arthropathie (arthrose, chondrocalcinose, arthrite virale, autres rhumatismes inflammatoires…).
L’évaluation et les objectifs
Les rhumatologues ont développé ces dernières années des outils cliniques et paracliniques très utiles pour évaluer l’arthrite et la PR. Ils permettent de mesurer de manière plus précise l’activité de la maladie et la réponse thérapeutique. La première démarche, une fois le diagnostic de PR confirmé, sera de compter les articulations douloureuses et gonflées par un examen minutieux des différents sites articulaires. Il sera également demandé au malade de compléter un questionnaire évaluant sur une échelle analogique de 0 à 10 le degré d’activité de la maladie, de la douleur, de la fatigue et de répondre à des questions évaluant le degré de difficultés de réaliser des activités courantes (questionnaire HAQ).
L’intégration du nombre d’articulations douloureuses, gonflées, de l’activité de la maladie évaluée par le patient et du taux inflammatoire (CRP ou VS) permet de calculer un score composite d’activité de la maladie (score DAS, le plus utilisé étant le DAS28-CRP en se limitant aux articulations des membres supérieurs et des genoux). Ce score validé dans de nombreux essais cliniques (5) permet à la fois de définir le degré d’activité (importante, modérée, légère ou rémission) et permet d’évaluer de manière plus précise la réponse thérapeutique. Ce score reste cependant imparfait car il inclut des paramètres subjectifs comme le compte articulaire douloureux et l’évaluation de la maladie par le malade ; il doit dès lors faire l’objet d’une interprétation et d’une analyse des composantes objectives et subjectives du score DAS (4).
D’autres scores ont été développés pour évaluer l’activité de la maladie comme le SDAI (Simplified Disease Activity Index) et le CDAI (Clinical Disease Activity Index) (5). Ce dernier est facile à réaliser car il consiste en une simple addition des articulations douloureuses et gonflées, de l’activité de la maladie évaluée par le patient mais également par le médecin (4). Le SDAI prend en compte la CRP en plus des éléments précités et constitue donc le score le plus global.
La rémission, ou si elle n’est pas possible une activité faible de la maladie, doivent être l’objectif à atteindre (6,7). L’inflammation est la cible thérapeutique principale (1). En réduisant l’inflammation rapidement, nous pouvons prévenir les dommages articulaires irréversibles et améliorer la fonction physique du patient à long terme (6). Les 3 objectifs centraux sont la rémission, la prévention des déformations articulaires liées au dommage radiologique et la restauration de la qualité de vie sans handicap fonctionnel. Des objectifs additionnels seront intégrés dans la prise en charge chronique tels que l’amélioration des plaintes des patients (douleur, fatigue...), la prévention des maladies associées (cardiovasculaire, ostéoporose...), la prévention des complications infectieuses et la diminution des doses voire l’arrêt de certains traitements tels que la cortisone.
Le traitement
Le traitement repose sur 3 objectifs principaux et 4 additionnels selon l’évolution et la présentation clinique des patients souffrant de PR (figure 1).
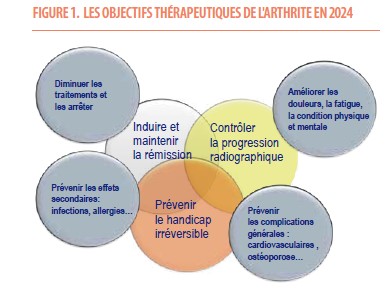
La littérature récente nous indique qu’une prise en charge précoce et intensive permet de modifier l’évolution de l’arthrite et de la PR (6,7).
La première médication pendant la phase de diagnostic et d’évaluation repose sur un traitement symptomatique par exemple par AINS (3) ou antalgiques en évitant les corticostéroïdes pour ne pas masquer la maladie.
Une fois le diagnostic établi, un traitement de fond par un csDMARD (conventional synthetic Disease-Modifying Antirheumatic Drug), idéalement le méthotrexate sera débuté (4,8). La dose initiale de méthotrexate peut être d’emblée de 15 mg par semaine associée à 5 mg d’acide folique le lendemain. La dose pourra être majorée jusque 20 mg/semaine après 4 semaines. Des glucocorticoïdes à faible dose (prednisolone inférieure à 7,5 mg par jour) peuvent être associés au méthotrexate en début de traitement. Les glucocorticoïdes devront cependant être réduits puis arrêtés endéans les 6 mois (1,3,9,10).
En cas d’échec après 3 à 6 mois d’évaluation ou d’intolérance, le méthotrexate pourra être associé ou remplacé par d’autres csDMARDs tels que la sulfasalazine, l’hydroxychloroquine ou le leflunomide (10).
Si une activité élevée de la maladie persiste malgré les csDMARDs, les patients peuvent bénéficier d’un traitement par bDMARDs (biologic Disease-modifying Antirheumatic Drug) ou par un inhibiteur des JAK kinases (10,11). L’indication d’un bDMARD est indispensable chez les patients réfractaires au csDMARDs avec des facteurs de mauvais pronostics (érosion précoce, DAS élevé, facteur rhumatoïde ou ACPA positifs). Ces traitements ont pu être développés suite à une meilleure compréhension de l’activation du système immunitaire en bloquant certaines protéines inflammatoires (TNF, IL-6...) ou en modulant les lymphocytes (T ou B). Les critères utilisés en Belgique sont une maladie active (DAS28-CRP > 3.7) malgré l’utilisation de 2 csDMARDs.
Il existe actuellement 4 types de bDMARDs avec des mécanismes d’action différents (1) :
- Agents bloquant le TNF (infliximab, adalimumab, certolizumab, etanercept et golimumab)
- Agents bloquant la co-stimulation avec le lymphocyte T (abatacept)
- Agents bloquant le récepteur de l’IL6 (tocilizumab, saralimumab)
- Agents inhibant les lymphocytes B (rituximab)
On dispose également de biosimilaires pour certaines de ces molécules. Les biosimilaires sont des molécules pharmaceutiques qui sont hautement similaires aux traitements biologiques déjà approuvés (11).
Les inhibiteurs des JAK kinases sont les dernières molécules arrivées sur le marché. Ce ne sont pas des traitements biologiques mais des molécules synthétiques ciblées permettant de moduler la voie enzymatique intracellulaire de la production des cytokines pro inflammatoires. Nous disposons des molécules suivantes en Belgique : tofacitinib, baricitinib, upadacitinib et filgotinib. Elles sont administrées une fois par jour par voie orale.
La figure 2 vous illustre que tous ces traitements ont une efficacité clinique similaire et on observe une diminution des taux de réponse en fonction des différentes lignes thérapeutiques (meilleure réponse après échec du MTX et réponse plus faible si échec à un ou plusieurs bDMARDs).

Lorsque le patient est en rémission sous traitement biologique depuis plus de 6 mois, une réduction de la dose du traitement biologique peut être proposée (après avoir réduit puis arrêté les glucocorticoïdes) (1,6,10).
En général, les bDMARDs sont bien tolérés. Il est à noter qu’ils majorent légèrement le risque infectieux, surtout respiratoire et cutané. Le risque d’apparition de tumeurs solides n’est pas augmenté dans la population traitée au long cours, seul le risque des cancers baso- ou spinocellulaires est légèrement augmenté. Le lymphome peut être observé sous biothérapie mais il est attribué à une complication potentielle de la PR et ce risque augmente en fonction de la sévérité de la maladie (12).
Les bDMARDs sont chers, un traitement d’une année représente un coût de 8 000 à 15 000 €. Il faut cependant prendre en considération les économies réalisables grâce à l’introduction précoce des traitements biologiques, avec une réduction des frais médicaux à long terme d’une maladie chronique par la prévention du handicap fonctionnel, des maladies associées et de la préservation de la vie socioprofessionnelle.
Outre les traitements médicamenteux, la prise en charge de la polyarthrite rhumatoïde doit être multidisciplinaire et reposer sur une prise en charge holistique par des moyens médicamenteux et non médicamenteux (infirmière coordinatrice et d’éducation, kinésithérapie…).
Le traitement des arthrites classées dans les sponyloarthropathies séronégatives est assez similaire à la PR avec l’utilisation d’agents biologiques spécifiques pour d’autres cibles immunologiques tels que les agents bloquant du TNF, de certains inhibiteurs des JAK Kinases (tofacitinib et upadacitinib) et les inhibiteurs de l’interleukine 17 (sécukinumab, ixékizumab, bimékizumb), de l’interleukine 23 (rizankizumab, guzelkumab) et d’un inhibiteur de la phosphodiesterase (apremilast).
Toutes les indications et données vont sont résumées dans la figure 3.

Le futur
Il n’est pas encore possible de prédire l’efficacité d’un médicament, ce qui expose les patients à des traitements potentiellement inutiles et à leurs effets indésirables. Des études visant à identifier les patients qui sont susceptibles de répondre à un traitement ciblé particulier sont donc menées. Il a notamment été constaté que d’un patient à l’autre, il existe une grande hétérogénéité dans les cellules et les molécules présentes dans les articulations malades. La recherche s’oriente vers des aspects de caractérisation physiopathologique de l’arthrite débutante et sur des schémas thérapeutiques visant à maximaliser les taux de rémission. Les informations obtenues à partir de l’analyse du tissu synovial des patients souffrant d’arthrite sont susceptibles d’apporter une aide considérable au diagnostic en distinguant différents pathotypes selon les infiltrats cellulaires et, dans un futur peut-être proche, à la prise de décisions thérapeutiques en se basant sur l’analyse de l’expression des gènes inflammatoires et des signatures moléculaires. On pourrait en effet identifier des marqueurs de diagnostic précoce, de pronostic et de réponse thérapeutique. Nous avons d’ailleurs participé à une étude évaluant le bénéfice du Tocilizumab versus Rituximab chez des patients présentant une PR sévère et réfractaire. Cette étude a pu démontrer une majoration de la réponse selon un choix orienté par les marqueurs synoviaux (13). De plus, des études ayant réalisé du RNAseq en masse ont permis de montrer une corrélation entre certaines signatures transcriptomiques et la réponse au traitement (14,15).
Par ailleurs, les études cliniques ont démontré que l’utilisation précoce des bDMARDs chez des patients présentant une PR débutante sévère apporte un bénéfice surtout marqué sur la prévention des destructions articulaires (11). Le traitement futur de la PR pourrait utiliser un bDMARD dès le diagnostic selon l’indication de biomarqueurs synoviaux et relayer le traitement par une phase de maintenance sous MTX. Cette approche ciblée et intensive dans la phase très précoce de la maladie permettrait d’induire un « reset » immunitaire. Nous nous orientons peut-être à l’avenir vers une médecine personnalisée où chaque patient aurait un schéma thérapeutique adapté aux caractéristiques et au pronostic de sa polyarthrite.
Conclusion
La connaissance plus précise de la physiopathologie, une meilleure évaluation clinique et l’avènement de nouveaux traitements ont permis de changer l’évolution de l’arthrite chronique. Des stratégies thérapeutiques ont ensuite pu être établies avec comme objectif principal la rémission ou du moins une activité faible de la maladie. Un diagnostic et une prise en charge précoces sont donc essentiels pour prévenir les conséquences potentielles de cette maladie.
Correspondance
Pr Patrick Durez
Pôle de Pathologies Rhumatismales et Systémiques
Institut de Recherche Expérimentale et Clinique, UCLouvain
Cliniques universitaires Saint-Luc
Service de Rhumatologie
Avenue Hippocrate 10
B-1200 Bruxelles
patrick.durez@uclouvain.be
Références
- Smolen JS, Aletaha D, McInnes. Rheumatoid arthritis. Lancet. 2016 Oct22;388(10055):2023-2038.
- Littlejohn EA, Monrad SU. Early Diagnosis and Treatment of Rheumatoid Arthritis. Prim Care. 2018 Jun;45(2):237-255.
- Aletaha D, Smolen JS. Diagnosis and Management of Rheumatoid Arthritis: A Review. JAMA. 2018 Oct 2;320(13):1360-1372.
- Mian A, Ibrahim F, Scott DL. A systematic review of guidelines for managing rheumatoid arthritis. BMC Rheumatol. 2019 Oct 22;3:42.
- Ajeganova S, Huizinga T. Sustained remission in rheumatoid arthritis: latest evidence and clinical considerations. Ther Adv Musculoskelet Dis. 2017 Oct;9(10):249-262.
- Legrand J, Kirchgesner T, Sokolova T, Vande Berg B, Durez P: Early clinical response and long-term radiographic progression in recent-onset rheumatoid arthritis: Clinical remission within six months remains the treatment target. Joint Bone Spine 2019 Oct;86 (5):594-599.
- Bortoluzzi A, Furini F, Generali E, Silvagni E, Luciano N, Scirè CA. One year in review 2018: novelties in the treatment of rheumatoid arthritis. Clin Exp Rheumatol. 2018 May-Jun;36(3):347-361.
- Nam JL. Rheumatoid arthritis management of early disease. Curr Opin Rheumatol. 2016 May;28(3):267-74.
- Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017 Jun;76(6):960-977.
- Burmester GR, Pope JE. Novel treatment strategies in rheumatoid arthritis. Lancet. 2017 Jun 10;389(10086):2338-2348.
- Caporali R, Crepaldi G, Codullo V, Benaglio F, Monti S, Todoerti M, et al. 20 years of experience with tumour necrosis factor inhibitors: what have we learned? Rheumatology (Oxford). 2018 Oct1;57:7.
- Humby F, Durez P, Buch MH, et al. Rituximab versus tocilizumab in anti-TNF inadequate responder patients with rheumatoid arthritis (R4RA): 16-week outcomes of a stratified, biopsy-driven, multicentre, open-label, phase 4 randomised controlled trial. Lancet. 2021;397(10271):305-317.
- De Groof, Aurélie et al. “Higher expression of TNFα-induced genes in the synovium of patients with early rheumatoid arthritis correlates with disease activity, and predicts absence of response to first line therapy.” Arthritis research & therapy. 2016 ; vol. 18,19
- Humby, Frances et al. “Synovial cellular and molecular signatures stratify clinical response to csDMARD therapy and predict radiographic progression in early rheumatoid arthritis patients.” Annals of the rheumatic diseases. 2019 ; vol.78, 6 : 761-772.