Introduction
Les tests génétiques sont utilisés pour identifier des anomalies de la molécule d’ADN responsables de maladies héréditaires (génétique constitutionnelle), de cancers (génétique somatique ou acquise) ainsi que pour obtenir des informations sur la réponse à un traitement ou sur les risques d’effets secondaires (pharmacogénétique).
Les anomalies constitutionnelles qui touchent un gène ou un chromosome sont rares et représentent 72% des maladies dites rares (1). Dans l’Union européenne, une maladie est classée comme rare sur base de sa prévalence correspondant à une valeur inférieure à moins d’une personne sur 2 000 dans la population (taux de prévalence <0.5).
Inexistante jusqu’au milieu du XIXe siècle, la génétique moléculaire doit son essor notamment aux différents travaux de Miescher (1869 ; acide désoxyribonucléique), de Walter et Remming (1879 ; chromosomes) et Watson et Crick (1953 ; structure de l’ADN en double hélice).
Le dernier quart du XXe siècle a aussi été le témoin des progrès de la biologie moléculaire et de la génétique médicale permettant d’identifier les causes d’un nombre croissant de troubles génétiques et d’innover de nouveaux tests génétiques. Avec le début du XXIe siècle, l’avènement des technologies des puces à ADN et de séquençage de nouvelle génération, conjugué à la croissance exponentielle des technologies de l’information, a radicalement changé l’approche du diagnostic génétique.
En Belgique, les tests de génétique sont effectués par huit centres de génétique médicale (CGM) dont trois sont situés à Bruxelles, 3 en Flandre et 2 en Wallonie (Tableau 1). Les centres fournissent différents types de tests associés aux maladies allant d’un simple changement d’acide nucléique vers des changements en nombre et en structure de larges portions chromosomiques tout en passant par l’épigénétique s’apparentant aux tests moléculaires, cytogénétiques et biochimiques.

Contexte de prise en charge des maladies rares
Pendant longtemps, les maladies rares sont restées un problème largement sous-estimé. À la fois un enjeu de santé publique important, les maladies rares sont rares, mais les patients sont nombreux estimés à 500 000 personnes dans notre pays soit 4.3% de la population, sans tenir compte des tumeurs, des maladies infectieuses et des intoxications rares (2).
Le nombre de maladies rares est impressionnant ; environ 6 200 ont été cliniquement définies (3) avec approximativement 5 nouvelles pathologies décrites chaque semaine dans les revues scientifiques internationales. En raison de leur très grande diversité d’expression tant en termes de symptômes que de prévalence et impliquant toutes les disciplines de la médecine, elles rendent l’organisation de la politique de santé dans ce domaine particulièrement difficile.
Elles représentent également un enjeu économique et industriel conséquent pour le développement de traitements dont leur mise au point est onéreuse, aléatoire, difficile à valider et dont la rentabilité n’est pas toujours assurée. Les nombreux enquêtes et travaux ont tous souligné que les patients atteints de maladies rares se heurtent à trois mêmes obstacles : (i) avant d’obtenir un diagnostic correct, les patients traversent souvent une odyssée avant que l’on puisse donner un nom à leur pathologie. Le délai d’attente moyen avant que les patients ne reçoivent un diagnostic est estimé à 4,4 ans (4) ; (ii) un manque d’information sur les pathologies et (iii) une recherche de traitement longtemps délaissée par les pouvoirs publics et les laboratoires privés. En effet, seuls 5% des maladies rares disposent aujourd’hui d’un traitement médicamenteux enregistré (5-7). Depuis, associations des patients, acteurs gouvernementaux et non gouvernementaux, industriels et chercheurs se mobilisent pour favoriser entre autres l’approche pluridisciplinaire de prise en charge des patients dans le parcours de soins des maladies rares, récolter et travailler les données afin d’augmenter la connaissance, impliquer davantage les pouvoirs publics dans l’harmonisation des parcours de soins pour les maladies rares et de disposer de médicaments nouveaux, plus innovants et moins chers.
Ainsi, compte tenu de l’ampleur des besoins non satisfaits des patients atteints de maladies rares, les pouvoirs publics ont mis en place des mesures incitatives dans le but de favoriser la recherche et le développement (R&D) de médicament orphelin. En 1983 la FDA Orphan Drug aux États-Unis suivi par l’Europe le 16 décembre 1999 reconnaissent et adoptent un cadre régulatoire spécifique afin d’encourager et d’inciter les industriels au développement de médicaments pour les maladies rares jusque-là sous-développé en offrant des avantages financiers et avantages en termes de propriétés intellectuelles (8). Parmi ceux-ci, on retrouve une compensation par les pouvoirs publics pour les risques que les industries pharmaceutiques prennent face à un retour sur investissement potentiellement moindre en fournissant des crédits d’impôt sur la conduite des essais cliniques, des dispenses de frais de processus d’autorisation de mise sur le marché du médicament, des subventions de la recherche et 10 ans d’exclusivité commerciale (plus 2 ans lorsqu’un plan de développement pédiatrique est finalisé à temps) (9).
Le concept de maladie rare et l’organisation officielle de leur prise en charge en Belgique sont récents. Suite à l’appel de l’Europe en 2009 demandant à ses États membres d’élaborer des plans et stratégies pour fin 2013, le premier plan belge pour les maladies rares a vu le jour fin 2013 (10). Ce plan préconise 20 actions ou initiatives concrètes à mettre en œuvre en Belgique s’articulant autour de 3 domaines principaux à savoir un meilleur diagnostic, l’optimisation des soins et une meilleure visibilité pour chercher les informations.
Objectifs
La BGTD est une base de données créée par Sciensano dans le but de constituer une ressource unique pour la Belgique en ce qui concerne les tests génétiques effectués dans notre pays. La base de données contient des informations détaillées et uniformes sur les tests génétiques ainsi que sur les aspects de la qualité associés tels que les accréditations de tests, la participation à une Évaluation externe de la qualité (EEQ). L’historique des données contenues dans la BGTD est conservée afin d’en assurer la traçabilité.
L’objectif de la BGTD est de fournir des informations aux professionnels de la santé afin que les patients obtiennent le test génétique adéquat pour établir un diagnostic. En outre, les données sont échangées avec des sources externes telles qu’Orphanet et des agences gouvernementales (INAMI, BELAC) ce qui permet d’accroître la visibilité de l’expertise en génétique clinique présente en Belgique. La base de données est une application web open source (https://gentest.healthdata.be/) qui répond aux besoins des différentes parties prenantes (des patients, des chercheurs, des cliniciens et des autorités sanitaires).
Présentation de la base de données
Le déploiement de la base de données des tests génétiques belges (BGTD) est mentionné dans l’action 2 du plan belge pour les maladies rares, conformément aux directives et recommandations des différentes parties prenantes. Sciensano a été mandaté pour implanter, développer et maintenir la BGTD où trois services sont impliqués : le service « Étude des soins de santé » pour la mise en œuvre, Healthdata.be pour soutenir l’aspect technique compte tenu de son expérience en matière d’inventaire, de collecte de données et de reporting et le service de « Qualité des laboratoires ». Le projet est supervisé par un comité de pilotage composé entre autres d’organismes gouvernementaux de la santé (INAMI, Service Public Fédéral (SPF Santé, KCE), des CGMs, RaDiOrg (l’association coupole belge pour les personnes atteintes d’une maladie rare) et par l’assurance maladie qui assure le monitoring, l’atteinte des objectifs et les développements futurs.
En accord avec les différentes parties prenantes, tables, variables et relations entre tables/variables ont été définies et mises en place ainsi qu’un moteur de recherche de mots clés, une gestion des identités et des accès, une gestion des flux, une validation des données et des modules/données sujets à l’export/impression.
Dans un premier temps, les informations relatives aux tests génétiques constitutionnels ont été extraites de diverses sources, telles que les sites web des laboratoires, des organisations gouvernementales et autres. Ces données ont ensuite été validées par chaque CGM. Sciensano est responsable du maintien et de la mise à jour de toutes les informations et ces données sont mises à jour au moins une fois par an par les centres de génétique.
Actuellement (dernier accès : décembre 2023), la base de données contient 854 tests génétiques moléculaires contenant des informations générales et annexes développées ci-dessous et une fonctionnalité d’impression. La très grande majorité des tests repose sur une analyse génétique dans le cadre d’une maladie héréditaire mais reprend également 10 tests réalisés dans le domaine acquis (somatique) et 36 tests pour étudier la réponse d’un individu à un médicament donné.
Informations générales liées aux tests génétiques
La page relative à un test donne accès à différentes informations et pages lorsqu’elles sont disponibles et développées ci-dessous.
- Le nom, le type de matériel biologique nécessaire, la ou les méthodes utilisée(s), les documents nécessaires à la prescription, le montant du remboursement de l’Institut national d’assurance maladie-invalidité (INAMI)1, l’inclusion dans le scope d’accréditation fournit par le Bureau d’Accréditation BELAC pour la période de validité mentionnée, la participation à une Évaluation Externe de Qualité EEQ, le délai d’exécution (TAT), les dates de publication et de dernière mise à jour ;
- Une alarme sous forme de banderole colorée apparaît si le test est associé à un formulaire spécifique et obligatoire pour la réalisation de l’analyse (Figure 1.A) ;
- Certaines données s’ouvrent sur une table spécifique comme par exemple, la méthode, le laboratoire (Figure 1.B), le code INAMI (RIZIV) (Figure 1.C) et les documents pour la prescription médicale (Figure 1.D et E) ;
- Un lien hypertexte vers le site du laboratoire effectuant le test génétique s’il existe (Figure 1.F) ;
- Chaque test est associé, en dessous de sa table, à différents modules, s’ils existent, à savoir « maladies, laboratoires fournisseurs, gènes (Analytes) et panels de gènes (Figure 1) ».

1 Les conditions de remboursement des examens génétiques sont définies à l’article 33 de la nomenclature de l’INAMI sous des codes généraux qui couvrent le diagnostic des maladies héréditaires [11].
Informations spécifiques annexes
Les maladies
Les tests génétiques peuvent être liés à un ou plusieurs gènes et maladies. Les gènes ou maladies sont importés et mis à jour annuellement d’Orphadata (http://www.orphadata.org/cgi-bin/index.php) qui représente une extraction partielle de la base de données Orphanet. Les informations sont par défaut en anglais. La BGTD restitue pour chaque maladie une table comprenant : un nom, une courte description, l’Orphacode, les synonymes, les références croisées vers Orphanet, OMIM2 et ICD-10 et 113 et aux gènes (analyte(s))4 responsables de la maladie, les dates de création et de dernière mise à jour.
Chaque table « maladie » est associée à différents modules lorsque la liaison existe à savoir « tests génétiques, laboratoires fournisseurs, gènes (Analytes), panels de gènes (Figure 2) ».
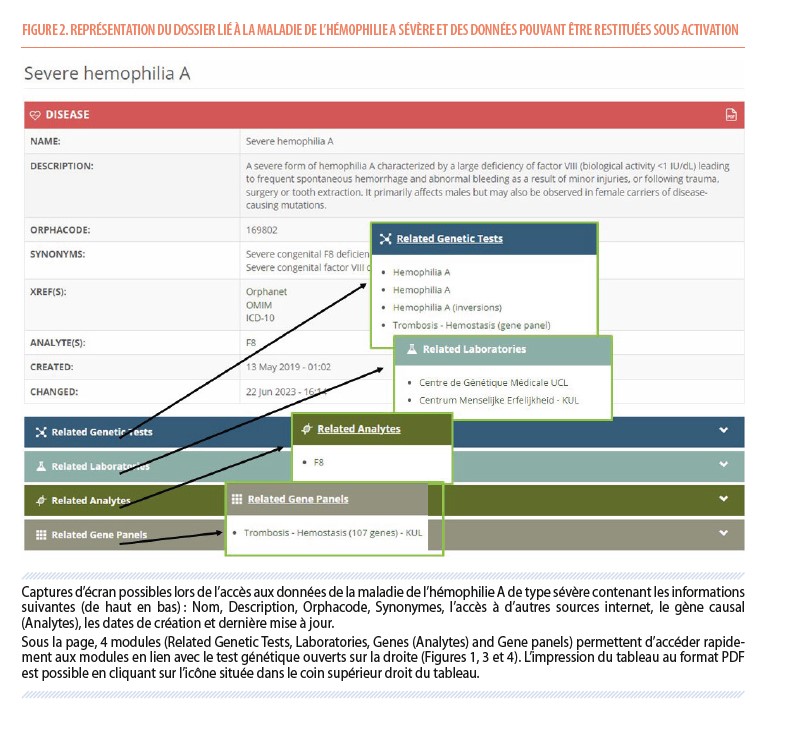
2 OMIM est une base de données de référence sur les gènes humains et les phénotypes génétiques, disponible gratuitement et mis à jour quotidiennement (https://www.omim.org/).
3 Traduit de l'anglais, la CIM-10 et -11 sont les 10e et 11e révisions de la Classification statistique internationale des maladies et des problèmes de santé connexes, une liste de classification médicale établie par l'Organisation mondiale de la santé. (https://icd.who.int/en).
4 Le mot « analytes » englobe les termes « Gene or locus or mRNA or Protein ».
Les gènes (Analytes)
La BGTD restitue pour chaque gène une table comprenant le nom unique long et court (ou symbole) approuvé par le comité “HUGO” (HUman Genome Organisation)5, les synonymes, l’accès à d’autres sources internet, les dates de création et de dernière mise à jour. Chaque table du « gène (analytes)» est associée à différents modules lorsque la liaison existe à savoir «tests génétiques, les maladies, panels de gènes (Figure 2 et 3) ».

5 https://www.genenames.org/
Les panels de gènes
La technique de séquençage de nouvelle génération (NGS) est utilisée pour certains tests génétiques et permet d’analyser plusieurs gènes simultanément. La liste des gènes est reprise dans une page « panel de gènes » comprenant les détails suivants : nom, abréviation, version du panel, description, le laboratoire fournisseur, les dates de création et de dernière mise à jour. Chaque panel de gènes est associé en dessous de sa table à deux modules lorsque la liaison existe à savoir « maladies » et « gènes (analytes) ». Le % de séquence codante suffisamment couverte pour détecter les mutations hétérozygotes, la détection des larges délétions/duplications d’un ou plusieurs exons (0= non ; yes= oui) et un éventuel commentaire sont également repris pour chaque gène de la liste (Figure 4). Pour répondre à l’évolution des connaissances médicales, les panels de gènes sont annuellement mis à jour par les CGMs.

Divers
L’essentiel des coûts des analyses génétiques sont remboursés par la sécurité sociale (INAMI/RIZIV). La quote-part du patient (ticket modérateur) est limitée à environ 9 euros par analyse. Le coût total, y compris la partie prise en charge par la sécurité sociale, va d’environ 90 euros pour les analyses ciblées, à 1600 euros pour les analyses extensives de nombreux gènes en parallèle. Ainsi chaque test génétique est associé à un code de remboursement défini à l’article 33 de la nomenclature de l’INAMI/RIZIV (11) dont les informations sont accessibles en activant le code de remboursement.
Pour pouvoir effectuer une analyse et attester des prestations remboursables, il est possible pour chaque test génétique d’accéder rapidement à la prescription médicale et de pouvoir l’imprimer. Certaines analyses requièrent également la signature du patient d’un document appelé « consentement éclairé ». Le consentement éclairé s’inscrit dans l’article 8 de la loi du 22 août 2002 relative aux droits du patient et respecte le code de déontologie médical et infirmier moyennant information préalable » (12). Les analyses génétiques doivent être librement acceptée et nécessite donc un accord formel.
Recherche d’une information
Il existe plusieurs voies pour récupérer les informations souhaitées sur un test génétique. L’onglet « Home » situé sur la barre d’outils affiche une liste permettant une recherche sur tous les composants de la base de données « Any » par défaut ou en se concentrant sur un domaine spécifique organisée en quatre sections : Analyte (Gene), disease, Laboratory, Genetic test. Les données peuvent être récupérées sur la base de la maladie, du nom ou symbole du gène (Analyte), d’un synonyme, d’un ORPHAcode6, d’un numéro OMIM7 ou HGNC8.
Alternativement, l’onglet « Genetic tests » fournit les tables basées sur les maladies et les gènes (symbole et/ou nom complet).
6 Un ORPHAcode est un identifiant numérique unique, stable dans le temps et non réutilisable. Il est généré aléatoirement par la base de données Orphanet
7 Les gènes et les phénotypes reçoivent des identifiants uniques et stables à six chiffres (MIMnumber) générés par la base de données OMIM (Online Mendelian Inheritance in Man)
8 Un identifiant unique est fourni par HGNC pour chaque gène avec un symbole approuvé. Les identifiants sont au format HGNC:n, où n est un numéro unique. Les identifiants HGNC restent stables même si un nom ou un symbole change.
L’impression
Chaque table peut être aisément imprimée en format PDF grâce à l’onglet se situant en haut et à droite de celle-ci.
La qualité
Chaque CGM garantit la validité des données assurant au minimum une fois par an leur mise à jour. Sciensano assure en continu celle relative à l’accréditation, aux évaluations externes de la qualité, aux gènes et aux maladies grâce à la collaboration avec le service « Qualité des Laboratoires » de Sciensano. En effet, toujours dans le cadre de l’action 2 du Plan belge pour les Maladies rares, ce service procède à la sélection des EEQs pour lesquelles la participation des centres belges de génétique humaine peut être remboursée.
Conclusion et perspectives
L’implantation d’une base de données répertoriant les tests génétiques est essentielle pour une prise de décision éclairée par les prestataires de soins de santé, les organisations gouvernementales de santé et les patients en Belgique qui ont tous besoin d’un accès facile à des informations validées sur les tests génétiques. Elle contribue également à mieux informer le public impliqué dans les maladies rares. La supervision par un comité multipartite permet de déterminer si la base de données atteint ses objectifs.
Dans un futur proche, la BGTD étendra son champ d’application pour inclure des tests somatiques (par ex. les analyses hémato-oncologiques), les tests non ADN/biochimiques, et autres développements à la demande des parties prenantes.
Prochainement, une vidéo d’instruction, une brochure d’information et une formation en ligne seront créées pour expliquer les objectifs et l’utilisation de la BGTD. Cette formation sera diffusée le plus largement possible à toutes les parties prenantes.
Références
- As defined in Regulation (EC) N°141/2000 of the European Parliament and of the Council of 16 December 1999 on orphan medicinal products, https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32000R0141....
- Rapport Orphanet 2021 (https://www.sciensano.be/en/biblio/rapport-dactivite-orphanet-belgium-2021)
- Prevalence and incidence of rare diseases: Bibliographic data”, Orphanet Report Series, Rare Diseases collection, January 2022, Number 1, : Diseases listed in alphabetical order : https://www.orpha.net/orphacom/cahiers/docs/GB/Prevalence_of_rare_diseas... ; The number of rare diseases listed in Orphanet is also available at the bottom of the Orphanet website homepage: https://www.orpha.net/consor/cgi-bin/index.php
- https://rarepatientvoice.global/fr/les-zebres-existent-bel-et-bien-odyss...
- Eurordis. The Voice of 12 000 Patients. Experiences and expectations of rare disease patients on diagnosis and care in Europe. 2010 www.eurordis.org/IMG/pdf/ voice_12000_patients/EURORDISCARE_FULLBOOKr. pdf (accès le 28.6.2011).
- Ayme, S., [Rare diseases: a long ignored public health problem]. Rev Epidemiol Sante Publique. 2001. 49(4): p. 329-30
- https://www.radiorg.be/fr/des-traitements-rares/
- EC Regulation 141/2000 on Orphan Medicinal Products
- Raïs Ali S., Tubeuf S. (2019). Maladies rares : des enjeux pour les économistes, Regards économiques, Numéro 154
- https://www.health.belgium.be/sites/default/files/uploads/fields/fpsheal...
- L’article 33 de l’annexe de l’arrêté royal du 14 septembre, 1984 fixant la nomenclature des prestations de santé sur l’assurance obligatoire des soins et des prestations médicales (version actuelle depuis le 01/01/2013). INAMI; 2013 Jan 1.
- https://etaamb.openjustice.be/fr/loi-du-22-aout-2002_n2002022737.html
Affiliations
Epidémiologie et Santé publique – Etude des soins de santé - Equipe Maladies Rares, Sciensano, B-1050 Bruxelles, Belgique
Correspondance
Dre Nathalie Lannoy, PhD
Collaborateur scientifique
Epidémiologie et Santé publique – Epidemiologie en volksgezondheid
Rue Juliette Wytsmanstraat 14, B-1050 Brussels
nathalie.lannoy@sciensano.be
www.sciensano.be