Lenacapavir : nouvelle révolution dans la lutte contre le VIH ?
Brieuc Van Nieuwenhuyse1,2, Laurence Bamps1,3, Julien De Greef1,2, Jean Cyr Yombi1,2, Leïla Belkhir1,2
Depuis le début de l’utilisation à grande échelle des traitements antirétroviraux (TAR) ciblant le virus de l’immunodéficience humaine (VIH) il y a une trentaine d’années, la prise en charge des personnes vivant avec le VIH (PVVIH) a connu une transformation majeure. Ces avancées ont permis d’améliorer considérablement tant leur qualité de vie que leur pronostic avec une espérance de vie proche de celle de la population générale (1). Par ailleurs, un bon contrôle de la charge virale par le TAR permet également de limiter la transmission du virus, dans une logique dite de « treatment as prevention », TasP. En effet, un patient dont la charge virale est durablement indétectable grâce au TAR ne transmet plus le virus que ce soit lors de rapports sexuels (I=I) ou lors de la grossesse et de l’accouchement, réduisant ainsi le risque de transmission au bébé à quasiment zéro. Pour autant, la lutte contre le virus et sa propagation fait encore face à de nombreux défis qu’ils soient d’ordre médical, scientifique, de santé publique ou encore de conscientisation sociétale. En outre, et notamment en cause, l’infection au VIH reste une infection incurable : la prise du TAR, même si elle supprime la réplication virale de façon très efficace, n’aboutit néanmoins pas à l’éradication du virus et doit donc être poursuivie à vie. Malgré la simplification du TAR ces dernières années, avec une prise le plus souvent réduite à une seule pilule combinant plusieurs médicaments dans la plupart des cas, certains patients rencontrent des difficultés à respecter l’exigence d’une prise quotidienne stricte, ce qui peut entraîner des échecs thérapeutiques voire l’émergence de résistances virales (2).
L’utilisation progressive de TAR injectables de longue durée d’action, tels que l’association de Cabotégravir et Rilpivirine chez des patients avec charge virale indétectable soigneusement sélectionnés, permet un « contrôle viral » quasi équivalent au traitement oral chez la très grande majorité des patients (3). Administrés par injection intramusculaire tous les deux mois, ils pourraient réduire la problématique de compliance au traitement oral susmentionnée, notamment dans ses aspects psycho-sociaux.
Par ailleurs, un des autres aspects de la lutte contre le VIH consiste à recommander, dans des populations non-infectées mais à haut risque de contamination par le VIH (e.g. patients à multiples partenaires et/ou à rapports à risque, travailleur(/euse)s du sexe), la prise prophylactique d’un TAR pour éviter de contracter l’infection et ainsi limiter plus largement la circulation du VIH (4) : on parle alors de prophylaxies pré-exposition (PrEP). La prise d’une association orale de Ténofovir Disoproxil Fumarate/Emtricitabine (TDF/FTC) est d’ailleurs remboursée dans cette indication en Belgique depuis juin 2017.
Plus récemment, une nouvelle molécule, le Lenacapavir, a suscité un intérêt scientifique et médical considérable en réunissant trois caractéristiques clés : grande efficacité et probable faible toxicité, longue durée d’action avec délai d’administration prolongé, et possible usage dans le cadre de la prophylaxie pré-exposition. Décrite pour la première fois en 2020 sous le nom de GS-6207, cette molécule est une révolution d’abord par son mécanisme d’action inédit (5). En effet, le Lenacapavir agit comme un « anti-capside » en interagissant à de multiples niveaux sur l’intégrité structurelle du VIH, diminuant sa « flexibilité » stérique (nécessaire à son entrée dans le noyau cellulaire à travers les pores nucléaires) et compromettant son assemblage en une forme conique caractéristique ainsi que sa fusion avec la membrane cytoplasmique lors du « bourgeonnement » des virions. Ses effets adviennent donc à la fois à des étapes très précoces et très tardives du cycle réplicatif (Figure 1). Ce mode d’action contraste avec ceux de tous les autres TAR utilisés à grande échelle, ciblant trois points clefs enzymatiques du métabolisme réplicatif du virus : transcriptase inverse, intégrase ou protéase. En outre, sa faible clearance spontanée in vivo et sa lente diffusion après injection sous-cutanée en font une thérapie de longue à très longue durée d’action, nécessitant une injection deux fois par an seulement.
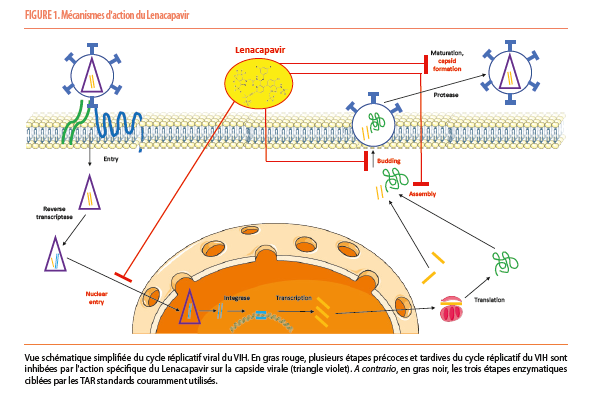
Au-delà des premiers résultats prometteurs du Lenacapavir chez certains patients en échec de traitement et porteurs de virus devenus multirésistants aux TAR couramment utilisés (6, 7, 8), l’usage du Lenacapavir a également été étudié dans une optique de prophylaxie pré-exposition. Cette indication a en effet fait l’objet de deux études cliniques de phase 3 randomisées en double aveugle, de parution récente : PURPOSE 1 et PURPOSE 2. Ces deux études ont étudié le potentiel du Lenacapavir utilisé seul dans une optique de prophylaxie pré-exposition par injection sous-cutanée tous les six mois, comparé à des bithérapies orales classiques considérées comme gold standard : TDF/FTC ou Ténofovir Alafénamide/Emtricitabine (TAF/FTC). PURPOSE 1, dont les résultats parurent en juillet 2024 (9), s’est concentrée sur la prophylaxie de 5338 jeunes femmes cisgenres d’Afrique du Sud et d’Ouganda. 55 séroconversions VIH furent détectées au cours de l’étude : 39 sous TAF/FTC (2.0 par 100 personnes années), 16 sous TDF/FTC (2.4 par 100 personnes années) et aucune sous Lenacapavir, la différence de ce dernier par rapport aux deux comparateurs étant statistiquement significative. PURPOSE 2, parue en novembre 2024 (10), a répliqué une méthodologie similaire auprès d’une population différente : 3271 hommes cisgenres et personnes de divers genres (hors femmes cisgenres) ayant des rapports avec des personnes de sexe masculin (assigné à la naissance), aux USA mais également dans plusieurs pays d’Afrique Sub-saharienne, d’Amérique du Sud et d’Asie. Onze séroconversions VIH furent mises en évidence : 2 dans le groupe lénacapavir, 9 dans le groupe TDF/FTC, cette différence étant à nouveau significative. Dans les deux études, un arrêt de traitement prématuré dans le groupe Lenacapavir pour cause d’effet indésirable fut rare (5 patients soit 0.2% dans PURPOSE 1 et 33 soit 1.5% dans PURPOSE 2), et en grande majorité lié à des réactions au site d’injection du Lenacapavir (4/5 dans PURPOSE 1, 26/33 dans PURPOSE 2). Les deux études concluent sur cette base à un profil de sécurité d’utilisation favorable. Ces résultats extrêmement prometteurs ont l’avantage d’avoir été établis dans des conditions « intention to treat » auprès de populations particulièrement touchées par l’épidémie et, en partie, souffrant le plus de l’inégalité d’accès au traitement et à un suivi médical régulier. PURPOSE 3 et PURPOSE 4 suivront prochainement, la première concernant la prophylaxie des femmes cisgenres par voie sexuelle aux USA, la seconde concernant, de façon inédite, la prophylaxie des usagers de drogues injectables. Certaines questions demeurent néanmoins comme la sécurité d’utilisation chez la femme enceinte ou, bien sûr, l’accessibilité financière de ce traitement dans une optique de commercialisation à large échelle. Enfin, d’autres études viendront prochainement préciser l’intérêt du Lenacapavir dans le traitement de l’infection par le VIH, par exemple en association avec le Cabotégravir (11) ou avec certains anticorps neutralisants à large spectre (Teropavimab, Zinlirvimab) (12). La prestigieuse revue Science a fait du Lenacapavir son « breakthrough of the year » 2024.
Références
- Trickey A, et al. Life expectancy after 2015 of adults with HIV on long-term antiretroviral therapy in Europe and North America: a collaborative analysis of cohort studies. Lancet HIV. 2023; 10, e295-e307.
- Prevoteau du Clary F, et al. Evaluation of HIV antiretroviral treatment adherence in 2019 using anonymized data from the French national health insurance claims data base: The COCOVIH study. HIV Medicine. 2024; 25, 1218-1226 4.
- Overton ET, et al. Long-Acting Cabotegravir and Rilpivirine Dosed Every 2 Months in Adults With Human Immunodeficiency Virus 1 Type 1 Infection: 152-Week Results From ATLAS-2M, a Randomized, Open-Label, Phase 3b, Noninferiority Study. Clin Infect Dis. 2023; 76, 1646-1654.
- Molina J-M, et al. Efficacy, safety, and effect on sexual behaviour of on-demand pre-exposure prophylaxis for HIV in men who have sex with men: an observational cohort study. Lancet HIV. 2017; 4, e402-e410.
- Link JO, et al. Clinical targeting of HIV capsid protein with a long-acting small molecule. Nature. 2020; 584, 614-618.
- Chatzidaki I, et al. Indirect Treatment Comparisons of Lenacapavir Plus Optimized Background Regimen Versus Other Treatments for Multidrug-Resistant Human Immunodeficiency Virus. Value Health. 2023; 26, 810-822.
- Gupta SK, et al. Lenacapavir administered every 26 weeks or daily in combination with oral daily antiretroviral therapy for initial treatment of HIV: a randomised, open-label, active-controlled, phase 2 trial. Lancet HIV. 2023; 10, e15-e23.
- Alford K, Sidat S, Bristowe K, Cicconi P, Vera JH, Cresswell F. Lenacapavir: Patient and healthcare provider perceptions and the potential role for a twice-yearly injectable HIV treatment. HIV Medicine n/a.
- Bekker L-G, et al. Twice-Yearly Lenacapavir or Daily F/TAF for HIV Prevention in Cisgender Women. New England Journal of Medicine. 2024; 391, 1179-1192.
- Kelley CF, et al. Twice-Yearly Lenacapavir for HIV Prevention in Men and Gender-Diverse Persons. New England Journal of Medicine.
- Gandhi M, et al. Case Series of People With HIV on the Long-Acting Combination of Lenacapavir and Cabotegravir: Call for a Trial. Open Forum Infectious Diseases. 2024; 11, (2024).
- Eron JJ, et al. Safety of teropavimab and zinlirvimab with lenacapavir once every 6 months for HIV treatment: a phase 1b, randomised, proof-of-concept study. Lancet HIV. 2024;.11, e146-e155.
Affiliations
1. Service de Médecine Interne et Maladies Infectieuses, Cliniques universitaires Saint-Luc, Bruxelles
2. Institut de Recherche Expérimentale et Clinique (IREC), UCLouvain, Bruxelles
3. Institut De Duve, UCLouvain, Bruxelles
Correspondance
Dr Brieuc Van Nieuwenhuyse
Cliniques universitaires Saint-Luc
Service de Médecine Interne et Maladies Infectieuses
Avenue Hippocrate 10
B-1200 Bruxelles