INTRODUCTION
L’infection par le virus de l’immunodéficience (VIH) reste un problème de santé publique dans le monde. Onusida estime que depuis l‘année 2000, 38.1 millions de personnes vivent avec le VIH et 25.3 millions de personnes sont décédées de sida (1). En 2014, on dénombrait 36.9 millions de personnes infectées par le VIH et 1.2 millions de décès liés au sida (1). En 2014 également, 2 millions de personnes ont été nouvellement infectées dans le monde contre 3.1 millions en 2000 (1). Les jeunes adultes sont ceux qui paient le tribu le plus lourd à l’épidémie du VIH, 40% de nouveaux cas sont répertoriés dans la tranche d’âge de 15 à 24 ans, la plus sexuellement active. En Belgique, en 2014, 1039 infections par le VIH ont été diagnostiquées ce qui correspond à 94 nouveaux diagnostics par million d’habitant ou encore à 2.8 nouveaux diagnostics par jour en moyenne (2). Le nombre d’infections diagnostiquées en 2014 est en recul de 8% par rapport à l’année 2013. Il faut signaler que l’épidémie est concentrée essentiellement dans deux populations : les hommes ayant des relations sexuelles avec des hommes (HSH), principalement de nationalité belge et européenne, et les personnes qui ont contracté le virus via des rapports hétérosexuels et provenant principalement des pays d’Afrique sub-Saharienne (1).
Face à la pandémie mondiale, il est urgent que tous les moyens de prévention soient mis en œuvre pour pouvoir lutter efficacement contre le VIH. Il existe quatre opportunités de prévention dans le cadre du VIH (tableau 1), chez les patients non exposés, chez les patients exposés en situation pré-coïtale ou coïtale, chez les patients exposés en position post-coïtale et chez les patients infectés (3). La prophylaxie post-exposition (PEP) par l’administration d’un traitement anti-rétroviral se situe dans la phase de prévention chez les patients exposés en situation post-coïtale. Les accidents d’exposition sont de deux types : les accidents dits professionnels qui peuvent être percutanés ou cutanéo-muqueux et les accidents non professionnels qui sont sexuels y compris les viols et comprenant également les accidents avec des aiguilles abandonnées dans la communauté, le partage de seringues et les morsures humaines. Quand il s’agit d’accidents dits professionnels, on parle de PEP et quand il s’agit d’accidents non professionnels, on parle de non-PEP ou nPEP. Il est important de savoir que des études de pathogenèse montrent qu’il existe une fenêtre d’opportunité pour éviter une contamination par l’infection au VIH en inhibant la réplication virale après une exposition. On sait qu’une fois que le VIH a traversé la barrière muqueuse, cela peut prendre entre 48 et 72 heures avant que le virus du VIH ne soit détecté au niveau régional, particulièrement au niveau ganglionnaire, et plus de 5 jours avant qu’il ne soit détecté au niveau sanguin (4-5). Dans les modèles animaux, l’initiation d’un traitement anti-rétroviral (TAR) a montré qu’il était possible de réduire la dissémination et la réplication du virus dans tous les compartiments tissulaires s’il est initié très précocement après l’inoculation (4-5). A la lumière de nouvelles recommandations anglaises et américaines (UK et CDC) nous allons dans cet article nous concentrer essentiellement sur la prophylaxie post-exposition après accidents non professionnels (nPEP), nous allons discuter du rationnel qui soutient cette prophylaxie, des facteurs de risque, de l’évaluation du risque de contamination, de l’indication de traitement, des schémas de traitements anti-rétroviraux à administrer, du suivi du patient. Nous allons également insister sur l’évaluation et la prise en charge des autres infections sexuellement transmissibles pouvant survenir lors de la prise de risque et nous terminerons par les perspectives.

ÉVIDENCES SCIENTIFIQUES SUR LESQUELLES SE BASENT LA PROPHYLAXIE POST-EXPOSITION
Les évidences des possibles bénéfices de la prophylaxie post-exposition après accidents non professionnels (nPEP) sont issues des études animales, de la transmission mère-enfant, de quelques études de la prophylaxie post-exposition après accidents professionnels et de certaines études observationnelles dans le cadre d’accidents non professionnels.
Les études animales
Les études animales suggèrent que la prophylaxie post-exposition pourrait potentiellement être efficace (6). Ceci va dépendre du temps d’initiation et de la durée d’administration du traitement (6). Un bémol à ces études est qu’elles ne sont pas standardisées et utilisent différents rétrovirus ainsi que différentes tailles d’inoculum et modes d’administration des ARV. C’est ce qui expliquerait leur hétérogénéité. Cependant, nous pouvons aborder deux études qui démontrent l’efficacité de l’administration du ténofovir en sous-cutané chez un modèle de macaque après injection intraveineuse du virus de l’immunodéficience simienne (SIV) (7) ou d’une inoculation intra-vaginale du VIH-2 (8). Ces études montrent que l’efficacité de la prophylaxie a été maximale quand elle était administrée dans les 24 à 36 heures et continuée pour une durée de 28 jours. Plus récemment, des études animales ont démontré l’efficacité d’une administration intermittente en prophylaxie pré-exposition et en prophylaxie post-exposition du ténofovir associé à l’emtricitabine en oral chez des macaques après une inoculation intra-rectale. La protection maximale était atteinte lorsque la première dose avait été administrée 22 heures à 7 jours avant l’exposition et la seconde dose 2 heures après l’exposition (9).
Les études humaines
Il n’existe pas d’études randomisées contrôlées pour déterminer l’efficacité de la prophylaxie post-exposition en cas d’accidents non professionnels et il n’y en aura certainement pas du fait des problèmes éthiques que cela pose et de la difficulté de pouvoir recruter un nombre suffisant de patients pour avoir une certaine puissance. Cependant, on peut se baser sur des données provenant d’une étude cas-contrôle rétrospective chez des professionnels de la santé qui ont été exposés de façon accidentelle au VIH et qui a montré que 28 jours de traitement à base de Zidovudine entraînait une réduction du risque de l’ordre de 80% (0.2 OR– IC à 95 % 0.06 à 0.52%) (10). On dispose également des données provenant de la transmission mère-enfant ou dans un sous-groupe de femmes dans l’étude ACTG 076 qui n’avait pas reçu la Zidovudine avant l’accouchement mais chez lesquelles le nouveau-né a reçu 6 semaines de Zidovudine initié dans les 48 heures après l’accouchement avaient un effet protecteur (11-12). Enfin, lors d’exposition sexuelle au VIH, deux études observationnelles de prophylaxie post-exposition ont été réalisées au Brésil : une chez des HSH et une autre chez des femmes après une agression sexuelle ont démontré peu de séroconversion chez les patients recevant cette prophylaxie par comparaison à ceux qui ne recevaient pas de prophylaxie (13). Il faut cependant signaler qu’aucune de ces études n’avait la puissance requise pour détecter une différence au niveau de l’incidence du VIH.
Risques de transmission du VIH
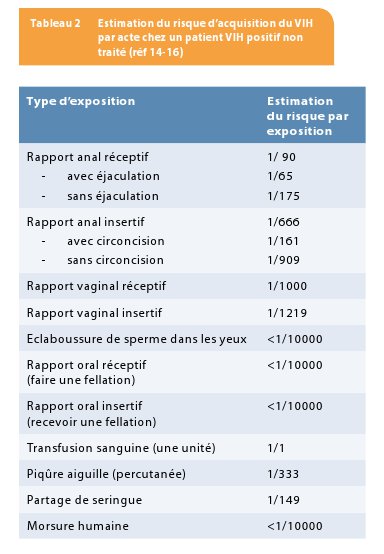
La probabilité de transmission du VIH dépend du type d’exposition, de l’état d’infectivité de la source, de la susceptibilité de la personne ayant été exposée et lorsque les patients sont exposées plusieurs fois durant 72 heures, la possibilité d’un effet cumulatif doit être discuté (14-16). Le tableau 2 résume le risque de transmission du VIH lors d’un accident d’exposition avec un patient VIH positif qui n’est pas sous traitement anti-rétroviral (TAR). Ces risques ont été estimés à partir des études de cohortes et des études de modélisation. Le risque pour un individu d’acquérir le VIH après un accident d’exposition peut être calculé en multipliant le risque que la personne source soit VIH positive par le risque lié à l’exposition. La formule suivante peut être appliquée :
Risque de transmission du VIH = risque que la source soit HIV positive x par le risque par exposition.
D’autre part certains facteurs peuvent augmenter le risque de transmission du VIH et doivent être considérés lors de la discussion en consultation avec le patient en vue de débuter une prophylaxie post-exposition. Les facteurs augmentant le risque de transmission sont les IST, les lésions génitales, les rapports sexuels pendant les règles, les saignements au cours des rapports sexuels, les traumatismes, le viol, les rapports multiples. Ces facteurs de risque sont résumés dans le tableau 3.

En résumé, l’évaluation du risque va tenir compte du type d’exposition, du type de rapport (par exemple, présence d’un préservatif ou pas), de la source (est-elle connue VIH positive ; si elle est VIH positive, est-elle sous TAR, est-ce que sa charge virale est détectable ou indétectable sous TAR); Si la sérologie VIH de la source est inconnue, est-ce qu’elle appartient à un groupe à haut risque du VIH (homo ou bi-sexuel, utilisateur de drogue intraveineuse, prostitution) ; est-ce que la personne vient d’une région haute prévalence du VIH (on considère qu’une région à haute prévalence du VIH est une prévalence supérieure à 2% dans la population générale).
ÉVALUATION DE LA PERSONNE EXPOSÉE ET DE LA SOURCE
L’évaluation de la personne exposée passe par la récolte de ses antécédents médicaux, de tous ses traitements y compris ceux ne nécessitant pas une prescription médicale (les vitamines, calcium,.. )., l’évaluation du status vaccinal notamment pour les virus des hépatites. Un bilan biologique complet comprenant une sérologie VIH, une sérologie hépatite B (antigène HbS, anticorps HbS et anticorps HbC), une sérologie hépatite C, une sérologie syphilis, la réalisation d’une PCR à la recherche de gonocoques et chlamydia (urines, frottis gorge et anus). Ces derniers peuvent être réalisés lors de l’évaluation du risque ou dans la semaine qui suit lors de la première consultation. Un bilan avec dosage des enzymes hépatiques, une mesure de la fonction rénale, un ionogramme et un test de grossesse s’il s’agit d’une femme.
Pour l’évaluation de la source, Il faut, autant que faire se peut, avoir des données fiables. Il faut s’assurer du status VIH de la source, des sérologies hépatite B, hépatite C si possible. Si la source est connue VIH positif, prend-elle un traitement anti-rétroviral ? A-t-elle une charge virale indétectable ? et si la charge virale est détectable sous traitement anti-rétroviral (échec du traitement ?), essayer d’avoir un profil de résistances.. Le plus souvent malheureusement, le status VIH de la source est inconnu. Il faut alors se baser sur le fait que la source appartient à un groupe à haut risque d’acquisition du VIH (bisexuel, homosexuel), utilisateur de drogue intraveineuse, prostitution ou source venant d’une région à haute prévalence du VIH (prévalence supérieure à 2% de la population générale – voir tableau 4). Par la suite si possible, il faut essayer de tester la source pour déterminer son status VIH ce qui est très compliqué en pratique (14-16).
DANS QUELLE SITUATION PRESCRIRE UNE PROPHYLAXIE ?
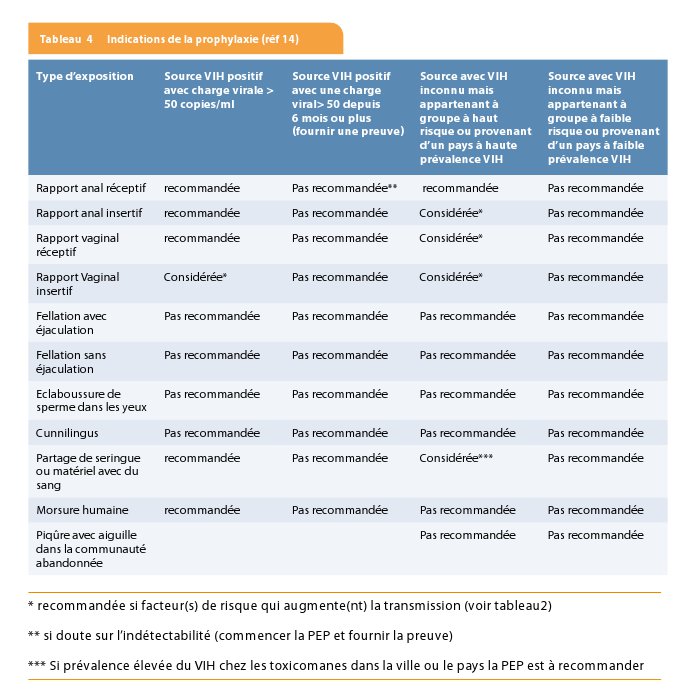
Il faut prescrire une prophylaxie dans toutes les situations où il y a un risque significatif de transmission du VIH (14-16). Une analyse du risque/bénéfice doit être réalisée devant tout individu se présentant après une exposition avec risque de transmission du VIH et la décision d’installer une prophylaxie doit se faire au cas par cas. Celle-ci doit considérer le risque que la source soit VIH positive et considérer également le risque de transmission du virus selon le type d’exposition. Tout récemment, les recommandations anglaises (14) ont fait le point sur cette prophylaxie post-exposition non professionnelle (nPEP). Les recommandations anglaises proposent les scénarios suivants (tableau 4): la prophylaxie est recommandée lorsque le risque de transmission est supérieur à 1/1000, lorsque le risque est compris entre 1/1000 et 1/10 000, le comité recommande de considérer une prophylaxie. Dans ce cas, le comité propose que la prophylaxie ne soit prescrite que s’il y a des risques additionnels qui augmentent le risque de transmission du virus. Lorsque le risque de transmission est inférieur à 1/10 000, la prophylaxie n’est pas recommandée (14).
Deux grandes situations vont dans ce cas se présenter :
• Premier scénario : on se trouve en face d’un status VIH inconnu de la source. Dans ce scénario, il faut réaliser une recherche pro-active pour pouvoir établir ce status. Il a été clairement démontré que si on procédait à une recherche pro-active, on arrivait à tester la source dans 43.4% des cas et on pouvait éviter ou arrêter une prophylaxie post-exposition dans 40.7% des cas ce qui pouvait conduire à une réduction d’au moins 31% des coûts (14,17). cette stratégie de recherche pro-active, permet l’arrêt de la prophylaxie évitant des effets secondaires inutiles et permet également de tester des populations à haut risque (18). Il est clair que si l’on n’arrive pas à établir le status de la source, si celle-ci provient d’une région à haute prévalence du VIH (prévalence supérieure à 2%), dans ce cas, la prophylaxie post-exposition sera recommandée après un rapport anal réceptif. A envisager lors d’un rapport anal insertif, vaginal réceptif et vaginal insertif. Celle-ci n’est pas du tout recommandée lors des fellations avec ou sans éjaculation.
• Deuxième scénario : la source est connue pour être VIH positive. Il est clair que dans ce contexte, nous devons déterminer le plus rapidement possible si le patient a une charge virale indétectable ou détectable, avoir son profil de résistance et les antécédents historiques du traitement. Si la source a une charge virale indétectable depuis plus de six mois, c’est-à-dire une charge virale < 50 copies, une prophylaxie n’est pas recommandée. Si l’on n’a pas de preuve formelle que cette charge virale est indétectable depuis plus six mois, alors dans le cas de rapport anal réceptif, la prophylaxie sera mise en route. Si on obtient plus tard l’information que la charge virale est indétectable depuis plus de six mois, on peut arrêter la prophylaxie. Lorsque la charge virale du patient source est détectable, la prophylaxie est recommandée en cas de rapport sexuel anal réceptif, anal insertif, vaginal réceptif et vaginal insertif. La prophylaxie n’est pas recommandée en cas de fellation avec ou sans éjaculation. Le risque estimé après fellation est inférieur à 1/10 000 (14). Une étude de cohorte a démontré qu’après environ 19000 contacts oraux génitaux avec un patient connu VIH positif, il n’y a eu aucune séroconversion (19). Il y a eu quelques rares cas de transmission du VIH en cas de rapport oral (20). La prophylaxie peut, dans certaines circonstances, être discutée si on se retrouve en présence d’une charge virale extrêmement élevée et des traumatismes ou ulcérations oro-pharyngés.
Quelques commentaires de situation à risque d’exposition
1 Le rapport anal réceptif.
Une étude de cohorte australienne estime que la probabilité de transmission du VIH chez les hommes qui ont un rapport sexuel avec les hommes (HSH), lors d’un rapport non protégé anal réceptif, est de 1.43% avec éjaculation ou de 0.65% sans éjaculation. Le risque via un rapport insertif était de 0.62% chez les hommes sans circoncision et de 0.11% chez les hommes avec circoncision (21). Une méta-analyse a démontré que le risque par acte lors des rapports anaux réceptifs non protégés était de 1.4% sans différence entre les hétérosexuels et les homosexuels (22). Cette méta-analyse a également démontré qu’il y avait une grande variabilité dans le risque lors des rapports anaux et qu’il fallait tenir compte des facteurs qui augmentent le risque de transmission même chez les partenaires sous traitement anti-rétroviral (cfr tableau 2).
2 Accident avec des aiguilles abandonnées.
En général, la prophylaxie n’est pas recommandée après un accident d’exposition avec une aiguille abandonnée surtout quand il est difficile de déterminer si l’aiguille a été utilisée et pour quelle raison, le status VIH de la source et l’intervalle entre l’utilisation et l’accident. On sait que lorsque l’aiguille est sèche, le VIH n’est plus viable après quelques heures. Dans les études où une petite quantité de sang était dans la seringue, on sait que le VIH n’était plus viable après 24 heures (23). Un des paramètres qui peut jouer est la prévalence du VIH chez les toxicomanes dans la ville ou le pays . Si la prévalence du VIH est très faible dans cette population de toxicomanes, cela renforce l’idée de ne pas prescrire une prophylaxie post-exposition.
3 Les morsures humaines.
En général, la prophylaxie n’est pas recommandée après une morsure car le risque de transmission n’est pas connu et -est probablement extrêmement faible. Dans les quelques cas rapportés de possible transmission après une morsure, la personne qui avait mordu était à un stade avancé du VIH,(SIDA) avait une charge virale élevée et il y avait beaucoup de sang dans la cavité oro-pharyngée suite au traumatisme et la plaie de la morsure était profonde (24-25). Dans ces circonstances ou si la personne source provient d’une région à haute prévalence VIH une prophylaxie doit être discutée avec le spécialiste.
4 Le viol.
Le risque de transmission du VIH est fortement augmenté en cas de traumatisme lors d’un rapport sexuel qu’il soit anal ou vaginal. Il faut donc recommander une prophylaxie dans ces situations, particulièrement si le patient vient d’une zone à haute prévalence pour le VIH ou appartient à un groupe à risque de VIH ou est VIH positif connu. Si l’agresseur vient d’un groupe faiblement à risque, les risques et bénéfices sont discutés avec le patient.
5 Les travailleurs du sexe.
Historiquement, en Europe de l’Ouest, la prévalence du VIH chez les travailleurs du sexe féminin est toujours restée basse, inférieure à 1%. Cette prévalence reste également faible en Europe Centrale où elle est d’environ 1 – 2% mais est très élevée en Europe de l’Est où elle varie entre 2.5 et 8% (26). La prévalence est également très augmentée chez les travailleurs du sexe qui s’injectent les drogues. La prévalence du VIH chez les travailleurs du sexe masculin est de l’ordre de 14% (27). Il est évident que lors d’un rapport non protégé avec un travailleur du sexe, il doit faire l’objet d’une évaluation essayer d’obtenir le plus rapidement possible le status sérologique du travailleur du sexe ; si celui-ci est négatif, il ne faut pas de prophylaxie. Si par contre, la personne a une sérologie VIH positive, si la charge virale de cette personne est prouvée indétectable depuis plus de six mois, nous ne recommandons pas de prophylaxie mais, si cette charge virale est détectable, la prophylaxie sera recommandée pour un rapport anal réceptif, anal insertif, vaginal réceptif, vaginal insertif. S’il est impossible d’obtenir le status sérologique de la personne source mais qu’elle provient d’une région où la prévalence est supérieure à 2% ou qu’il s’agit de prostitués non encadrées, venant des zones de l’Europe de l’est ou de l’Afrique subsaharienne ou qu’ils s’injectent des drogues intraveineuses, la prophylaxie est recommandée
DÉLAI D’INITIATION DE LA PROPHYLAXIE
La prophylaxie post-exposition doit être initiée le plus rapidement possible après l’accident d’exposition, préférablement dans les 24 heures, mais on peut considérer une prophylaxie jusque 72 heures. Après 72 heures, la prophylaxie n’est pas recommandée (14-16). Dans une étude récente chez les singes rhésus, le traitement anti-rétroviral a été initié au J3 après une inoculation intra-rectale du virus de l’immunodéficience symienne. Ceci a permis de bloquer l’émergence du RNA-viral et du DNA-proviral dans le sang périphérique, les ganglions et le tractus gastro-intestinal. Après arrêt du traitement anti-rétroviral 24 heures plus tard, tous les animaux ont montré un rebond viral (28). Cette notion supporte un maximum de 72 heures de délai pour débuter la prophylaxie post-exposition. Tous les efforts doivent être donc faits pour pouvoir initier cette prophylaxie le plus rapidement possible après l’exposition et ce avant 72 heures.
DURÉE DE LA PROPHYLAXIE POST-EXPOSITION
La durée de la prophylaxie post-exposition doit être de 28 jours. La durée optimale de la prophylaxie reste inconnue mais des études animales et des études cas-contrôle chez des professionnels suggèrent que l’efficacité de la PEP diminue lorsqu’elle est utilisée moins de 28 jours. On sait également que si le patient prend un risque 48 heures avant l’arrêt de sa prophylaxie, celle-ci devra être continuée pour au moins 72 heures. Durant la prophylaxie, si le test de la source réalisé sur un test sanguin de 4ème génération est négatif, la PEP peut être arrêtée.
FACTEURS INFLUENÇANT L’EFFICACITÉ DE LA PROPHYLAXIE POST-EXPOSITION
La nPEP n’est pas considérée comme efficace à 100%. On a pu démontrer des cas d’acquisition du VIH malgré la prescription d’une prophylaxie. Les facteurs qui influencent l’échec sont le délai d’initiation (> 72h), la contamination par un virus hautement résistant, la variabilité de la pénétration des antirétroviraux au niveau tissulaires particulièrement dans le tissu génital, la mauvaise ou la non observance, la durée courte de la prophylaxie (<28 jours), le mauvais choix de la prophylaxie et la multiplication des risques d’exposition au VIH.
QUELLES MÉDICATIONS UTILISER POUR LA PROPHYLAXIE POST-EXPOSITION ?
La plupart des directives récentes (14,16) recommandent 2 inhibiteurs nucléosidiques de la transcriptase inverse (NRTI) + soit un inhibiteur de l’intégrase (INI) soit un inhibiteur de protéase boosté par le Ritonavir (IP/r). Le premier choix des recommandations anglaises et américaines associe le Truvada à l’Isentress (Raltégravir) ou le Tivicay(Dolutegravir). Le tableau 6 résume les différentes possibilités. Si la source a un historique de traitement avec des échecs virologiques, la prophylaxie post-exposition devra tenir compte des résistances éventuelles associées à ces échecs de traitement. La sélection des différentes molécules doit tenir compte des différents risques de toxicité et de la tolérance du traitement. Par exemple, pour les NRTI, l’utilisation de l’Abacavir n’est pas recommandée, une hypersensibilité a été rapportée jusqu’à 8% chez des patients traités avec ce médicament. Le risque n’a cependant pas été démontré chez les patients VIH négatifs. En situation urgente on ne peut déterminer le HLAB57*O1 qui est associer à ce mécanisme d’hypersensibilité. Les inhibiteurs non nucléosidiques de la transcriptase inverse (NNRTI) ne sont pas recommandés dans le traitement prophylactique, la Nevirapine peut entraîner une hépatotoxicité de grade 3 à 4 dans 10% des cas.Des lésions de toxicité hépatique sévères ayant nécessité une transplantation ou ayant entrainé un décès ont été rapportés (14-16). L’Efavirenz est, quant à elle, associée à des troubles du système nerveux central, et donc peu indiquée dans les conditions de stress provoquées par les accidents d’exposition au VIH. Les inhibiteurs de protéase boostés par le Ritonavir posent le problème des interactions médicamenteuses et d’ une moins bonne tolérance digestive : nausées, vomissements et parfois des diarrhées sont régulièrement rapportés. Ces symptômes qui peuvent être améliorés en temps normal par des anti-diarrhéiques et des antiémétiques posent le problème des interactions par exemple pour la Domperidone. Le Kaletra, qui est une association de Lopinavir et Ritonavir, a été l’inhibiteur de protéase le plus indiqué dans les nombreuses recommandations mais sa tolérance est moins bonne que celle du Darunavir-Ritonavir ou de l’Atazanavir-Ritonavir, qui ont en plus l’avantage d’être pris 1x/j. Du fait de possible effets secondaires, des interactions médicamenteuses, il est important de choisir un schéma toléré par le patient, nécessitant peu d’adaptations médicamenteuses et peu de surveillance biologique d’où la prescription à l’heure actuelle d’un schéma de préférence qui est le Truvada associé au Raltegravir (tableau 5). Les schémas utilisés dans la plupart des centres belges sont résumés dans le tableau 6.

PARTICULARITÉS BELGES
En Belgique, le remboursement de la prophylaxie post-exposition fait l’objet d’une convention avec l’Institut National d’Assurance et de Maladie et d’Invalidité. C’est un arrêté royal de juin 2009 qui crée ce fond spécial de l’INAMI qui rembourse uniquement le traitement prophylactique s’il est prescrit par un hôpital où il existe un centre de référence SIDA, si l’indication respecte les recommandations nationales de prophylaxie post-exposition, s’il n’y a pas de prise en charge par une autre assurance et si toutes les autres modalités administratives sont respectées.
QUI EST COUVERT PAR LA CONVENTION INAMI ?
Toute personne quelle que soit sa nationalité, son statut d’assurabilité ou de séjour, les professionnels de la santé non couverts par une assurance ad hoc, médecin généraliste, gynécologue de ville, infirmière indépendante, dentiste et autres professionnels non couverts par une assurance ad hoc ou l’assurance de leur employeur sont couverts par la convention. Cette convention octroie une somme de 650€ par traitement. Ce montant ne couvre pas le coût du traitement recommandé par les recommandations internationales ce qui nous oblige à prescrire des schémas plus anciens et moins bien tolérés. Ces schémas ne sont plus recommandés par les recommandations internationales. Le fait que ces schémas sont moins bien supportés par les patients, l’adhérence au traitement est moins bonne. Si on veut améliorer cette compliance, il est nécessaire non seulement d’actualiser les recommandations belges (2009), cela permettrait de restreindre les indications et d’autre part revoir les schémas de traitement avec des anciennes molécules remplacées par des nouvelles mieux tolérées mais plus chères. Ces schémas ne nécessitent pas une surveillance clinique et biologique rapprochée. On sait qu’actuellement le follow-up des patients bénéficiant d’une prophylaxie post-exposition complète n’est pas très élevé et oscille entre 30 et 50%.
L’ADHÉRENCE
L’adhérence est fondamentale pour pouvoir assurer une efficacité du traitement. On sait que les patients adhérents et qui complètent un traitement complet de 28 jours, que ce soit lors des prophylaxies post-exposition professionnelle ou non professionnelle est faible. Plusieurs facteurs peuvent influencer cette faible adhérence: le nombre de comprimés, les effets secondaires du traitement, le stress psychologique. Après 2 ou 3 jours, lorsque le stress est un peu retombé, les personnes réévaluent le risque avec parfois plus d’objectivité et le traitement est alors arrêté. Cette adhérence est moins bonne encore chez les patients victimes d’agression sexuelle. Globalement on estime que l’adhérence au cours du traitement oscille autour de 67% (29). Cette adhérence est beaucoup plus élevée chez les patients qui ont été suivis et conseillés au cours de leur traitement. Un support psycho-social est indispensable pour accompagner les patients au cours de la prophylaxie post-exposition.
LE SUIVI DES PATIENTS APRÈS PRESCRIPTION DE LA PROPHYLAXIE
1 Le suivi clinique.
Les patients doivent être revus à une consultation 48 à 72 heures plus tard pour évaluer la prise de leur prophylaxie, la tolérance de cette prophylaxie, réévaluer le risque de transmission du VIH et la discussion sur les différentes méthodes de prévention. A cette occasion, si le patient ne supporte pas sa prophylaxie, on peut la modifier. C’est également l’occasion de réévaluer le risque ; si celui-ci est faible, la prophylaxie peut être arrêtée ou si le patient apporte des éléments montrant que la source est VIH négative ou si la source est VIH positive avec une charge virale contrôlée depuis plus de six mois, le traitement peut être arrêté.
2 Le suivi biologique.
Il y a une prise de sang de base qui doit être réalisée, celle-ci comprend un hémogramme, une fonction rénale, un ionogramme, des enzymes hépatiques, les sérologies hépatite B – hépatite C ainsi que la sérologie HIV-1-et 2. A cette occasion, il faut rechercher les autres IST en fonction de la situation clinique. Ce screening peut être répété à 12 semaines post-exposition. Les études observationnelles ont montré que 16.5% des patients bénéficiant d’une prophylaxie post-exposition ont une infection sexuellement transmissible au screening de base et 4% supplémentaire auront une infection diagnostiquée deux semaines plus tard (30). Pour le chlamydia, le gonocoque, une PCR dans les urines, sur le frottis rectal et frottis de gorge doit être réalisée. Si la PCR gonocoque s’avère positive, un traitement à base de Ceftriaxone 250 mg en IM et Azythromycine 2 gr en une dose sera prescrit, si la PCR Chlamydia est positive, la Doxycycline 100 mg 2x pendant une semaine ou Azithromycine 2 gr en une seule dose sera administré. Pour l’hépatite B, une sérologie de base doit être réalisée. Souvent la sérologie du patient source est inconnue. On peut attendre les résultats de la sérologie avant de débuter une vaccination. Si le patient source est atteint d’une hépatite B active ou à risque d’hépatite B, une dose de gammaglobuline peut être administrée lors de cette consultation de suivi et poursuivre la vaccination. Pour l’hépatite C, il n’existe pas de prévention, seul un suivi des enzymes hépatiques et la sérologie doit être réalisé ; si celles-ci se perturbent, une PCR hépatite C doit être demandée. Il faut se rappeler que le risque de transmission sexuelle de l’hépatite C est extrêmement faible. Après 2 semaines, le patient sera revu pour réaliser un suivi biologique (fonction rénale et hépatique) en fonction de la prophylaxie administrée et un nouveau bilan des IST si symptômes. Les nouveaux schémas de prophylaxie comprenant le Truvada et Raltegravir sont peu toxiques et ne nécessitent probablement pas de contrôle biologique à 14 jours sauf si les éléments biologiques de base sont perturbés ou si le patient présente des symptômes pouvant évoquer une toxicité médicamenteuse, le Raltegravir, peut donner des douleurs musculaires évoquant une myosite. A 8 et à 12 semaines post-exposition, un contrôle biologique va comporter une sérologie VIH, une sérologie hépatite B et un bilan biologique minimal avec une fonction rénale, des enzymes hépatiques et éventuellement un contrôle des autres paramètres si ceux-ci avaient été perturbés lors du suivi. (Voir tableau 7).
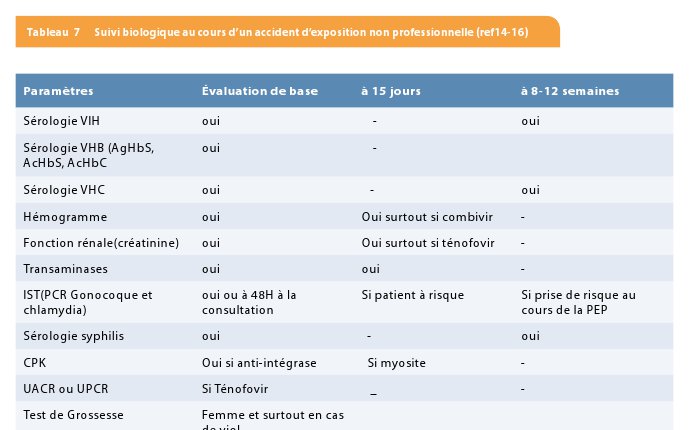
3 Un screening pour la sérologie VIH à 8 et 12 semaines est actuellement recommandé car le test à 12 semaines est souvent peu réalisé par les patients (de l’ordre de 30 à 67%). Le fait de faire un test à 8 semaines pourrait améliorer ce chiffre. Il doit être fait par un test sanguin de 4ème génération. Si le patient, au cours de son suivi, présente des symptômes grippaux ou type rash cutané, il est impératif que le patient retourne en consultation pour discuter d’un nouveau test afin d’exclure une séroconversion VIH (faire PCR VIH si possible). Si celle-ci survient pendant que le patient prend sa prophylaxie, il faudra la poursuivre et faire un bilan biologique comprenant les CD4, la charge virale y compris le génotype afin de voir si le patient a été contaminé par un virus résistant auquel cas le schéma de traitement devra être modifié.
QUE FAIRE EN CAS D’ARRÊT OU LORSQUE LE PATIENT OUBLIÉ DES DOSES ?
Il n’y a pas de recommandation claire sur la question. Cependant, on peut s’aider de la pharmacocinétique des différentes molécules utilisées au moment de la prophylaxie. On sait que le Raltegravir a une courte demi-vie de l’ordre de 9 heures et on sait qu’il sera sub-thérapeutique après 18 heures si on a raté une dose et indétectable après 45 heures. Le Truvada a une demi-vie plasmatique de 12 à 18 heures mais parfois plus longue de l’ordre de 31 à 37 heures pour le Ténofovir et l’Emtricitabine respectivement. En intra-cellulaire, la demi-vie médiane est de l’ordre de 150 à 160 heures et 39 heures respectivement pour le Ténofovir et l’Emtricitabine (31). La gestion des arrêts peut être résumée de la façon suivante (tableau 8): Si c’est un oubli endéans les 24 heures, on reprend la dose immédiatement et on continue sa prophylaxie. Si le temps d’oubli est compris entre 24 et 48 heures, on continue sa prophylaxie post-exposition et si on a oublié plus de 48 heures, on préfère arrêter cette prophylaxie.

QUE FAIRE SI LE PATIENT PREND UN NOUVEAU RISQUE AU COURS DE SA PROPHYLAXIE ?
Si le patient prend un nouveau risque au début de sa prophylaxie, il doit continuer sa prophylaxie car on sait que la prophylaxie pré-exposition reste efficace. Si, par contre, le patient prend un haut risque les deux derniers jours de sa prophylaxie, il faut poursuivre cette prophylaxie pendant 48 à 72 heures (32).
PERSPECTIVES
La prophylaxie post-exposition après un accident non professionnel est un élément faisant partie d’un ensemble de mesure de prévention pour le VIH. Ces mesures de prévention peuvent intervenir à différents moments en pré- pendant et post exposition comme rappelés dans l’introduction. Il est important de rappeler toutes les méthodes de prévention et notamment encourager le port du préservatif pendant les rapports sexuels. Certains patients à haut risque de transmission qui ont bénéficié d’une prophylaxie post-exposition peuvent revenir plusieurs fois. Ces patients sont, malgré tous nos efforts, à très haut risque de contamination. Les hollandais ont montré que chez des patients homosexuels ayant bénéficié d’une prophylaxie post-exposition, il y a une incidence accrue d’acquérir le VIH qui était de l’ordre de 6.4/100 patients/année (33), par comparaison à ceux qui n’avaient pas bénéficié de PEP qui était de l’ordre de 1.6/patient/année. Ces données ont été confirmées par l’étude Prood en Angleterre qui a montré que malgré l’usage répété de la prophylaxie post-exposition, les patients à haut risque avaient un taux élevé de séroconversion (34). Ces patients à haut risque doivent pouvoir bénéficier d’une prophylaxie pré-exposition(PrEP) si celle-ci est accessible dans leur pays. La discussion autour du coût de la PEP est important, il faut mettre en balance le coût du traitement avec l’efficacité et surtout le bénéfice lié au fait qu’on évite des nouvelles contaminations. Des schémas avec des nouvelles molécules telle que le Truvada et le Raltegravir qui coûtent nettement plus chers que le prix accordé par l’INAMI et le prix d’un traitement d’un patient VIH durant toute une vie. Par exemple, le coût d’une prophylaxie post-exposition à base de Truvada, Raltegravir en Belgique est de l’ordre de 1000€ et le coût du traitement d’un patient VIH positif oscille entre 450 000 et 500 000€ sur toute la durée de la vie.
Remerciements
Dr Anne Vincent pour la relecture et correction.
Correspondance
Pr. Jean-Cyr Yombi
Cliniques universitaires Saint-Luc
Service de Médecine interne
Pathologies infectieuses et tropicales
Centre de Référence SIDA
jean.yombi@uclouvain.be
Références
1. ONUSIDA. Fiche d’information 2015 statistiques mondial du VIH. Disponible à : http://www.unaids.org/sites/default/files/media_asset/20150901_FactSheet_2015_fr.pdf. Consulté le 21 mars 2016.
2. Sasse, A., Deblonde, J. et Van Beckhoven, D. (2015) Epidémiolgie du Sida et de l’infection à VIH en Belgique. Sante publique et surveillance. Belgique. Disponible à : https://epidemio.wiv-isp.be/ID/reports/Rapport_VIH-SIDA_2014.pdf
3. Cohen MS, Hellmann N, Levy JA, DeCock K, Lange J. The spread, treatment, and prevention of HIV-1: evolution of a global pandemic. J Clin Invest 2008 Apr;118(4):1244-54. doi: 10.1172/JCI34706.
ouvrir dans Pubmed
4. Pinto LA, Landay AL, Berzofsky JA, et al. Immune response to human immunodeficiency virus (HIV) in healthcare workers occupationally exposed to HIV-con- taminated blood. Am J Med 1997; 102(5B): 21–24.
ouvrir dans Pubmed
5. Spira AI, Marx PA, Patterson BK, et al. Cellular targets of infection and route of viral dissemination after an intravaginal inoculation of simian immunodeficiency virus into rhesus macaques. J Exp Med 1996; 183(1): 215–225.
ouvrir dans Pubmed
6. Bourry O, Mannioui A, Sellier P, et al. Effect of a short- term HAART on SIV load in macaque tissues is dependent on time of initiation and antiviral diffusion. Retrovirology 2010; 7: 78.
ouvrir dans Pubmed
7. Tsai CC, Emau P, Follis KE, et al. Effectiveness of post- inoculation (R)-9-(2-phosphonylmethoxypropyl) adenine treatment for prevention of persistent simian immuno- deficiency virus SIVmne infection depends critically on timing of initiation and duration of treatment. J Virol 1998; 72(5): 4265–4273.
ouvrir dans Pubmed
8. Otten RA, Smith DK, Adams DR, et al. Efficacy of post- exposure prophylaxis after intravaginal exposure of pig- tailed macaques to a human-derived retrovirus (human immunodeficiency virus type 2). J Virol 2000; 74(20): 9771–9775.
ouvrir dans Pubmed
9. Garcia-Lerma JG, Cong ME, Mitchell J, et al. Intermittent prophylaxis with oral truvada protects macaques from rectal SHIV infection. Sci Transl Med 2010; 2(14): 14ra4.
ouvrir dans Pubmed
10. Cardo DM, Culver DH, Ciesielski CA, et al. A case-con- trol study of HIV seroconversion in health care workers after percutaneous exposure. Centers for Disease Control and Prevention Needlestick Surveillance Group. New Engl J Med 1997; 337(21): 1485–1490.
ouvrir dans Pubmed
11. Sperling RS, Shapiro DE, Coombs RW, et al. Maternal viral load, zidovudine treatment, and the risk of trans- mission of human immunodeficiency virus type 1 from mother to infant. Pediatric AIDS Clinical Trials Group Protocol 076 Study Group. New Engl J Med 1996; 335(22): 1621–1629.
ouvrir dans Pubmed
12. Wade NA, Birkhead GS, Warren BL, et al. Abbreviated regimens of zidovudine prophylaxis and perinatal trans- mission of the human immunodeficiency virus. New Engl J Med 1998; 339(20): 1409–1414.
ouvrir dans Pubmed
13.Schechter M, do Lago RF, Mendelsohn AB, et al. Behavioral impact, acceptability, and HIV incidence among homosexual men with access to postexposure chemoprophylaxis for HIV. J Acquir Immune Defic Syndr: JAIDS 2004; 35(5): 519–525.
ouvrir dans Pubmed
14. Cresswell F, Waters L, Briggs E, Fox J, Harbottle J, HaCouperwkins D, et al. UK guideline for the use of HIV Post-Exposure Prophylaxis Following Sexual Exposure, 2015. Int J STD AIDS 2016 Apr 19. pii: 0956462416641813.
ouvrir dans Pubmed
15. Sultan B, Benn P, Waters L. Current perspectives in HIV post-exposure prophylaxis HIV AIDS (Auckl). 2014 Oct 24;6:147-58.
ouvrir dans Pubmed
16. Updated guidelines for antiretroviral postexposure prophylaxis after sexual, injection drug use, or other nonoccupational exposure to HIV—United States, 2016. http://www.cdc.gov/hiv/pdf/programresources/cdc-hiv-npep-guidelines.pdf
17. Greub G, Maziero A, Burgisser P, et al. Spare post-expo- sure prophylaxis with round-the-clock HIV testing of the source patient. AIDS 2001; 15(18): 2451-2452.
18. Greub G, Gallant S, Zurn P, et al. Spare non-occupational HIV post-exposure prophylaxis by active contacting and testing of the source person. AIDS 2002; 16(8): 1171–1176.
19. del Romero J, Marincovich B, Castilla J, et al. Evaluating the risk of HIV transmission through unprotected oro- genital sex. AIDS 2002; 16(9): 1296–1297.
ouvrir dans Pubmed
20. Vittinghoff E, Douglas J, Judson F, et al. Per-contact risk of human immunodeficiency virus transmission between male sexual partners. Am J Epidemiol 1999; 150(3): 306–311.
ouvrir dans Pubmed
21. Jin F, Jansson J, Law M, et al. Per contact probability of HIV transmission in homosexual men in Sydney in the era of HAART. AIDS 2010;24(6):907-913.
ouvrir dans Pubmed
22. Baggaley RF, White RG, Boily MC. HIV transmission risk through anal intercourse: systematic review, meta-analysis and implications for HIV prevention. Int J Epidemiol 2010;39(4):1048–1063.
ouvrir dans Pubmed
23 Abdala N, Stephens PC, Griffith BP, et al. Survival of HIV-1 in syringes. J Acquir Immune Defic Syndr Hum Retrovirol 1999; 20(1): 73-80.
ouvrir dans Pubmed
24. Richman KM and Rickman LS. The potential for transmission of human immunodeficiency virus through human bites. J Acquir Immune Defic Syndr 1993; 6(4): 402–406.
ouvrir dans Pubmed
25. Wahn V, Kramer HH, Voit T, et al. Horizontal transmission of HIV infection between two siblings. Lancet 1986; 2(8508): 694.
ouvrir dans Pubmed
26. Platt L, Jolley E, Rhodes T, et al. Factors mediating HIV risk among female sex workers in Europe: a systematic review and ecological analysis. BMJ Open 2013; 3(7): e002836.
27. UNAIDS. The GAP report 2014. http://www.unaids.org/ en/resources/campaigns/2014/2014gapreport/gapreport (accessed 19 March 2016).
28. James B, Whitney AIH, Sanisetty Srisowmya, Penaloza- MacMaster Pablo, et al. Rapid seeding of the viral reservoir prior to SIV viraemia in rhesus monkeys. Nature 2014; 000: 1-4.
29. Chacko L, Ford N, Sbaiti M, Siddiqui R. Adherence to HIV post-exposure prophylaxis in victims of sexual assault: a systematic review and meta-analysis. Sex Transm Infect 2012;88(5):335–341.
ouvrir dans Pubmed
30. de Vrieze NHN, van Rooijen MS, van de Loeff MS, et al. Additional gonorrhea and Chlamydia Infections found with rapid follow-up screening in men who have sex with men with an indication for HIV postexposure prophylaxis. Sex Transm Dis 2014; 41(8): 515–517.
31. Jackson A, Moyle G, Watson V,et al. Tenofovir, emtricitabine intracellular and plasma, and efavirenz plasma concentration decay following drug intake cessation: implications for HIV treatment and prevention. J Acquir Immune Defic Syndr 2013; 62(3): 275–281.
ouvrir dans Pubmed
32. Molina JMCC, Charreau I, Meyer L, et al. On demand preexposure prophylaxis in man at high risk for HIV-1 infection. N Engl J Med 2015; 373(23): 2237-2246.
ouvrir dans Pubmed
33. Heuker J, Sonder GJ, Stolte I, Geskus R, van den Hoek A. High HIV incidence among MSM prescribed postexposure prophylaxis, 2000-2009: indications for ongoing sexual risk behaviour. AIDS 2012 Feb 20;26(4):505-12.
ouvrir dans Pubmed