DÉFINITION
Pendant de nombreuses années, le diabète gestationnel a été défini par l’ADA (American Diabetes Association) et par l’OMS (Organisation Mondiale de la Santé) comme tout degré d’intolérance glucidique ayant débuté ou ayant été mis en évidence pour la première fois durant la grossesse (1), indépendamment du traitement nécessaire ou de l’évolution en post partum. Cette définition englobait en fait deux entités différentes :
- un diabète patent, habituellement de type 2, existant avant la grossesse mais mis en évidence seulement à ce moment et persistant après l’accouchement ;
- une détérioration transitoire de la tolérance glucidique apparaissant durant la grossesse, généralement dans la seconde moitié et se résolvant, au moins temporairement, durant la période du post partum (2).
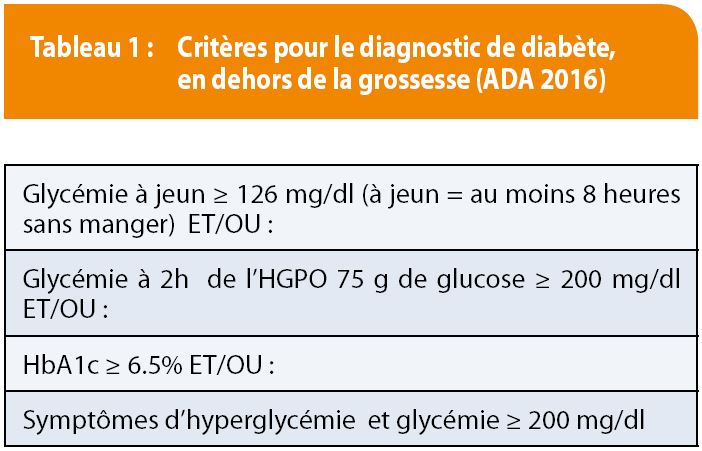
Au vu de l’épidémie d’obésité et de diabète, les femmes en âge de procréer ayant un diabète de type 2 non diagnostiqué au moment de la grossesse sont de plus en plus nombreuses. C’est pourquoi l’ADA recommande de dépister les femmes à risque de diabète de type 2 à la première visite prénatale, en utilisant les critères habituels de diabète en dehors de la grossesse (tableau 1). Les femmes avec un diabète à la première visite sont considérées comme ayant un diabète de type 2. Le diabète gestationnel est quant’ à lui diagnostiqué durant le deuxième ou le troisième trimestre de la grossesse (3). La place du dépistage précoce du diabète gestationnel reste débattue et la plupart des associations (3,4) estiment qu’il n’existe actuellement pas de preuve suffisante du bénéfice à dépister un diabète gestationnel avant 24 semaines chez des femmes enceintes asymptomatiques.
ÉPIDÉMIOLOGIE
La prévalence du diabète gestationnel est difficile à estimer. Elle est très variable dans le monde et parfois même au sein d’un même pays en fonction de l’origine ethnique des habitants. De plus, la prévalence dépend de la méthode de dépistage (universel ou ciblé), des critères diagnostiques utilisés et de la prévalence du diabète de type 2 dans chaque pays.
La tendance actuelle est à l’élévation de la prévalence dans la plupart des groupes ethniques étudiés (5). Un âge maternel avancé, l’épidémie actuelle d’obésité et de diabète, la sédentarité et l’adoption du mode de vie moderne dans les pays en voie de développement contribuent à augmenter la prévalence du diabète gestationnel (6).
Pour prendre l’exemple concret de l’Europe, on observe de grandes variations en fonction des pays. Par exemple, en Norvège, la prévalence médiane du diabète gestationnel est de 22,3% (avec un intervalle allant de 13 à 31,5% selon l’utilisation des critères WHO (World Health Association) 1999 et des critères IADPSG (International Association of Diabetes and Pregnancy Study Group), respectivement) alors qu’en Irlande, la prévalence est seulement de 1.8% (avec les critères de NICE (National Institute for Health and Care Excellence) (7). En Belgique, la prévalence est estimée à 5% environ et en France à 11,6% (8).
La prévalence en Belgique est très probablement sous-estimée puisqu’elle se base essentiellement sur une étude (9) réalisée dans un centre belge (Leuven) où la prévalence du diabète gestationnel est faible.
D’autres données belges, par exemple au centre hospitalier de Mouscron (10) montrent une prévalence du diabète gestationnel de 8% avec les critères de Carpenter et Coustan et de 23% avec les critères IADPSG, utilisés dans leur centre dès 2011.
FACTEURS DE RISQUE
Parmi les facteurs de risque classiques, ceux qui ont le plus d’impact sont les antécédents personnels de diabète gestationnel, l’âge maternel et l’obésité. L’origine ethnique et les antécédents familiaux de diabète de type 2 ont une influence significative mais plus modérée. Plusieurs facteurs non classiques ont été caractérisés au cours de ces dernières années, qu’ils soient physiologiques (faible poids de naissance, petite taille maternelle) ou pathologiques (insulinorésistance, syndrome des ovaires polykystiques). La multiplicité des facteurs de risque et de leurs interactions rend complexe la prédiction du risque individuel (5).
PHYSIOPATHOLOGIE
La grossesse est caractérisée par une augmentation de la résistance à l’insuline, qui est corrélée avec l’avancée de l’âge gestationnel. L’unité foeto-placentaire est à l’origine de cette insulinorésistance et, bien que les mécanismes ne soient pas complètement connus, la production placentaire de TNF-α (Tumor Necrosis Factor-α), de l’hormone lactogène placentaire, d’hormone de croissance et l’augmentation des taux sanguins de cortisol et de progestérone sont des facteurs contributifs clairement démontrés (11). Pour contrecarrer cette augmentation de la résistance à l’insuline et maintenir une normoglycémie chez la mère, la production d’insuline par les cellules β se majore également.
Les changements résultants dans le métabolisme des hydrates de carbone et des lipides chez la mère assurent qu’une nutrition adéquate arrive au fœtus. La délivrance de glucose au fœtus, médiée par le placenta, est facilitée par une augmentation de 30% de la production endogène basale maternelle de glucose hépatique (11). Les femmes qui sont incapables de s’adapter suffisamment à ces changements physiologiques induits par la grossesse développent un diabète gestationnel.
La physiopathologie du diabète gestationnel et du diabète de type 2 sont similaires, de sorte que le diabète gestationnel pourrait être le reflet d’un stade précoce de diabète de type 2 survenant dans le contexte de la grossesse. Cela explique donc que les patientes ayant présenté un diabète gestationnel sont exposées à un risque accru de développer un diabète de type 2 par la suite (11). La majorité des femmes développant un diabète gestationnel présentent aussi un déficit relatif de la fonction β, provoquant une hyperglycémie post-prandiale au début et une hyperglycémie à jeun par la suite. Des études longitudinales (12,13) montrent que la sensibilité à l’insuline est diminuée avant la dysfonction des cellules β. Si les patientes présentent déjà une insulinorésistance avant la conception, le processus est accéléré.
Les taux de glucose sanguins élevés fournissent le substrat pour une croissance fœtale majorée qui est en partie stimulée par l’hyperinsulinisme fœtal. Les taux élevés d’acides aminés et d’acides gras non saturés contribue aussi à la physiopathologie du diabète gestationnel (11).
HISTORIQUE, L'APPORT DE O'SULLIVAN
L’augmentation du risque obstétrical associée au diabète découvert durant la grossesse a été décrite pour la première fois en 1954, durant la période de l’après–guerre, par le Dr J.P.Hoet dans un article écrit en Français puis traduit en Anglais par le Dr F. D. Lukens. Peu de temps après, l’institut national de la santé aux USA a développé un programme sur l’épidémiologie des maladies chroniques et un centre de recherche a été établi à Boston. C’est à cette époque que le Dr John B. O’Sullivan, Irlandais diplômé du collège royal des médecins et chirurgiens, a rejoint ce programme. A l’époque, il existait une grande controverse sur les critères de diagnostic du diabète gestationnel (14).
O’Sullivan a réalisé des épreuves d’hyperglycémie orale (HGPO) avec 100g de glucose chez 752 femmes enceintes, aux 2ème et 3ème trimestres de grossesse et a publié les premiers critères pour établir les limites de la normalité glycémique durant la grossesse. Ces critères diffèrent de ceux de la population générale (limite supérieure plus haute à 2 et 3 heures du fait qu’il existe physiologiquement une tolérance glucidique diminuée chez les femmes enceintes par rapport à la population normale) (15). Ces critères de O’Sullivan ont représenté le standard de détection du diabète gestationnel pour les 40 années suivantes.
Ensuite, O’Sullivan et Mahan, en se basant sur ces mêmes critères pour diagnostiquer les patientes atteintes de diabète gestationnel, ont étudié l’effet de l’insulinothérapie chez ces patientes. Ils ont montré dans ce travail que le traitement par insuline pouvait réduire l’incidence des enfants macrosomes (16). Les études de suivi ont également mis en évidence que ces patientes ayant présenté un diabète gestationnel développaient une intolérance glucidique dans 50% des cas dans les années suivant la grossesse (17). Dans les années 1970, l’intérêt pour la physiopathologie du diabète gestationnel et pour les complications qu’il occasionne a grandi progressivement.
LE DÉPISTAGE
1. Les critères de dépistage
L’intérêt et la méthode de dépistage du diabète gestationnel sont débattus depuis de nombreuses années. Pour exemple, en 2005 en France, l’expertise de la haute autorité de la santé (HAS) concluait : « les données de la littérature scientifique ne permettent pas de conclure à propos des meilleures stratégies de dépistage et de diagnostic du diabète gestationnel, ni à propos de leurs modalités de réalisation. L’ampleur des controverses et des incertitudes conduit à ne pas faire de recommandations dans l’attente d’études complémentaires » (18). Historiquement, les valeurs seuils avaient été définies par les critères d’O’Sullivan et Mahan en 1964 mais essentiellement en fonction du risque maternel d’évoluer vers un diabète de type 2. Ces critères ont été progressivement contestés car ils n’étaient pas établis en fonction de la morbidité foeto-maternelle à court terme (18).
Les critères de O’Sullivan ont été révisés par the National Diabetes Data Group en 1979 et Carpenter et Coustan ont encore modifié les critères en 1982. Les critères de Carpenter et Coustan ont été adoptés par l’ADA (American Diabetes Association) en 1990 et par l’ACOG (American College of Obstetricians and Gynecologists) en 2001 (19).
L’étude HAPO en 2008 (Hyperglycemia and Adverse Pregnancy Outcome) (20) a marqué un tournant capital dans la prise en charge du diabète gestationnel. Cette étude multicentrique, internationale et en double aveugle a porté sur 25000 patientes non diabétiques connues, au 3ème trimestre de gestation et a été planifiée pour clarifier les risques d’évènements défavorables en relation avec le degré d’intolérance glucidique maternelle. Les patientes dans l’étude bénéficiaient d’un dépistage du diabète gestationnel entre 24 et 32 semaines, basé sur une HGPO 75 g de glucose, avec une mesure de la glycémie à jeun, de la glycémie à 1h et à 2h. Les critères de jugement principaux étaient définis par le taux de macrosomie, le taux de césarienne, le taux d’hyperinsulinisme fœtal reflété par un dosage du peptide-C sur le cordon ≥ 90ème percentile et le taux d’hypoglycémie néonatale clinique. Ces critères s’élèvent tous en fonction des glycémies maternelles et il existe une relation continue entre les valeurs glycémiques maternelles et la fréquence des complications citées. Le risque de complications périnatales (prééclampsie, accouchement prématuré, dystocie des épaules ou traumatisme obstétrical, transfert du nouveau-né en soins intensifs, hyperbilirubinémie) augmente aussi avec les glycémies maternelles.
Après cette étude, le travail sur l’établissement des nouvelles valeurs seuils a été confié à un autre groupe (l’IADPSG : International Association of Diabetes and Pregnancy Study Group) regroupant des Européens, des Japonais, des Australiens, des Américains, des Indiens et des Canadiens (225 médecins, issus de 40 pays différents). Les principaux critères de jugement retenus par l’IADPSG pour définir les valeurs seuils ont été la macrosomie fœtale (définie comme un poids de naissance >percentile 90 pour l’âge gestationnel), l’hyperinsulinisme fœtal (défini comme un peptide C sur le sang de cordon > percentile 90) et l’adiposité fœtale (1). Les valeurs seuils diagnostiques ont été choisies par le groupe IADPSG sur base d’un « Odd Ratio » de 1,75, c’est-à-dire des valeurs pour lesquelles il y avait un sur-risque de 75% de macrosomie, d’hyperinsulinisme et d’adiposité fœtale dans l’étude HAPO (21). Ces critères, publiés en 2010 (1), ont été adoptés par l’ADA (American Diabetes Association) en 2014 et par l’OMS (Organisation Mondiale de la Santé) en 2013.
Malgré cela, ces critères restent encore controversés et régulièrement remis en question. Ils ne sont pas admis de manière universelle, en raison des coûts de traitement qu’ils occasionnent et de l’évidence limitée de bénéfice de traiter avec des valeurs seuils plus basses (22). Ainsi, récemment, en 2015, l’association anglaise NICE (National Institute for Health and Care Excellence) a recommandé de nouvelles valeurs seuils pour le dépistage du diabète gestationnel, différentes des valeurs IADPSG (Tableau 2).

2. À quel moment réaliser le dépistage
Le dépistage du diabète gestationnel est classiquement recommandé entre 24 et 28 semaines, date à laquelle la tolérance au glucose se détériore au cours de la grossesse.
Cependant l’augmentation de la prévalence du diabète de type 2 chez les femmes en âge de procréer fait que l’on recommande, chez les femmes à haut risque, un dépistage du diabète de type 2 à la première visite prénatale (3). Le dépistage précoce du diabète gestationnel (avant 24 semaines), reste débattu et ne fait plus partie des recommandations actuelles (3,4). Une étude récente (23) a montré que malgré un dépistage précoce du diabète gestationnel et un traitement adéquat, les patientes diagnostiquées précocement avec un diabète gestationnel gardaient de mauvais résultats durant la grossesse (pour les patientes dépistées <12 semaines de grossesse, les résultats étaient similaires à ce que l’on peut voir en cas de diabète de type 2 préexistant). D’autres études sont nécessaires pour évaluer l’efficacité des approches thérapeutiques pour améliorer les résultats dans ces grossesses à haut risque.
3. Dépistage ciblé ou universel ?
La plupart des « guidelines », incluant celles de L’ADA en 2016 (3) (American Diabetes Association), recommandent un dépistage universel du diabète gestationnel, mais d’autres organisations, comme l’association anglaise NICE (National Institute for Health and Care Excellence), en 2015, recommandent uniquement un dépistage ciblé sur les facteurs de risque de diabète gestationnel (24). Les facteurs de risque considérés par NICE en 2015 sont un indice de masse corporelle (IMC) supérieur à 30 kg/m², un antécédent de macrosomie de 4,5 Kg ou plus, un diabète gestationnel antérieur, une histoire familiale de diabète ou l’appartenance à une minorité ethnique avec une haute prévalence de diabète gestationnel.
En Belgique, la plupart des centres (9,10) proposent un dépistage du diabète gestationnel à toutes les femmes enceintes, indépendamment des facteurs de risque.
COMPLICATIONS
1. Complications maternelles
Le diabète gestationnel est associé à un risque accru de pré-éclampsie et de césarienne. Ces risques démontrent une corrélation linéaire positive avec le degré d’hyperglycémie initiale (25). Le surpoids et l’obésité sont des facteurs de risque de pré-éclampsie et de césarienne, indépendamment du diabète gestationnel. Les taux d’accouchement instrumentalisé, de déchirure périnéale sévère et d’hémorragie du post-partum ne semblent pas être majorés par le diabète gestationnel (25).
Pour ce qui concerne le plus long terme, les femmes ayant présenté un diabète gestationnel ont un risque de récurrence de diabète gestationnel situé entre 30-84% lors d’une grossesse ultérieure et ont un risque multiplié par 7 de développer un diabète de type 2, un risque multiplié par 2 à 5 de développer un syndrome métabolique et un risque multiplié par 1,7 de développer plus tard une maladie cardiovasculaire. Le diabète de type 2 peut apparaitre en post-partum (5 à 14% des cas) ou plus tard (risque majoré jusqu’à 25 ans) (25, 26,27).
2. Complications fœtales et néonatales
Les complications périnatales spécifiquement liées au diabète gestationnel sont rares mais elles sont augmentées en cas de diabète de type 2 méconnu. La macrosomie est la principale conséquence néonatale démontrée d’un diabète gestationnel. Elle est le facteur principal associé aux complications rapportées en cas de diabète gestationnel (28).
L’augmentation modérée de la fréquence des malformations en cas de diabète gestationnel par rapport à la population générale est vraisemblablement liée à l’existence de cas de diabète de type 2 méconnu. Le risque d’asphyxie néonatale et de décès périnatal n’est pas augmenté dans le cadre du diabète gestationnel. Les traumatismes obstétricaux et les atteintes du plexus brachial sont des évènements rares et l’augmentation du risque en cas de diabète gestationnel n’est pas formellement démontrée (28).
Le risque de détresse respiratoire toute cause confondue est difficile à apprécier. Il n’existe pas de données pour établir un lien entre les troubles respiratoires néonataux et le diabète gestationnel. La fréquence rapportée de l’hypoglycémie néonatale sévère en cas de diabète gestationnel est faible mais le risque est difficile à apprécier en raison de l’hétérogénéité de la définition de l’hypoglycémie dans les différentes études. Le risque d’hypocalcémie en cas de diabète gestationnel est comparable à celui de la population générale. Le risque d’hyperbilirubinémie est faiblement augmenté (28).
3. Complications chez les enfants à long terme
L’hyperglycémie maternelle durant la grossesse est associée avec un risque majoré d’obésité dans l’enfance (29,30). Certaines études (31) ont également démontré qu’un environnement intra-utérin hyperglycémique pouvait jouer un rôle dans le développement du diabète de type 2 et du syndrome métabolique à l’âge adulte.
TRAITEMENT
La prise en charge spécifique du diabète gestationnel (diététique, autocontrôles glycémiques, insulinothérapie si nécessaire) réduit les complications périnatales sévères, la macrosomie fœtale et la prééclampsie, par comparaison à l’abstention thérapeutique, sans augmenter le risque de césarienne (32, 33).
1. Prévention du diabète gestationnel
Plusieurs études d’intervention ont été publiées ces dernières années pour essayer de prévenir l’apparition du diabète gestationnel, dans le but de diminuer les complications qu’il occasionne à court et à long terme mais aussi dans le but de diminuer le coût des soins de santé. Ces études concernent soit des programmes d’activité physique, soit une modification de l’alimentation soit encore l’utilisation de compléments alimentaires (probiotiques, huile de poisson) ou de metformine, dans certaines populations à risque (syndrome des ovaires micropolykystiques). Ces programmes n’ont pas encore pu apporter la preuve de leur efficacité et la compliance des patientes est souvent aléatoire (11).
2. La thérapie nutritionnelle et l’activité physique
La thérapie nutritionnelle est la pierre angulaire du traitement chez toutes les patientes présentant un diabète gestationnel. En ce qui concerne la prise de poids recommandée chez les patientes présentant un diabète gestationnel, celle-ci dépend de leur IMC initial (« guidelines » révisés de l’institut de médecine en 2009) (34) :
- IMC < 18.5 kg/m²: prise pondérale recommandée de 12.5-18 kg
- IMC 18.5-24.9 kg/m²: prise pondérale recommandée de 11.5-16 kg
- IMC 25-29.9 kg/m²: prise pondérale recommandée de 7-11.5 kg
- IMC ≥ 30 kg/m²: prise pondérale recommandée de 5- 9 kg
Les femmes obèses doivent réduire leur apport calorique d’un tiers comparé aux apports avant la grossesse, avec un minimum de 1600 à 1800 Kcal/jour (34). L’apport en hydrates de carbone doit se limiter à 35-45% du total des calories et cet apport doit être divisé en 3 repas et 2-4 collations (34). Les hydrates de carbone avec un index glycémique bas ainsi que la consommation de fibres peuvent aider au contrôle glycémique (35).En l’absence de contre-indication obstétricale, une activité physique régulière d’environ 30 minutes 3 à 5x/semaine est également recommandée (34,35).
3. L’insulinothérapie
L’insulinothérapie est initiée si les objectifs glycémiques ne sont pas atteints après 7 à 10 jours de mesures hygiéno-diététiques. Les données disponibles dans la littérature sont rassurantes concernant l’efficacité et la sécurité des analogues rapides Lispro et Aspart durant la grossesse. Si une insuline à longue durée d’action est nécessaire, la NPH est utilisée habituellement (34).
4. Les autres agents hypoglycémiants
Les agents hypoglycémiants oraux ne sont pas recommandés actuellement en première intention durant la grossesse même si les données sur le glibenclamide et la metformine semblent rassurantes (36, 37). D’autres études sont nécessaires pour que leur usage en routine puisse être considéré durant la grossesse, le problème principal étant que la plupart des hypoglycémiants oraux franchissent la barrière placentaire et qu’il y a peu de données sur la sécurité à long terme pour les enfants (3).
Dans la plus grande étude à ce jour comparant la metformine à l’insuline pour le traitement du diabète gestationnel (38), il n’y a pas de différence significative observée au niveau des complications fœtales entre les deux groupes et approximativement la moitié des mères traitées par metformine ont aussi nécessité une insulinothérapie pour arriver aux cibles thérapeutiques recommandées. Malgré cela, la metformine semble être avantageuse en ce qui concerne la prise de poids et la quantité d’insuline nécessaire durant la grossesse (39).
5. Contrôles glycémiques recommandés et cibles thérapeutiques
Les autocontrôles glycémiques sont recommandés entre 4 et 6x/jour (35), à jeun et 1 ou 2 h après le repas. Les cibles thérapeutiques sont les suivantes (3,34) :
- Glycémie pré-prandiale : < 90-95 mg/dl
- Glycémie 1h après le début du repas : ≤130-140 mg/dl
- Glycémie 2h après le début du repas : ≤ 120 mg/dl
Certaines études (40) montrent un avantage (notamment un taux de macrosomie plus bas) à obtenir des glycémies à jeun < 90 mg/dl.
RECOMMANDATIONS POUR LE SUIVI EN POST PARTUM
Il est très important de conseiller au patientes ayant présenté un diabète gestationnel de refaire un bilan glucidique en post-partum. En effet, le diabète gestationnel peut masquer un diabète de type 2 non diagnostiqué avant la grossesse ou même parfois un diabète de type 1 voir un autre diabète (MODY). L’ADA (American Diabetes Association) en 2016 recommande la réalisation d’une HGPO 75 g de glucose 6 à 12 semaines après l’accouchement, avec les critères habituels utilisés en dehors de la grossesse pour le diagnostic du diabète. L’hémoglobine glycatée mesurée immédiatement en post-partum peut encore être faussement abaissée du fait de la diminution persistante de la demi-vie des globules rouges ou des pertes sanguines secondaires à la grossesse, raison pour laquelle l’HGPO est encore conseillée pour le diagnostic (3).
Le diabète gestationnel étant un facteur de risque d’apparition de diabète de type 2 à plus long terme, il est aussi recommandé de contrôler les patientes tous les 1 à 3 ans même si l’HGPO était normale en post partum (3). La fréquence du dépistage dépend des autres facteurs de risque associés (obésité, histoire familiale, insulinothérapie durant la grossesse...).
Des progrès sont encore à réaliser de ce côté puisque le taux de patientes se présentant pour leur contrôle en post-partum reste relativement faible (41).
POINTS CLEFS POUR LE DIABÈTE GESTATIONNEL
1. Il existe un manque de consensus international sur les critères diagnostiques à utiliser
2. La place du dépistage précoce (avant 24 semaines) n’est pas clairement établie
3. Il faut renforcer nos efforts pour améliorer la compliance au suivi en post-partum
CORRESPONDANCE
Dr Nathalie Pirson
Cliniques universitaires Saint-Luc
Service d’endocrinologie et nutrition
Avenue Hippocrate 10
B-1200 Bruxelles
RÉFÉRENCES
1. International Association of Diabetes and Pregnancy Study Groups Recommendations on the Diagnosis and Classification of Hyperglycemia in pregnancy. Diabetes Care 2010; 33: 676-682. Ouvrir dans PubMed
2. Expert consensus on gestational diabetes mellitus. Diabetes and Metabolism 2010; 36: 695-699. Ouvrir dans PubMed
3. American Diabetes Association. Standards of medical care in diabetes 2016, Diabetes care 2016; 39 (supplement 1): 18-20 and 86-93.
4. Moyer V, on behalf of the U.S.Preventive Services Task Force. Screening for Gestational Diabetes Mellitus: U.S.Preventive Services Task Force Recommendation Statement. Ann Intern Med 2014; 160:414-420. Ouvrir dans PubMed
5. Expert consensus on gestational diabetes mellitus. Diabetes and Metabolism 2010; 36: 628-651. Ouvrir dans PubMed
6. Ferrara A. Increasing Prevalence of Gestational Diabetes Mellitus. Diabetes Care 2007; 30 (suppl 2) : 141-146. Ouvrir dans PubMed
7. Zhu Y, Zhang C. Prevalence of gestational diabetes and risk of progression to type 2 diabetes: a global perspective. Curr Diab Rep 2016; 16:7. Ouvrir dans PubMed
8. Guariguata L, Linnenkamp U, Beagley J, Whiting DR, Cho NH. Global estimates of the prevalence of hyperglycaemia in pregnancy. Diab Res Clin Pract 2013; 103:176-185. Ouvrir dans PubMed
9. Benhalima K, Hanssens M, Devlieger R, Verhaege J, Mathieu C. Analysis of Pregancy Outcomes Using The New IADPSG Recommendation Compared With The Carpenter and Coustan Criteria in an Area with a Low Prevalence of Gestational Diabetes. Int J Endocrinol 2013; http://dx.doi.org/10.1155/2013/248121. Ouvrir dans PubMed
10. Selvais Ph, Buts R, Fernandez Cl, Gilleman U, Jacobs J-L, Loumaye R et al. Diabète gestationnel: à quoi nous attendre? Louvain Med 2012; 131 (9): 511-513.
11. Agha-Jaffar R, Olivier N, Jonhston D, Robison S. Gestational diabetes mellitus: does an effective prevention strategy exist? Nat Rev Endocrinol 2016; 12:533-546. Ouvrir dans PubMed
12. Lapolla A, Dalfra MG, Mello G, Parretti E, Cioni R, Marzari M et al. Early detection of insulin sensitivity and beta-cell function with simple tests indicates future derangements in late pregnancy. JCEM 2008; 93(3): 876-880. Ouvrir dans PubMed
13. Catalano PM, Tysbir ED, Roman NM, AminiSB, Sims EA. Longitudinal changes in insulin release and insulin resistance in nonobese pregnant women. Am J Obstet Gynecol 1991; 165: 1667-1672. Ouvrir dans PubMed
14. Knopp R. John B.O’Suillvan: a pioneer in the study of gestational diabetes. Diabetes Care 2002; 25: 943-944.
15. O’Sullivan J, Mahan C. Criteria for the oral glucose tolerance test in pregnancy. Diabetes 1964;13:278-285.
16. O’Sullivan J. Insulin treatment for gestational diabetes. In early diabetes in early life. Camerini-Davalos R, Cole H, Eds New York, Academic Press 1975, P447-453 and 503-519.
17. O’Sullivan JB. Diabetes mellitus after GDM. Diabetes 1991; 40 (suppl 2): 131-135
18. Legardeur H, Girard G, Manderlbrot L. Dépistage du diabète gestationnel: vers un nouveau consensus? Gynécologie obstétrique et fertilité 2011 ; 39 : 174-179.
19. En-Tzu W, Feng-Jung N, Chun-Heng K, Szu-Chi C, Kuan-Yu C, Lee-Ming C et al. Diagnosis of more gestational diabetes lead to better pregnancy outcomes: comparing the IADPSG criteria and the carpenter and coustan criteria. J Diabetes Investig 2015; 7:121-126.
20. HAPO cooperative study research group. Hyperglycemia and adverse pregnancy outcomes. N Engl J Med 2008 ; 8, 358 (19) : 1991-2002.
21. Collège National Des Gynécologues et Obstétriciens francais (CNGOF) et société francophone du diabète (SFD) Le diabète gestationnel. Médecine des Maladies Métaboliques 2010 ; 36 :511-700
22. Meek C, Patient C, Simmons D. Diagnosis of gestational diabetes mellitus: falling through the net. Diabetologia 2015; 58(9):2003-2012.
23. Sweeting A, Ross G, Hyett J, Molyneaux L, Constantino M, Harding A et al. Gestational diabetes mellitus in early pregnancy: evidence for poor pregnancy outcomes despite treatment. Diabetes Care 2016; 39:75-81
24. National Institute for Health and Care Excellence (NICE). Diabetes in pregnancy: management of diabetes and its complications from preconception to the postnatal period. NICE guideline 2015 N°3 ; https://www.ncbi.nlm.nih.gov/books/NBK293625/
25. Expert consensus on gestational diabetes mellitus. Diabetes and Metabolism 2010; 36: 595-616.
26. Damm P, Houshmand-oeregaard A, Kelstrup L, Lauenborg J, Mathiesen ER, Clausen TD. Gestational diabetes mellitus and long-term consequences fort mother and offspring: a view from Denmark. Diabetologia 2016; 59(7): 1396-1399.
27. Bellamy L, Casas JP, Hingorani AD, Williams D. Type 2 diabetes mellitus after gestational diabetes: a systematic review and meta-analysis. Lancet 2009; 373: 1773- 1779.
28. Expert consensus on gestational diabetes mellitus. Diabetes and Metabolism 2010; 36: 617-627.
29. Hilier T, Pedula K, Schmidt M, Mullen J, Charles M, Pettitt D. Childhood obesity and metabolic imprinting: the ongoing effects of maternal hyperglycemia. Diabetes Care 2007; 30: 2287- 2292.
30. Zhao P. et al. (ISCOLE research group). Maternal gestational diabetes and childhood obesity at age 9-11: results of a multinational study. Diabetologia 2016; 59 (11): 2339-2348.
31. Clausen T, Mathiesen E, Hansen T, Pedersen O. High prevalence of type 2 diabetes and pre-diabetes in adult offspring of women with gestational diabetes mellitus or type 1 diabetes. Diabetes Care 2008; 31: 340-346.
32. Crowther CA, Hillier JE, Moss JR, McPhee AJ, Jeffries WS, Robinson JS. Effect of treatment of gestational diabetes mellitus on pregnancy outcomes. N Engl J Med 2005; 352: 2477-2486.
33. Landon MB et al. A multicenter randomized trial of treatment for mild gestational diabetes. N Eng J Med 2009; 361: 1339-1348.
34. Blumer I, Hadar E, Hadden DR, Jovanovic L, Mestman JH, Murad MH et al. Diabetes and pregnancy: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2013; 98 (11):4227-42249.
35. Expert consensus on gestational diabetes mellitus. Diabetes and Metabolism 2010; 36: 695-699.
36. Kitwitee P, Limwattananon S, Limwattananon C, Waleekachonlert O, Ratanachotpanich T, Phimphilai M. et al. Metformin for the treatment of gestational diabetes: an updated meta-analysis. Diabetes Res Clin Pract 2015; 109: 521-532.
37. Singh KP, Rahimpanah F, Barclay M. Metformin for the management of gestational diabetes mellitus. Aust N Z J Obstet Gynaecol 2015; 55: 303-308.
38. Rowan JA, Hague WM, Gao W, Battin MR, Moore MP and MIG trial investigators. Metformin versus insulin for the treatment of gestational diabetes. N Eng J Med 2008; 358:2003-2015.
39. Rowan Ja, Rush EC, Obolonkin V, Battin M, Wouldes T, Hague WM. Metformin in gestational diabetes: the offspring follow-up. Diabetes Care 2011; 34:2279-2284.
40. Prutsky GJ, Domenecq JP, Wang Z, Carranza Leon BG, Elraiyah T, Nabban M et al. Glucose targets in pregnant women with diabetes: a systematic review and meta-analysis. J Clin Endocrinol Metab 2013 ; 98(11): 4319-4324.
41. Noctor E et al. Abnormal glucose tolerance post-gestational diabetes mellitus as defined by the International Association of Diabetes and Pregancy Study Groups Criteria. Eur J Endocrinol 2016 ; 175 :287-297