INTRODUCTION
Les Témoins de Jéhovah (TJ) refusent les transfusions de dérives sanguins stables et labiles. La prise en charge de ces patients lors d’une chirurgie à risque de saignement est un challenge médical, éthique, psychologique et légal (1) . En effet, les TJ ont plus de probabilité de mourir dans ce contexte que les non TJ. Une prise en charge spécifique doit être réalisée(2).
CONVICTIONS DES TJ
Le groupe des TJ est né dans les années 1870 en Pennsylvanie et rassemble 7.8 millions de membres dans le monde (3). La société a été enregistrée en 1881 sous le nom de Watch Tower Society (WTS). Le Collège Central est l’autorité suprême depuis 1975. Il fait éditer par la WTS des publications, notamment La Tour de garde et Réveillez-vous ! La foi des TJ est fondée sur une lecture littérale de la Bible. La violation d’interdits débouche sur le rejet de la communauté. La majorité des conflits légaux a abouti au renforcement des droits et de l’autonomie du patient, poussant le médecin à accepter la prise en charge souhaitée par le patient TJ. C’est en 1945 que la WTS a considéré que les transfusions étaient contraires à la loi divine. Elle fondait cette conclusion sur ces passages bibliques : « Vous ne devrez manger le sang d’aucune sorte de chair ». La Tour de garde du 1/7/51 explique ce verset : « Un patient peut être nourri par (…) les veines. Lorsque des solutions sucrées sont administrées en intraveineuse (IV), l’opération est dénommée alimentation IV. Le médecin qui administre la transfusion nourrit le patient par ses veines, et le patient qui la reçoit mange par ses veines » (3).
Les TJ perçoivent les versets bibliques comme des règles à suivre interdisant la transfusion de sang complet, plasma, leucocytes et plaquettes (Tableau 1).
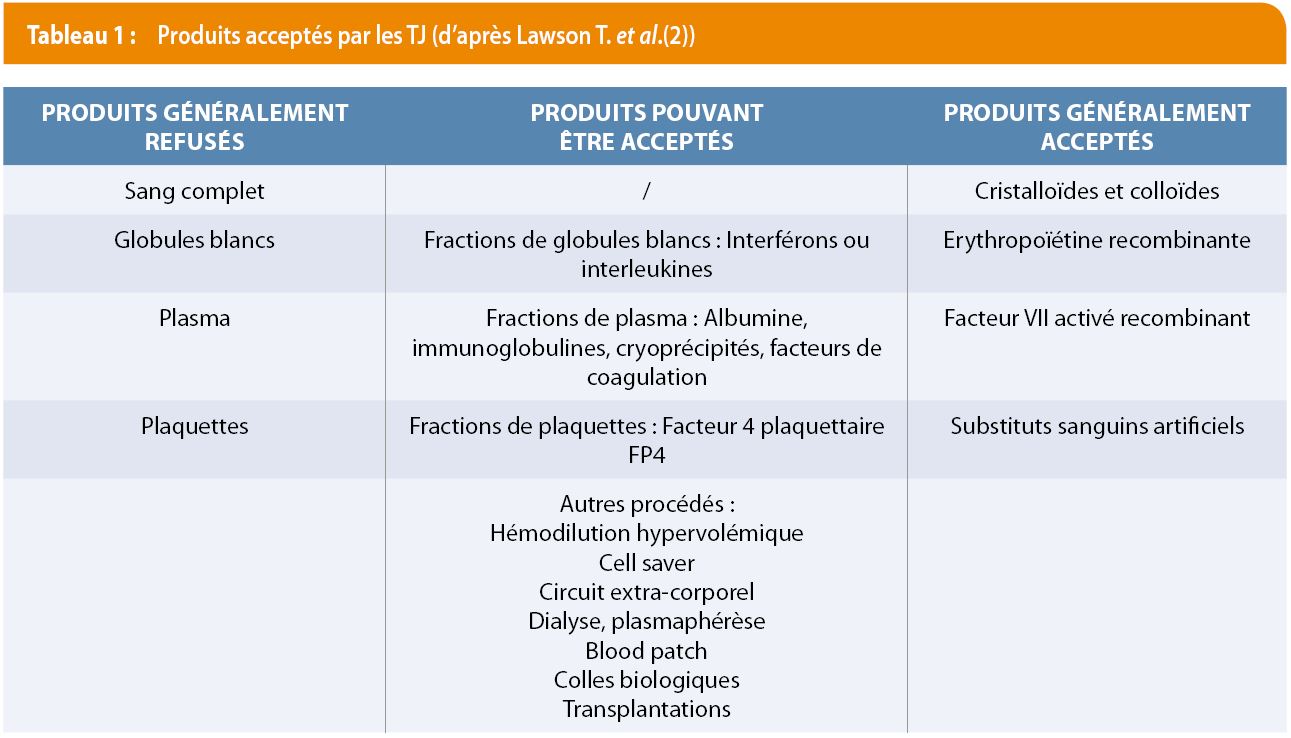
Les TJ s’opposent à la collecte anticipée de leur sang pour une utilisation différée, puisque le sang sorti du corps doit être versé à la terre. Ils acceptent les dispositifs de circulation extracorporelle s’ils sont amorcés avec des produits non sanguins et reliés en permanence au patient.
En urgence, il n’existe pas de produits disponibles en alternative à la transfusion de globules rouges. Il faut connaître les procédures à risque de saignement afin d’anticiper.
CHIRURGIES À RISQUE DE SAIGNEMENT
Elles sont rappelées dans le Tableau 2. Les produits sanguins sont parfois difficiles d’accès et ont un coût (Tableau 3) (4).
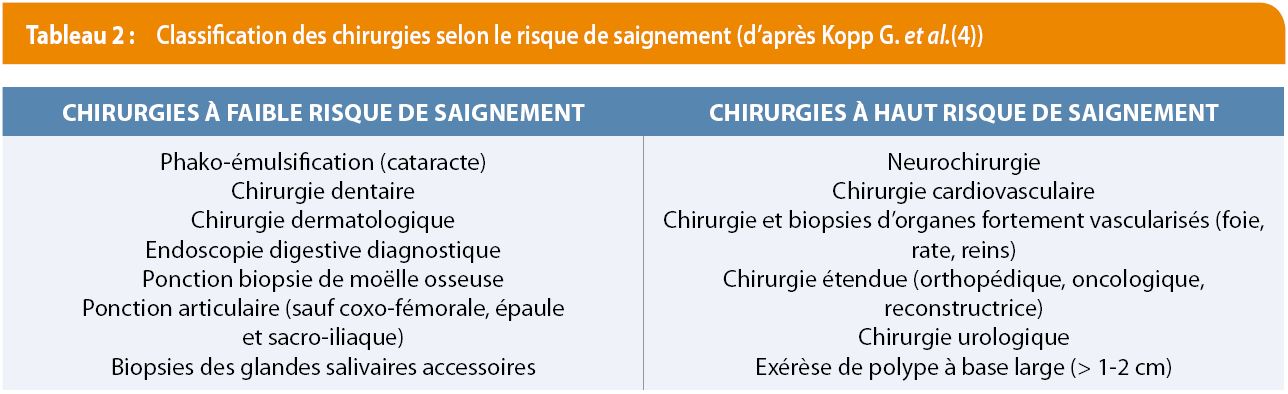
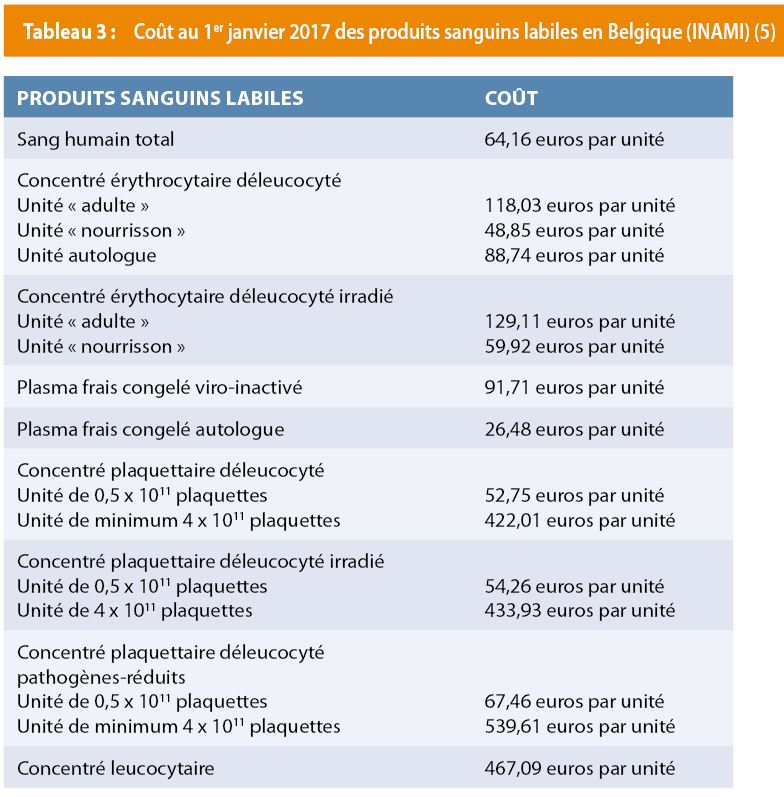
En raison de l’intransigeance des TJ et de la rareté des produits sanguins, l’évolution des connaissances médicales oriente les médecins vers des stratégies d’épargne sanguine.
STRATEGIES D’ÉPARGNE SANGUINE
Ces conduites visent à prévenir le risque de saignement et à limiter le risque de transfusion allogénique.
Stratégies préopératoires
L’épargne sanguine se prépare dès l’évaluation préopératoire. Une attention particulière doit être portée sur une anamnèse en faveur d’un désordre hémostatique, le terrain (femme jeune), des traitements modifiant la coagulation et des prélèvements sanguins adaptés (hémogramme, tests évaluant la coagulation), afin de limiter les facteurs de risque de transfusion (5) : sexe féminin, âge > 75 ans, insuffisance rénale, anémie, poids < 60 kg, infarctus du myocarde ou accident vasculaire cérébral, prise d’un antiagrégant plaquettaire ou anticoagulant.
Il y a 4 objectifs dans la prise en charge d’un TJ : minimiser le saignement, augmenter l’érythropoïèse, optimiser la délivrance d’oxygène, favoriser une bonne hémostase. S’y ajoutent les principes de réhabilitation précoce. La prise en charge d’un TJ dépend du cadre urgent ou électif et consiste à déterminer précisément ce que le TJ accepte (2).
Minimiser le risque de saignement
Une perte sanguine peropératoire de plus de 500 cc augmente la mortalité péri-opératoire indépendamment du taux d’hémoglobine préopératoire (6). Il faut limiter les prélèvements sanguins. Les cathéters doivent être posés par un médecin expérimenté.
Une bonne gestion pluridisciplinaire (cardiologues, anesthésistes, chirurgiens) préopératoire des traitements augmentant le risque de saignement (anticoagulants/ antiagrégants plaquettaires (AAP)/ anti-inflammatoires non stéroïdiens/ phytothérapie (ail, gingembre)) est nécessaire (7).
Selon leurs caractéristiques (Tableau 4), la gestion des AAP est la suivante (5) . Dans la mesure du possible, il faut poursuivre l’aspirine. Le délai d’arrêt est de 5 jours pour l’aspirine (si arrêt impératif), 7 jours pour le clopidogrel et le ticagrelor, 10 jours pour le prasugrel ; sans relais. La reprise post-interventionnelle doit être rapide. Les recommandations sont cependant différentes chez les patients TJ porteurs d’un stent intracoronaire (8).
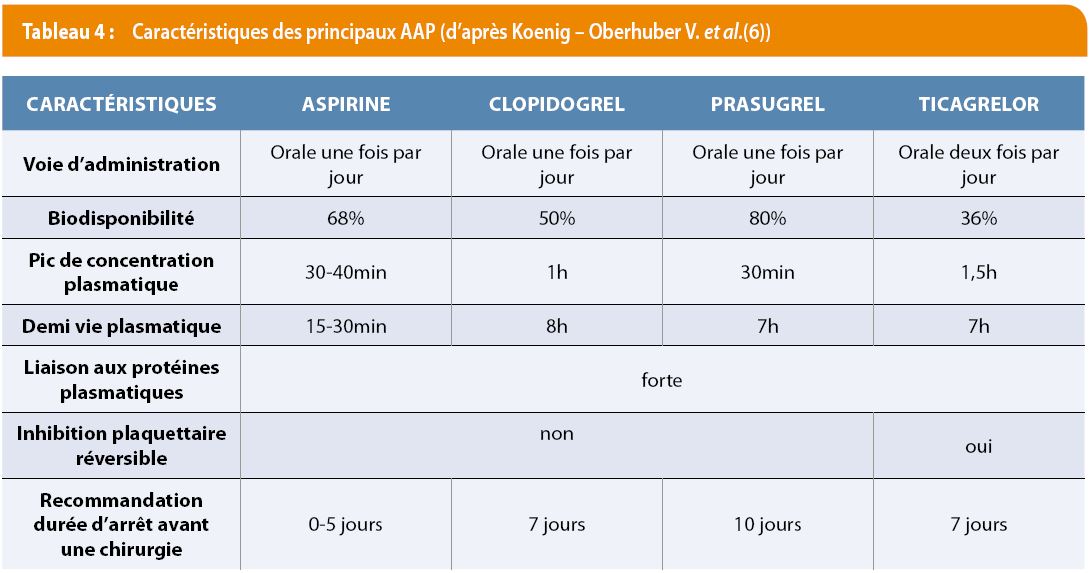
En cas d’urgence, il n’y a pas d’antagoniste direct, la transfusion de plaquettes est possible, il faut surveiller la fonction plaquettaire et tout préparer pour l’éventualité d’hémorragies.
Dans le cas des TJ hémophiles, les concentrés de facteurs VIII et IX recombinants sont utilisés (1-2). Ces traitements doivent être gérés en concertation pluridisciplinaire par des médecins hématologues. La dose administrée est 30-50 UI FVIII ou FIX/kg, répétée si nécessaire en fonction de la nature du geste. La prise en charge d’un TJ sous anticoagulant est un véritable challenge. En cas d’urgence, on peut assurer la réversibilité de l’effet anticoagulant de certains médicaments, soit par le recours à un antidote spécifique, soit avec des facteurs de coagulation. Les caractéristiques des principaux anticoagulants sont rappelées dans le tableau 5.
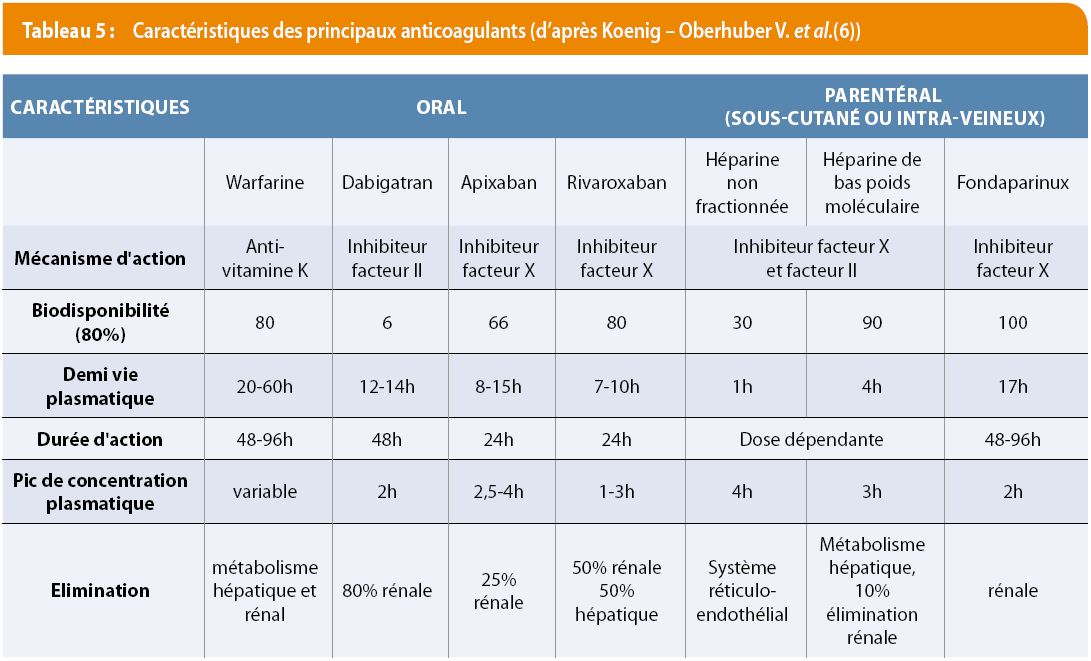
Les héparines sont relativement simples à antagoniser. Un milligramme de protamine neutralise 1 milligramme d’héparine non fractionnée (100 UI). La protamine est un antagoniste partiel des héparines de bas poids moléculaire.
Les AVK sont antagonisés par la vitamine K hors contexte d’urgence. En urgence, les facteurs de coagulation vitamine K-dépendants peuvent également être remplacés par un concentré de complexe prothrombinique (PCC : facteurs II, VII, IX, X), PPSB®, Octaplex® ou Cofact® en Belgique, recommandé chez les TJ à la dose de 20 UI FIX /kg en intraveineux administré en 15 min (2). La valeur de l’INR cible doit être déterminée au préalable (9).
Le tableau 6 résume la gestion périopératoire des nouveaux anticoagulants oraux (NACO). Les NACO ont une demi-vie courte ; plus on attend, plus le risque de saignement diminue. En cas d’urgence ou d’hémorragie persistante, on peut recourir à une réversion non-spécifique, après s’être assuré que la calcémie, l’équilibre acido-basique et la température du malade sont normaux (5). Les PCC permettent la réversion partielle des xabans (rivaroxaban, Xarelto®, apixaban, Eliquis®) in vitro, mais sont inefficaces sur le dabigatran (Pradaxa®) (10).
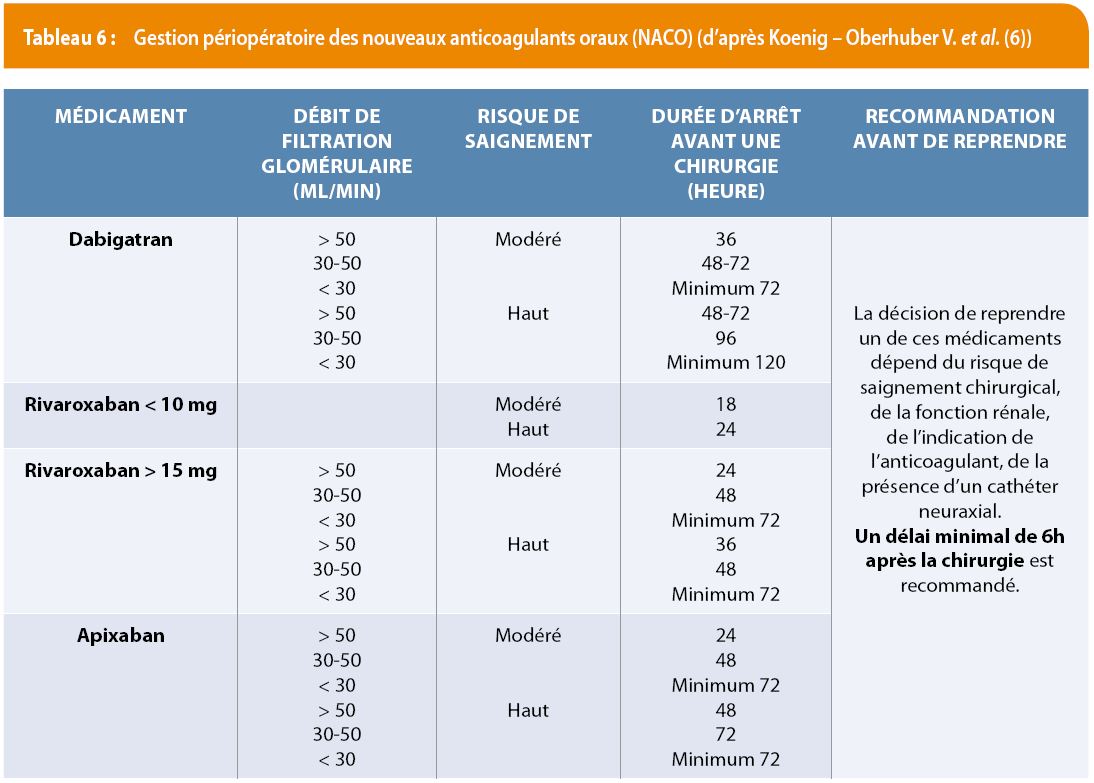
Concernant les aPCC (a pour activés) et le facteur VII recombinant activé (rFVIIa), même si certaines guidelines mentionnent le recours au FEIBA® (aPCC, Factor Eight Inhibitor Bypassing Activity) ou au rFVIIa, classiquement réservées aux patients hémophiles avec inhibiteur, il s’agit d’options qui n’ont jamais été validées et ne sont pas dénuées de risque thrombotiques.
L’ordre d’efficacité croissant des diverses stratégies permettant de corriger l’effet anticoagulant du rivaroxaban est : PCC < aPCC < rFVIIa ; toutefois l’effet ne dépasse pas 50 % de correction. Les aPCC et le facteur rVIIa peuvent occasionner des thromboses artérielles dans 1 à 11% des cas. Le PCC est donc un agent de premier choix dans les circonstances graves. Ces traitements sont basés sur le jugement clinique et les tests de coagulation (TP, aPTT, TT, thromboélastographie, anti-Xa) (5). En l’absence d’héparine, une valeur anti-Xa < 0.1 U/mL suggère que l’effet a disparu. Le thromboélastomètre (Low TF Rotem ® pour apixaban et rivaroxaban) est un test très instructif. Des dosages spécifiques des concentrations circulantes des nouveaux anticoagulants sont actuellement disponibles dans plusieurs institutions et permettent d’identifier un éventuel surdosage ou une activité résiduelle anticoagulante avant un geste invasif. Leur utilisation doit être privilégiée.
De nouveaux antidotes contre les NACO sont disponibles ou en cours d’étude : l’idarucizumab (Praxbind ®) constitue l’agent de choix pour neutraliser spécifiquement et rapidement l’effet anticoagulant du dabigatran (Pradaxa ®) à la dose de 5g en IV lente, à renouveler si besoin. L’andexanet alpha, un facteur Xa recombinant modifié, est un antidote en cours d’étude pour la réversion de l’apixaban et du rivaroxaban. L’aripazine est le troisième antidote en cours de développement, destiné à inhiber l’apixaban, le rivaroxaban et l’enoxaparine.
À défaut de réverser, on peut freiner l’absorption digestive du produit avec du charbon actif si la dernière prise remonte à moins de 2-6 heures, ou éliminer la substance par filtration (5).
Le potentiel hémostatique de l’acide tranexamique a été au départ révélé par l’étude CRASH-2 (11) spécifiquement en traumatologie comme facteur de réduction de la mortalité par saignement. Puis son utilisation a été étendue à d’autres indications très différentes. L’acide tranexamique est actuellement recommandé dans les protocoles de prise en charge des hémorragies majeures chez les TJ (2,9). L’administration de 500 à 1000 mg en IV ou de 10 mg/kg/6 heures jusqu’à maximum 100 mg/min a montré son efficacité (2).
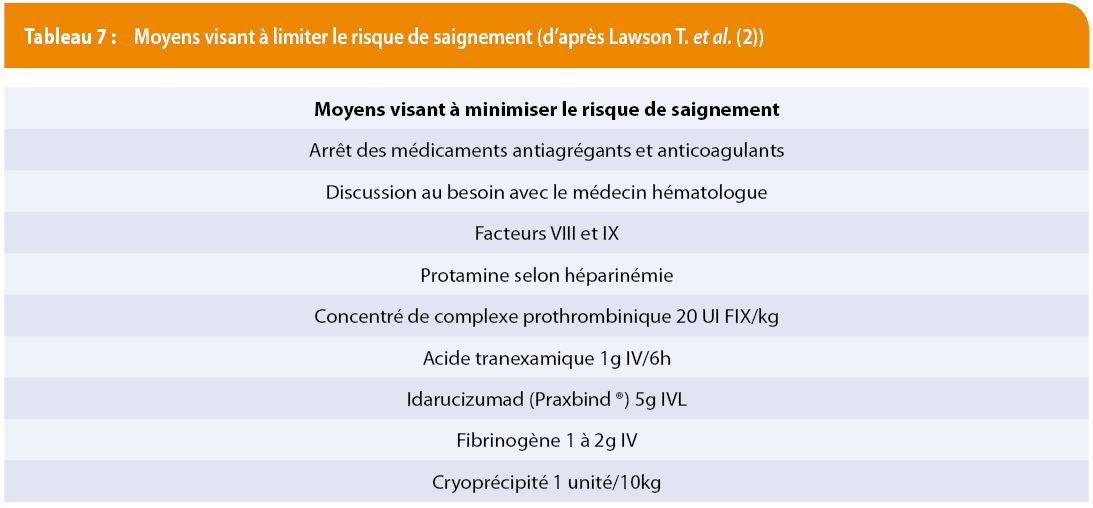
Le tableau 7 regroupe tous ces différents moyens visant à limiter le risque de saignement lors de la prise en charge d’un patient TJ.
Augmenter l’érythropoïèse
Une hémoglobinémie inférieure à 5 g/dl représente un facteur indépendant de risque de mortalité (1). La stratégie actuelle consiste à limiter la transfusion. Dans l’étude TRICC (Transfusion Requirements In Critical Care), la mortalité à 30 jours était diminuée dans 2 sous-groupes de patients (seuil transfusionnel < 7g/dl) (12). En situation aiguë, selon la tolérance clinique, la transfusion est parfois recommandée sous 10 g/dl (2) particulièrement chez les patients aux antécédents cardiovasculaires (14), indiquée sous 8 g/dl ou 25% d’hématocrite (5, 13), toujours indiquée sous 7 g/dl (2, 9, 13 14). Les patients TJ présentant une anémie et devant bénéficier d’une chirurgie à risque de saignement ont un risque plus élevé d’être transfusés (15). Il est donc primordial d’élever le taux d’hémoglobine par l’utilisation d’érythropoïétine (EPO), de fer, d’acide folique et de vitamine B12. Il faut vérifier les constituants de l’EPO car certaines préparations peuvent contenir de l’albumine humaine, non acceptée par tous les TJ (1, 2). Un taux optimal d’hémoglobine peut être obtenu en 2 à 4 semaines. Il est préférable d’évaluer la réticulocytose à un intervalle de 72 heures. La supplémentation en fer est bénéfique même en cas de concentration normale (16).
En Belgique, l’utilisation de l’EPO en préopératoire est recommandée pour la chirurgie orthopédique hémorragique chez les patients modérément anémiques. Il s’agit des epoetines alfa : l’Eprex ® et Binocrit ® . Ces EPO sont incluses dans le forfait hospitalier depuis le 1er juillet 2012. Le forfait hospitalier couvre 75 % des médicaments remboursés forfaitarisés administrés au cours de l’hospitalisation du patient, quelle qu’en soit la durée ou la cause.
La dose recommandée (16) est 600 UI/kg en sous-cutané, une fois par semaine aux J-21, J-14 et J-7, ainsi que le jour J. Lorsque le délai pré-interventionnel doit être réduit à moins de 3 semaines, l’EPO doit être administrée quotidiennement à la dose de 300 UI/kg pendant 10 jours consécutifs avant l’intervention, ainsi que le jour J et pendant les 4 jours suivant. Lors du bilan préopératoire, si l’hémoglobine atteint 15 g/dl, l’EPO doit être interrompue. Elle est contre-indiquée en cas d’hypertension artérielle non contrôlée ou d’antécédents d’accidents vasculaires cérébraux. Aucune thrombose secondaire à l’EPO n’a été observée chez les futurs opérés (15). Tous les patients TJ sous EPO doivent recevoir un complément de fer. Il faut apporter un complément en B12 et folate si un déficit préopératoire est identifié (1, 2) (Tableau 8).

Stratégies peropératoires
Mesures chirurgicales
L’équipe chirurgicale doit être expérimentée, préférer des procédures mini-invasives ou fonctionner par étapes (16). Les chirurgiens ont un accès direct aux sources de saignement, et des outils adaptés comme les bistouris électriques diathermiques, la colle de fibrine etc...(1)
Mesures anesthésiologiques
Une équipe d’anesthésie expérimentée connaissant le contexte médical, psychologique, éthique et légal du cas du patient TJ doit être rassemblée.
Les stratégies sont les suivantes :
- le positionnement et le monitoring : site chirurgical au-dessus du coeur, garrots (2), NIRS (Near-infrared spectroscopy) pour identifier une hypoperfusion cérébrale (17) ;
- le plan d’anesthésie : préférer les anesthésies locorégionales (15), un monitoring invasif, optimiser le débit cardiaque, adapter le remplissage, les inotropes et la FiO2 ;
- la ventilation : éviter l’hypercapnie, limiter la pression positive (2) ;
- l’hémodilution hypervolémique : remplir avec des cristalloïdes ou des colloïdes (9) (intéressants dans ce contexte, controversés dans le remplissage vasculaire chez les patients en état critique (18)) afin de diminuer l’hématocrite. À volume de sang perdu équivalent, la perte d’hémoglobine est plus basse ;
- le Cell saver (9): circuit extracorporel. Le sang perdu est aspiré, anticoagulé, collecté, centrifugé, lavé et retransfusé (2). L’appareil ne récupère ni les plaquettes ni les facteurs de coagulation, et contient un chélateur de calcium. Il faut corriger une hypocalcémie (9) et toute coagulopathie (16) ;
- l’hypothermie relative contrôlée : entre 33 et 36°C, l’hypothermie altère l’agrégation plaquettaire. Sous 33°C, l’hypothermie altère la fonction plaquettaire et la cascade de coagulation. Une température sous 35°C peut entraîner une augmentation des pertes sanguines et des besoins transfusionnels. Le maintien d’une normothermie permet d’éviter une coagulopathie et de limiter les pertes sanguines (9). Cependant, l’hypothermie relative (> 35°C) a été appliquée avec succès chez des TJ afin de réduire la consommation totale d’oxygène et d’augmenter la proportion d’oxygène dissout sans altérer l’extraction d’oxygène (2) ;
- l’hypotension relative contrôlée : sous anesthésie : pression artérielle systolique de 80-90 mmHg, pression artérielle moyenne de 50-65 mmHg, ou baisse de 30% de la pression artérielle moyenne basale. Le seuil de pression artérielle moyenne est basé sur la limite inférieure du seuil d’autorégulation du débit sanguin cérébral. Le maintien d’une hypotension contrôlée adaptée au patient permettrait de réduire le risque de transfusion allogénique. Cette technique est contre-indiquée en cas d’hypertension artérielle mal contrôlée ou d’artériopathie cliniquement significative ;
- la correction d’une coagulopathie : selon les tests : thromboélastographie, thromboélastométrie, analyse de la fonction plaquettaire, autres. La supplémentation en calcium, facteurs de coagulation, antifibrinolytique, fibrinogène ou cryoprécipité si disponible (fraction de plasma contenant du fibrinogène, du facteur Willebrand et du facteur VIII) doit être réalisée si nécessaire. Le traitement de première intention est le fibrinogène (9). La dose initiale recommandée est de 1 à 2 g (2). Les cryoprécipités (non disponibles en Europe) ne sont pas toujours acceptés chez les TJ. La dose est de 1 à 2 unités/10 kg ou 2 pools (équivalent à 10 unités). Cette dose augmente la concentration de fibrinogène d’1g/L ;
- les médicaments hémostatiques : l’acide tranexamique est indiqué (1, 11).
Stratégies post-opératoires
Il est nécessaire de surveiller les pertes sanguines, de les limiter, d’anticiper une supplémentation. Plus de 30% des transfusions de sang en réanimation sont liées aux prélèvements sanguins. Les prélèvements sanguins doivent être limités et réalisés dans des tubes pédiatriques (16).
Chez les patients TJ présentant une anémie aiguë postopératoire, il faut minimiser la consommation d’oxygène et augmenter sa délivrance; c’est-à-dire augmenter le débit cardiaque, maintenir le volume sanguin périphérique, mettre en place une oxygénothérapie, maintenir le patient au repos, contrôler la température. Chez les patients TJ sous ventilation mécanique ou en hypothermie, il faut augmenter l’hématocrite par du fer et de l’EPO. Le protocole d’administration d’EPO proposé en post-opératoire est le suivant : 600 UI/kg à 24 et 48 heures après une chirurgie, puis trois doses de 300 UI/kg respectivement à J3, J4 et J5(2). Le cell-saver peut être utilisé. Les traitements antihypertenseurs, anticoagulants et AAP doivent être adaptés.
Soigner un patient TJ signifie également respecter le cadre légal et psychologique.
LOI BELGE ET CONTEXTE PSYCHOLOGIQUE
Dans la prise en charge médicale du témoin de Jéhovah, le médecin se voit confronté à un dilemme légal, éthique et moral : d’une part il se doit de tout mettre en œuvre pour sauver le patient, d’autre part il est contraint de respecter ses croyances religieuses.
La loi du 22 aout 2002 relative aux droits du patient et les recommandations du Comité de Bioéthique (19) s’appliquant aux transfusions sanguines de nécessité vitale doivent être prises en compte. Le médecin doit prendre toutes les précautions nécessaires et verser au dossier médical les éléments qui motivent sa décision.
Concernant le TJ majeur capable : le patient a le droit de consentir librement à toute intervention du praticien professionnel moyennant information préalable. Le patient a droit de refuser ou de retirer son consentement. Le consentement se doit donc d’être éclairé, libre et spécifique du traitement concerné. Le refus de consentir à un geste médical doit être fixé par écrit et ajouté au dossier médical. Le médecin est obligé de respecter le refus d’une transfusion sanguine de nécessité vitale, même si cela signifie le décès du patient.
L’information doit être fournie au patient. Le colloque singulier fait partie intégrante de toute relation médecin / patient sous le principe général de conscience / confiance. Le patient doit donc bénéficier d’un colloque singulier avec le médecin et doit maintenir expressément son refus après avoir été informé des conséquences. Le médecin doit faire signer au patient une décharge, il doit ajouter cette décharge au dossier médical. Après avoir pris acte du refus de la transfusion sanguine de nécessité vitale, le médecin peut appliquer une clause de conscience, c’est-à-dire refuser de traiter le patient et l’adresser à un confrère excepté le cas où l’état de santé du patient ne le permet pas. Le médecin est tenu de communiquer le dossier médical au confrère qui a accepté la prise en charge dudit patient.
Concernant le TJ majeur incapable : il faut distinguer deux situations : l’incapacité permanente et l’incapacité temporaire. Pour le majeur incapable de manière permanente, le médecin peut respecter le refus d’une transfusion sanguine de nécessité vitale s’il existe une déclaration anticipée de volonté rédigée par le patient en toute conscience et signée par lui. Toute déclaration anticipée sera recherchée de principe. Si une personne de confiance a été désignée par le patient, le médecin doit l’entendre et tenir compte de ses déclarations. A défaut, la volonté des proches ou de la famille n’est pas suffisante.
Pour l’incapable de manière temporaire, l’article 14 prévoit la possibilité de désigner une personne qui se substituera au patient pour autant et aussi longtemps qu’il n’est pas en mesure d’exercer ses droits lui-même. La désignation se fait par un mandat écrit spécifique signé et daté par le patient et la personne elle-même. En absence de mandant désigné, le législateur énonce un ordre subséquent de personnes pouvant exercer ce rôle. À défaut ou lors de conflits entre ces personnes, il revient alors au médecin concerné, le cas échéant dans le cadre d’une concertation pluridisciplinaire, de veiller aux intérêts de la personne malade.
Concernant le TJ mineur : l’article 2 énonce que le patient mineur est associé à l’exercice de ses droits selon son âge et sa maturité. Cela signifie qu’au minimum le mineur reçoit toute information concernant son état de santé et les soins qui lui seront prodigués. Si le mineur est considéré par le médecin qui en a la charge comme détenteur de la capacité de discernement compris comme la possibilité du mineur à être apte à estimer et apprécier ses intérêts, alors il exerce ses droits de manière autonome. Aucune notion ou limite d’âge n’est fixée par la loi. Cette capacité de discernement est laissée à l’appréciation du médecin. Rien n’empêche ce dernier à recourir à l’avis d’un confrère psychologue ou psychiatre pour déterminer cette aptitude. Cette capacité (dite de fait) n’est octroyée par le législateur qu’en matière de soins de santé. En cas de doute, le médecin doit prendre les mêmes mesures que dans le cas du mineur incapable de discernement. Ses droits sont exercés par les parents ou le tuteur légal. En absence des parents ou s’il le juge nécessaire pour l’intérêt exclusif de l’enfant ou si son abstention thérapeutique engendre un risque vital pour l’enfant, il est laissé à la discrétion du médecin prescripteur la mise en œuvre du traitement. Dans ce cas, le médecin devra justifier son acte et singulièrement prouver le processus informatif, préalable à tout acte médical. Enfin, si l’intérêt du mineur est menacé, le médecin peut recourir au tribunal de la jeunesse afin d’imposer des mesures d’aide contraignante.
En cas d’incertitude concernant l’existence ou non d’une volonté exprimée au préalable par le patient ou son représentant, toute intervention est pratiquée immédiatement par le praticien professionnel toujours dans l’intérêt du patient. C’est le cas lorsqu’une personne inconsciente est amenée aux urgences et qu’aucun membre de la famille n’est joignable.
D’un point de vue pénal : le médecin qui outrepasse la volonté du témoin de Jéhovah de ne pas être transfusé ne sera pas pénalement responsable par l’application de « l’état de nécessité ». Pour être applicable, « l’état de nécessité » implique la rencontre de quatre conditions strictes et cumulatives :
- il faut être en présence de 2 valeurs ou intérêts dont l’une semble plus importante que l’autre (principe de proportionnalité). Le médecin choisit volontairement de réaliser une infraction (ici celle de transgresser le refus de soins) pour sauver une vie ;
- et, il faut que la valeur considérée comme de moindre valeur (ici le consentement) soit légalement protégée, c’est-à-dire consacrée par une loi ou une règle de droit ;
- et, il faut une menace imminente (c’est-à-dire à brève échéance), grave et certaine ;
- et, il faut qu’il n’y ait pas d’autres alternatives pour sauver cette valeur.
Il faudra donc prouver en cas de litige que la transfusion réalisée sans le consentement du patient était absolument vitale et qu’aucune alternative n’était possible dans le cas d’espèce.
Le contexte psychologique est donc particulier pour le patient et pour l’équipe médicale (19,20).
La difficulté réside dans le fait que le devoir d’assistance à personne en danger fait face au principe de recueil de consentement libre et éclairé de la personne.
L’équipe médicale s’interdit tout jugement concernant la légitimité même des croyances religieuses des TJ, et s’engage vis-à-vis des patients TJ à tout mettre en œuvre pour éviter le recours à la transfusion. Cela signifie que les médecins exposent clairement le risque de décès et demandent en retour à leur patient d’accepter de les libérer de la charge morale d’avoir à les laisser mourir.
Cependant, il ressort de déclarations d’ex-TJ que le caractère libre et volontaire de leur choix n’est souvent pas rempli. Ce manque d’autonomie réside dans le fort investissement de la relation médecin/malade par des proches très interventionnistes, souvent TJ eux-mêmes, et dont les objectifs seraient moins de soutenir le patient dans l’expression de sa volonté, que de défendre à tout prix leurs propres convictions. Ce problème n’est qu’en partie résolu par le « colloque singulier ». En effet, l’opposition collective des TJ contre les transfusions sanguines est si forte et constante qu’il est à craindre qu’en cas d’administration d’une transfusion à l’encontre de la volonté du patient, ils seront amenés à exclure ce TJ, avec les répercutions psychologiques qui en résultent ; et à refuser complètement les aides spécialisées de deuxième et troisième lignes. Ne pas respecter le refus peut donc créer une situation dans laquelle la tentative de réduire le nombre de victimes aura pour résultat d’augmenter ce nombre.
C’est pourquoi, tenant compte de ces difficultés, le Comité de Bioéthique reste d’avis qu’il convient de collaborer avec les TJ dans la mesure du possible. Les représentants de la Congrégation chrétienne des TJ en Belgique ont fait expressément savoir qu’ils désirent collaborer avec le corps médical et ne recherchent pas les conflits.
Tenant compte de ces subtilités sociologiques complexes, le fait que les TJ disposent d’une certaine marge de manœuvre pour juger s’ils peuvent accepter ou non tel ou tel produit ouvre petit un espace de négociations dans lequel pourra être réalisé, en connaissance de cause par les deux partis, un accord sur une stratégie de soins.
CONCLUSION
La prise en charge des TJ dans les chirurgies à risque de saignement est un challenge médical, psychologique, éthique et légal. Les stratégies d’épargne sanguine permettent de soigner ces patients suivant leurs convictions et en diminuant les risques opératoires ; qui restent cependant non négligeables (21). Ces stratégies sont mises en place suivant le cadre légal belge : l’équipe médico-chirurgicale doit respecter le refus d’une transfusion sanguine de nécessité vitale quand elle est formulée par un TJ majeur et capable après l’avoir informé des conséquences de son refus lors d’un colloque singulier, lui avoir fait signer un document écrit constatant son refus et exposant les alternatives qu’il accepte. Ce document de décharge complète le dossier médical dans l’hypothèse où un tiers viendrait à accuser l’équipe médicale de non-assistance à personne en danger (art. 422bis du code pénal) ou d’homicide par imprudence (art. 418 du code pénal) (20).
RECOMMANDATIONS PRATIQUES
- Connaître les procédures chirurgicales à risque de saignement
- Être conscient du challenge médical, éthique et légal que représente la prise en charge d’un patient témoin de Jéhovah
- Anticiper les risques, mettre en place les stratégies d’épargne sanguine le plus tôt possible et durant toute la prise en charge
- Travailler en équipe : médecin anesthésiste, médecin intensiviste, chirurgien et médecin généraliste.
- Respecter le contexte psychologique et le cadre légal belge
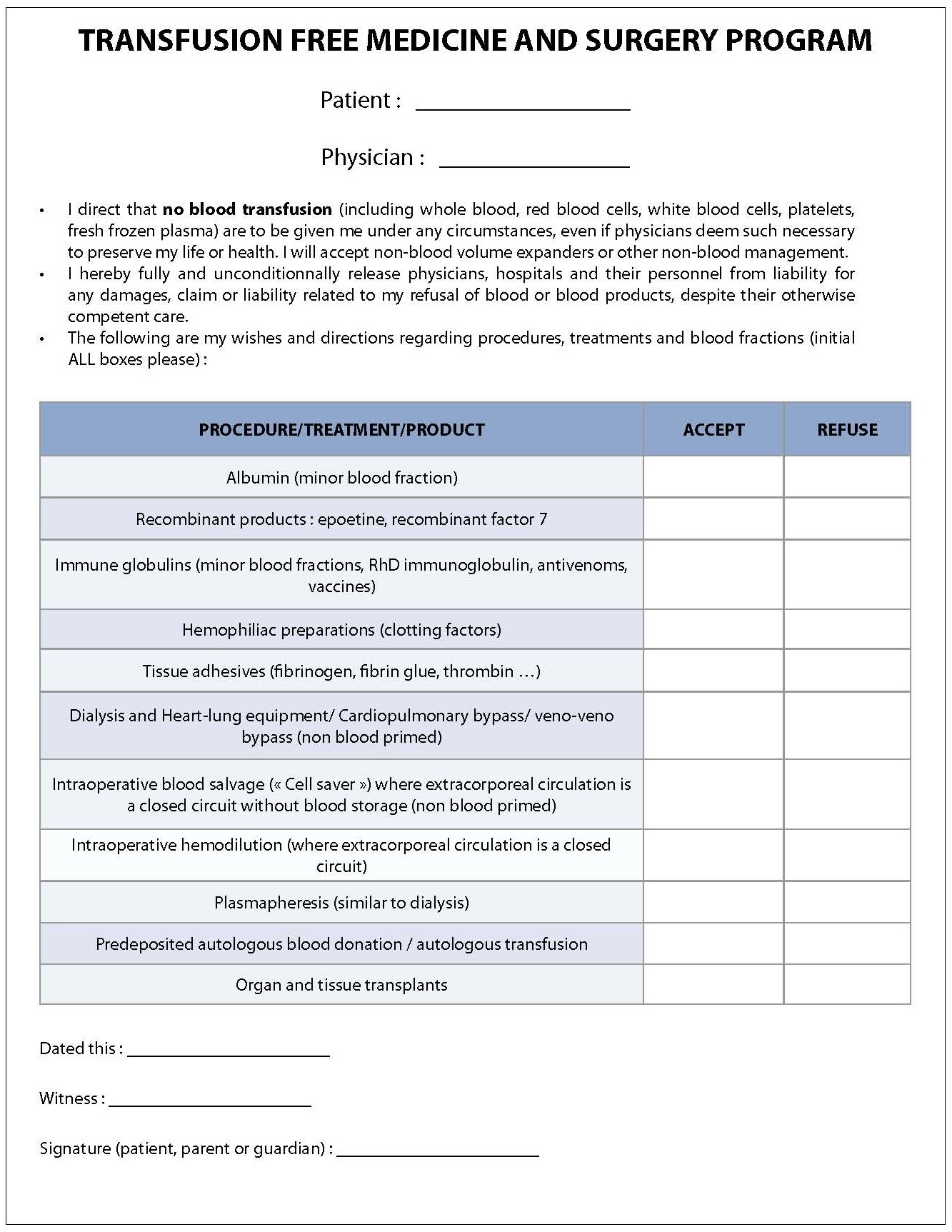
- Faire signer un document de décharge devant figurer dans le dossier médical. Ci-dessous une proposition de document de décharge (document modifié à partir des travaux du Professeur Jabbour (16) )
REMERCIEMENTS
Je tiens tout particulièrement à remercier le Professeur Patrice Forget qui m’a toujours encouragée et guidée dans la conception et la réalisation de ce travail, et sans qui rien n’aurait été possible.
Je tiens ensuite à remercier le Professeur Mona Momeni pour son soutien, son aide, l’intérêt et le temps qu’elle a consacrés à mon travail.
Je tiens enfin à remercier les Professeurs Hermans et Jabbour pour leurs précieux conseils.
Les auteurs n’ont aucun conflit d’intérêt à déclarer.
AFFILIATIONS
(1) Pr. Mona Momeni, MD, PhD
Cliniques universitaires Saint Luc
Département de médecine aiguë
Service d’Anesthésiologie
Avenue Hippocrate 10
1200 Bruxelles
(2) Pr. Dr. Patrice Forget, M.D., Ph.D.
Vrije Universiteit Brussel (VUB), Universitair Ziekenhuis Brussel (UZ Brussel)
Anesthesiology and Perioperative Medicine
Laarbeeklaan 101,
1090 Brussels, Belgium
CORRESPONDANCE
Dr. Virginie Faucon
Cliniques universitaires Saint-Luc
Anesthésie et Réanimation
Avenue Hippocrate 10
B-1200 Bruxelles
virginie.faucon@student.uclouvain.be
RÉFÉRENCES
- Chand NK, Subramanya HB, Rao GV. Management of patients who refuse blood transfusion. Indian J Anaesth 2014;58(5):658. Ouvrir dans PubMed
- Lawson T, Ralph C. Perioperative Jehovah’s Witnesses: a review. Br J Anaesth 2015;115(5):676-687. Ouvrir dans PubMed
- 2013 Yearbook of Jehovah Witnesses. Watchtower Bible and Tract Society of New York, INC., New York, 2013.
- INAMI. Prix du sang humain et des produits sanguins labiles 2017 [updated 15 décembre 2016. ; . Available from: http://www.inami.fgov.be/SiteCollectionDocuments/sang-humain-produits-sa....
- Koenig-Oberhuber V, Filipovic M. New antiplatelet drugs and new oral anticoagulants. Br J Anaesth 2016;117(suppl 2):ii74-ii84. Ouvrir dans PubMed
- Spence RK, Carson JA, Poses R, Pello M, Alexander J, Popovich J, et al. Elective surgery without transfusion: influence of preoperative hemoglobin level and blood loss on mortality. Am J Surg 1990;159(3):320-324. Ouvrir dans PubMed
- Practice guidelines for perioperative blood transfusion and adjuvant therapies: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Blood Transfusion and Adjuvant Therapies. Anesthesiology 2006;105(1):198-208. Ouvrir dans PubMed
- Kristensen SD, Knuuti J, Saraste A, Anker S, Botker HE, De Hert S, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur J Anaesthesiol 2014;31(10):517-573. Ouvrir dans PubMed
- Kozek-Langenecker SA, Ahmed AB, Afshari A, Albaladejo P, Aldecoa C, Barauskas G, et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology: First update 2016. Eur J Anaesthesiol 2017 Jun;34(6):332-395. Ouvrir dans PubMed
- Remmers PA, Speer AJ. Clinical strategies in the medical care of Jehovah’s Witnesses. Am J Med 2006;119(12):1013-1018. Ouvrir dans PubMed
- Shakur H, Roberts I, Bautista R, Caballero J, Coats T, Dewan Y, et al. Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet 2010;376(9734):23-32. Ouvrir dans PubMed
- Hébert PC, Wells G, Blajchman MA, Marshall J, Martin C, Pagliarello G, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999;340(6):409-417. Ouvrir dans PubMed
- Carson JL, Guyatt G, Heddle NM, Grossman BJ, Cohn CS, Fung MK, et al. Clinical Practice Guidelines From the AABB: Red Blood Cell Transfusion Thresholds and Storage. JAMA 2016;316(19):2025-2035. Ouvrir dans PubMed
- Carson JL, Stanworth SJ, Roubinian N, Fergusson DA, Triulzi D, Doree C, et al. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochr Libr 2016. Ouvrir dans PubMed
- Goodnough LT. Preoperative Management and Preparation for Transfusion-Free Surgery. In: Transfusion-Free Medicine and Surgery, 60-74, Blackwell Publishing; 2007.
- Jabbour N. Basic principles of bloodless medicine and surgery. In: Transfusion-Free Medicine and Surgery, 338-346, John Wiley & Sons, Ltd; 2014.
- Murkin JM, Arango M. Near-infrared spectroscopy as an index of brain and tissue oxygenation. BJA: Br J Anaesth 2009; 103 (suppl1): i3–i13. Ouvrir dans PubMed
- Perel P, Roberts I, Ker K. Colloids versus crystalloids for fluid resuscitation in critically ill patients. Cochr Libr 2013. Ouvrir dans PubMed
- Belgique Ccdmd. Avis n° 16 - Transfusion sanguine et les Témoins de Jéhovah. 2002.
- Barbot J, «Entre volonté du patient et nécessité médicale. Les médecins face au refus de transfusion». J Econ Med 2009; 27: 123-133.
- Carson JL, Noveck H, Berlin JA, Gould SA. Mortality and morbidity in patients with very low postoperative hb levels who decline blood transfusion. Transfusion 2002; 42 : 812 - 818. Ouvrir dans PubMed