Introduction
Un bloc auriculo-ventriculaire complet doit faire l’objet d’un bilan exhaustif et toutes les pistes étiologiques sont à explorer. Bien que dans la majorité des cas, une fibrose des voies de conduction ou une cardiopathie ischémique (infarctus inférieur) sont à l’origine des troubles de conduction, il existe d’autres causes plus rares et réversibles. En effet, des désordres métaboliques (hyperthyroidie (1), hyperkaliémie (2)), infectieux (Lyme (3), Borrelia, Chagas, myocardite), inflammatoires (œdème post chirurgical, sarcoidose) et néoplasiques ont été décrits (4). Parmis ceux-ci, le lymphome cardiaque primitif est une cause exceptionnelle. Il est décrit comme un lymphome non hodgkinnien touchant uniquement le cœur et/ou le péricarde (5). Le diagnostic est difficile et souvent tardif en raison d’une présentation insidieuse. Cependant, avec un traitement adéquat, la réponse thérapeutique peut être spectaculaire.
Vignette clinique
Une patiente de 77 ans, immunocompétente, avec comme comorbidité un diabète de type 2, une hypertension et de la dyslipidémie, se présente en salle d’urgence pour de la dyspnée (classe NYHA III), de l’asthénie depuis quelques semaines ainsi qu’une douleur thoracique constrictive. Elle décrit également une inappétence et des épisodes de sudations profuses.
L’examen clinique est banal. La biologie révèle un léger syndrome inflammatoire (CRP 30 mg/l), des LDH normaux (245 U/L) et des troponines T majorées (65 pg/ml pour une normale < 14).
L’ECG 12 dérivations montre un bloc auriculo-ventriculaire du deuxième degré Mobitz II 2/1 avec ondes T négatives en antéro-septal (Figure 1).

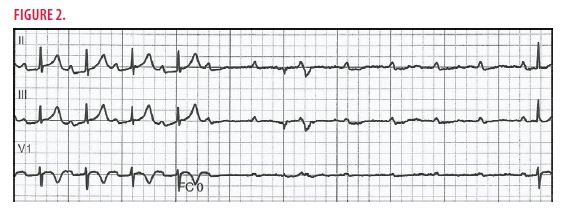
La patiente est monitorisée et quelques heures plus tard, elle développe du bloc auriculo-ventraire complet (Figure 2).
Un pacemaker endoveineux temporaire est mis en place et le bilan est poursuivi avec la réalisation d’une échocardiographie. Celle-ci révèle la présence d’un processus tumoral ventriculaire gauche et d’un épanchement péricardique discret. La masse entreprend la paroi antérieure, l’apex et la chambre de chasse du ventricule droit et prend très largement le contraste échographique (Figure 3a et b).

Le scanner thoracique confirme la présence de tissu tumoral hétérogène développé en nappe, au niveau du septum, de la paroi antérieure du ventricule gauche (VG) jusqu’à l’apex. Cette masse est traversée par l’artère coronaire interventriculaire antérieure sur toute sa longueur (Figure 4). Au 18-FDG-PET, le processus tumoral présente un métabolisme très intense mais l’épanchement péricardique est par contre peu actif et il n’y a pas d’autre foyer suspect.

Des biopsies myocardiques sont réalisées par cathétérisme cardiaque et un pacemaker double chambre définitif est implanté et programmé en DDD avec une fréquence de base à 50/min. Les résultats des biopsies reviendront positifs pour un lymphome B diffus à grandes cellules de type germinal center. Durant la même hospitalisation, un traitement par chimiothérapie de type RCHOP (Rituximab, Cyclophosphamide, Hydroxyadriamycine, Oncovin, Prednisone) est débuté. Dix semaines plus tard, une échocardiographie est répétée et démontre une évolution favorable avec disparition de la masse myocardique (figure 5). Lors du contrôle du pacemaker 9 mois plus tard, la stimulation ventriculaire gauche cumulée sur la période est inférieure à 1%, indiquant une récupération quasi complète de la conduction auriculo-ventriculaire.

Discussion
Le lymphome primitif cardiaque est une pathologie rare, représentant 1% des tumeurs cardiaques primitives (7). Il entreprend souvent le cœur droit (92%) et préférentiellement les oreillettes aux ventricules, ce qui fait la particularité de notre patiente.
La présentation clinique est variable. La dyspnée est la plus fréquente (64%), ensuite viennent les arythmies (56%), principalement atriales. Les autres atteintes concernent des troubles de conduction comme l’apparition d’un bloc de branche droit ou gauche ou plus sévèrement du bloc auriculo-ventriculaire complet ou de la tachycardie ventriculaire (5). Certains patients présentent des précordialgies, de l’insuffisance cardiaque aigue/subaiguë, ou une tamponnade. Les symptômes généraux ne sont pas toujours présents (fièvre, sudation, perte de poids). L’échocardiographie transthoracique permet de détecter la présence d’une masse intracardiaque avec une sensibilité de 55-60%, la voie transoesophagienne améliore nettement la sensibilité du test avec des valeurs proches de 97-100% (8,9,10). L’utilisation du produit de contraste en échographie permet souvent de mieux définir les limitations de la tumeur. La captation du produit de contraste témoigne d’une vascularisation importante et permet par exemple de faire la distinction avec un thrombus (10). Pour caractériser de manière précise la morphologie et la localisation de la tumeur, une imagerie doit être réalisée. Les deux techniques utilisées sont le scanner et la résonnance magnétique (sensibilité du scanner : 70%, sensibilité de l’IRM : 90%) (8). Enfin le PET CT est utile pour le diagnostic différentiel entre un lymphome cardiaque primitif et l’extension cardiaque d’un lymphome d’une autre origine. Le diagnostic doit cependant être confirmé par l’analyse anatomopathologique du tissu (biopsie chirurgicale ou intravasculaire).
Plusieurs facteurs de mauvais pronostic ont été décrits. Parmi ceux-ci, nous retenons l’atteinte du ventricule gauche, l’atteinte extracardiaque, l’immunodépression. L’absence de symptômes cardiaques et particulièrement l’absence d’arythmie est également de mauvais pronostic en raison d’un diagnostic retardé (5).
Le traitement se base essentiellement sur la chimiothérapie avec un taux de rémission de 71% (8). Dans certains cas, la chirurgie ou la radiothérapie peuvent être adjoint à la chimiothérapie.
Conclusion
Cet article illustre l’importance de rechercher un diagnostic étiologique en présence d’un bloc auriculo-ventriculaire. Le lymphome cardiaque primitif est une pathologie rare avec une mortalité importante sans traitement. Avec un diagnostic précoce et un traitement adéquat, la réponse thérapeutique peut être spectaculaire et permettre de normaliser les troubles de conduction.
Affiliations
1 Cliniques universitaires Saint-Luc, cardiologie, B-1200 Bruxelles
Correspondance
Dr. Justine Vereeke
Cliniques universitaires Saint Luc
Cardiologie
Avenue Hippocrate 10
B-1200 Bruxelles
justine.vereeke@uclouvain.be
Références
- Al Bannay R., Husain A., Khalaf S. Complete heart block in thyrotoxicosis, is it a manifestation of thyroid storm? A case report and review of the literature. Case Rep Endocrinol. 2012, doi:10.1155/2012/318398.
ouvrir dans Pubmed - Kim NH, Oh SK., Jeong JW. Hyperkalaemia induced complete atrioventricular block with a narrow QRS complex. Heart. 2005;91:p.e5.
ouvrir dans Pubmed - Kostic T, Momciovic S, Perisic ZD, et al. Manifestations of Lyme carditis. Int J Cardiol. 2016;232:24–32.
ouvrir dans Pubmed - Crisel RK, Knight BP, Kim SS. Reversible, complete atrioventricular block caused by primary cardiac lymphoma in a nonimmunocompromised patient. J Cardiovasc Electrophysiol. 2012;23(12):1386-1389.
ouvrir dans Pubmed - Petrich A, Cho SI., Billett H. Primary cardiac lymphoma. Cancer. 2011;117(3):581-589.
ouvrir dans Pubmed - Frikha Z, Abid L, Kammoun S. Cardiac tamponade and paroxysmal third-degree atrioventricular block revealing a primary cardiac non-Hodgkin large B-cell lymphoma of the right ventricle: a case report. J Med Case Rep. 2011;5(1):433.
ouvrir dans Pubmed - Hu S, Zhu LL, Hu CH. Imaging Features of Primary Cardiac Lymphoma. Chin Med J. 2017;130(17):2123.
ouvrir dans Pubmed - Faganello G, Belham M, Wilde P. A case of primary cardiac lymphoma: analysis of the role of echocardiography in early diagnosis. Echocardiography. 2007;24(8):889-892.
ouvrir dans Pubmed - Mugge A, Daniel WG, Lichtlen PR. Diagnosis of noninfective cardiac mass lesions by two-dimensional echocardiography. Comparison of the transthoracic and transesophageal approaches. Circulation. 1991;83:70-78.
ouvrir dans Pubmed - Mankad R., Herrmann J. Cardiac tumors: echo assessment. Echo Res Pract. 2016;3(4):65–77.
ouvrir dans Pubmed