Introduction
La fibrillation auriculaire non valvulaire (FANV) et la maladie thrombo-embolique veineuse (MTEV) représentent les principales indications justifiant le recours à l’anticoagulation orale. Au cours de la dernière décennie, de multiples études ont démontré que les anticoagulants oraux directs (AODs) peuvent se substituer aux anti-vitamine K (AVKs) avec une efficacité antithrombotique supérieure (FANV) ou égale (MTEV). Ces études ont mis en évidence que les AODs entraînent globalement moins de complications hémorragiques (majeures et cérébrales) même si les hémorragies digestives ne sont, pour leur part, pas inhabituelles et requièrent une vigilance et des précautions particulières.
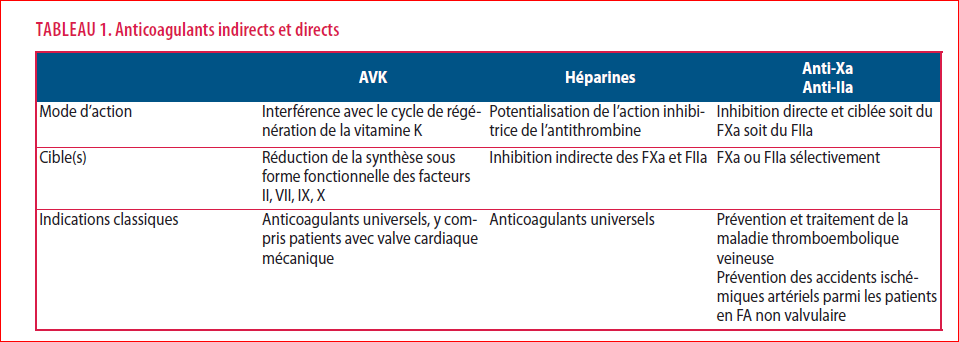
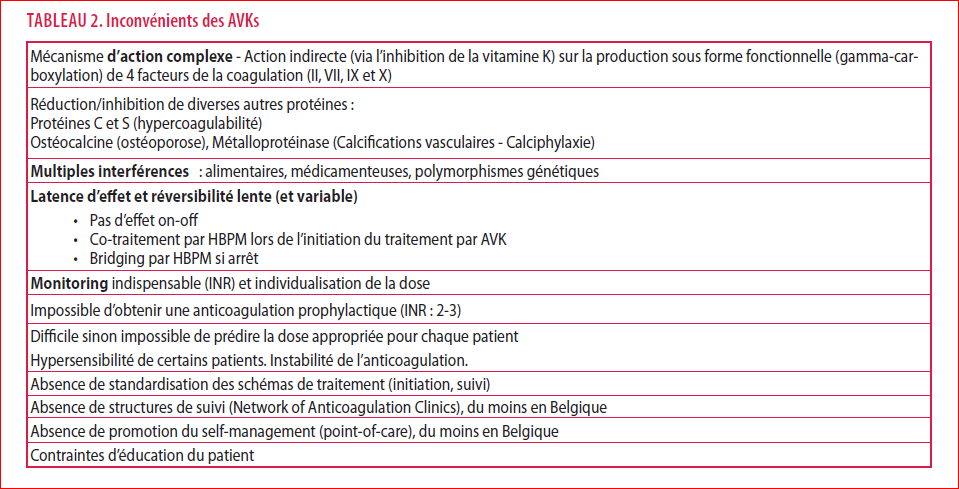
Outre l’efficacité antithrombotique et le moindre risque hémorragique, les avantages des AODs sont multiples : prise orale une ou deux fois par jour, monothérapie (pas d’initiation par héparines de bas poids moléculaires (HBPM) en début de traitement pour certains d’entre eux ou de relais par HBPM en cas d’arrêt), délai d’action précoce, demi-vie courte et réversibilité rapide, effet thérapeutique prévisible (absence de monitoring requis pour adapter la posologie), interactions médicamenteuses et alimentaires limitées, éducation des patients relativement simple. Ces avantages, liés au mécanisme d’action différent (Tableau 1), contrastent avec les multiples faiblesses des anticoagulants classiques, en particulier les AVKs (Tableau 2).
Parmi les faiblesses des AODs, citons l’élimination par les reins, toutefois variable d’un AOD à l’autre, mais pouvant entraîner l’accumulation en cas de dégradation de la fonction rénale, la multiplicité des molécules ayant chacune leur spectre spécifique de posologies, de précautions d’utilisation et d’indications validées, source d’éventuelle confusion, incertitudes concernant leur utilisation appropriée dans certaines indications.
Des données récentes issues de registres ou de sous-analyses des études de phase III nous fournissent un nouvel éclairage sur le potentiel d’utilisation des AODs et du rivaroxaban (Xarelto®) en particulier, dans de nombreux contextes tels que l’insuffisance rénale, les patients gériatriques y compris très âgés, les patients diabétiques, la MTEV associée au cancer ou survenant chez les enfants. En outre, le potentiel de protection vasculaire artérielle des AODs chez les patients en FANV et les indications d’une bithérapie antithrombotique prolongée (AOD + acide acétylsalicylique (AAS) à faible dose) sont actuellement mieux établies. C’est toutefois dans la prévention des affections thrombotiques artérielles par l’association d’une petite dose de rivaroxaban et d’AAS que des progrès majeurs ont été réalisés.
Ce sont ces données récentes qui révolutionnent la prise en charge médicamenteuse des affections thrombotiques que cet article ambitionne de revoir de façon synthétique et pratique.
Rivaroxaban et FANV chez le patient gériatrique
La FANV représente le trouble du rythme cardiaque le plus fréquent. Sa prévalence est d’environ 1 % dans la population générale et elle augmente avec l’âge. On estime que près de 70 % des patients en FANV ont plus de 75 ans et que la prévalence est supérieure à 10 % chez les personnes de plus de 80 ans (17 % au-delà des 85 ans). Ces chiffres sont très certainement sous-estimés.
Rivaroxaban et FANV au-delà de 75 ans
Il est recommandé que tous les patients de 75 ans ou plus présentant une FANV reçoivent un traitement anticoagulant, en tenant compte du risque hémorragique. Le risque hémorragique augmentant avec l’âge, il peut conduire les professionnels de santé à renoncer au traitement anticoagulant. Seuls 50 % des patients résidant en maison de retraite et porteurs de FANV reçoivent un traitement anticoagulant selon une étude récente (1). Pourtant, les recommandations de la Société Européenne de Cardiologie (ESC) indiquent que le risque majeur d’AVC en l’absence de traitement anticoagulant est souvent supérieur au risque hémorragique sous anticoagulant, et ce même chez les patients âgés, que ce soient les patients avec des troubles cognitifs ou les patients fragiles et chutant fréquemment.
Les vastes études cliniques de phase III (RELY, ROCKET-AF, ARISTOTLE et ENGAGE AF) nous indiquent que les AODs permettent de réduire l’incidence des accidents thrombotiques (AVC et embolie systémique) et des hémorragies (majeures et cérébrales) chez les patients de plus de 75 ans en FANV (rapport aux AVKs).
Des données de registres récents confirment les bénéfices des AODs chez les personnes (très) âgées. Le bénéfice clinique net en faveur des AODs a été démontré dans le cadre du registre PREFER comparant 1556 patients sous AODs et 2269 patients sous AVKs de plus de 75 ans, les hémorragies majeures étant numériquement plus fréquentes sous AVK que sous AODs chez les patients à haut risque ayant un faible indice de masse corporelle ou un âge égal ou supérieur à 85 ans (2). Dans ce même registre, le critère d’évaluation composite intégrant les hémorragies majeures et les accidents ischémiques était clairement en faveur du rivaroxaban (HR (95% CI), 0.58 (0.4-0.86) par rapport aux AVKs.
Se basant sur des données de la vraie vie parmi des patients de plus de 80 ans, le rivaroxaban démontre également une efficacité antithrombotique supérieure à celle des AVKs (HR (95% CI): 0.61 (0.39-0.93) (3).
Rivaroxaban et FANV au-delà de 80 ans : l’étude SAFIR-AC
L’étude SAFIR-AC, prospective observationnelle, a étudié la sécurité d’utilisation du rivaroxaban parmi des patients très âgés (≥80 ans) présentant une FA non-valvulaire, suivis en gériatrie, en comparaison avec une cohorte de patients traités par AVK. SAFIR-AC a permis de suivre pendant 1 an 995 patients sous rivaroxaban et répartis dans 33 centres de gériatrie. Un suivi par téléphone était effectué tous les 3 mois, comprenant les résultats d’une évaluation gériatrique globale, des examens de routine réalisés en laboratoire ainsi que les scores obtenus à différents tests tels que HAS-BLED, HEMORR2AHGES, ATRIA et CHA2DS2-VASc. Les résultats obtenus pour cette cohorte ont été comparés à ceux obtenus parmi les 924 patients d’une cohorte similaire, traités eux par AVK. L’âge moyen des patients était de 86 ans, et 23% d’entre eux avaient plus de 90 ans. La majorité était des femmes (61%). Les principales comorbidités étaient l’hypertension (77%), la malnutrition (49 %), l’anémie (43%), la démence (39%), l’insuffisance cardiaque (36%) et les chutes (27 %). Par ailleurs, 48 % des patients avaient un taux de filtration glomérulaire estimé inférieur à 50 mL/min (eGFR < 50 mL/min)(9). Après un an de suivi, le taux d’événements hémorragiques majeurs était de 6,4 % dont 0,8 % d’hémorragies fatales et 1,1% d’hémorragies intracrâniennes. Le taux d’accidents ischémiques était de 1,4 %. La comparaison avec les résultats de la cohorte de patients traités par AVK met notamment en évidence une incidence moindre des événements hémorragiques majeurs (– 46 % ; [HR 0,54 ; IC 95 % (0,38-0,78)], en particulier des hémorragies intracrâniennes (– 64 % ; (HR 0,36 ; IC 95 % (0,36-0,76)) chez les patients sous rivaroxaban en comparaison avec la cohorte AVK (Figure 1).
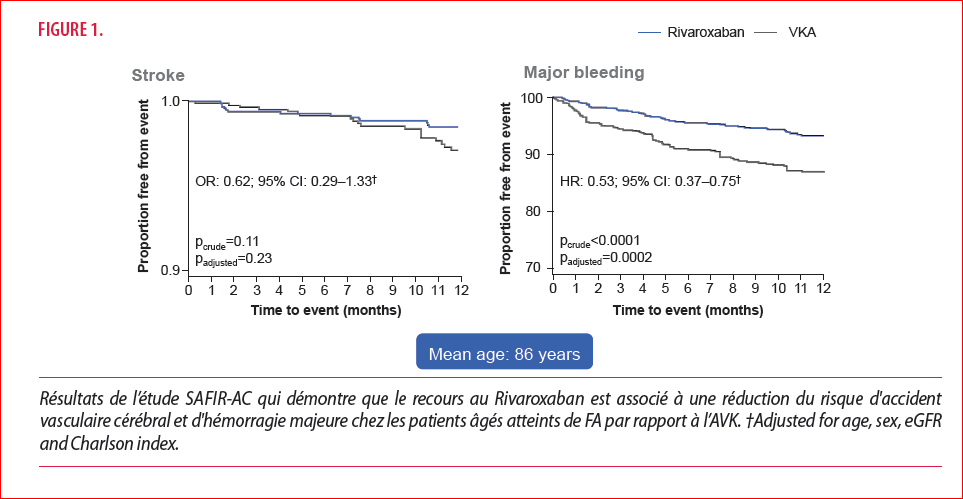
On observe également une tendance à la diminution des AVC ischémiques (HR : 0,62 ; IC 95 % (0,29-1,33)). Dans l’étude Rocket AF, qui a évalué une population plus jeune (âge moyen : 73 ans), des taux similaires d’hémorragies ont été observés par rapport aux AVK (critère primaire de safety, HR 1,03 ; IC 95 % (0,96-1,11).
Cette étude a le mérite d’avoir étudié une population très fragile constituée de patients très âgés, polypathologiques et polymédiqués en vie réelle et corrobore les données des essais randomisés. Cette étude confirme le bénéfice des anticoagulants oraux, et plus particulièrement du rivaroxaban. Ce bénéfice est même plus prononcé que chez les patients plus jeunes des essais randomisés car ces patients très âgés sont à très haut risque thrombotique et ischémique. Les patients très âgés atteints de FANV soit ne sont pas anticoagulés ou ne reçoivent pas un traitement approprié.
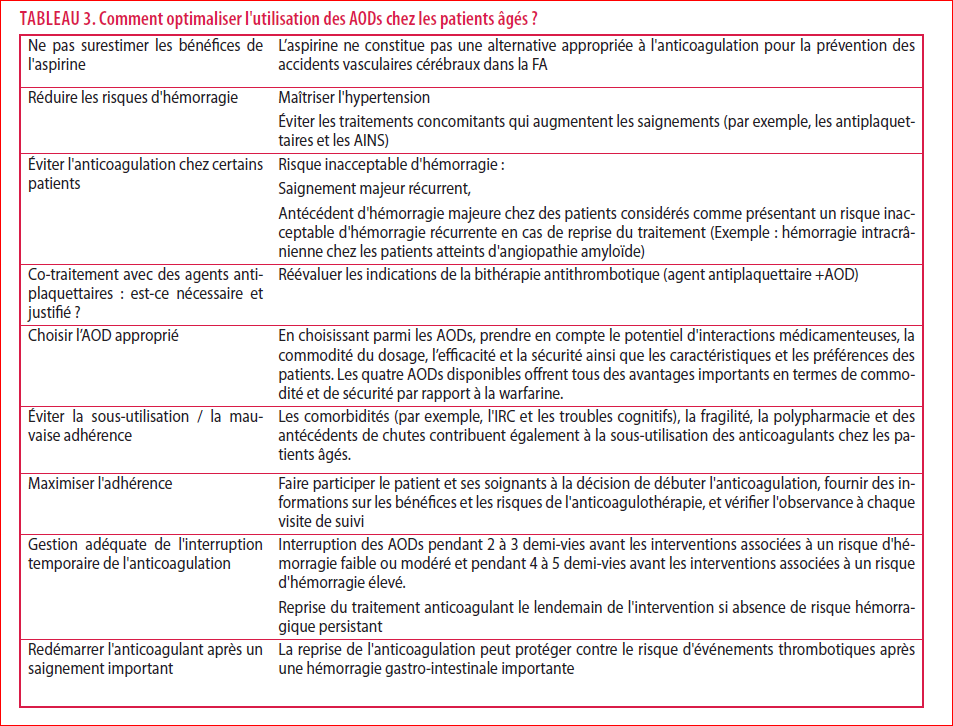
L’étude SAFIR-AC est la première étude observationnelle prospective chez ce type de patients traités par rivaroxaban. Elle complète les données de l’étude Rocket AF de phase III et confirme que le rivaroxaban peut être utilisé chez les patients gériatriques très âgés. De nombreuses précautions sont recommandées pour optimiser l’utilisation des AODS chez les patients âgés (Tableau 3).
Rivaroxaban et insuffisance rénale sévère
On estime que 30 % des patients en FANV présentent une insuffisance rénale chronique (IRC). Par ailleurs, 10 à 20 % des patients en IRC sont en FANV versus 1 à 5 % de la population générale. La FANV et l’IRC partagent de nombreux facteurs de risque et s’entretiennent mutuellement. Le risque hémorragique est classique-ment doublé chez le patient en IRC et 3 à 10 fois plus élevé chez le patient en hémodialyse par rapport à la population générale. Pour ce qui est du risque thrombotique, les patients dialysés en FA courent un risque 3 fois plus élevé de développer un AVC ischémique (10 % des patients dialysés en FA sont hospitalisés annuellement pour AVC ischémique). Malgré ces données, de nombreux patients dialysés en FANV ne sont pas anticoagulés. En outre, l’anticoagulation par AVK se révèle problématique chez les patients en IRC avec seules 45 % des valeurs d’INR obtenues chez les patients en IRC étant dans le range thérapeutique. Dans ce contexte, on peut certainement s’interroger sur la place des AODs pour les patients en IRC.
Pour ce qui est de la pharmacocinétique, l’élimination rénale des AODs est de 80 % (Dabigatran Etexilate) et comprise entre 25-35 % pour les agents ciblant le facteur Xa. Elle est de 33 % pour le rivaroxaban. La demi-vie du rivaroxaban de 8.3 heures (clearance de créatinine > 80 ml/min) s’allonge tout au plus à 9.5 heures en cas d’IR sévère (clearance de la créatinine < 30 ml/min). L’aire sous la courbe, témoin de l’exposition du patient, double en cas d’insuffisance rénale sévère (4), alors qu’elle augmente d’un facteur 6 pour le Dabigatran Etexilate dans les mêmes circonstances (Tableau 4).
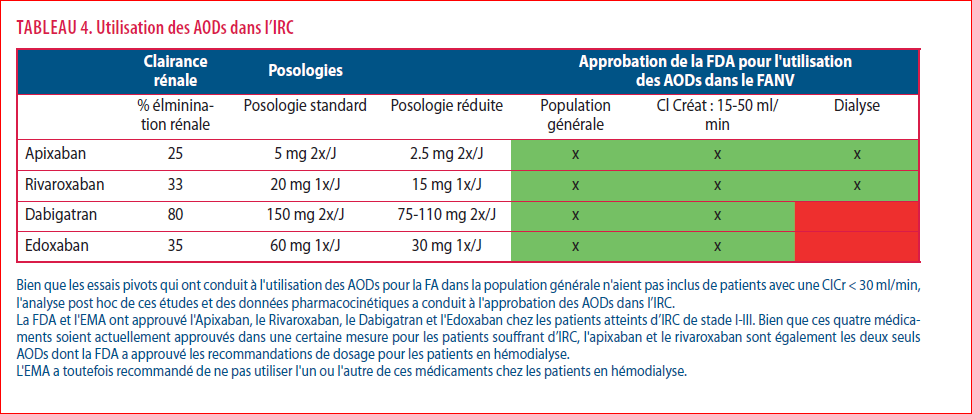
Les essais cliniques de phase III ont exclu les patients avec IRC (clairance de la créatinine < 30 ml/min). Diverses analyses post-hoc de ces études ont abouti à l’approbation de l’utilisation des AODs chez les patients avec IRC, y compris en dialyse par la FDA aux USA, du moins pour l’Eliquis et le rivaroxaban.
Une étude belge a bien démontré que chez les patients dialysés sans fonction rénale résiduelle, l’exposition à une dose réduite de 10 mg est semblable à celle d’une posologie de 20 mg chez des sujets sains sans insuffisance rénale, sans évidence d’une accumulation en cas d’exposition répétée (5).
Bénéfices du Rivaroxaban chez les patients avec IRC en FANV
Les données ci-dessus sont encourageantes pour promouvoir l’utilisation du rivaroxaban parmi les patients avec IRC, y compris dialysés. C’est dans ce sens que plaide une vaste étude ayant inclus 1896 patients sous rivaroxaban (38,7% ont reçu une dose <20 mg/j) et 4848 sous AVK, 88 % des patients inclus ayant une IRC de stade 5 ou étant en hémodialyse. Le rivaroxaban n’a pas réduit de manière significative les accidents vasculaires cérébraux, les embolies systémiques (HR = 0,55, 95 % IC = 0,27-1,10) ou les accidents vasculaires ischémiques (HR = 0,67, 95 % IC = 0,30-1,50) seuls, mais son utilisation était associée à une réduction significative de 32 % (95 % IC = 1-53 %) du risque de saignement majeur par rapport aux AVKs.
Cette étude suggère que pour les patients avec FANV avec une IRC de stade 4 ou 5 ou bénéficiant d’une hémodialyse, le recours au rivaroxaban semble associé à une réduction significative des hémorragies majeures par rapport à la warfarine (6). En Belgique toutefois, l’utilisation du rivaroxaban dans ce contexte se fait hors autorisation de mise sur le marche (AMM) (off-label use).
Effet néphroprotecteur du Rivaroxaban
Le déclin de la fonction rénale est fréquent chez les patients atteints de FANV traités par des anticoagulants oraux. Les AVKs peuvent entraîner ou aggraver une néphropathie en favorisant les calcifications rénovasculaires, un effet lié à l’inhibition des certaines métalloprotéinases dépendantes de la vitamine K et impliquées dans le remodelage vasculaire. Les AODs pourraient être potentiellement protecteurs car ils inhibent le facteur Xa et la thrombine, deux facteurs dont il a été démontré qu’ils sont associés à l’inflammation vasculaire.
L’effet néphroprotecteur des AODs a été évalué dans une vaste étude publiée en 2017. En utilisant une importante base de données administratives américaine, 9769 patients avec FANV ont été identifiés. Tous avaient débuté un traitement anticoagulant entre le 1er octobre 2010 et le 30 avril 2016 par un AOD ou un AVK. Le risque cumulé au bout de 2 ans d’altération de la fonction rénale (réduction de la clairance, doublement de la créatinine sérique, insuffisance rénale aiguë) était moindre pour les patients sous AODs par rapport à ceux sous AVKs. En comparant chaque AOD avec la warfarine, il a été mis en évidence que rivaroxaban est associé à des risques plus faibles de diminution de ≥ 30% du degré de filtration glomérulaire, de doublement de la créatinine sérique et d’insuffisance rénale aigue. Même si le déclin de la fonction rénale est fréquent chez les patients atteints de FANV traités par des anticoagulants oraux, les AODs dont le rivaroxaban semblent associés à un risque plus faible d’effets indésirables sur la fonction rénale que la warfarine (7).
Dans l’étude RELOADED comparant 22339 traités par rivaroxaban (5121 présentant des problèmes rénaux) et 23552 patients sous AVK (7289 avaient une maladie rénale) suivis pendant 1.1 an, le rivaroxaban a réduit le risque de développement d’insuffisance rénale terminale et de dialyse par près de deux tiers pour la population globale (HR 0,34 (0,23 ; 0,51)) et par près de trois quarts pour les patients avec insuffisance rénale (HR 0,27 (0,16 ; 0,43)) (8). Ces données plaident en faveur d’un effet bénéfique des AODs qui préservent la fonction rénale par rapport aux AVKs.
Sur base de ces données, les guidelines mentionnent explicitement qu’à long terme les AODs (dont le rivaroxaban et le Dabigatran Etexilate) sont associés à un moindre risque d’effet délétère pour les reins que les AVKs parmi les patients en FANV (9)
Rivaroxaban et vitamine K chez les patients hémodialysés
Les AVKs ont été incriminés comme cause probable de calcifications vasculaires accélérées chez les patients en hémodialyse. Une carence fonctionnelle en vitamine K pourrait contribuer à leur susceptibilité à ces calcifications. L’effet du statut de la vitamine K sur la progression des calcifications vasculaires a été étudié parmi 132 patients en hémodialyse souffrant de FANV (10). Les patients ont été randomisés entre AVK avec un INR cible de 2-3, rivaroxaban 10 mg par jour, ou rivaroxaban 10 mg par jour plus vitamine K2 2000 µg trois fois par semaine pendant 18 mois. Les niveaux systémiques de dp-ucMGP (desphospho-uncarboxylated Matrix Gla Protein) ont été quantifiés pour évaluer le statut vasculaire en vitamine K de même que la charge en calcium de l’aorte. Le dp-ucMGP de base était très élevé dans tous les groupes. L’initiation ou la poursuite des AVK a encore augmenté le dp-ucMGP, alors que les niveaux ont diminué dans le groupe rivaroxaban et dans une plus large mesure dans le groupe rivaroxaban+vitamine K2, mais sont restés néanmoins élevés. Les changements des calcifications des artères coronaires, de l’aorte thoracique et des valves cardiaques n’étaient pas significativement différents entre les groupes de traitement. Les taux de mortalité, d’accidents vasculaires cérébraux et d’événements cardiovasculaires n’étaient pas différents entre les groupes. La fréquence des hémorragies n’était pas significativement différente, à l’exception d’un nombre plus faible d’épisodes d’hémorragies majeures et potentiellement mortelles dans les bras Rivaroxaban par rapport au bras AVK.
En conclusion, l’interruption de la prise d’AVK et des doses élevées de vitamine K2 améliorent le statut en vitamine K chez les patients sous hémodialyse, mais n’ont pas d’effet favorable significatif sur la progression des calcifications vasculaires. Les complications hémorragiques graves sont moins fréquentes sous Rivaroxaban que sous AVK. µ
Bénéfices du Rivaroxaban chez Les patients diabétiques en FA
La prévalence de la FANV et du diabète sucré sont en augmentation, et ces deux affections sont souvent associées (Figure 2).
De plus, le diabète sucré est un facteur de risque indépendant d’accident vasculaire cérébral chez les patients en FANV. Il était dès lors logique d’évaluer la sécurité et l’efficacité du rivaroxaban par rapport à la warfarine chez les patients souffrant de FANV et de diabète sucré dans une analyse secondaire pré-spécifiée de l’essai ROCKET-AF. Les 5 695 patients atteints de diabète (40 %) identifiés dans l’étude ROCKET-AF étaient plus jeunes, plus obèses et souffraient de FANV plus persistante. Moins nombreux étaient ceux qui avaient déjà présenté un accident vasculaire cérébral (le score CHADS2 comprend le diabète et l’accident vasculaire cérébral). L’efficacité relative du rivaroxaban et de la warfarine était similaire chez les patients atteints de diabète de type 2 (1,74 contre 2,14/100 patients-années, rapport de risque [HR] 0,82) et chez les patients sans diabète de type 2 (2,12 contre 2,32/100 patients-années, HR 0,92) (interaction P = 0,53). La sécurité du rivaroxaban par rapport à la warfarine en ce qui concerne les complications hémorragiques était indépendante du statut diabétique.
Des analyses exploratoires ajustées ont suggéré des taux d’accidents vasculaires cérébraux, de mortalité vasculaire et d’infarctus du myocarde 1,3, 1,5 et 1,9 fois plus élevés sur deux ans chez les patients atteints de diabète (11). Une réduction significative de près de 20 % de la mortalité cardiovasculaire a été mise en chez les patients diabétiques en FANV traités par rivaroxaban (2.83 décès/100 patient-années) versus ceux traités par warfarine (3.65 décès/100 patients-années) (HR (95% CI) : 0.8 (0.64-0.99).
L’efficacité et la sécurité relatives du rivaroxaban par rapport à la warfarine étaient similaires chez les patients avec et sans diabète, ce qui plaide en faveur de l’utilisation du rivaroxaban comme alternative à la warfarine chez les patients diabétiques atteints de FANV.
Rivaroxaban et risque réduit de fracture osseuse
Les antagonistes de la vitamine K peuvent contribuer à réduire la densité osseuse en diminuant les taux d’ostéocalcine et en inhibant les protéines de la matrice osseuse, ce qui pourrait augmenter le risque d’ostéoporose et de fractures. En utilisant les des bases de données de demandes administratives chez des patients atteints de FA non valvulaire de 2010 à 2015, 167275 nouveaux utilisateurs d’anticoagulation orale ont été identifiés et inclus. Ils avaient un âge moyen de 68,9 ans et étaient majoritairement de sexe masculin (62 %). Ont été pris en compte fractures de la hanche (en hospitalisation), les fractures nécessitant une hospitalisation et toutes les fractures (en hospitalisation et en consultation externe). La warfarine était l’anticoagulant le plus courant (n=82 625), suivie du rivaroxaban (n=35 252), du dabigatran (n=31 647) et de l’apixaban (n=17 751). Les patients sous AOD en tant que groupe, comparés aux VKA, avaient un risque plus faible de toutes les fractures (HR, 0,93 ; 95% CI, 0,88-0,98) et des fractures nécessitant une hospitalisation (HR, 0,87 ; 95% CI, 0,79-0,96), mais pas des fractures de la hanche nécessitant une hospitalisation (HR, 0,91 [0,78-1,07]). Lorsque chaque AOD a été comparé individuellement à la warfarine, le rivaroxaban et l’apixaban présentaient tous deux un risque plus faible de fractures nécessitant une hospitalisation et de toutes les fractures. Une analyse appariée a ensuite été effectuée, comparant l’apixaban au rivaroxaban et l’apixaban au dabigatran, et n’a documenté aucune différence significative pour aucun des résultats de la fracture (12).
Même si cet effet osseux est modeste, il doit être pris en compte et pousser à privilégier un AOD plutôt que les AVKs chez les patients ostéoporotiques.
Bithérapie antithrombotique (AAS et Rivaroxaban) et prévention tertiaire des accidents cardiovasculaires artériels
L’administration d’AAS en prévention cardio-vasculaire dite secondaire (documentation de lésions vasculaires d’artériosclérose) et tertiaire (post événement cardiovasculaire) est recommandée depuis de nombreuses années, initialement à la dose de 75 à 150 mg/j, sur base des preuves apportées par les publications de l’«Antithrombotic Trialists Collaboration » plus récemment à une dose faible de 75 à 100 mg/j.
Dans le décours d’un accident vasculaire aigu, notamment coronarien, une bithérapie antiplaquettaire (aspirine et un agent ciblant le récepteur plaquettaire à l’ADP – P2Y12 / Clopidogrel – Prasugrel ou Ticagrelor) est recommandée pour une durée variable. Cette durée est prolongée parmi les patients à haut risque de récidive thrombotique et dont le risque hémorragique est acceptable.
Même si les plaquettes sanguines jouent un rôle majeur dans la formation de caillots artériels, la coagulation est elle aussi impliquée suite à la libération de facteur tissulaire qui active la coagulation sanguine en générant du FXa et de la thrombine qui convertit le fibrinogène en fibrine, constituant important des thrombi, y compris artériels. Plusieurs études ont antérieurement démontré un effet antithrombotique artériels des AVKs utilisés seuls ou en associant avec des agents antiplaquettaires au prix toutefois d’un risque hémorragique majoré. Ces données ont stimulé de nombreuses études visant à explorer le rôle des AODs dans les thromboses artérielles, notamment dans la prise en charge du syndrome coronarien aigu (Tableau 5).

C’est toutefois par une vaste étude ayant évalué le rivaroxaban à petite dose en association avec l’aspirine en prévention secondaire et tertiaire des thromboses artérielles que se distingue le rivaroxaban. L’étude COMPASS a montré l’intérêt en termes de prévention d’un critère composite (décès cardiovasculaire, AVC ou infarctus du myocarde) d’une association de rivaroxaban à faible dose (2 x 2,5 mg par jour) à de l’aspirine à enrobage gastrique (100 mg/j par jour) versus aspirine seule chez des sujets ayant une pathologie coronarienne ou une artériopathie périphérique stable, avec fréquemment d’autres risques cardiovasculaires (HTA, diabète, hypercholestérolémie), généralement polymédiqués, âgés (moyenne de 68,2 ans). Cet effet est obtenu au prix d’une augmentation du risque d’hémorragie majeure. La prise de rivaroxaban seul (2 x 5 mg/j) n’a pas apporté de meilleurs résultats cardiovasculaires que l’aspirine tout en provoquant davantage d’événements hémorragiques majeurs (13,14). L’identification des patients tirant le plus grand bénéfice de cette association s’impose comme une démarche importante. Il a été démontré que le rapport bénéfice / risque est d’autant plus élevé que le nombre de lits vasculaires artériels atteints est élevé et est associé à des co-morbidités. Les patients qui tirent le plus grand bénéfice de cette association ont plus de 2 lits vasculaires artériels atteins, des antécédents de défaillance cardiaque, une insuffisance rénale (filtration glomérulaire < 60 ml/min) ou un diabète(15,16).
Sur base de ces données, la Société Européenne de Cardiologie recommande pour la prévention secondaire à long terme l’ajout d’un second médicament antithrombotique (rivaroxaban 2.5 mg 2x/J) à l’aspirine chez les patients avec un risque élevé (IIa) ou modérément accru (IIb) d’événements ischémiques et sans risque élevé d’hémorragie (17). Des articles de revue récents fournissent d’excellentes synthèses à propos du rationnel et des modalités de bithérapie antithrombotique (18,19) (Figure 3).

Rivaroxaban et artérite des membres inférieurs revascularisée
Les patients avec artérite de jambes ayant été revascularisés sont à haut risque d’événements cardiovasculaires (ischémies aiguës, amputations majeures et évènements cardio-vasculaires fatals ou non). La prise en charge antithrombotique se révèle problématique. Aucun bénéfice n’a été démontré en post-revascularisation avec les différents schémas thérapeutiques testés (AVKs, association AVK-antiplaquettaire, association d’antiplaquettaires). De plus, ces schémas thérapeutiques majorent le risque hémorragique. Ces données suggèrent l’opportunité d’évaluer la place des AODs dans cette indication.
L’étude VOYAGER PAD est un essai en double aveugle avec un suivi médian de 28 mois, ayant inclus 6564 patients avec artérite des membres inférieurs revascularisés qui ont été randomisés pour recevoir du rivaroxaban (2,5 mg x 2/j) plus aspirine ou un placebo plus aspirine. Les patients étaient inclus au 10ème jour d’une revascularisation sous inguinale fonctionnelle avec stratification selon le type de revascularisation réalisée (chirurgicale, endovasculaire ou hybride), et la prise concomitante de clopidogrel dans la strate revascularisation endovasculaire ou hybride (20).
Le critère primaire d’efficacité était composite et évaluait l’incidence cumulée à 3 ans de : ischémie aiguë de membre inférieur, amputation majeure de cause vasculaire, infarctus du myocarde, accident vasculaire cérébral ischémique, mortalité cardio-vasculaire. La tolérance était jugée sur la survenue d’un saignement majeur selon la classification TIMI (critère principal) ou ISTH (critère secondaire). Les principales caractéristiques des 6364 patients inclus étaient : âge médian = 67 ans, proportion de femmes = 26%, index de pression systolique médian = 0.56, tabagisme actif = 35%, diabète = 40%, hypertension artérielle = 81%, débit de filtration glomérulaire < 60 ml/mn/1.73m2 = 20%, statine = 80%, bloqueur du système rénine angiotensine = 63%, antécédent coronaire = 31%, antécédent d’IDM = 11%. L’artérite était évoluée puisque 36% des patients avaient un antécédent de revascularisation des membres inférieurs, 6% un antécédent d’amputation et 30 % un antécédent d’ischémie critique chronique. Un tiers des patients ont été traités par chirurgie conventionnelle (35%) et 2/3 par technique endovasculaire ou hybride (65%). Il faut noter que près d’un quart des patients étaient au stade d’ischémie critique chronique (23%). Le suivi médian était de 28 mois. Le taux de perdus de vue était de 0.09 % dans les 2 groupes.
Le nombre d’évènements ischémiques majeurs (critère primaire incluant ischémie aiguë et amputation majeure de membre) était significativement moindre dans le groupe rivaroxaban. Le principal critère d’efficacité est en effet noté chez 508/3286 sous rivaroxaban et 584/3278 sous placebo, soit des incidences à 3 ans de 17,3 % vs. 19,9 % respectivement (HR 0,85, IC 95 %, 0,76-0,96; p = 0,009). En revanche, le risque hémorragique était significativement plus élevé dans le groupe rivaroxaban. Des saignements majeurs TIMI sont notés chez 62 patients sous rivaroxaban vs. 44 patients sous placebo (2,65 % et 1,87 %; HR 1,43; IC9 5% 0,97-2,10; p = 0,07), et les saignements majeurs selon l’ISTH chez 140 vs. 100 patients respectivement (5,94 % et 4,06 %; HR 1,42; IC 95 % 1,10-1,84; p = 0,007). Aucune différence n’a été mise en évidence pour les hémorragies intra-crâniennes ou fatales.
Ainsi chez les patients avec artérite des membres inférieurs à haut risque ayant bénéficié d’une revascularisation, l’association rivaroxaban + aspirine réduit, par rapport à aspirine seule, le nombre d’amputations, d’infarctus du myocarde, d’AVC ischémique et de décès cardiovasculaires au prix d’un risque d’hémorragie majoré (pas intracrânienne ou fatale).
Rivaroxaban et traitement de la MTEV chez le patient cancéreux
La maladie thrombo-embolique veineuse est indissociable des affections cancéreuses dont elle représente une manifestation révélatrice ou une complication fréquente. Même si les HBPMs se sont imposées comme des agents antithrombotiques préventifs ou curatifs de premier plan, leurs faiblesses ne sont pas négligeables et ont motivé de multiples initiatives pour valider les AODs comme alternatives antithrombotiques pour les patients cancéreux avec MTEV.
C’est dans cet environnement que s’inscrit l’étude SELECT-D. Cet essai multicentrique randomisé, ouvert et prospectif a randomisé 406 patients avec cancer et MTEV symptomatique/incidentelle pour recevoir du rivaroxaban (15 mg deux fois par jour pour 3 semaines puis 20 mg une fois par jour) versus la daltéparine (200 UI/kg par jour pendant 1 mois, puis 150 UI/kg par jour) pendant 6 mois. Plus de 95% des patients des deux bras présentaient une tumeur maligne solide, 58 % une maladie métastatique et environ 70 % recevaient actuellement un traitement contre le cancer. Cette étude a montré une réduction statistiquement significative du résultat primaire de la MTEV récurrente à 6 mois dans le bras du rivaroxaban par rapport à la daltéparine (4,0% contre 9,0%, respectivement, HR 0,43, 95% CI 0,19-0,99). Les hémorragies majeures étaient plus importantes avec le rivaroxaban qu’avec la daltéparine (5,4 % contre 3,0 %, respectivement), mais pas statistiquement significatives (HR 1,83, 95 % IC 0,68-4,96). Les hémorragies pertinentes mais non majeurs étaient pour leur part plus fréquentes dans le bras du rivaroxaban, 12,3 %, contre 3,4 % avec la daltéparine (HR 3,76, 95 % IC 1,63-8,69). Les deux principaux types de cancer qui étaient associés aux saignements pertinents mais non majeurs dans le bras rivaroxaban étaient les cancers de la vessie et le colorectaux. La survie pendant la période de traitement de six mois était plus élevée dans le groupe traité au rivaroxaban, soit 75 %. (95 % IC 69 % -81 %) par rapport à la daltéparine, 70 % (95 % IC 63 % -76 %).
L’essai SELECT-D a montré que le rivaroxaban était plus efficace pour prévenir la MTEV récurrente parmi des patients avec cancer actif que la daltéparine au prix d’une augmentation des saignements (21).
Rivaroxaban et prophylaxie de la MTEV chez des patients ambulatoires atteints de cancer
Si la prophylaxie antithrombotique est souvent prescrite pour une courte durée en post-hospitalisation ou chirurgie chez patients souffrant d’un cancer, son bénéfice absolu pour une couverture à plus long terme serait plus faible. Des études ont cependant suggéré que cette prévention serait intéressante chez les patients ayant un score Khorana ≥3, mais le bénéfice pour un score de 2 semble moins probant.
L’étude de phase III en double aveugle CASSINI a évalué l’intérêt du rivaroxaban 10 mg/j dans la prophylaxie de la MTEV chez 1080 patients ambulatoires atteints de cancer. Leur âge médian était de 66 ans et 57 % étaient des hommes. Seuls les individus ayant un score Khorana ≥2 à l’inclusion (côté entre 0 et 6, les scores les plus élevés indiquant un risque plus élevé) étaient inclus dans l’étude (22).
Le critère composite principal d’évaluation était constitué de la survenue objectivement confirmée d’une thrombose veineuse profonde proximale sur un membre inférieur ou symptomatique sur membre supérieur ou distale sur membre inférieur, ou d’une embolie pulmonaire, ou du décès suite à une thrombose veineuse profonde. Le cancer le plus fréquent des patients inclus était le cancer pancréatique (32,6%). Au total, 54,5% de l’ensemble de la population ayant une tumeur solide avait une maladie métastatique. La durée moyenne du traitement était de 4,3 mois, et au total, 43,7% et 50,2% des sujets respectivement sous rivaroxaban et placebo ont arrêté prématurément l’étude pour des raisons similaires dans les deux groupes.
Sur les 180 jours de suivi, le critère composite principal d’évaluation a concerné 6% des patients sous rivaroxaban et 8,8% de ceux sous placebo, soit un hazard ratio (HR) de 0,66 [0,40-1,09], (p=0,10). Les analyses portant uniquement sur la période de traitement montrent que le critère principal d’évaluation était survenu chez 2,6% des sujets sous rivaroxaban et 6,4% de ceux sous placebo (HR 0,40 [0,20, 0,80]).
Au cours des 180 jours de suivi, 20,0% des individus sous rivaroxaban et 23,8% sous placebo sont décédés (HR 0,83 [0,62-1,11]). Des saignements non majeurs sont survenus chez 2,7% des patients sous rivaroxaban et 2,0% de ceux sous placebo (HR 1,34 [à 0,4-3,32]). Des saignements majeurs ont été notifiés chez 2,0% (n=8) des patients sous rivaroxaban et 1,0% (n=4) de ceux sous placebo, sans différence significative de risque : HR de 1,96 [0,59-6,49]. Les saignements majeurs d’origine gastro-intestinale étaient les plus fréquents (8 patients).
Il faut noter qu’un fort taux de sujets a arrêté prématurément l’étude et que la mise en œuvre de la thromboprophylaxie ne semble pas avoir modifié la survie globale.
Les résultats obtenus par l’étude CASSINI et la facilité d’administration du rivaroxaban devraient favoriser la prophylaxie antithrombotique ambulatoire des patients souffrant d’un cancer (23).
Rivaroxaban et MTEV chez l’enfant
L’incidence de la maladie thromboembolique veineuse (MTEV) chez l’enfant est 20 à 100 fois moindre que chez l’adulte. Chez l’enfant, la physiopathologie de la thrombose, sa localisation anatomique et ses réponses pharmacologiques aux traitements anticoagulants diffèrent des adultes.
L’objectif de l’étude EINSTEIN-Junior était de comparer l’efficacité et l’innocuité des schémas posologiques pédiatriques de rivaroxaban ajustés au poids corporel avec ceux des anticoagulants standards chez les enfants atteints de MTEV aigüe ayant reçu au moins 5 jours de traitement par héparine (24) (Figure 4).

Les enfants pouvaient être inclus dans cette étude de la naissance à l’âge de 17 ans s’ils présentaient une MTEV confirmée et qu’un traitement par héparine avait été initié. Après 5 à 9 jours d’anticoagulation avec de l’héparine non fractionnée, de l’héparine de bas poids moléculaire ou du fondaparinux, les enfants ont été randomisés pour recevoir des anticoagulants standards ou du rivaroxaban. Les enfants alloués au rivaroxaban ont reçu une dose équivalente à 20 mg pour l’adulte ajustée au poids corporel, administrée une fois par jour (pour des poids corporels ≥ 30 kg), deux fois par jour (pour des poids corporels de 12 à < 30 kg) ou trois fois par jour (pour des poids corporels < 12 kg). Le rivaroxaban a été administré sous forme de comprimés pelliculés à libération immédiate disponibles en dosages de 5, 10, 15 ou 20 mg ou en suspension. La suspension a été fournie sous forme de granulés dans un flacon qui a dû être rempli d’eau à une concentration de 1 mg/ml. Les enfants du groupe des anticoagulants standards ont poursuivi le traitement par héparine ou sont passés à un antagoniste de la vitamine K, à la discrétion du clinicien. La période de traitement de l’étude était de 3 mois, à l’exception des enfants de moins de 2 ans qui avaient une MTEV liée au cathéter, pour lesquels la période de traitement était de 1 mois.
De novembre 2014 à septembre 2018, 500 enfants ont été inclus dont 25% avaient des thromboses en lien avec un cathéter. Les thromboses veineuses étaient non provoquées dans 11% des cas. Les thromboses étaient provoquées par un facteur de risque persistant dans 17% des cas et un facteur de risque transitoire dans 47% des cas. Les localisations des thromboses veineuses étaient les suivantes : thromboses aux membres inférieurs dans 33% des cas, thromboses au niveau des veines cérébrales dans 23% et au niveau des artères pulmonaires dans 16% des cas.
Dans le groupe traitement standard, 64% des patients ont eu un traitement par héparine seul et 34% héparine puis AVK. Le suivi médian était de 91 jours pour les enfants avec une période de traitement de trois mois et de 31 jours pour les enfants avec une période de traitement d’un mois. Une récurrence symptomatique de MTEV est survenue dans 1% des cas dans le groupe rivaroxaban contre 3% dans le groupe anticoagulation standard. Il n’y a eu aucune MTEV fatale. 3% des patients du groupe rivaroxaban ont eu des épisodes de saignements cliniquement relevant, 2% dans le groupe contrôle ; le critère composite de récurrence de MTEV et de saignement majeur est survenu pour 1% des patients du groupe rivaroxaban et 4% des patients du groupe contrôle. Un enfant du groupe rivaroxaban est décédé du fait de la progression de son cancer.
Dans cette étude, le traitement de la MTEV chez l’enfant avec des posologies ajustées aux poids a montré que les risques de récidive thrombo-embolique et d’hémorragie significative étaient similaires au traitement anticoagulant standard. Il est possible que le traitement par rivaroxaban réduise davantage la masse thrombotique que le traitement standard.
Cette étude montre que le traitement par rivaroxaban à une posologie ajustée au poids n’occasionne pas de sur-risque de récurrence de MTEV ou d’hémorragie significative par rapport aux traitements anticoagulants classiques. A la différence des posologies adultes, où un traitement est commencé d’emblée à 15 mg 2 x par jour pendant trois semaines puis 20 mg/jour, dans cette étude pédiatrique le traitement de la phase aigüe était une héparinothérapie pendant 5 jours suivi d’un traitement par rivaroxaban à une posologie équivalente à 20 mg/jour pour un adulte.
Le rivaroxaban pourrait être une option pour traiter les thromboses veineuses de l’enfant selon une posologie adaptée au poids. L’utilisation du rivaroxaban éviterait ainsi les contrôles biologiques répétés comme les injections sous-cutanées.
Les contre-indications du Rivaroxaban
Alors que les sections précédentes de cet article témoignent du succès de la validation du rivaroxaban dans de nombreux contextes, plusieurs contre-indications persistent qui sont d’ailleurs communes aux autres AODs.
Le rivaroxaban est contre-indiqué pour les patients porteurs d’une valve cardiaque mécanique. Il en est de même pour les patients ayant bénéficié d’un remplacement valvulaire aortique percutané (TAVI) (25). Le traitement par rivaroxaban doit donc être interrompu chez les patients qui bénéficient d’un TAVI et être remplacé par un traitement conventionnel.
De même dans le syndrome anti-phospholipide, surtout si compliqué de thromboses artérielles, la contre-indication des AODs dont le rivaroxaban demeure formelle.
Gestion du risque hémorragique associé au Rivaroxaban
Le recours à tout agent anticoagulant (AVK, HBPM, AOD) est associé à un risque de complications hémorragiques. Ce risque doit toutefois être individualisé et confronté aux bénéfices antithrombotiques et aux risques hémorragiques associés aux autres anticoagulants. Il est globalement plus faible pour les AODs dont le rivaroxaban par rapports aux AVKs, à l’exception des complications hémorragiques digestives.
Il est important d’en tenir compte lors de l’initiation du traitement (anamnèse fouillée des antécédents digestifs, protection anti-acide gastrique, information du patient invité à être vigilant vis-à-vis de toute symptomatologie ou signe clinique suspects) et de son suivi.
A l’occasion de gestes invasifs associés à un risque hémorragique accru, le rivaroxaban doit être interrompu pour une période de 1 à 2 jours (rarement 3) sans bridging par HBPM. En post-procédure, le rivaroxaban ne doit pas être repris trop rapidement (>6 heures par rapport à la fin du geste) et éventuellement remplacé par une HBPM si une reprise précoce est jugée à risque.
En cas de complication hémorragique sous rivaroxaban, en fonction du délai par rapport à la dernière prise, de la posologie quotidienne, de la présence de comorbidités (IRC) ou de co-médications majorant le risque hémorragique, de la mesure de la concentration sanguine circulante faite dans de nombreux laboratoires de routine, le recours à un traitement de substitution par concentré de facteurs dépendants de la vitamine K (PCC/PPSB) sera envisagé (posologie de 25 IU/kg) (26). Ce traitement sera éventuellement répété en fonction du contrôle de l’hémorragie.
Conclusions
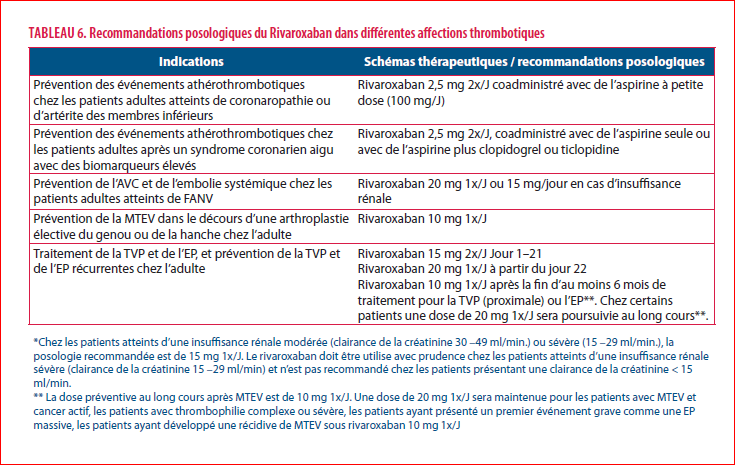
Les AODs ont révolutionné la prise en charge des affections thrombotiques. Par son spectre d’études originales, le rivaroxaban se démarque par une richesse d’études et de données qui ouvrent de nouveaux horizons pour le traitement et la prévention des affections thrombotiques tant artérielles que veineuses, éventuellement associées à de multiples comorbidités, de la petite enfance aux âges les plus avancés (Tableau 6).
Compte tenu du risque hémorragique inhérent à l’utilisation des anticoagulants, le défi au quotidien est d’identifier les candidats qui tireront le plus grand bénéfice antithrombotique du rivaroxaban au prix du moindre risque hémorragique.
Correspondance
Pr. Cédric Hermans, MD, FRCP (Lon, Edin), PhD
Cliniques universitaires Saint-Luc
Service d’Hématologie
Avenue Hippocrate 10,
B-1200 Bruxelles
Université catholique de Louvain (UCLouvain)
cedric.hermans@uclouvain.be ou hermans.cedric@gmail.com
orcid.org/0000-0001-5429-8437
Conflits d’intérêt : l'auteur déclare avoir perçu de la Société Bayer des honoraires de consultance pour sa participation à des Advisory Boards, l’animation de conférences et la rédaction d’articles scientifiques.
Références
- Bahri O, Roca F, Lechani T, Druesne L, Jouanny P, Serot JM et al. Underuse of oral anticoagulation for individuals with atrial fibrillation in a nursing home setting in France: comparisons of resident characteristics and physician attitude. J Am Geriatr Soc. 2015; 63(1):71-76.
- Patti G, Pecen L, Lucerna M, Huber K, Rohla M, Renda G et al. Net Clinical Benefit of Non-Vitamin K Antagonist vs Vitamin K Antagonist Anticoagulants in Elderly Patients with Atrial Fibrillation. Am J Med. 2019 ; 132(6):749-757.
- Coleman CI, Weeda ER, Nguyen E, Bunz TJ, Sood NA. Effectiveness and safety of rivaroxaban vs. warfarin in patients 80+ years of age with non-valvular atrial fibrillation. Eur Heart J Qual Care Clin Outcomes. 2018; 4(4):328-329.
- McCullough PA, Ball T, Cox KM, Assar MD. Use of Oral Anticoagulation in the Management of Atrial Fibrillation in Patients with ESRD: Pro. Clin J Am Soc Nephrol. 2016; 11(11):2079-2084.
- De Vriese AS, Caluwe R, Bailleul E, De BD, Borrey D, Van VB et al. Dose-finding study of rivaroxaban in hemodialysis patients. Am J Kidney Dis. 2015; 66(1):91-98.
- Coleman CI, Kreutz R, Sood NA, Bunz TJ, Eriksson D, Meinecke AK et al. Rivaroxaban Versus Warfarin in Patients With Nonvalvular Atrial Fibrillation and Severe Kidney Disease or Undergoing Hemodialysis. Am J Med. 2019; 132(9):1078-1083.
- Yao X, Tangri N, Gersh BJ, Sangaralingham LR, Shah ND, Nath KA et al. Renal Outcomes in Anticoagulated Patients With Atrial Fibrillation. J Am Coll Cardiol. 2017; 70(21):2621-2632.
- Bonnemeier H. Renal function worsening in factor-xa inhibitors vs phenprocoumon in patients with non-valvular atrial fibrillation and renal disease - insights from the RELOADED study. 2020. Ref Type: Online Source
- January CT, Wann LS, Calkins H, Chen LY, Cigarroa JE, Cleveland JC, Jr. et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Heart Rhythm. 2019; 16(8):e66-e93.
- De Vriese AS, Caluwe R, Pyfferoen L, De BD, De BK, Delanote J et al. Multicenter Randomized Controlled Trial of Vitamin K Antagonist Replacement by Rivaroxaban with or without Vitamin K2 in Hemodialysis Patients with Atrial Fibrillation: the Valkyrie Study. J Am Soc Nephrol. 2020; 31(1):186-196.
- Bansilal S, Bloomgarden Z, Halperin JL, Hellkamp AS, Lokhnygina Y, Patel MR et al. Efficacy and safety of rivaroxaban in patients with diabetes and nonvalvular atrial fibrillation: the Rivaroxaban Once-daily, Oral, Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF Trial). Am Heart J. 2015; 170(4):675-682.
- Lutsey PL, Norby FL, Ensrud KE, MacLehose RF, Diem SJ, Chen LY et al. Association of Anticoagulant Therapy With Risk of Fracture Among Patients With Atrial Fibrillation. JAMA Intern Med. 2020; 180(2):245-253.
- Eikelboom JW, Connolly SJ, Bosch J, Dagenais GR, Hart RG, Shestakovska O et al. Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med. 2017; 377(14):1319-1330.
- Connolly SJ, Eikelboom JW, Bosch J, Dagenais G, Dyal L, Lanas F et al. Rivaroxaban with or without aspirin in patients with stable coronary artery disease: an international, randomised, double-blind, placebo-controlled trial. Lancet. 2018; 391(10117):205-218.
- Anand D, Ray S, Bhargava S, Srivastava LM, Garg A, Gafoor I et al. Exploration of eosinopenia as a diagnostic parameter to differentiate sepsis from systemic inflammatory response syndrome: Results from an observational study. Indian J Crit Care Med. 2016; 20(5):285-290.
- Hiatt WR, Hess CN, Bonaca MP. Heterogeneity of Risk and Benefit in Subgroups of COMPASS: Relatively Similar But Absolutely Different. J Am Coll Cardiol. 2019; 73(25):3292-3294.
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020; 41(3):407-477.
- Capodanno D, Bhatt DL, Eikelboom JW, Fox KAA, Geisler T, Michael GC et al. Dual-pathway inhibition for secondary and tertiary antithrombotic prevention in cardiovascular disease. Nat Rev Cardiol. 2020; 17(4):242-257.
- Weitz JI, Angiolillo DJ, Geisler T, Heitmeier S. Dual Pathway Inhibition for Vascular Protection in Patients with Atherosclerotic Disease: Rationale and Review of the Evidence. Thromb Haemost. 2020; 120(8):1147-1158.
- Bonaca MP, Bauersachs RM, Anand SS, Debus ES, Nehler MR, Patel MR et al. Rivaroxaban in Peripheral Artery Disease after Revascularization. N Engl J Med. 2020; 382(21):1994-2004.
- Young AM, Marshall A, Thirlwall J, Chapman O, Lokare A, Hill C et al. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT-D). J Clin Oncol. 2018; 36(20):2017-2023.
- Khorana AA, Soff GA, Kakkar AK, Vadhan-Raj S, Riess H, Wun T et al. Rivaroxaban for Thromboprophylaxis in High-Risk Ambulatory Patients with Cancer. N Engl J Med. 2019; 380(8):720-728.
- Agnelli G. Direct Oral Anticoagulants for Thromboprophylaxis in Ambulatory Patients with Cancer. N Engl J Med. 2019; 380(8):781-783.
- Male C, Lensing AWA, Palumbo JS, Kumar R, Nurmeev I, Hege K et al. Rivaroxaban compared with standard anticoagulants for the treatment of acute venous thromboembolism in children: a randomised, controlled, phase 3 trial. Lancet Haematol. 2020; 7(1):e18-e27.
- Dangas GD, Tijssen JGP, Wohrle J, Sondergaard L, Gilard M, Mollmann H et al. A Controlled Trial of Rivaroxaban after Transcatheter Aortic-Valve Replacement. N Engl J Med. 2020; 382(2):120-129.
- Cheung YW, Barco S, Mathot RAA, van den Dool EJ, Stroobants AK, Serlie MJ et al. Pharmacokinetics of dabigatran etexilate and rivaroxaban in patients with short bowel syndrome requiring parenteral nutrition: The PDER PAN study. Thromb Res. 2017; 160:76-82.