Introduction
Le syndrome du ligament arqué médian (SLAM), également appelé syndrome de Dunbar, est une pathologie congénitale rare. Elle consiste en une compression du tronc cœliaque (TC) par le ligament arqué médian du diaphragme (LAM), provoquant une douleur abdominale diffuse par ischémie organique ainsi que compression nerveuse. Découvert en 1963 par Harjola, la première étude est publiée par Dunbar en 1965 (1). Malgré sa faible prévalence, cette pathologie peut être une cause de douleurs abdominales chroniques inexpliquées. Cet article explore l’anatomie régionale, la pathologie, la clinique, le diagnostic, les traitements et les facteurs prédictifs.
Anatomie
Le LAM est une structure anatomique appartenant au diaphragme (figure 1). Il sépare les deux piliers de ce dernier. Le LAM crée une arche avec les corps vertébraux adjacents ; le hiatus aortique. Dans ce dernier, passent l’aorte thoracique qui deviendra abdominale, la veine azygos et le canal thoracique.
Le TC est l’un des confluents les plus proximaux de l’aorte abdominale, situé en regard de T12. De cet endroit, partent différentes artères qui perfusent l’étage abdominal supérieur :
- l’artère gastrique gauche ;
- l’artère splénique ;
- l’artère hépatique commune.
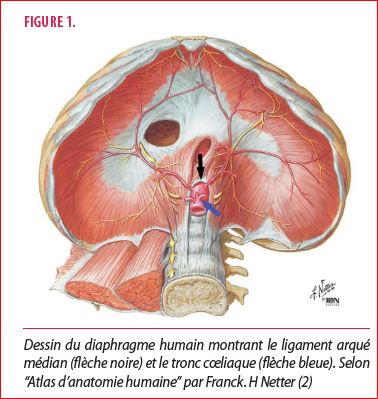
Sur le plan neurologique, le TC contient également des ganglions nerveux formant le plexus cœliaque. Ceux-ci sont des relais contenant trois types de fibres nerveuses. Des fibres sympathiques provenant des ganglions paravertébraux via les nerfs splanchniques thoraciques. Des fibres parasympathiques provenant du tronc vagal postérieur. Enfin, des fibres afférentes sensitives venant des différents viscères abdominaux, tels que l’estomac, le foie et le pancréas. Une communication avec les ganglions mésentériques permet la transmission d’informations nerveuses du rein, de l’intestin grêle et du côlon (2).
Pathologie
Le SLAM provoque une douleur abdominale diffuse. Deux causes possibles expliquent ce phénomène : d’une part la compression vasculaire avec ischémie organique et d’autre part la compression nerveuse avec l’apparition de douleurs neuropathiques. Cette variante anatomique touche 10 à 24% de la population générale, préférentiellement le sexe féminin (4/1). L’âge moyen serait de 32 ans (3). Cependant, une faible proportion développe des douleurs abdominales. Le SLAM fut initialement décrit en 1963 par Harjola, et Dunbar sera le premier à effectuer une étude clinique en 1965 (1).
En 1971, Linder et al publièrent une étude d’autopsie sur la variabilité anatomique du LAM chez 75 spécimens. 33% d’entre eux présentaient un tronc cœliaque au même niveau, voire supérieur au LAM. Les auteurs arrivèrent à la conclusion suivante : la position anormalement caudale du LAM est plus probable que l’inverse. Le plexus cœliaque, composé de fibres nerveuse et d’un tissu fibreux, forme une armature imposante et peut, à lui seul, constituer un facteur de risque de compression. L’athérosclérose du tronc cœliaque peut être à l’origine du bruit auscultatoire en clinique. Les auteurs considèrent également le morphotype comme facteur de risque. En effet, les individus mésomorphes (patient avec une masse musculaire développée et une silhouette en “V”) et endomorphes (patients aux formes rondes avec un bassin élargi et un métabolisme lent) sont plus susceptibles de détenir cette anomalie anatomique que les individus ectomorphes (grands minces au métabolisme rapide avec peu de masse grasse) (4).
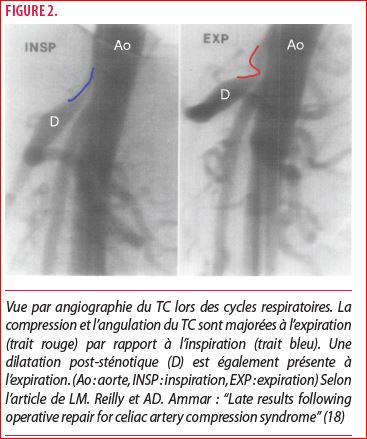
La littérature évoque également un lien mécanique entre le degré de compression et le cycle respiratoire. En 1973, Reuter et al ont mis en évidence ce phénomène. Ils ont constaté que le TC et le LAM s’éloignent à l’inspiration profonde et se rapprochent à l’expiration, majorant la sténose (5) (figure 2).
Le SLAM développe au long terme différentes complications liées à la compression vasculaire prolongée. Cette dernière peut notamment provoquer un remaniement tissulaire. D’un point de vue histologique, une compression chronique du LAM modifie la conformation de la paroi du tronc cœliaque. En effet, des études ont mis en évidence une désorganisation de la média et de l’adventice ainsi qu’une hyperplasie intimale avec une prolifération de muscle lisse et de fibres élastiques anormales. Tout ceci aggrave le degré d’occlusion d’un SLAM (6). Comme autre complication du SLAM, l’anévrisme post-sténotique a été décrit dans une cohorte rétrospective de 23 patients atteints de SLAM. 11 patients (48%) ont développé un anévrisme artériel, contre 0.1 à 2% dans la population générale. Parmi ces patients, 73% ont développé une maladie anévrismale au niveau pancréatico-duodénal (7).
Sur le plan neurologique, une compression des ganglions cœliaques peut provoquer une surstimulation des fibres nerveuses et développer des douleurs neuropathiques (8).
Clinique
Le SLAM est symptomatique dans une faible proportion des patients atteints de ce conflit anatomique. Les douleurs abdominales incessantes sont à la fois provoquées par une ischémie viscérale ainsi que par une compression nerveuse. La forme clinique la plus fréquente se décrit par une triade symptomatique :
- douleur abdominale post-prandiale ;
- perte de poids ;
- bruit auscultatoire suite à la sténose artérielle (35% des patients symptomatiques).
D’autres symptômes peuvent apparaître tels que des nausées- vomissements, de la diarrhée, de la fatigue et une intolérance à l’effort physique. Les patients sont souvent des jeunes femmes de 30 à 50 ans qui ont subi de multiples explorations médicales pour leurs douleurs abdominales (8).
Malgré sa faible prévalence, une errance diagnostique peut apparaître dans le cadre de douleurs chroniques. L’intégration de cette pathologie dans un diagnostic d’exclusion est donc intéressante.
Diagnostic
Il existe différents examens diagnostiques permettant la mise en évidence de cette anomalie anatomique. Nous évoquons ici essentiellement la technique iconographique, l’angiographie ainsi que la tonométrie.
L’échographie duplex (DUS) est l’examen le plus performant en première ligne afin d’identifier la compression du tronc cœliaque. Ce type d’échographie étudie la vitesse du flux dans les vaisseaux ainsi que leurs structures. Le terme “Duplex” se réfère à l’association du mode B, qui étudie la structure du vaisseau en question, au mode Doppler qui évalue sa vitesse du flux (9).
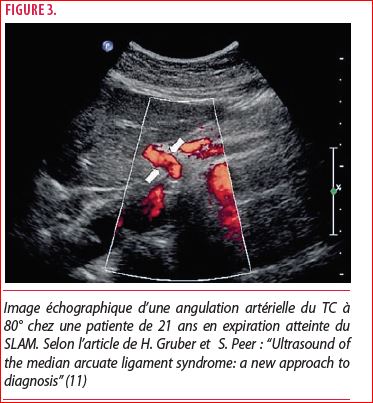
Cet examen de première ligne est notamment non invasif, non irradiant et peu onéreux. Il offre également des images dynamiques en temps réel. Par contre, il dépend de l’expérience de l’opérateur. Dans une étude rétrospective réalisée par Gruber et al, ont été mis en évidence la sensibilité et spécificité de cet examen. Parmi les patients avec des antécédents de SLAM, six d’entre eux présentaient un tableau clinique chronique et une confirmation par angiographie de SLAM. 100% de ces derniers présentaient une angulation du tronc cœliaque de plus de 50°, contre 40% des volontaires du groupe contrôle. Cet article met également en évidence la différence de vélocité systolique maximale (PSV) entre ces deux groupes. En effet, la sténose provoque une augmentation de débit distal transformant un flux laminaire en un flux turbulent (10). Ainsi, la PSV à l’expiration est plus élevée chez les patients atteints du SLAM (425 +- 130.1 cm/s) que le groupe contrôle (209.9 +- 80.1 cm/s). Les auteurs concluent leur étude en affirmant que la combinaison d’une déviation de plus de 50° (figure 3) du tronc cœliaque avec une PSV de plus de 350 cm/s confèrent une sensibilité de 83%, une spécificité de 100% et une valeur prédictive positive de 100%. Notons néanmoins des données basées sur un nombre faible de candidat (11).
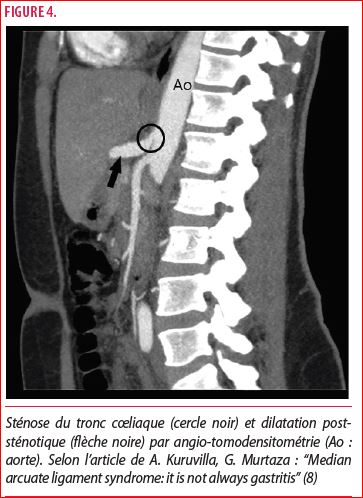
L’angiographie par tomodensitométrie (CTA) est une alternative légèrement plus invasive. Elle permet notamment de localiser une occlusion artérielle et d’en faire un diagnostic différentiel. En effet, cet examen d’imagerie oriente le diagnostic par la mise en évidence d’un rétrécissement du tronc cœliaque avec l’apparence d’un crochet (“hooking”). Par conséquent, ces caractéristiques permettent de distinguer le SLAM d’une athérosclérose. La forme tridimensionnelle (3D) permet d’apprécier le degré d’angulation du TC par rapport à l’aorte abdominale. La CTA est fortement recommandée par la Société Européenne de la Chirurgie Vasculaire (ESVS) dans le cadre d’une suspicion d’ischémie mésentérique chronique (1) (figure 4).
La CTA permet également d’apprécier le système de collatéralisation en lien avec le tronc cœliaque. D’un point de vue anatomique, il existe une vicariance entre le TC et l’artère mésentérique supérieure notamment par le biais de l’arcade pancréatico-duodénale (Rio Branco) (figure 5). Il semblerait que la présence ou non de collatéralité dans le cadre de SLAM pourrait impacter la convalescence post-opératoire. En effet, van Petersen et al ont réalisé une analyse rétrospective de 129 patients atteints du SLAM, diagnostiqué cliniquement ou radiologiquement. Tous ont été traité chirurgicalement par une technique rétropéritonéale ou laparoscopique. Parmi ces patients, certains possédaient des collatérales en préopératoire. Les auteurs décrivent une récupération clinique optimale de 81% chez les patients dépourvus de collatérales (grade 0) et 89% chez les patients avec peu de collatérales (grade 1). Par contre, ceux ayant développé plusieurs collatérales (grade 2), ont une récupération post-opératoire médiocre (52%).
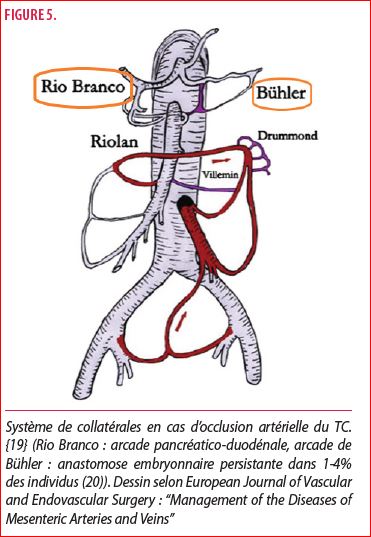
Ainsi, cet article conclut que les patients présentant plusieurs collatérales ont une probabilité mitigée d’évoluer vers une récupération clinique optimale, après chirurgie. Ils suggèrent notamment de contre-indiquer l’opération chez ces patients. Cependant, ils considèrent que cette restriction mérite une confirmation par le biais d’études prospectives (12).
Notons que l’angiographie par résonnance magnétique (angio-IRM) est également utilisée. Bien que non irradiant, cet examen requiert de longs délais d’attente.
La tonométrie gastrique à l’effort (GET) consiste en l’introduction d’une sonde nasopharyngée avec ballonnet intragastrique perméable aux gaz. La GET capte la pression partielle en dioxyde de carbone (Pco2) présente dans la lumière gastrique. Une augmentation de la Pco2 indique une ischémie tissulaire, en l’occurrence gastrique. Elle est mise en relation avec la Pco2 artérielle. Une inhibition d’acidité gastrique est nécessaire afin de ne pas biaiser le différentiel de pression. Cet examen pourrait être prometteur à visée diagnostique mais aussi dans le cadre du suivi post-opératoire du SLAM. Une étude prospective hollandaise, menée par Mensink et al, a démontré l’efficacité de la GET. 43 patients symptomatiques ont été retenus dans cette étude, après mise en évidence d’une sténose du TC à l’angiographie (Digital Substraction Angiography). Parmi ceux-ci, 29 personnes détenaient une GET positive préopératoire et ont été opérées. 24 ont été libérées de leurs symptômes, et ont récupéré une normalisation, voire une amélioration des valeurs de la GET postopératoire. Les 5 autres patients ont gardé leurs symptômes, et ainsi une ischémie gastrique confirmée par la GET post-chirurgicale. En conclusion, les auteurs ont cherché à démontrer qu’une compression significative du TC provoque une ischémie gastrique. Ils ont également mis en évidence l’efficacité de la tonométrie gastrique, comme outil diagnostique, ainsi que comme moyen de suivi de l’ischémie gastrique dans le cadre du SLAM. Ils déplorent, néanmoins, l’impact limité de cet examen en clinique (13).
Traitement
Traitement non chirurgical
Une des causes de douleurs associées au SLAM est la douleur neuropathique par compression du plexus cœliaque, réseau nerveux détenant des fibres afférentes, sympathiques et parasympathiques. Le bloc du plexus cœliaque (CPB) consiste en une injection de lidocaïne à ce niveau. Il pourrait avoir une utilité d’un point de vue diagnostique, prédictif mais également antalgique préopératoire. Un article de Sun et al, paru dans une revue d’anesthésie, rapporte un cas de SLAM après investigation approfondie, chez qui un CPB a été effectué. La patiente était sous patch de fentanyl (25µg), une équivalence de dose morphinique de 100mg. Un abord postérieur trans-aortique percutané a été préféré pour la CPB avec un repérage fluoroscopique. Par la suite, la douleur aurait réduit de 90% et la dose de fentanyl et équivalence morphinique seraient passées respectivement à 12µg et 30mg (14).
Une autre analyse rétrospective de 5 patients ayant reçu un CPB préopératoire a mis en évidence une résolution des douleurs post-opératoires dans 80% des cas (4 patients) (15).
Ainsi, une réponse positive du CPB pourrait être un indicateur prédictif positif préopératoire pour une convalescence optimale. L’effet sympatholytique améliore le débit sanguin distal et pourrait expliquer ce changement clinique. Cependant, une étude à large spectre est nécessaire afin de confirmer cette possibilité.
Traitement chirurgical
Pour la plupart des patients symptomatiques atteints de SLAM, une intervention chirurgicale est le traitement de choix. Elle consiste en une décompression du TC par section du LAM afin d’optimiser le flux sanguin. Il existe différents types de chirurgie, ayant chacun des avantages et des inconvénients :
- la chirurgie laparoscopique ;
- la chirurgie endovasculaire ;
- la chirurgie robotique ;
- la chirurgie par laparotomie de la ligne blanche, ou rétropéritonéale (non évoquée dans cet article).
La chirurgie laparoscopique, pratiquée quotidiennement, a pour avantage d’être à invasion minime. Cette opération consiste en une exposition de la cavité péritonéale au moyen de trocarts par lesquels passent une caméra et des instruments chirurgicaux afin de sectionner le LAM et ainsi décomprimer le TC (figure 6).
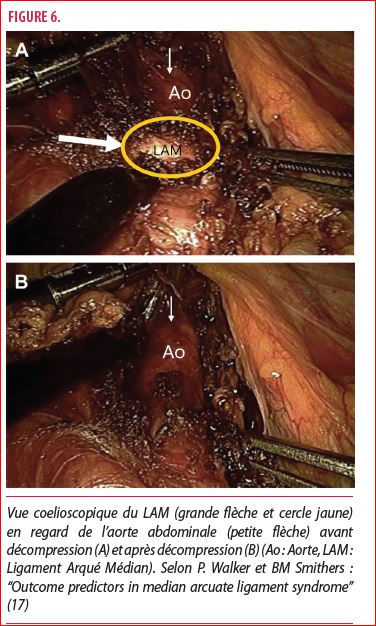
Elle permet au patient une meilleure récupération, une faible douleur post-opératoire, une durée d’hospitalisation raccourcie, une perte sanguine minime, une diminution du risque infectieux ainsi que de petites cicatrices. Pour le chirurgien, la coelioscopie permet une bonne exposition sur le site opératoire. Selon une revue de la littérature de Romero et al sur l’utilité de la laparoscopie pour un SLAM, seulement 4,2% de reconversion en laparotomie, 85.3% de résolution des symptômes et aucun décès rapporté. L’avantage de la laparoscopie est la courte durée opératoire (136 minutes en moyenne) et d’hospitalisation (3.8 jours) (3).
Cependant, il existe également des inconvénients à cette voie d’abord :
- risque de léser l’aorte abdominale (mobilité limitée du chirurgien) ;
- risque de résection incomplète ;
- hémostase limitée en cas d’hémorragie.
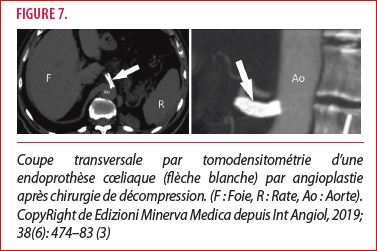
La chirurgie endovasculaire est une intervention endoluminale servant à ôter un obstacle et lutter contre la sténose d’un vaisseau. Dans le cadre du SLAM, cette intervention pourrait avoir un impact sur la sténose du tronc cœliaque, notamment due à l’hyperplasie intimale. L’angioplastie percutanée, avec endoprothèse, a peu de chance d’aboutir à une résolution du syndrome de Dunbar. Par contre, elle pourrait constituer un traitement complémentaire en cas de resténose après chirurgie de décompression (3) (figure 7). Cependant, une anti-agrégation plaquettaire sera nécessaire, généralement double durant un mois puis simple ad vitam.
La chirurgie laparoscopique robotique est une chirurgie laparoscopique où le chirurgien opère à distance en commandant des bras articulés. Concernant le SLAM, une étude comparative de 16 patients entre la chirurgie laparoscopique classique (12 patients) et robotique (4 patients) a été réalisée par Do et al. (16). D’après cet article, la chirurgie robotique apporte une image 3D, une précision du geste chirurgical permettant un travail plus méticuleux avec les avantages de la chirurgie laparoscopique tels qu’un raccourcissement de la durée d’hospitalisation et une diminution de la morbidité périopératoire par rapport à la laparotomie. Au vu de la rareté de cette pathologie, peu de données sur la chirurgie robotique du SLAM sont disponibles.
Facteurs prédictifs du traitement
Certains patients demeurent symptomatiques en post-opératoire. Il est donc indispensable d’établir des facteurs prédictifs de chaque patient afin d’évaluer les indications opératoires.
Dans une étude rétrospective menée par Walker et al, ont été mis en évidence différentes présentations cliniques ayant un impact prédictif sur la convalescence post-opératoire. En effet, sur une série de 43 patients opérés, la présence d’une douleur abdominale à l’effort en préopératoire a démontré un bon résultat clinique après chirurgie. Par contre, une faible amélioration clinique post-opératoire a été décrite dans le cadre de vomissements ou des douleurs abdominales spontanées préopératoires (17).
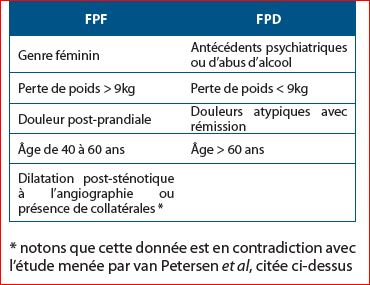
Selon Reilly et al sur une série rétrospective de 44 patients, différentes corrélations cliniques ont été établies dans le cadre d’une récupération à long terme. Selon cette étude, certaines caractéristiques constituent des facteurs prédictifs favorables (FPF) et défavorables (FPD) au long terme (18).
Conclusion
Le syndrome du ligament arqué médian est une pathologie congénitale rare présente chez 10 à 24% de la population générale dont 1% devient symptomatique. Ainsi, face à des douleurs abdominales chroniques inexpliquées après multiples explorations, le SLAM doit intégrer un diagnostic d’exclusion. Bien que rare, sa méconnaissance peut mener à une errance diagnostique. La DUS et la CTA constituent les meilleurs examens pour sa mise en évidence tandis que la GET pourrait faire partie du suivi. L’intervention chirurgicale de décompression n’améliore pas toujours la clinique du patient. Par conséquent, il est important d’établir les facteurs prédictifs positifs afin d’anticiper une résolution totale ou partielle de la symptomatologie après chirurgie.
Recommandations pratiques
Le SLAM doit être évoqué face à des douleurs abdominales chroniques inexpliquées chez une femme de 30-40 ans souffrant d’une perte de poids, des nausées-vomissements et des douleurs majorées à l’effort. Le diagnostic se fait par la DUS et/ou la CTA. La présence de facteurs prédictifs positifs oriente vers un traitement chirurgical optimal.
Conflit d’intérêt
Les auteurs attestent n’avoir aucun conflit d’intérêt dans cet article
Affiliations
Cliniques du Sud Luxembourg – Vivalia, Chirurgie Générale, B-6700 Arlon etienne.mauel@vivalia.be
Correspondance
Dr. Adam Abechri
Cliniques du Sud Luxembourg - Vivalia
Service de chirurgie générale
Rue des Déportés 137
B- 6700 Arlon
adam.abechri@hotmail.com
Références
- Goodall R, Langridge B, Onida S et al: Median arcuate ligament syndrome. J Vasc Surg, 2020; 71(6): 2170–76
- Netter, Franck H (2011). Atlas of Human Anatomy. Elsevier Masson, Philadelphie, 2011, 5e édition.
- San Norberto EM, Romero A, Fidalgo-Domingos LA et al: Laparoscopic treatment of median arcuate ligament syndrome: A systematic review. Int Angiol, 2019; 38(6): 474–83.
- Lindner HH, Kemprud E. A clinicoanatomical study of the arcuate ligament of the diaphragm. Arch Surg 1971;103: 600-5.
- Reuter SR, Bernstein EF. The anatomic basis for respiratory variation in median arcuate ligament compression of the celiac artery. Surgery 1973;73:381-5.
- Bech FR. Celiac artery compression syndromes. Surg Clin North Am 1997;77:409-24.
- Nasr LA, Faraj WG, Al-Kutoubi A, Hamady M, Khalifeh M, Hallal A et al. Median arcuate ligament syndrome: a singlecenter experience with 23 patients. Cardiovasc Intervent Radiol 2017;40:664-70.
- A. Kuruvilla, G. Murtaza, A. Cheema, H.M.S. Arshad. Median arcuate ligament syndrome: it is not always gastritis, J. Invest. Med. High Impact Case Rep. 5 (3) (2017), 2324709617728750.
- https://stanfordhealthcare.org/medical-tests/u/ultrasound/procedures/dup...
- https://radiopaedia.org/articles/peak-systolic-velocity-doppler-ultrasound
- Gruber H, Loizides A, Peer S, Gruber I. Ultrasound of the median arcuate ligament syndrome: a new approach to diagnosis. Med Ultrason 2012;14:5-9.
- van Petersen AS, Kolkman JJ, Gerrits DG, van der Palen J, Zeebregts CJ, Geelgerken RH et al. Clinical significance of mesenteric arterial collateral circulation in patients with celiac artery compression syndrome. J Vasc Surg 2017;65: 1366-74.
- Mensink PB, van Petersen AS, Kolkman JJ, Otte JA, Huisman AB, Geelkerken RH. Gastric exercise tonometry: the key investigation in patients with suspected celiac artery compression syndrome. J Vasc Surg 2006;44:277-81.
- Zhuo Sun, David A. Fritz, S. Turner, David M. Hardy, Steffen E. Meiler et al. Celiac Plexus Block as a Predictor of Surgical Outcome for Sympathetically Mediated Abdominal Pain in a Case of Suspected Median Arcuate Ligament Syndrome : A Case Report. Anesthesia & Analgesia Practice. 2018;11(3):76–78.
- Weber JM, Boules M, Fong K, Abraham B, Bena J, El-Hayek K, et al. Median arcuate ligament syndrome is not a vascular disease. Ann Vasc Surg 2016;30:22-7.
- Do MV, Smith TA, Bazan HA, Sternbergh WC 3rd, Abbas AE, Richardson WS. Laparoscopic versus robot-assisted surgery for median arcuate ligament syndrome. Surg Endosc 2013;27:4060–6.
- Ho KK, Walker P, Smithers BM, Foster W, Nathanson L, O’Rourke N, et al. Outcome predictors in median arcuate ligament syndrome. J Vasc Surg 2017;65:1745-52.
- Reilly LM, Ammar AD, Stoney RJ, Ehrenfeld WK. Late results following operative repair for celiac artery compression syndrome. J Vasc Surg 1985;2:79-91.
- https://www.ejves.com/article/S1078-5884(17)30058-8/fulltext
- https://radiopaedia.org/articles/arc-of-buhler